1. Introducción
La orquídea de vainilla (Vanilla planifolia) tiene origen en los bosques tropicales de México y Centro América (Bory et al., 2008), cuya explotación o beneficio comienza con las culturas prehispánicas las cuales la bautizaron con el nombre de “Tlixochitl” (flor negra) haciendo clara referencia a los vainas beneficiadas la cuales adquieren un color oscuro y su exquisita y perfumada fragancia (Figura 1).

Figura 1. Fenología de Vanilla planifolia, al centro se encuentran las vainas beneficiadas (flor negra). 1: Plántula de vainilla germinada; 2: Plántula de vainilla (5 meses de edad); 3: Planta de vainilla (4 años); 4: Botones florales de vainilla; 5: Flor de vainilla; 6: Vainas verdes de vainilla.
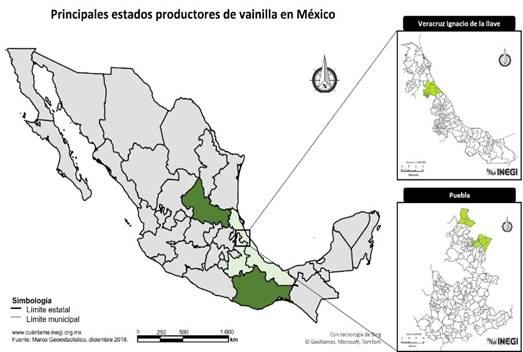
La vainilla se ha cultivado desde tiempos prehispánicos principalmente en la región Totonaca, la cual actualmente es la zona con mayor producción de vainilla y está constituida por municipios del norte de Veracruz y Puebla (SIAP, 2020) (color verde claro en la Figura 2).
Uno de los primeros reportes del aprovechamiento de la vainilla, data de esta práctica desde antes de los tiempos precolombinos (Bruman, 1948). Posterior a la conquista de los Mexicas (aztecas) sobre el imperio Totonaca, esta especie fue consumida principalmente por la nobleza en una bebida a base de cacao, llamada “Xocolatl” que realizaban desde los años 1300 hasta la llegada de los españoles (Bruman, 1948; Ramachandra & Ravishankar, 2000; Gallage & Møller, 2018).
Esta especie atrajo la atención de los españoles durante la conquista, razón por la que fue exportada a Europa, África y Asia para ser aprovechada por sus cualidades aromáticas y saborizantes (Teoh, 2019). Sin embargo, en estos continentes presentaron un gran problema, la ausencia de un polinizador natural, abejas pertenecientes al género Euglossa, razón por la cual fue imposible la obtención de vainas de vainilla (Watteyn et al., 2020). No fue hasta que en el año 1841 que lograron la polinización artificial de esta especie, logrando así el establecimiento de plantaciones fuera de México y Centro América (Lubinsky et al., 2006).

Figura 3 Estructuras vegetales de Vanilla planifolia. A: Crecimiento hemiepífito; B: estructuras florales en racimo; C: artesanías hechas con vainas de vainilla, estracto y esencia natural de vainilla; D: vainas de vainilla beneficiadas; E: vainas verdes de vainilla.
A pesar del valor histórico que representa la vainilla en México, el primer cultivo clonal comercial se estableció en 1760 en el municipio de Papantla, Veracruz (SAGARPA, 2021). Lo cual ha representado una oportunidad de ingreso económico (de hasta $5512 dólares/tonelada en el 2020) (FAOSTAT 2020) para las familias principalmente indígenas (totonacas) debido a la venta de vainillas curadas, proceso por el cual las vainas adquieren su aroma característico a través de un proceso de secado controlado y artesanías elaboradas con las vainas (Teoh, 2019) (Figura 3). México es considerado centro de origen del cultivo de vainilla y fue catalogado como el principal país productor de vainilla hasta que se descubrió la polinización artificial en 1961. Esto representó una alternativa promisoria para la obtención de vainas de vainilla fuera de México, perdiendo así el primer puesto de producción de vainilla, posición que no ha podido recuperar a la actualidad (FAOSTAT, 2020).
2. Tipos de sistemas productivos
Después de la domesticación de esta especie en México, se establecieron diferentes sistemas productores como “acahual” o tradicional (zonas de recuperación de flora endémica); bajo tutores (principalmente arboles cítricos); sistemas semi-tecnificados (invernaderos con malla sombra) y, por último, invernaderos tecnificados (Díaz-Bautista et al., 2019; Figura 4). Una de las grandes diferencias entre estos sistemas productivos es el rendimiento (kg de vainas por ha-1), ya que bajo tutor cítrico se producen 230 kg en comparación con 435 kg bajo sistema semi-tecnificado (Barrera-Rodríguez et al., 2009). Sin embargo, Espinoza-Pérez et al. (2018) en su estudio organizan a los productores de vainilla según el perfil de intensidad de manejo sobre este cultivo, siendo los más eficientes, los que empiezan a tomar en cuenta los ingresos que representa este cultivo, es decir, aquellos que siembran vainilla bajo tutores de cítricos y malla sombra.
3. Características del cultivo y producción de Vanilla planifolia
Las plantas de vainilla se cultivan en climas tropicales cálidos y húmedos y tienen ciertos requisitos agroecológicos en términos de temperatura (20 - 32 °C), precipitación (promedio de 2000 a 3000 mm por año), altitud (desde el nivel del mar hasta 600 m), sombra (50% - 70%), con suelo rico en humus, árboles de soporte (tutores) (Soto-Arenas, 1999). La vaina de vainilla se obtiene a través de la polinización manual principalmente, las flores de vainilla se disponen en estructuras llamadas “candelabros”. Los productores procuran no polinizar más de 20 flores por candelabro, ya que la presencia de más vainas por estructura puede debilitar a la planta incluso puede abortar dichos frutos. Las vainas son cosechadas antes de su madurez plena, para que después de un complejo proceso de deshidratación y secado mediante el cual el fruto prácticamente inodoro e insípido cobra un particular aroma y sabor que lo pone en condiciones de ser comerciadas (Hernández-Hernández, 2011).

Figura 4 Tres tipos de sistemas productivos de vainilla. A: Acahual; B: bajo tutor de cítricos (naranjo); C: semi-tecnificado (malla sombra).
La floración de la vainilla es anual y en México comienza a partir del mes de abril hasta mayo, se genera en racimos de 20 flores que tienen un lapso de vida de 6 horas (efímeras), por lo que debe ser polinizada en ese lapso entre las 6 am y 12 pm de otra manera la flor se marchita y se vuelve inviable (Hernández-Ramírez, 2020). Una vez polinizada la flor, el fruto debe madurar sobre su racimo durante 9 meses para ser cortada y posterior a ello colocarse en camas de secado para su beneficiado y potenciar su dulce aroma y sabor, cabe destacar que, la flor requiere las condiciones ideales como la temperatura, agua y sombra para no abortar su fruto (Khoyratty et al., 2018).
V. planifolia destaca por su importancia económica debido al compuesto que se extrae de sus vainas curadas, el cual se llama “vainillina”, utilizada principalmente como saborizante con aroma dulce y suave (Banerjee & Chattopadhyay, 2019). Inclusive se ha aprovechado por sus cualidades medicinales como antimicrobiano y antioxidante. En el mercado se comercia con tres tipos diferentes de vainillina; natural, biotecnológica y sintética, sin embargo, la producción de vainillina natural representa menos del 1% de la producción total (Baqueiro-Peña & Guerrero-Beltrán, 2017). Este es un compuesto muy codiciado entre las industrias cosméticas, farma céuticas y gastronómica, actualmente es una de las tres especias más demandadas y costosas del mundo (Cardone et al., 2020; Khoyratty et al., 2018). También destaca por su importancia ecológica ya que se considera un producto no maderable que contribuye a la conservación y valorización de los bosques nativos y otros recursos naturales (Gómez & Moreno, 2012), debido a que su aprovechamiento data de la época precolombina con fines alimentarios (Teoh, 2019). Y finalmente desde un punto de vista social ya que el cultivo de la vainilla se puede beneficiar a los pequeños productores obteniendo grandes ingresos económicos a través de estrategias de planeación y transferencias de tecnología (Borbolla-Pérez et al., 2017).
La vainilla al ser un cultivo clonal se encuentra fuertemente amenazada por factores de estrés tanto bióticos (Hongos; Colletotrichum orchidophilum (Charron et al., 2018), Colletotrichum gloeosporoides (Guevara-Suarez et al., 2022) y Fusarium (Ramírez-Mosqueda et al., 2019), como abióticos (sequía) (Iglesias-Andreu et al., 2021; Martínez-Santos et al., 2021). Esto es debido a la ausencia de diversidad genética que permita aumentar la probabilidad de supervivencia con la presencia de genes que respondan de manera favorable a situaciones de estrés que afecte a las plantas morfo-fisiológicamente, derivando en problemas como aborción floral y/o de frutos, cierre estomático, reducción de la tasa fotosintética, inhibición del crecimiento, reducción del área foliar, deshidratación severa, aumento en la susceptibilidad de patógenos y por último necrosis (Borbolla-Pérez et al., 2016).
Existen opciones que permiten mejorar la cadena de suministro, por ejemplo, a través del fitomejoramiento (potenciado el aroma y sabor, tamaño y grosor de las vainas, así como la resistencia a Fusarium oxysporum) (Cai et al., 2019; Pérez-Silva et al., 2021; Serrano-Fuentes et al., 2022; Silva et al., 2022). A pesar de ser una opción que ofrece resultados prometedores en cuanto a producción, el problema radica en las condiciones adversas económicamente hablando de los pequeños productores de vainilla, ya que carecen de la infraestructura necesaria y de los fondos necesarios para el establecimiento de biofábricas.
4. Producción mundial y en México
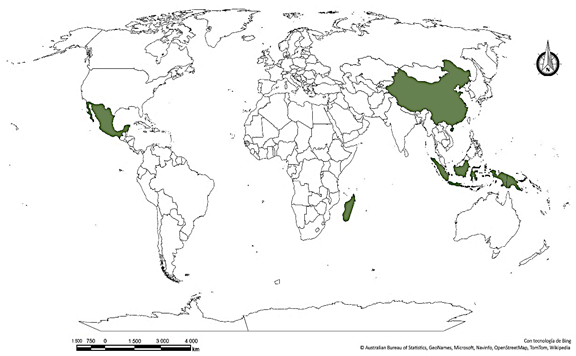
A pesar del valor socioeconómico y cultural que representa este cultivo para el país, México figura como el 3er país productor de vainilla en el mundo (6,7 %), antecediendo con una gran brecha a Madagascar (41,6%) e Indonesia (30,1%) (1er y 2do lugar respectivamente) (figuras 5y6). Las primeras plantaciones de vainilla se establecieron a partir de 1767 por la población Totonaca (en la región de Veracruz) (Ecott, 2004), esta región convirtió a México en el productor de vainilla más importante en el mundo (Bruman 1948) (Figura 7).
Para México, recuperar el liderazgo de producción de vainilla en el mundo es una situación compleja, debido a factores que en conjunto perjudicaron la producción y el valor económico de esta. Entre estos factores se listan a continuación:
I. La excesiva oferta de vainilla en el mercado, derivada de la polinización artificial, lo que en consecuencia provocó una baja en el precio internacional de esta especia (Hérnandez-Hérnandez, 2018).
II. La creación del saborizante artificial (cuyo precio es mucho menor y más accesible para los hogares) (Baqueiro-Peña & Guerrero-Beltrán, 2017).
III. El cambio climático, aumentando la temperatura y la sequía de la principal región productora de México, comprometiendo la producción de vainilla en dos de los sistemas productivos de vainilla (monocultivo y malla sombra) (Parada-Molina et al., 2022).
IV. La poca variabilidad genética de esta especie, la vuelven altamente susceptible a plagas y/o enfermedades (Watteyn et al., 2020).
Para Barrera-Rodríguez et al. (2014), las actuales organizaciones de productores de vainilla en México tienen una posición competitiva frágil. Esto se debe a la debilidad de su cadena de suministro: grandes diferencias con respecto al sector privado (competidores) en los modos de producción, gestión y comercialización, y la incapacidad de satisfacer las necesidades del cliente.
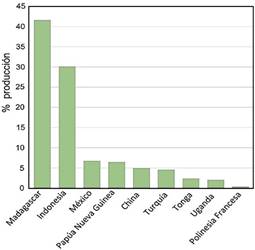
Figura 5 Principales países productores de vainilla en el mundo durante el año 2020 (FAOSTAT, 2020).
Los autores proponen tres estrategias comerciales para mejorar su desempeño: comercializar vainilla verde a las empresas locales de procesamiento, vainilla procesada y desarrollar la agroindustria para vender esencia de vainilla.
5. Prospectiva de la vainilla como agroindustria
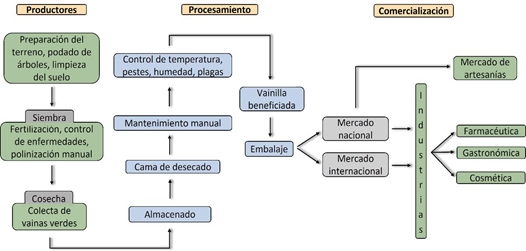
Para la producción de vainilla en México, la opción más realista es la comercialización de la vaina verde, teniendo en cuenta los problemas estructurales de las organizaciones agrícolas de México (Figura 8). Esto implica evitar costos durante el procesamiento, en el mantenimiento, almacenaje, energéticos en el manejo de deshidratación de las vainas, debido a que en esta etapa las vainas se vuelven frágiles ya que aquí es en donde se presenta la mayor incidencia de hongos y, por lo tanto, mayor pérdida de vainas (Khoyratty et al., 2018). Por lo que las grandes empresas tienen una mayor facilidad para enfrentar los retos de producción a los que se enfrenta la vainilla, combatir la presencia de patógenos, almacenaje, distribución, estableci miento de estructuras para la producción como invernaderos de malla sombra (Garza-Morales et al., 2021).
El cultivo de vainilla es una labor intensiva para los productores, puesto que se encuentra ante una situación frágil debido al escaso financiamiento hacia esta agroindustria, el poco o nulo equipo de procesamiento y la poca variabilidad genética que en conjunto comprometen el desarrollo seguro de la materia prima (Espejel-García et al., 2016). Actualmente se han desarrollado estudios en donde se menciona la diversidad genética de vainilla (Bramel & Frey, 2021), en donde V. planifolia resalta como principal especie de interés por sus menciones. Cabe destacar que existen otras especies como V. pompona, V. insignis, V. inodora, V. tahitensis y V. odorata que, si bien son explotadas para la extracción de vainillina, uno de los principales intereses es la obtención de híbridos entre V. planifolia y las antes mencionadas para otorgar resistencia a patógenos como Fusarium oxysporum sin comprometer la calidad de la vainillina. De esta manera se pueden crear híbridos para aprovechar las características de V. planifolia y otras especies pertenecientes al género, por ejemplo, V. insignis (resistencia a F. oxysporum f. sp. vanillae) (Bautista-Aguilar et al., 2022), V. pompona (resistencia a sequía) y V. tahitensis (aprovechada también para saborizantes y fragancias) (Ramos-Castellá & Iglesias-Andreu, 2022).
Estas razones limitan el crecimiento del mercado nacional en combinación con la competencia internacional, saborizantes sintéticos, el gasto económico que representa la fase de procesamiento. En México durante el 2016 se cosecharon 512 toneladas (cuyo valor total se estimó en 50 millones de pesos mexicanos), de las cuales el 95% se destinan al mercado nacional y el 5% restante se exporta principalmente a Estados Unidos y a Francia (SAGARPA, 2021). Con este contexto, el cultivo de vainilla combinado con la aplicación de herramientas tecnológicas potenciaría sus cualidades y facilitaría la exportación y aprovechamiento de esta especie.
La vainilla en México es consumida ampliamente al igual que el café, chocolate y bebidas como el mez cal, sotol, bacanora y tequila (Youssef & Spence, 2021; Baqueiro-Peña et al., 2017; Damirón-Velázquez, 2004). Sin embargo, esta especie presenta graves problemas de conservación debido a poca variación genética intrapoblacional, las principales dificultades a las que se enfrenta como la excesiva recolección para su venta ilegal, deforestación de sus ecosistemas naturales y alta susceptibilidad a patógenos (Vega et al., 2020; Ramírez-Mosqueda et al., 2019; Srivastava et al., 2018; Lubinsky et al., 2008; Bory et al., 2008).
Es debido a la erosión genética (provocada por la excesiva propagación vegetativa) que la susceptibi lidad de esta especie ante cambios climáticos (frío/calor cada vez más acentuados), estrés biótico (ataque de hongos, bacterias y/o insectos) y estrés abiótico (presencia de sequía, déficit nutrimental, presencia de metales pesados en el sustrato) lo que se deriva en la aborción de la flor o la vaina verde (fruto inmaduro), principal producto con el que comercian los productores en México, lo cual afecta severamente la productividad de este sector (Barrera-Rodríguez et al., 2009; Borbolla-Pérez et al., 2016; Castro-Bobadilla et al., 2011). En México debido al conjunto de estos factores esta especie se encuentra catalogada como “sujeta a protección especial (PR)” (SEMARNAT, 2019).
Espejel-García et al. (2016) concluyeron que la in teracción entre actores e instituciones, y la falta de infraestructura de soporte es debido a los proble mas socioeconómicos que presenta la cadena productiva limitando la construcción de sistemas de innovación de V. planifolia en los principales estados productores de México como Veracruz, Puebla y San Luís Potosí. A una conclusión similar llegaron Borbolla-Pérez et al. (2016a) al reportar que la producción se encuentra limitada por la infraestructura, tecnología, susceptibilidad a diferentes tipos de estrés, así como la nula capacitación y la poca organización entre productores, aunado al bajo nivel educativo que presentan los productores limitando así la aplicación de este conocimiento al campo. Por otro lado, Méndez-Cortés et al. (2019) reportan que la participación de los agentes (productores e intermediarios) en Papantla, Veracruz difiere de valor respecto a la ubicación de estos, por citar un ejemplo, establecen que el mayor margen de ganancia (42%) lo obtienen los acopiadores (beneficiadores), seguido de los productores (40%) al vender la vaina verde, después el intermediario (10%) y por último el detallista (8%).
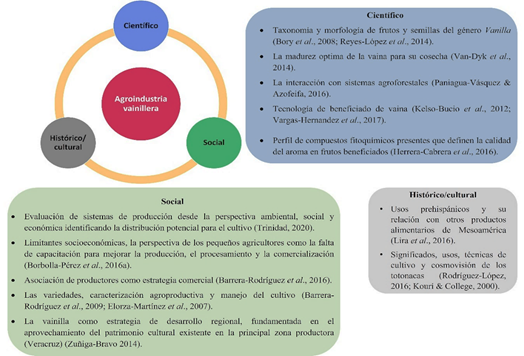
La vainilla ha sido estudiada con fines agroindus triales desde diferentes ángulos, entre ellos se encuentran el histórico/cultural, científico y social (Figura 9). En este sentido, se propone un FODA con información de estudios de Espejel-García et al. (2016); Lubinsky et al. (2018) y Méndez-Cortés et al. (2019) (Tabla 1) como una he rramienta que permita identificar las características de los sistemas agroproductivos vainilleros para la toma de decisiones.
Bajo este contexto y dada la relevancia de la vainilla, es que debido a sus cualidades se puede considerar como una especie promisoria para la explotación en biofábricas. En México existen algunos ejemplos exitosos como la “Biofábrica siglo XXI” en Morelos, la cual tiene como meta mejorar la rentabilidad y sustentabilidad de productos agrícolas; Biofábrica CICY (Centro de Investigación Científica de Yucatán) la cual trabaja con henequén (Agave fourcroydes), agave mezcalero (Agave angustifolia), banano (Musa paradisiaca), papaya (Carica pa paya), café (Coffea arabica), achiote (Bixa orellana), etc., Biopla In Vitro, empresa de biotecnología en Villahermosa, Tabasco la cual se dedica a propagar plátano (Musa paradisiaca), papaya (Carica papaya), y estevia (Stevia rebaudiana). Esto agrega un alto valor bajo el concepto de integración pro ductiva, biorrefinerías y economía circular. Sin embargo, para Paniagua-Vásquez et al. (2013), la susceptibilidad de V. planifolia es preocupante debido a la falta de variabilidad genética provocada principalmente por la pérdida de su hábitat natural, a la casi nula presencia de su polinizador natural y a la propagación clonal (por medio de esquejes) a gran escala.
Así pues, existe un valor agregado en el sentido del aprovechamiento de la especie por parte de las biofábricas, por ejemplo, Baqueiro-Peña & Guerrero-Beltrán (2017) concluyeron que los resi duos o subproductos del beneficio de vainilla no se han estudiado y caracterizado en su composición. Por lo tanto, representa una opción interesante para la explotación, ya que hay antecedentes de aprovechamiento de “residuos” en especies como la pulpa del café (antioxidante, anticancerígeno, antiinflamatorio), melazas de caña (ácido cítrico para la industria farmacéutica), flores como las rosas (extracción de compuestos aromáticos), etc.
Sin embargo, queda sin resolver el principal reto de la conservación, el mantenimiento de la diversidad genética que aún existe. Por lo que Azofeifa-Bolaños et al. (2014) plantearon la urgencia de desarrollar estrategias que permitan la conserva ción y aprovechamiento de este recurso vegetal con fines de mejoramiento, investigación y producción comercial.
En este sentido, el germoplasma de la vainilla tradicionalmente se ha conservado ex situ a largo plazo mediante plantas enteras en condiciones de cultivo en campo, pero esta forma enfrenta altos riesgos de pérdida de la diversidad genética ya que la propagación de esta especie se da mayormente por esquejes, lo que conlleva al aumento de poblaciones clonales altamente susceptibles a cualquier patógeno y cambio climático, por otro lado, la germinación de semillas de vainilla es complicada naturalmente, debido a la impermeabilidad de la testa que impide el flujo de líquidos y nutrientes a la semilla (Yeh et al., 2021; Schlüter et al., 2007).
En México se utilizan tres métodos para propagar la vainilla. 1) Esquejes o tramos de tallo de 80 cm o más; 2) Cultivo in vitro y 3) Semillas. El primero es el que se utiliza comercialmente para su propagación. En las regiones vainilleras de México, los esquejes se obtienen en plantaciones comerciales, ya que no existen viveros que se dediquen exclusivamente a la producción de éstos (Santillán-Fernández, 2019). La propagación convencional es lenta, requiere mucho trabajo y consume mucho tiempo para el crecimiento y desarrollo de la planta madre (Geetha & Shetty, 2000; Giridhar & Ravishankar, 2004). El segundo caso es el más ampliamente utilizado, debido a la practicidad que implica, ya que se puede conseguir una gran cantidad de propágulos en espacios reducidos y en menor cantidad de tiempo (Loyola-Vargas & Ochoa-Alejo, 2018). Además de estar limitada la propagación sexual por la baja viabilidad y tasa de germinación de sus semillas (Sasikumar, 2010).
Las técnicas biotecnológicas, como estrategias de innovación tecnológica, contribuyen significativamente en los programas de propagación y conser vación de las especies vegetales que permitan crear nuevos bancos de germoplasma y disponer de abundante material en condiciones fitosanitarias adecuadas (Wang et al., 2009). El cultivo in vitro es una herramienta clave en la biotecnología vegetal que explora la naturaleza totipotencial de las célu las vegetales, que se utiliza en la propagación a gran escala de clones libres de enfermedades y conservación de germoplasma (Grout, 2017). La micropropagación se ha convertido en la base de una gran industria de propagación de plantas comerciales que involucra a cientos de laboratorios alrededor del mundo.
Es crucial explotar el potencial de cultivo in vitro para multiplicar y suministrar la cantidad necesaria de materiales de plantación a gran escala (Abebe et al., 2009). Esta tecnología también puede ser utilizada para satisfacer la demanda del mercado de vainilla y superar las dificultades en métodos alternativos de propagación. Por todo lo anterior el presente trabajo, está enfocado a analizar las estrategias biotecnológicas actuales, para la propagación y conservación in vitro de germoplasma de vainilla.
6. Innovaciones biotecnológicas en el cultivo in vitro de la vainilla
Uno de los principales enfoques en la investigación biotecnológica es el desarrollo de nuevas técnicas y herramientas que permitan la propagación a una escala deseable de especies vegetales para su aprovechamiento con fines agronómicos, económicos y ecológicos (Loyola-Vargas & Ochoa-Alejo, 2018). Desde sus inicios, el cultivo de tejidos vegetales se ha convertido en una herramienta indispensable para la producción de plantas libres de enfermedades, propagación a gran escala en espacios pequeños, conservación de germoplasma, transformación genética, producción de metabolitos de interés (Dagla, 2012; Smith, 2013).
V. planifolia se ha propagado utilizando técnicas de cultivo de tejidos las cuales han mostrado mayores ventajas que el método convencional. A través del cultivo de tallos (Giridhar et al., 2001), puntas de raíz (Philip & Nainar 1986), puntas de brotes (Kalimuthu et al., 2006), brotes axilares (Divakaran et al., 2006; Geetha & Shetty, 2000; Lee-Espinosa et al., 2008), así como porciones de hojas (Janarthanam & Seshadri, 2008; Tan et al., 2011,2013).
6.1 Micropropagación vía segmentos nodales
Los primeros trabajos de micropropagación en vainilla se han llevado a cabo exitosamente en donde la principal fuente de explante son los segmentos nodales (Philip & Nainar, 1986; Rao et al, 1993; Ganesh et al., 1996; George & Ravishankar, 1997; Geetha & Sudheer 2000), el lapso de estos estudios para completar la inducción y proliferación de brotes era de 4 a 6 meses. El medio basal ha consistido en altas concentraciones de sales, como las que constituyen el medio MS (Murashige & Skoog, 1962) el cual ha demostrado desde su primer reporte ser uno de los principales medios de sales basales para el cultivo in vitro de la vainilla en sus diferentes etapas.
Sin embargo, para tener una mejor respuesta el medio de cultivo es suplementado con reguladores de crecimiento vegetal, entre los más utilizados se encuentran la Bencilaminopurina (BA) en concentraciones que varían entre 0,5 y 2 mg L-1, Ácido naftalenacético (ANA) de 0,5 a 1 mg L-1, Ácido indolacético (AIA) y Kinetina (KIN) (Giridhar & Ravishankar 2004; Gopi et al., 2006; Chitra et al., 2007; Abebe et al., 2009; Gantait et al., 2009). Cabe destacar que V. planifolia no solo responde positivamente al medio MS, por ejemplo, Giridhar & Ravishankar (2004) probaron con éxito el medio N69 (Nitsch, 1969) reportando hasta 12 brotes por explante con una longitud 1,2 cm con la adición de zeatina. Las tasas de regeneración por explante se han podido incrementar con la adición de Thidiazuron (TDZ) y agua de coco 100% (Tabla 2) (Kalimuthu et al., 2006; Tan et al., 2011). Chin et al. (2011) mostraron un aumento significativo en la tasa de regeneración al adicionar nitroprusiato de sodio (NPS).
Tabla 2. Efecto de diferentes reguladores de desarrollo vegetal en segmentos nodales de Vanilla planifolia
| Reguladores de desarrollo vegetal | Número de brotes por explante | Número de hojas por brote | Número de raíces por brote | Referencia |
| AgNP's | 7,9 | 2,7 | --- | Pastelín-Solano et al., 2020 |
| BA | 3,27 | 3,8 | 1,6 | Inderiati et al., 2019 |
| TDZ | 1,6 | --- | --- | Jing et al., 2014 |
| BA + NAA | 4,2 | --- | --- | Tan et al., 2011 |
| BA | 9,43 | --- | --- | Kalimuthu et al., 2006 |
| BA + IBA | 13,5 | --- | 2,46 | Divakaran et al., 2006 |
Se ha observado que la posición de los explantes nodales tiene un efecto en la capacidad de regeneración y/o crecimiento en las plantas (Giridhar & Ravishankar 2004; Lee-Espinosa et al., 2008). El cultivo in vitro se ha realizado mayormente empleando medio semisólido con la adición de Phytagel o agar como agentes gelificantes a diferencia del uso de biorreactores (Figura 10).

Figura 10 Propagación de Vanilla planifolia in vitro. A: Sembrada en medio semisólido, B: Sembrada en Bioreactor RITA®.
Cabe destacar que, existen estudios en donde se ha observado el incremento en el número de brotes al exponer los explantes a medio líquido en Sistemas de Inmersión Parcial (SIP) (Tan et al., 2011; Ramos-Castellá et al., 2014). Domingues et al. (2013) desarrollaron un eficiente método a partir de segmentos nodales para la propagación in vitro usando un sistema de cultivo de doble fase (medio semisólido y una capa de medio líquido), incrementando la tasa de regeneración 2,5 veces que un medio normal.
6.2 Sistemas de Inmersión Temporal
Actualmente se han desarrollado nuevas metodologías para la propagación in vitro de plantas, dentro de las que destacan los Sistemas de Inmersión Temporal (SIT). La micropropagación en SIT consiste en el cultivo de células, tejidos u órganos expuestos temporalmente a medio de cultivo líquido en biorreactores semiautomatizados bajo condiciones axénicas y controladas (Bello-Bello et al., 2014,2015). Existe una gran variedad de SIT implementados con sistemas automatizados lo cual reduce la manipulación del material vegetal, por ejemplo, el Recipiente de Inmersión Temporal (RITA®), Biorreactor de Inmersión Temporal (BIT), Biorreactor Modular de Inmersión Temporal (BioMINT®) y más recientemente los biorreactores MATIS®, Plantima®, ELECTIS y SETIS™ (Alvard et al., 1993; Escalona et al., 1999; Robert et al., 2006) (Figura 11).
Los SIT se han convertido en una herramienta eficaz para la micropropagación (Berthouly & Etienne 2005; Watt 2012), ya que representa diferentes ventajas:
a) Incrementa el coeficiente de multiplicación,
b) Producción a gran escala,
c) Reduce los costos de producción, al reducirse las manipulaciones,
d) Simplifica los cambios de medios de cultivo,
e) Mejoramiento en la calidad del material regenerado.
Si bien se ha demostrado la utilidad en la propagación de diferentes especies vegetales en los diversos biorreactores existentes (Tabla 3), también pueden ser empleados para la producción de metabolitos secundarios (El-Sharabay & El Dawayati, 2019). Los SIT con diferentes frecuencias de inmersión han sido reportado para mejorar la calidad y elevar las tasas de multiplicación en plántulas de vainilla (Etienne & Berthouly, 2002). Ramos-Castellá et al. (2014) reportan la micropropagación más eficiente para vainilla en RITA® el cual permitió aumentos sustanciales en el número de brotes (14,27 brotes por explante) formados en un período de tiempo más corto, sin requerir subcultivos que puedan aumentar los costos de producción, la frecuencia de inmersión utilizada fue de 2 min cada 4 h, seguido del sistema de inmersión parcial (8,64 brotes) y medio sólido (5,80 brotes).
Ramírez-Mosqueda & Iglesias-Andreu (2016), observaron diferentes respuestas de las plántulas in vitro de vainilla, según el tipo de sistema de inmersión temporal utilizado, resultando 18,06 brotes por explante en sistemas BIT® seguido de RITA® con 12,77 y BIG 6,83. Teniendo un efecto positivo el sistema BIT® en la tasa de supervivencia de las plántulas micropropagadas del 100%. La utilización del cultivo in vitro de segunda generación, en numerosos sistemas de inmersión temporal, ofrece muchas ventajas en el proceso de micropropagación a escala de Vanilla planifolia.
Tabla 3. Aplicaciones de propagación para diferentes especies vegetales
| Sistema de cultivo | Número de brotes por explante | Especie | Referencia |
| ELECTIS | 30 | Malus sylvestris | Sota et al., 2021 |
| RITA | 2,5 | Salix viminalis | Gago et al., 2021 |
| RITA | 3,05 | Agave angustifolia | Monja-Mio et al., 2021 |
| TIBS | 21 | Larix × eurolepis Henry | Kim-Cuong et al., 2021 |
| SETIS | 7,3 | Mussa AAA cv. Grand Naine | Bello-Bello et al., 2019 |
| RITA | 8,47 | Stevia rebaudiana | Bayraktar 2019 |
| TIBS | Bletilla striata | Zhang et al., 2018 | |
| TIS | 4,5 | Spathiphyllum cannifolium | Dewir et al., 2006 |
6.3 Germinación in vitro de las semillas
La germinación de las semillas in vitro de la vainilla ha sido muy estudiada, sin embargo, son pocos los reportes que han tenido éxito con esta estrategia. El medio de cultivo más eficiente para la germinación in vitro de vainilla es el MS (Murashige & Skoog, 1962). Menchaca (2011) empleó medio MS adicionado con 400 mg L-1 de glutamina y 80 mg L-1 de sulfato de adenina para germinar semillas de V. planifolia, V. pompona e híbridos de estas. El mejor resultado para la germinación (85%) lo obtuvieron con V. planifolia x V. pompona, seguido de V. pompona x V. planifolia (57%), en contraparte la tasa de germinación más baja (10%) se reportó en V. pompona x V. pompona, por último, en cruzas de V. planifolia x V. planifolia no hubo germinación. Pedroso-do-Morales et al. (2012) determinaron que sesenta segundos de escarificación con H2SO4 en un medio MS con sus sales reducidas al 25% proporcionó los mejores resultados alcanzado el 65% de germinación, siendo un procedimiento viable para la producción comercial de esta especie.
Los estudios a partir de semillas de Vanilla planifolia han sido diversos, sin embargo, muy pocos han sido con la finalidad de germinar las semillas, la mayoría se ha enfocado a tomar como fuente de explante las semillas para la producción de callos (Palama et al., 2010; Menchaca et al., 2011). La germinación in vitro de semillas de V. planifolia representa una alternativa para recuperar la variabilidad genética obteniendo una germinación exitosa.
Palama et al. (2010) sembraron aproximadamente de 200 a 300 semillas (de vainas verdes de 7 meses de edad), las cuales fueron cultivadas bajo oscuridad en un medio MS con 0,5 mg L-1 TDZ obteniendo callo embriogénico. Los callos embriogénicos primarios fueron formados después de transferir a un medio basal con AIA (0,5 mg L-1) y TDZ (0,5 mg L-1). Estos callos fueron mantenidos por subcultivo en medio basal que contiene IAA (0,5 mg L-1) y TDZ (0,3 mg L-1) durante 6 meses para estimular la formación de embriones somáticos. Tan et al. (2011) indujeron la formación de callo en medio MS con 2,0 mg L-1 de ácido naftanelacético (ANA) y 1,0 mg L-1 de 6-benciladenina (BA) a partir de explantes juveniles de hojas (5%) y segmentos nodales (35%), posteriormente se indujo organogénesis indirecta generando 4,2 brotes por callo en medio MS con 1,0 mg L-1 de BA y 0,5 mg L-1 de ANA. Ramírez-Mosqueda & Iglesias-Andreu (2015) partieron de semillas de vainas inmaduras para la obtención de callo organogénico.
6.4 Variación somaclonal
Debido a que V. planifolia es propagada principalmente de forma vía asexual, la casi nula polinización natural y la poca diversidad de poblaciones silvestres, es que se ha provocado una alta erosión genética en esta especie (Paniagua-Vásquez et al., 2013). Por estas razones se vuelve necesario el desarrollo de estrategias que permitan la inducción de variación somaclonal. Villegas-Ramírez & Palma-Zuñiga (2022) reportan que la vainilla bajo condiciones in vitro y una constante exposición al BAP (6 a 10 subcultivos) comienzan a generar va riación genética.
Tabarés et al. (1991) definen la variación somaclonal como la variación genética que se origina en los cultivos celulares y de tejidos vegetales. La variabi lidad genética se puede ampliar mediante técnicas de cultivo in vitro. El uso de rutas morfogénicas in directas permite aumentar el porcentaje de varia ción somaclonal en plántulas regeneradas.
Ramírez-Mosqueda & Iglesias-Andreu (2015) establecieron un protocolo para la organogénesis indirecta en V. planifolia, el callo friable fue inducido de semillas inmaduras cultivadas en la oscuridad, utilizando medio MS suplementado con 2,27 μM Tidiazuron (TDZ). Se regeneraron 6,8 brotes por callo en medio MS suplementado con 8,88 mM de BA. Los análisis moleculares de las plántulas regeneradas vía organogénesis indirecta revelaron la existencia de un 71,66% de polimorfismo. La variabilidad generada puede ser de gran interés para la obtención de líneas celulares tolerantes y/o resistentes a diversos factores de estrés abiótico (déficit hídrico) y/o bióticos (Fusarium oxysporum f. sp. vanillae), factores que han sido atribuidos a la caída de frutos en este cultivo (Ramírez-Mosqueda et al., 2015).
Se sabe que las mutaciones se presentan de forma natural en las poblaciones, sin embargo, unas lo hacen con mayor frecuencia que otras, un ejemplo de esto son las mutaciones espontaneas, las cuales se presentan muy raramente en poblaciones naturales, por lo que el estímulo para la aparición de estas puede representar una estrategia para ampliar el acervo genético de V. planifolia y generar especies tolerantes y/o resistentes a estrés biótico y abiótico. Además, abriría nuevas perspectivas para implementar una mejora genética.
6.5 Marcadores moleculares
Los marcadores del ADN se basan fundamentalmente en el análisis de las diferencias en pequeñas secuencias del ADN entre individuos. Existe una gran diversidad de marcadores, clasificados principalmente en dos grupos; dominantes o codominantes. El uso de marcado res RAPD, AFLP e incluso SSR ha permitido separar claramente individuos V. planifolia, V. tahitensis y V. pompona estos resultados han sido esenciales para el análisis genético de los especímenes cultivados de vainilla durante su introducción (Favre et al., 2022; Besse et al., 2004). Por otro lado, Divakaran et al. (2006) además de RAPD ha combinado el uso de AFLP para evaluar la variabilidad y la naturaleza de genotipos y producción de híbridos entre V. planifolia y V. aphylla.
La baja diversidad genética en vainilla ha sido reportada a través de análisis RAPD (Besse et al., 2004) y AFLP (Duval et al., 2006) también a través de RAPD e ISSR (Verma et al., 2008) y SSR’s (Simiyu et al., 2020). Se ha descrito además el aislamiento y caracterización de microsatélites de V. planifolia los cuales fueron transferibles a V. tahitensis y a especies silvestres de América, África y Asia. Los microsatélites han resultado útiles para estudios de diversidad, hibridación y estudios filogeográficos en el género Vanilla (Andriamihaja et al., 2021; Bory et al., 2008, Gigant et al., 2012). Por otro lado, diversos estudios han demostrado la eficacia de ISSR en el cultivo de vainilla tales como fidelidad genética (Bautista-Aguilar et al., 2021; Reddampalli et al., 2007), diversidad genética (Chambers et al., 2021; Praveen et al., 2009), variación somaclonal (Ramírez-Mosqueda & Iglesias-Andreu, 2015).
6.6 Conservación de Vanilla planifolia
Debido a la poca variabilidad genética presente en V. planifolia es que se ha desarrollado interés en la polinización cruzada con otras especies del género Vanilla (pompona, tahitensis e insignis principalmente) y obtener beneficios de la diversidad genética intraespecífica, por ejemplo, combinar la resistencia a estrés biótico y/o abiótico al mismo tiempo que se estimula la producción de vainilla (Pansarin & Ferreira et al., 2021; Ramachandra & Ravishankar, 2000). Si bien es importante la conservación de germoplasma, esta representa una alta inversión económica, limitando el número de accesiones que pueden ser preservadas (Divakaran et al., 2006).
Las estrategias de conservación más eficientes en la actualidad tienen un enfoque biotecnológico, ya que complementan a las estrategias tradicionales ya establecidas (huertos y bancos de semillas). Estos métodos consisten en limitar el crecimiento hasta tasas mínimas llamada “conservación por lento crecimiento” (Hernández-Leal et al., 2020) o a la supresión total del metabolismo celular conocida como “crioconservación” (Hernández-Ramírez et al., 2020). Dentro de las ventajas de las estrategias biotecnológicas se encuentra el poco espacio requerido para el establecimiento de vitro plantas, reducción en trabajo mecánico y manipulación del material vegetal, salvaguardando su integridad e inocuidad y permitiendo así el mantenimiento de bancos de germoplasma eficientes y funcionales (Nhut 2022; Engelmann & González-Arnao, 2013).
Estas técnicas de conservación a mediano y largo plazo en Vanilla spp. han sido estudiadas ampliamente por diversos autores (González-Arnao et al., 2018; Chaipanich et al., 2019; Hernández-Ramírez et al., 2020; Divakaran et al., 2006; González-Arnao et al., 2009; Divakaran & Babu, 2009). Por lo que es en este sentido que el sistema de conservación in vitro por medio del cultivo de tejidos vegetales que se puede optar por la ruta de la conservación de germoplasma de vainilla con especial interés ante diferentes factores de producción, resistencia, tolerancia, etc. (Gantait, 2017; Martínez-Santos et al., 2021; Pastelín-Solano et al., 2019; Divakaran et al., 2006).
6.7 Crioconservación
Se han desarrollado investigaciones cuyo principal objetivo es la reducción del crecimiento y desarrollo de las plantas para su conservación a mediano y largo plazo, siendo la principal técnica la “Crioconservación”, cuyo principio es exponer el tejido vegetal a temperatura muy bajas. La combinación de esta técnica con el cultivo de tejidos vegetales resulta en una herramienta muy útil para la conservación de germoplasma a lapso deseado (por lo general a largo plazo) (Agrawal et al., 2019; Panis et al., 2020; Panis & Lombardi, 2005; Khoury et al., 2010; Pritchard et al., 2013).
Existe una gran diversidad de técnicas de crioconservación, como la inmersión en nitrógeno líquido, deshidratación por medio de agentes osmorreguladores, encapsulación y vitrificación, todo en dependencia de la especie y órgano(s) que se deseen conservar (semillas, embriones cigóticos, muestras de tejidos, yemas apicales, meristemos, etc.) (González-Arnao et al., 2020; Calva-Estrada et al., 2018; Ocampo-Salinas et al., 2020; Sakai, 1995; Panis, 1995, González-Arnao et al., 2009). Se ha estudiado el almacenamiento seguro de ápices de vainilla mediante técnicas basadas en la vitrificación, como es el caso de la técnica de Gota-Vitrificación (G-V) (González-Arnao et al., 2009), donde se experimentó en las distintas etapas que implica la técnica, sin embargo la combinación que resultó con mayores índices de regeneración fue empleando un pre acondicionamiento utilizando medio de cultivo MS suplementado con sacarosa (0,3 M) durante un solo día, un tratamiento de carga también con sacarosa 0,4 M en combinación con el glicerol 2 M y la solución vitrificadora PVS3 [50% (w/v) de glicerol + 50% (w/v) de sacarosa], durante 30 minutos de exposición, manteniendo a los tejidos en total oscuridad durante una semana, para favorecer su recuperación. Se obtuvo 30% de sobrevivencia, sin embargo, solo se obtuvo un 10% de regeneración después de 6 meses de la crioconservación.
Hernández-Ramírez et al. (2014) realizaron modificaciones a lo reportado anteriormente, utilizaron trehalosa, durante el preacondicionamiento y el tratamiento de carga. Prolongaron la duración del preacondicionamiento (7 días de recuperación de los ápices recién extraídos), en medio MS y posteriormente 1 o 7 días en medio de cultivo MS suplementado con trehalosa (0,3 M), tratados con solución de carga trehalosa-glicerol, manteniendo a los tejidos en total oscuridad por al menos 3-4 meses para su recuperación, antes de su transferencia a las condiciones estándar de iluminación. Esto favoreció el aumento de la sobrevivencia (de 30% a 60%). Sin embargo, estos resultados no se han logrado reproducir hasta ahora y tampoco han mejorado la tasa de regeneración (10%) de los ápices crioconservados en comparación con lo reportado por González-Arnao et al. (2009).
Las condiciones que se han reportado para obtener estos porcentajes tanto de sobrevivencia como de regeneración establecen un antecedente que da pauta a cuáles podrían ser las alternativas que garanticen el almacenamiento seguro de germoplasma de vainilla a largo plazo, por lo que es necesario seguir abundando en este tema y estudiar otras técnicas criogénicas que han resultado exitosas para otras especies vegetales con características similares a la vainilla.
7. Conclusiones
México se caracteriza por ser un país megadiverso que con la aplicación de herramientas biotecnológicas puede plantear estrategias de conservación y aprovechamiento sustentables con la capacidad de producir, conservar, aumentar la variabilidad genética para obtener plantas de vainilla resistentes a estrés biótico y/o abiótico. A pesar de que México aún se encuentra en el desarrollo de estas tecnologías, aunado a la escasa capacitación productiva de los productores vainilleros en el país, se encuentra en tercer lugar de producción mundial. Es por las razones antes expuestas que México representa un campo de oportunidades muy interesante para la aplicación de las tecnologías antes mencionadas. Debido al estatus de conservación en el que se encuentra la vainilla es necesario llevar a cabo acciones para la conservación, aprovechamiento y uso sostenible de esta especie.
En este estudio, se evidenciaron las aportaciones de los distintos proyectos de investigación referentes a los métodos de propagación y conservación in vitro de la especie Vanilla planifolia, que se han realizado por diversas organizaciones en todo el mundo y en particular en México donde es considerado centro de origen y diversificación. Las aportaciones hacen referencia a las estrategias biotecnológicas para el cultivo, mejoramiento genético y almacenamiento seguro a largo plazo de esta especie. Se discutió la relevancia de estos hallazgos y su posible impacto en la promoción de la conservación de la vainilla y la prospectiva de su uso diversificado.