1. Introducción
El café (Coffea spp.) originario de la provincia etíope de Kaffa, África, es uno de los productos más comercializados a nivel mundial con creciente importancia económica en los últimos 150 años, solo por detrás del petróleo (Daglia et al., 2000; Carvalho et al., 2011; Dechassa, 2019). Aunque el género Coffea cuenta aproximadamente con 125 especies, solo C. arabica L., y C. canephora Pierre ex A. Froehner conocidos como café arábica y robusta, respectivamente, son las especies más representativas con aproximadamente el 99% de la producción mundial (Ogundeji et al., 2019; Pilozo et al., 2022). El café es cultivado en más de 80 países (Lu et al., 2022), considerado un cultivo de importancia económica debido a los ingresos de su producción y la cantidad de personas que dependen de ella para su sustento diario, especialmente en regiones tropicales (Harelimana et al., 2022). Los registros de producción hasta el 2019 en toneladas métricas posicionan a Brasil como el mayor productor a nivel mundial con 3.370 t, seguido de Vietnam y Colombia con 1.606 y 738 t, respectivamente (NationMaster, 2021).
En los últimos años, la producción de cerezas (granos) de café se ha visto afectada negativamente por el cambio climático y baja fertilidad de suelos (Adhikari et al., 2020; Naik et al., 2021; Wang et al., 2015), dificultando grandemente el manejo de sus enfermedades (Kumar et al., 2020). A esto se le puede sumar las malas prácticas agrícolas como el mal uso de pesticidas sintéticos, que resulta en una pérdida de sensibilidad de las moléculas usadas en el manejo de enfermedades fungosas (Kumar et al., 2020). Así, debe considerarse la importancia de las enfermedades en el cultivo de café, ya que estos factores bióticos alteran su estado normal, e interrumpen y modifican sus procesos fisiológicos, ocasionándoles daños considerables (Ventura et al., 2017; Esgario et al., 2022).
Entre las enfermedades que afectan los cafetales sea en un sistema a cielo abierto o bajo un sistema agroforestal, posiblemente las de etiología fúngica son las que más reducen la producción de granos. Entre estas enfermedades, las más importantes en Latinoamérica próximas a la línea ecuatorial, están la Roya (Hemileia vastatrix Berkeley & Broome), Mal de hilachas (Ceratobasidium noxium (Donk) Roberts) y Cercosporiosis (Cercospora coffeicola (Cooke) J. A. Stev. & Wellman). La primera enfermedad puede reducir en hasta un 90% el rendimiento de granos en un cafetal (Sera et al., 2022; Bigirimana et al., 2012). Mal de hilachas afecta prácticamente todos los tejidos aéreos de las plantas de café, reduciendo considerablemente el rendimiento del cultivo (Belachew et al., 2015). Poco o nada se conoce sobre la interacción entre cafetos y Mal de hilachas. Finalmente, la Cercosporiosis infecta el área foliar y los granos de plantas de café, reduciendo en hasta un 50% el rendimiento de granos (Fernández-Borrero et al., 1982).
Considerando la importancia del cultivo de café y sus enfermedades fúngicas como Roya, Mal de hilachas y Cercosporiosis, en esta revisión literaria se consideró describir a) la sintomatología y etiología de las tres enfermedades, usando para esto figuras y micrografías propias con alta resolución tomadas en campo y laboratorio, respectivamente; b) un ciclo de vida para cada enfermedad tomando en cuenta cada una de las fases dentro de una interacción planta-patógeno usando para esto el software en línea BioRender; y c) el manejo aislado e integrado de cada una de las tres enfermedades.
2. Roya
Etiología
Aunque la roya fue reportada de forma general en 1861 por un explorador inglés en África Oriental (cerca del Lago Victoria) en especies silvestres de café, en 1869 Berkeley y Broome en el este de África y Ceilán, describieron el patógeno y lo nombraron de H. vastatrix (Talhinhas et al., 2017). En Latinoamérica, la roya está presente en Brasil (Medeiros, 1970), Nicaragua (OIRSA, 1976), Perú (Echeverri, 1979), El Salvador (Echeverri, 1980), Guatemala (Schieber & Sánchez, 1982), Ecuador (INIAP, 1981), México (Vásquez, 1983) y Venezuela (Silva-Acuña et al., 1997).
Taxonómicamente el agente causal de la roya pertenece al Phylum: Basidiomicota, Clase: Pucciniomicetes, Orden: Pucciniales, Familia: Mikronegeriaceae, Género: Hemileia, y Especie: Hemileia vastatrix (Aime et al., 2006; Talhinhas et al., 2017; McTaggart et al., 2016). Además de H. vastatrix, H. coffeicola ha sido reportada como el agente etiológico de la roya polvorienta pero únicamente en cafetales de África (Gil-Vallejo, 2003). Hasta el momento, H. coffeicola no ha sido reportada en las zonas cafetaleras del continente americano (Gil-Vallejo, 2003). El basidiomiceto H. vastatrix presenta uredosporas mayoritariamente reniformes que miden entre 27 a 34 × 18 a 28 µm, con una superficie convexa y cóncava en la parte superior e inferior, respectivamente (Figura 1 C-E) (Keith et al., 2022). Sus teliosporas tienen forma subesférica y napiforme, son pediceladas con papila terminal, con diámetro de 12 a 27 x 15 a 27 µm, y sus paredes son lisas y delgadas de color amarillo pálido (Fernandes et al., 2009).
Sintomatología
A pesar de no estar claro, se cree que las hojas jóvenes son difíciles de ser infectadas, posiblemente porque el agua tiende a escurrir con mayor facilidad, cuando comparadas con las hojas adultas que son infectadas con facilidad (Rayner, 1961). Sin embargo, en ambos tipos de hojas se presentan pústulas de Roya. Los síntomas comienzan en el haz de hojas con la presencia de pequeñas man chas de color amarillo pálido (Figura 1 A), que se expanden hasta los 2 cm de diámetro (Zambolim, 2016). Posteriormente, aparecen manchas polvo rientas de color anaranjado en el envés de hojas denominadas pústulas, que son predecesoras de la diferenciación de las uredias supraestomatales (Figura 1 B) (Zambolim, 2016; Talhinhas et al., 2017). Independiente del tipo o sistema de cultivo, la roya causa intensa defoliación en cafetos. Una incidencia de alrededor del 36% puede causar defoliación severa en plantas de café (Figura 2 E), que resulta en una reducción significa tiva en su producción de granos (Aristizábal & Johnson, 2022).
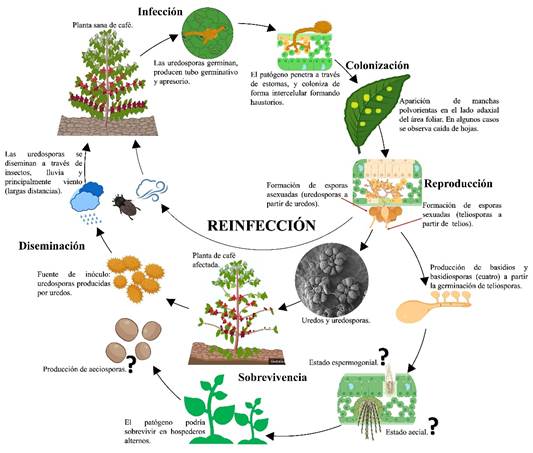
Ciclo de vida
El basidiomiceto causante de la roya es un patógeno biótrofo (parasito obligado) que depende de su hospedero vivo, el cafeto (Segura-Escobar, 2017). Sin embargo, H. vastatrix podría tener hospederos alternos como arvenses del género Croton, Euphorbia y Rubus (Koutouleas et al., 2019). Las uredosporas presentes en cafetos u hospederos alternos conformarían el inóculo primario. Estas estructuras fúngicas pueden ser transportadas por insectos y el viento a cortas y largas distancias, respectivamente (Martínez et al., 1975). Incluso, el viento podría dispersar uredosporas de H. vastatrix a nivel transcontinental (Brown & Hovmøller, 2002). La lluvia también es un factor de dispersión del patógeno a nivel local, afectando favorablemente la intensidad de la enfermedad dentro del cafetal (Figura 2) (Waller, 1982; Brown & Hovmøller, 2002).
Algunas poblaciones de H. vastatrix tienen la capacidad de infectar más de una especie de Coffea (Ramírez-Camejo et al., 2022). Una vez que las uredosporas alcanzan el haz de las hojas, el patógeno requiere una lámina de agua constante y prolongada en la superficie de por lo menos 8 horas, temperatura entre 21 y 25 °C, y alta humedad relativa (80%), para que dentro de 18 horas estas puedan germinar y producir de uno a tres tubos germinativos (Kushalappa & Eskes, 1989; Zambolim, 2016). En el proceso de infección las hifas del patógeno penetran, para luego colonizar intercelularmente la cámara subestomatal y las células del mesófilo, mediante la abundante formación de haustorios (Figura 2) (Kushalappa & Eskes, 1989; Fernandes et al., 2019; Zambolim, 2016).
El basidiomiceto H. vastatrix se reproduce clonalmente en todas las áreas donde este se distribuye, y donde exista una basta población de plantas hospedantes para sustentar su crecimiento (Ramírez-Camejo et al., 2022). El patógeno se reproduce a través de diferentes estructuras sobre tejidos foliares de los cafetos. produciendo uredias y sobre estas uredosporas (reproducción asexuada o anamórfica) entre 10 y 25 días, tiempo contabilizado desde el inicio de la infección hasta su producción (Djuikem et al., 2021).

Figura 1 Síntomas de roya y estructuras de Hemileia vastatrix en cafetos. A) Lesiones (pústulas) de la roya sobre la superficie del envés de hojas de cafetos. B) Presencia de una mancha polvorienta de color anaranjado o conjunto de pústulas. C) Uredias y uredosporas. D) Uredosporas. E) Uredosporas sobre la epidermis de hojas de cafetos. Ep: epidermis. Es: estomas. Me: mesófilo. Pu: pústulas. Ur: uredias. Us: uredosporas. Barras (C-E): 20 µm.
El tiempo dependerá de las condiciones ambientales. Estas estructuras que son observadas en el envés de las hojas aparecen como manchas polvorientas de color anaranjado. Independientemente de la intensidad de la roya, puede darse la defoliación del cafeto (Zambolim, 2016). La producción de uredias y uredosporas es intensa y cíclica en los cafetales, haciendo con que la roya sea clasificada como una enfermedad policíclica. Esto puede ser potenciado principalmente por el viento y precipitaciones pluviales (Figura 2) (Avelino & Rivas, 2013).
El patógeno también produce telios y sobre estos teliosporas (reproducción sexuada o teleomórfica). La etapa sexual del ciclo de vida de un hongo causante de la roya es de particular importancia, porque a través de su recombinación facilita el surgimiento de nuevos biotipos (Shattock & Preece, 2000; Ramírez-Camejo et al., 2022). Es posible que uredosporas y teliosporas sean formadas conjuntamente dentro de una misma pústula (Fernandes et al., 2009; Djuikem et al., 2021), proceso conocido como criptosexualidad (Carvalho et al., 2011). La formación de las teliosporas es inducida por una disminución de la temperatura y la pluviosidad en los cafetales (Fernandes et al., 2009). Posteriormente, basidiosporas son formadas a partir de teliosporas por medio de meiosis (McTaggar et al., 2019). Parece ser que esta parte del ciclo biológico de la roya en cafetos aún no está del todo claro. Por ejemplo, se cree que las teliosporas y basidiosporas no son capaces de causar infección en cafetos (Figura 2) (Rodrigues, 1990; Talhinhas et al. 2017). Por otra parte, podría ser que las basidiósporas no puedan volver a infectar a la misma especie vegetal (Kolmer et al., 2009). Sin embargo, este proceso no se reporta muy a menudo en la literatura y no se ha sido observado en condiciones de campo (Ventura et al., 2019).
Espermogonios y aecios también son estructuras que podrían ser producidas por H. vastatrix, pero en tejidos foliares de huéspedes alternativos como arvenses, lo que permitiría al patógeno completar su ciclo de la enfermedad (Koutouleas et al., 2019). El desconocimiento de las funciones de ambas estructuras fúngicas del basidiomiceto en la ocurrencia de la Roya en cafetos ha hecho con que el ciclo de la enfermedad sea definido como incompleto (Figura 2) (Talhinhas et al., 2017; Djuikem et al., 2021). Aunque en la actualidad se conoce los posibles hospederos alternativos de la Roya y la participación de espermogonios y aecios de H. vastatrix en esas plantas, sigue este misterio que ha desconcertado a la comunidad fitopatológica durante más de 150 años (Koutouleas et al., 2019).
Manejo de la enfermedad
El control genético a través del uso de genotipos resistentes es considerado como una de las mejores estrategias de manejo a largo plazo (de Resende et al., 2021), incluso es un método amigable con el ambiente y económicamente viable (Shigueoka et al., 2014). La piramidación asistida por marcadores de genes de resistencia 'SH' ha sido usada para contrarrestar la roya del café, identificándose hasta el momento los genes 'SH1', 'SH2', 'SH3', 'SH4' y 'SH5'. Sin embargo, genotipos con genes SH1, SH2, SH4 y SH5 ya han sido reemplazados por otros, principalmente debido a la gran diversidad de razas de H. vastatrix (Sera et al., 2022). De hecho, continuamente los fitomejoradores han buscado desarrollar nuevos cultivares con resistencia duradera a la roya del café, pero esta labor se ha visto afectada por el aparecimiento de nuevas razas del basidiomiceto (Carvalho et al., 2011; Shigueoka et al., 2014). De cualquier manera, genotipos de café con genes SH1, SH2, SH4 y SH5 son importantes en la pirámide de genes para lograr una resistencia duradera a la roya (Sera et al., 2022).
Entre los cultivares de café reportados como resistentes a la roya están Tupi IAC 1669-33 III-3, Tupi IAC 1669-33 II-7 y IAPAR-59 UBS (Sera et al., 2007). Recientemente, Pereira et al. (2020) analizaron los efectos del control genético y químico de plantas de C. arabica contra la roya, encontrando que el híbrido Timor MG0277 presenta resistencia a la enfermedad. Otros cultivares de café reportados como resistentes a la roya, son Sacramento MG1 desarrollado a partir del cv. Red Catuaí IAC 81 x selección del híbrido Timor UFV 438-52, Catiguá MG 1, Catiguá MG 2 y Catiguá MG 3, todos tres derivados del cruce artificial entre el cv. Yellow Catuaí IAC 86 y la selección del híbrido Timor Hybrid UFV 440-10, y finalmente Iapar 59 originario del híbrido CIFC H361-4 (Villa Sarchi x híbrido Timor) (Zambolim, 2016).
El uso de medidas culturales en un cafetal es una importante herramienta contra la roya del café. La poda de ramas excesivas, eliminación de brotes jóvenes, control de arvenses, manejo de la densidad poblacional, y correcto plan de fertilización, son medidas importantes para reducir la intensidad de la Roya en un cafetal (Aristizábal & Johnson, 2022; Sera et al., 2022). Con respecto a la fertilización, Pérez et al. (2019) mencionan que la incorporación de elementos como nitrógeno (N) y potasio (K) puede reducir la severidad de la Roya.
Hay que tener en cuenta que, en Latinoamérica muchos de los cafetales están asociados con especies forestales denominados comúnmente de sistemas agroforestales (SAF). Así, es importante llevar un control de la sombra ejercida por el tipo de especie forestal usada (Lu et al., 2022). Un porcentaje de una sombra excesiva o ausente afecta negativamente el crecimiento y rendimiento del cafeto, debido a la mayor prevalencia de enfermedades foliares como la roya (Durand-Bessart et al., 2020; Mohammednur & Yesuf, 2021). De cualquier manera, la sombra ejercida por especies forestales en un cafetal bajo un SAF aún sigue siendo un factor muy polémico para la producción de café en términos de reducción potencial del rendimiento, y por las interacciones entre las especies arbóreas y las plagas y enfermedades en el cafetal (Koutouleas et al., 2022).
Otra medida de manejo amigable con el medio ambiente es el uso de controladores biológicos. Hasta la fecha, se han llevado a cabo estudios acerca del uso de agentes biológicos candidatos para el control de la roya del café, e incluso ya se cuenta con biocontroladores registrados para el control de la enfermedad (de Resende et al., 2021). Especies del género bacteriano Bacillus están entre los controladores más estudiados y reportados por su efectividad para reducir la intensidad de la roya, llegando incluso su efecto a ser comparado con el proporcionado por el fungicida y bactericida hidró xido de cobre (Haddad et al., 2009). Según Daivasikamani & Rajanaika (2008), los antagonistas bacterianos B. subtilis y Pseudomonas fluorescens aislados de suelos de la rizosfera de plantas de café, usados de forma aislada (1 x 109 ufc ml-1) o consorciados (1 x 108 ufc ml-1), inhiben la germinación de uredosporas (> 60%) y reducen la incidencia de Roya (entre 26% y 43%) en condiciones de laboratorio y de campo, respectivamente. No obstante, en la segunda temporada de campo (período posterior al monzón) ellos encontraron una reducción de la enfermedad menor a 15% en comparación con la de la primera temporada (período previo al monzón).
Las bacterias no solamente actúan como controladores biológicos de patógenos, sino también como promotores del crecimiento vegetal. Por ejemplo, B. megaterium (cepa 109G) es eficaz en reducir la severidad de Roya en hojas de café, pero Escherichia fergusonii (cepa 85G) genera un aumento del crecimiento en plántulas de café (Silva et al., 2012).

Figura 3 Control biológico ejercido por Lecanicillium lecani (enemigo natural) sobre la roya (Hemileia vastatrix) en cafetos. A-B) Presencia de micelio blanquecino sobre las pústulas de Roya. C) Pústulas de Roya (mancha polvorienta de color anaranjado) y aparente necrosis en una zona del envés de la hoja donde L. lecani parasitó a H. vastatrix. D) Uredosporas. E) Hifas, conidióforos y conidios de L. lecani. F) Uredosporas parasitadas por hifas de L. lecani. Co: conidios. Cf: conidióforos. Hi: Hifas. Us: Uredosporas. Barras (D-F): 20 µm.
En dicho experimento se evaluaron un total de 234 bacterias endófitas (217) y hongos (17) aislados de tejidos de café. Aunque especies de Pseudomonas también promueven el crecimiento de las plantas y coloniza una amplia gama de ambientes, puede ser un excelente biocontrolador contra la Roya en cafetos (de Sousa et al., 2022). La creciente preocupación por evitar o reducir el uso de plaguicidas y fertilizantes inorgánicos en el cultivo de café, y optar por alternativas sostenibles y respetuosas con el medio ambiente, ha hecho que entre las investigaciones más demandadas estén el uso de microorganismos y sus compuestos en el manejo de enfermedades como la Roya (Castillo et al., 2022).
En los últimos años ha aumentado el interés por el potencial de micoparásitos como Lecanicillium lecanii, para el manejo de Roya en cafetos (Jackson et al., 2012; de Resende et al., 2021). Lecanicillium muestra un parasitismo cercano al 70% sobre H. vastatrix (Gómez-de la Cruz et al., 2018). Sin embargo, L. lecanii no es solo un potencial micoparásito natural contra varios patógenos fúngicos como H. vastatrix (Hajian-Forooshani et al., 2023). Al contrario, también es un hongo entomopatógeno que puede controlar insectos plagas como cochinilla verde (Coccus viridis), mosca blanca (Bemisia tabaci biótipo Q) y pulgones (Plutella xylostella) (Jackson et al., 2012; Ravindran et al., 2018; Xie et al., 2019).
Epizootias (brotes) de L. lecanii en cafetales mexicanos, han sido asociadas con grandes poblaciones de la cochinilla verde que a su vez están asociadas con su socio mutualista la hormiga anidadora (Azteca instabilis) (Jackson et al., 2012). Hay que tener en cuenta que aparte de L. lecanii, H. vastatrix posee otros tres enemigos naturales principales i.e. un díptero fungívoro, un ácaro fungívoro y un caracol generalista, que contribuirían al mantenimiento del patógeno en niveles bajos en los cafetales (Hajian-Forooshani et al., 2023). Por ejemplo, la producción de enzimas hidrolíticas por micoparásitos destruye las uredosporas (Gómez-de la Cruz et al., 2022). La interacción entre H. vastatrix y L. lecanii dentro de un cafetal parecen ser complejas y podrían involucrar múltiples mecanismos (Figura 3). Tanto las interacciones complejas no solo entre H. vastatrix y L. lecanii, sino también con los otros enemigos naturales, siembran la necesidad de dilucidar los mecanismos subyacentes de su relación.
El uso de fungicidas es también usado en el manejo de Roya en cafetos, siendo considerado el más efectivo debido a la variación de la resistencia presentada en cultivares (Zambolim, 2016; Talhinhas et al., 2017). Antes de formular un programa de aplicación de fungicidas, se debe tomar en consideración la molécula a ser usada, así como su dosis, frecuencia y tecnología de aplicación, con la finalidad mantener la eficiencia y la relación costo-beneficio (Sera et al., 2022). Normalmente son usados fungicidas de contacto con acción protectora i.e. ditiocarbamatos y cúpricos (cobre metálico o Cu2+) (La Torre et al., 2018; Sera et al., 2022). El cobre es un elemento esencial muy usado en la agricultura orgánica, siendo de bajo costo, altamente tóxico contra patógenos como el causante de la Roya, de largo período residual, y bajamente tóxico para los mamíferos (de Resende et al., 2021). Algunos de los fungicidas cúpricos son óxido cuproso 50% Cu WP (3,8 kg ha-1), hidróxido cúprico 50% Cu WP (3,8 kg ha-1), y cloruro cúprico 50% Cu WP (7,0 kg ha-1), cualquiera de ellos aplicados al follaje en intervalos de 3 semanas (Mohammednur & Yesuf, 2021). Otra molécula también efectiva contra la Roya y aplicada foliarmente es Flutriafol (0,4 kg ha-1) (Capucho et al., 2013). El fungicida-insecticida Ciproconazol + Thiametoxam (Verdadero® 60 WG, 1,0 kg ha-1) también podría ser aplicado vía drench en plantas de café (Pereira et al., 2020).
El manejo integrado de enfermedades (MIE) busca el uso racional de fungicidas sintéticos (Belan et al., 2020). El MIE propone la integración de varias técnicas, iniciando con la selección de cultivares resistentes denominado de control genético, seguido del cultural, físico, biológico y en última instancia el químico (Gamarra et al., 2016; Zambolim, 2016). Para la integración de estas medidas se debe monitorear constantemente la Roya en el cultivo (Belan et al., 2020), tomando en cuenta la incidencia de la enfermedad que debe permanecer por debajo del umbral de daño (≤ 5%) (Aristizábal & Johnson, 2022). Hoy en día, la Roya podría ser monitoreada con herramientas y técnicas de agricultura de precisión, debido a que brinda información precisa y oportuna (Kumar et al., 2020). Además del monitoreo, está el soporte técnico y los sistemas de pronóstico o predicción de la enfermedad (Motisi et al., 2022; Sera et al., 2022).
3. Mal de hilachas
Etiología
A pesar de que el Mal de hilachas aparentemente está presente en cafetales Sudamericanos, apenas se lo ha reportado en Brasil (Rosseti et al., 1982) y Venezuela (Burt, 1918). La enfermedad fue descrita por primera vez por Cooke en 1876 afectando cafetos en la India, siendo nombrado como Pellicularia koleroga Cooke (Tims et al., 1954). Más tarde, Von Höhnel redescribió el patógeno en 1910, nombrándolo Corticium koleroga (Cooke) Von Höhnel 1910 (Tims et al., 1954). Actualmente, otros nombres han sido usados como sinónimos para referirse al patógeno i.e. Botryobasidium koleroga (Cooke) Venkatar, Hypochnus koleroga Stevens & Hall, Koleroga noxia Donk, y Ceratobasidium noxium (Donk) P. Roberts (Venkatarayan, 1949; Ceresini et al., 2012). Desde hace años atrás, el Mal de hilachas ha sido asociado con el complejo de especies del género Ceratobasidium (Cavalcante & Sales, 2001). En la actualidad se conoce que la enfermedad puede ser causada por C. noxium (Ceresini et al., 2012) y también por C. chavesanum (de Melo et al., 2018). Así, taxonómicamente el patógeno corresponde al Phylum: Basidiomicota, Clase: Agaricomicetes, Orden: Cantharellales, Fami lia Ceratobasidiaceae, Género: Ceratobasidium, y Especie: Ceratobasidium noxium.
La colonia de C. noxium sobre medio de cultivo papa dextrosa agar presenta micelio aéreo generalmente de color blanco y en menor proporción blanco floral (Belachew et al., 2015; Dechassa et al., 2020). Sus hifas son largas, con un ancho entre 3,75 a 5,00 µm (Dechassa et al., 2020), binucleadas y ramificadas en ángulos de 90° similar a las de Rhizoctonia (Figura 4 G), y que pueden agruparse formando cordones siendo observados a simple vista (de Melo et al., 2018). Sus basidios son entre oblongos y elipsoides, son más anchos que su hifa base, y sobre estos son producidos basidiósporas fusiformes, lisas, hialinas y delgadas, que miden 10 a 13,75 µm x 3,75 a 5 µm (Figura 4 H, I) (Dechassa et al., 2020). Los basidios tienden a colapsar después de la formación de las basidiósporas (Burt, 1918). Aparte del micelio con ramificaciones de 90°, formación de cordones de hifas, basidios y basidiosporas, otras estructuras como hifopodios y esclerocios han sido asociadas a Ceratobasidium (de Melo et al., 2018).
Sintomatología
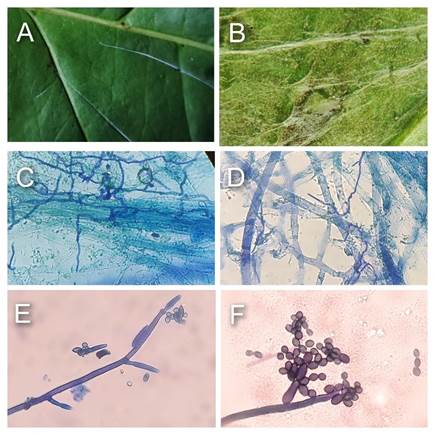 Los síntomas de Mal de hilachas en plantas de café arábico aparecen diez días después de la infección con C. noxium, observándose necrosis en el pecíolo, y luego manchas necróticas en el lado inferior de la hoja junto al peciolo hasta transformarse en un tizón foliar (de Melo et al., 2018; Dechassa et al., 2020). Las hojas necrosadas quedan suspendidas mediante un hilo formado por una masa o cordón de micelio del hongo (Figura 4 B, C), similar a hilos de una telaraña (de ahí proviene el otro nombre de la enfermedad “mal del arañuelo”) (Castro-Caicedo, 2003; de Melo et al., 2018). Estas estructuras pueden ser observadas incluso en la parte media del tallo hasta los nudos y entrenudos de ramas jóvenes (Dechassa et al., 2020). La enfermedad parece afectar tanto hojas como frutos, tejidos que pueden ser observados colgando por cordones de micelio (Figura 4 B-E). El estrato superior de los cafetos es donde más se observa Mal de hilachas. Si bien esta enfermedad no es capaz de matar la planta, causa intensa defoliación (Figura 4 A) (Castro-Caicedo, 2003).
Los síntomas de Mal de hilachas en plantas de café arábico aparecen diez días después de la infección con C. noxium, observándose necrosis en el pecíolo, y luego manchas necróticas en el lado inferior de la hoja junto al peciolo hasta transformarse en un tizón foliar (de Melo et al., 2018; Dechassa et al., 2020). Las hojas necrosadas quedan suspendidas mediante un hilo formado por una masa o cordón de micelio del hongo (Figura 4 B, C), similar a hilos de una telaraña (de ahí proviene el otro nombre de la enfermedad “mal del arañuelo”) (Castro-Caicedo, 2003; de Melo et al., 2018). Estas estructuras pueden ser observadas incluso en la parte media del tallo hasta los nudos y entrenudos de ramas jóvenes (Dechassa et al., 2020). La enfermedad parece afectar tanto hojas como frutos, tejidos que pueden ser observados colgando por cordones de micelio (Figura 4 B-E). El estrato superior de los cafetos es donde más se observa Mal de hilachas. Si bien esta enfermedad no es capaz de matar la planta, causa intensa defoliación (Figura 4 A) (Castro-Caicedo, 2003).
Ciclo de vida
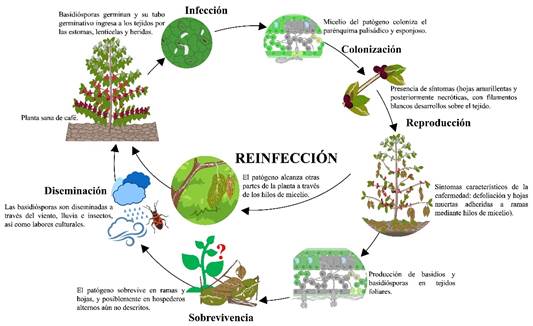
Aunque la sobrevivencia a largo plazo se da por microesclerocios, basidiósporas y micelio en diferentes especies de Ceratobasidium, se desconoce la existencia de estas estructuras en C. noxium en el cultivo de café (de Melo et al., 2018). Se cree que el patógeno sobrevive la temporada invernal en forma de micelio en restos vegetales infectados (Burt, 1918), y posiblemente en hospederos alternos (Belachew et al., 2015; de Melo et al., 2018) (Figura 5). Según Samuels et al. (2012), en plantas de cacao cuando su hoja infectada con C. theobromae cae durante períodos prolongados de lluvia, las hifas pueden emerger de los restos de tejidos vasculares en la cicatriz de la hoja, y formar basidiomas corticioides blancos sobre y alrededor de la cicatriz. El hongo no sigue esporulando ni sobrevive en las ramas muertas de cacao.
La diseminación de Ceratobasidium comienza con la liberación de basidiósporas a partir de basidios establecidos durante el tiempo húmedo, y que son transportadas por el viento, insectos (probablemente del orden Hemiptera) (Dechassa et al., 2019), y herramientas usadas en labores culturales, hasta alcanzar tejidos de cafetos sanos (Mathew, 1953). Una vez que es iniciado este proceso, este es continuo y cíclico. El factor determinante para que este proceso continue, es la formación de cordones de micelio del patógeno que se extienden rápidamente entre las ramas afectadas, permitiendo su diseminación hacia otras hojas y ramas de plantas sanas (Dechassa et al., 2019) (Figura 5).
Muy seguramente, bajo condiciones favorables no documentadas como alta humedad relativa y temperatura alrededor de 25 °C (Dechassa, 2019), el patógeno germina produciendo tuvo germinativo y apresorio para penetrar los tejidos vegetales. Un dato muy interesante es que al inicio de las investigaciones con C. noxium se creía que el patógeno no penetraba los tejidos aéreos, y que su alimentación era a través de osmosis.

Figura 4 A) Síntomas de Mal de hilachas y estructuras de Ceratobasidium spp. en cafetos. A-D) Hojas y granos (cerezas) de café colgando mediante un cordón de micelio. E-F) Micelio del patógeno sobre la superficie de tejidos foliares jóvenes (E) y senescentes (F). G) Hifas formando ángulos de 90° tipo Rhizoctonia (flechas rojas). H-I), Hifas, basidios y basidiosporas. Ba: basidios. Bs: basidiosporas. Hi: hifas. Mi: micelio. Barras (G-I): 20 µm.
Sin embargo, actual mente se conoce que al igual que otros patógenos, C. noxium pasa por un proceso de penetración in tracelular para hacer efectiva la infección (Von Höhnel, 1910) (Figura 5).
El patógeno ingresa en las ramas a través de las lenticelas y/o por heridas, mientras que, en las hojas, la infección se da a través de estomas (Narasimhan, 1933). C. noxium puede entrar en un periodo de dormancia de 6 a 10 días o de 5 a 8 días en ramas, lo que dependería de la disponibilidad de los estomas (Dechassa, 2020). Posteriormente, el patógeno coloniza el parénquima esponjoso e incluso alcanza el parénquima en empalizada (Narasimhan, 1933). El micelio que hasta entonces se encontraba dentro de los tejidos vegetales, emerge en varios puntos del envés de la hoja formando hebras blanquecinas largas de diámetro uniforme, y se extiende a lo largo de la nervadura central y las ramas presentando un color gris pardo hasta producir fructificaciones como basidios y sobre estos las basidiósporas (Figura 5) (Burt, 1918; Dechassa, 2019).
Manejo de la enfermedad
A pesar de la amenaza potencial que representa el Mal de hilachas para los cultivos de café, su escasa información científica hace que su manejo sea complejo (Dechassa, 2019). A esto se podría sumar el desconocimiento por parte de los agricultores, haciendo con que la enfermedad presente una alta intensidad en las plantaciones de café, incidiendo directamente en su alta dispersión y reducido manejo, como sucede en el suroeste de Etiopía (Teferi et al., 2008; Belachew et al., 2015).
El uso de cultivares resistentes es un punto clave dentro del manejo integrado de Mal de hilachas, no solo consiguiendo reducir significativamente los costos de producción, sino también ofreciendo una alternativa amigable con el medio ambiente (Dechassa, 2019). La información respecto a cultivares con resistencia genética al Mal de hilachas es muy escasa. Hasta la fecha se han evaluado 124 genotipos de C. arabica, de los cuales 42 demostraron determinados niveles de resistencia hacia el Mal de hilachas, entre ellos la variedad comercial '74112' considerado como moderadamente resistente (Dechassa et al., 2019). Una buena alternativa ante la falta de cultivares resistentes, es el uso de biocontroladores (Sutton & Peng, 1993). Lo poco que se conoce, es lo mencionado por Jansen (2005), quienes reco miendan el uso de hongos antagonistas como Gliocladium spp., Trichoderma spp. y Verticillium spp.
Otra herramienta de manejo sería el uso de fungicidas. Según Quevedo (2014), la aplicación de moléculas sintéticas para el control de Mal de hilachas puede hacerse de forma preventiva y curativa. Es importante considerar la época, número y frecuencia de aplicación. Autores como Sotomayor y Duicela (1995) mencionan que es suficiente aplicar la dosis recomendada dos veces por año, la primera aplicación durante la abundancia de follaje tierno que ocurre en los primeros días de lluvia, y una segunda aplicación seis semanas después de la primera. Pueden ser usadas las mezclas de los fungicidas Bavistin® (Carbendazim 50 WP) y Bordeaux al 1% del ingrediente activo (compuesto principalmente por cal hidratada o apagada, hidróxido de calcio y agua) (Sudhakar & Shankara, 1995). Si la incidencia de la enfermedad es alta, es recomendable el uso de fungicidas cúpricos (Müller et al., 2009). Otros fungicidas recomendados por Sudhakar & Shankara (1992) y (1995) para el manejo de Mal de hilachas son Carbendazim 50 WP, Triadimefón 25 WP, Oxicarboxin 20 WP, Propiconazol 25 WP y Tiofanato de metilo M 70 WP.
El MIE en cafetos reduce considerablemente la dependencia de fungicidas sintéticos. La implementación de prácticas culturales cumple un papel importante en el manejo de la enfermedad, pudiendo reducir su desarrollo y diseminación (Quevedo, 2014). Entre estas herramientas están la optimización de sombras dentro de los SAF, ventilación asociada a la disposición de los cafetos (distancia de siembra), y poda de ramillas y ramas marchitas o enfermas (Dechassa, 2019). Las ramas enfermas una vez cortadas se deben quemar, al igual que sus hojas y frutos afectados por C. noxium (Müller et al., 2009). Una mayor penetración de luz solar y circulación de aire en el dosel de las plantas de café, reducirían la presión de la enfermedad en el cultivo (Teferi et al., 2008).
4. Cercosporiosis
Etiología
La Cercosporiosis o Mancha de hierro fue descrita por primera vez por Berkeley y Cooke en 1881 afectando hojas de café en Jamaica, y en Sudamérica ha sido reportada solo en Brasil (Noack, 1901; Souza et al., 2011). La enfermedad es causada por el hongo Cercospora coffeicola, que puede afectar la planta durante sus diferentes estados fenológicos (Souza et al., 2019; Cooke, 1881; Souza et al., 2010), y causar daños en su producción de granos de hasta 30% (de Paula et al., 2016). Taxonómicamente se ubica dentro del Phyllum: Ascomicota; Clase: Dothideomycetes; Orden: Mycosphaerellales; Familia: Mycosphaerellaceae; Género: Cercospora; Especie: Cercospora coffeicola (EPPO, 2002). El patógeno tiene algunos sinónimos i.e. C. coffeae, C. herrerana, Ramularia goeldiana (formas asexuadas) y Mycosphaerella coffeicola (forma sexuada) (Vale et al., 2021; Souza et al., 2012; Botelho et al., 2021).
Los conidióforos suelen encontrarse solos o agrupados (fascículos) (Figura 6E, G, H), formando células conidiógenas en su parte superior (Souza et al., 2010). Los conidios son hialinos, con forma acicular a obclavado, semi rectos, con ápice agudo y base truncada, hilios visibles y septados, midiendo entre 40-150 x 2-4 µm (Figura 6F) (Nelson, 2008). Además, el patógeno forma estromas que miden ±50 µm, globulares y de color marrón oscuro (Nelson, 2008). Al igual que otras especies de Cercospora que son consideradas como hemibiótrofas debido su largo período de latencia (Andrade et al., 2021), C. coffeicola utilizaría la misma estrategia de colonización del tipo necrótrofa para obtener nutrientes, pudiendo incluso matar las células del huésped a través de la producción de especies reactivas de oxígeno y toxinas (Daub et al., 2013).
Sintomatología
Los síntomas de Cercosporiosis en cafetos pueden ser variados, siendo las manchas con centro claro y borde amarillento denominadas como mancha de ojo marrón son las más comunes (Figura 6A), mientras que las menos comunes son las manchas oscuras designadas como mancha negra (Figura 6B) (Andrade et al., 2021). Los síntomas comienzan en el lado adaxial de la hoja, y con el aumento de la infección en estos tejidos las manchas aumentan de tamaño, presentando en el centro de la lesión una coloración blanquecina, borde marrón y halo amarillo (Figura 6C), siendo consideradas en este punto como manchas maduras (Souza et al., 2010). En el centro y próximas a este en cada lesión pueden ser observados signos del patógeno (Figura 6D-H), que no son otra cosa que conidióforos y conidios (Nelson, 2008; Souza et al., 2010).
Los síntomas en granos pueden ser diferentes, dependiendo principalmente de la edad de estos tejidos. Por ejemplo, en cerezas verdes independientemente de su etapa de desarrollo, se pueden observar manchas color marrón oscuro, hundidas, alargadas, y de forma irregular y centro cenizo con borde amarillento, que pueden alcanzar una longitud de hasta 5,8 cm, denominadas de manchas marrones (Nelson, 2008; de Paula et al., 2019) (Figura 6C).
En granos maduros se pueden observar man chas oscuras hundidas con coloración plateada, que pueden ser fácilmente confundidas con las producidas por hongos como Colletotrichum gloeosporioides, agente causal de Antracnosis en café; como resultado, se reduce la capacidad fotosintéticamente activa que ocasionaría una maduración prematura de frutos, y repercutiría negativamente en el sabor final del café (Nelson, 2008).
La etiología asociada a los diferentes tipos de síntomas producidos por C. coffeicola fue elucidado por Vale et al. (2021). Estos investigadores encontraron que los aislados obtenidos tanto a partir de la mancha marrón como de la negra encontradas en el área foliar de cafetos, presentan las mismas características morfológicas y producen manchas en tejidos en condiciones de invernadero. Esto confirmaría que la especie asociada a ambos tipos de manchas foliares en hojas sería C. coffeicola, eso sí, proponiendo un epitipo para esta especie. Los síntomas caracterizados como manchas negras podrían estar asociadas a diferentes condiciones del huésped durante el proceso de infección por el patógeno (Botelho et al., 2019).
Ciclo de vida
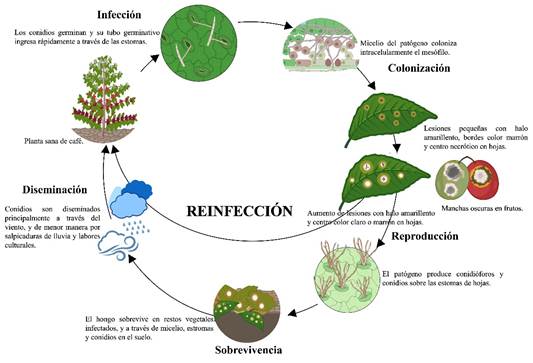
Existen pocos estudios sobre la interacción entre café y C. coffeicola, especialmente sobre la sobrevivencia del patógeno en los cafetales en comparación con otras especies de Cercospora. Khan et al. (2008) demostraron que C. beticola sobreviven en forma de estromas sobre restos vegetales depositados en el suelo hasta por 22 meses, perdiendo totalmente su via bilidad luego de 34 meses. Otras especies como C. capsici sobrevive de forma latente como micelio y conidios en restos vegetales infectados por 120 días con temperaturas de 30 a 42 °C, y en la superficie del suelo hasta por 165 días (Swamy et al., 2012). Se creería que C. coffeicola tendría hábitos de sobrevi vencia similares al de las otras especies descritas de Cercospora (Figura 7).
La diseminación se daría a través del viento (principalmente durante el día), salpicaduras de lluvia, y por el movimiento de trabajadores y de sus maquinarias y herramientas (Nelson, 2008). Una vez que los conidios alcanzan la superficie adaxial foliar del cafeto, en aproximadamente cuatro horas estos producen un tubo germinativo que crece en dirección a las aperturas estomáticas (Souza et al., 2010).

Figura 6 Síntomas de Cercosporiosis y estructuras de Cercospora coffeicola en cafetos. A) Mancha foliar marrón con halo amarillento. B-C) Manchas foliares oscuras. D) Lesión foliar presentando conidióforos (pequeños puntos negros). E) Conidióforos observados sobre aperturas estomáticas. F). Germinación de conidios y penetración de hifas a través de aperturas estomáticas. G) Conidióforos y conidios sobre una apertura estomática. H) Conidióforo. Et: estoma o apertura estomática. Co: conidios. Cf: conidióforos. Hi: hifas. Barras (E-H): 20 µm.
Un mal estado de salud de los cafetos y temperaturas entre 20 y 28 °C y humedad ambiental de 36 a 72 h continuas, harían que la infección de C. coffeicola en los tejidos sea exitosa (Nelson, 2008). En frutos inmaduros el patógeno penetra a través de heridas en la epidermis sin formación de apresorios, completando la infección en hasta 72 h después de la inoculación (de Paula et al., 2019). El proceso infeccioso o período latente en café puede durar meses, incluso sin observarse síntomas sobre el tejido infectado (Figura 7) (de Paula et al., 2019).
Durante el proceso de colonización, C. coffeicola produce Cercosporina (C29H26O10), una micotoxina inespecífica fotosensible que mata rápidamente las células vegetales en presencia de luz solar y que es un factor de virulencia, esta puede ser encontrada en cualquier lesión producida por el patógeno independientemente del cultivar de café (Vale et al., 2019; Ramos et al., 2022). La colonización de los tejidos por el patógeno es un poco lenta, tardando más de un mes. Las hifas del patógeno crecen en células del parénquima y debajo de la cámara subestomática, donde posteriormente emergerían los respectivos conidióforos (Figura 7) (Souza et al., 2010). Finalmente, la reproducción del patógeno ocurre sobre la superficie de hojas o frutos, mediante la formación de una basta cantidad conidióforos y conidios (Figura 6D-H; 7).
Cercosporiosis podría ser encuadrada como una enfermedad policíclica, esto en gran medida a que la infección de nuevos tejidos aéreos como hojas y frutos podría darse a través de reinfecciones por parte del patógeno. Una vez el patógeno dentro de los tejidos vegetales este los colonizaría, y posteriormente produciría conidióforos y conidios sobre las aberturas estomáticas de tejidos como hojas, dando lugar a múltiples ciclos subsecuentes dentro del cafetal (Figura 7).
Manejo de la enfermedad
La resistencia contra enfermedades como Cercosporiosis es una de las principales estrategias para tener en cuenta. Actualmente, se conoce el cv. comercial 'Sarchimor MG 8840' presenta resistencia a la enfermedad, seguida de otros genotipos de la colección Sarchimor, seguida de individuos de la colección de germoplasma (Botelho et al., 2017). Otras fuentes de resistencia son las reportadas por Pereira et al. (2019), quienes describen al cultivar 'Big Coffee VL' por presentar características de grano largo, y sus progenies 'M5' y 'P23' poseen buenas características de producción y un alto potencial de resistencia a C. coffeicola. Aunque se puede encontrar información sobre resistencia genética en café contra C. coffeicola, ésta aún no ha sido explorada a profundidad (Botelho et al., 2017).
Otro de los métodos usados para manejar la Cercosporiosis es el cultural, entre estas el riego, y la fertilización orgánica e inorgánica. El riego es una práctica que modifica el microclima del cultivo, interfiere en la luminosidad, temperatura y humedad relativa del aire, y la intensidad de la enfermedad en cafetos. De hecho, plantas irrigadas presentan 30% menos de incidencia de Cercosporiosis que las no irrigadas (Paiva et al., 2013). Por otro lado, una fertilización con dosis altas de N, K y fósforo (P) reducen considerablemente la Cercosporiosis en hojas, y mantienen un mayor número de hojas y el balance nutricional en plantas de café (Vilela et al., 2022). El uso de abonos verdes intercalados con plantas de café también reduce la incidencia y el número de lesiones de Cercosporiosis en hojas, y la incidencia de pudrición en frutos, ambas enfermedades causadas por C. coffeicola, siendo su eficiencia similar a la mostrada por la aplicación de urea (Cardoso et al., 2013). Otras prácticas culturales que podrían reducir considerablemente la enfermedad en cafetos comerciales i.e. seleccionar semillas de ata calidad, trasplantar las plántulas a poca profundidad, seleccionar densidades poblacionales razonables, eliminar arvenses, restos de cultivos y tejidos o plantas infectadas, y proporcionar entre 35% y 65% de sombra (Nelson, 2008; Lu et al., 2022).
Con respecto al control biológico se han reportado algunos biocontroladores potenciales contra Cercosporiosis en café. Según Sirinunta & Akarapisan, (2015), encontraron que aislados de B. megaterium y B. badius aplicados en plántulas de café en condiciones de invernadero reducen la enfermedad en más del 50%. Hongos también han sido reportados como potenciales biocontroladores de la Cercosporiosis, por ejemplo, Trichoderma. Este hongo aplicado en plantas adultas puede reducir la enfermedad en más del 50%, pudiendo ser comparado incluso con la eficiencia mostrada por el fungicida Bordeaux (Bhandari et al., 2021). También existen reportes del hongo saprófito Phialomyces macrosporus, que reduce el crecimiento, esporulación y viabilidad de C. coffeicola hasta en un 40%, debido probablemente a su producción de compuestos volátiles y no volátiles (Laborde et al., 2018).
El uso de moléculas sintéticas para el control de Cercosporiosis se torna casi necesario en regiones cafetaleras húmedas, usando fungicidas como clorotalonil y estrobilurinas y sus mezclas, pero respetando las dosis, frecuencias y rotaciones (Lu et al., 2022). También los triazoles estarían dentro del grupo de fungicidas a ser tomados en cuenta. Por ejemplo, tebuconazol 25,9 EC (1 mL L-1) y la mezcla trifloxistrobina 25% + tebuconazol 50% WG (2 g L-1) reducen considerablemente la incidencia de Cercosporiosis en cafetos (Machenahalli et al., 2019). Mezclas de estrobilurinas y triazoles como azoxistrobina + ciproconazol (500 mg L-1) reduce totalmente la germinación de esporas y el crecimiento micelial de C. coffeicola (Carvalho et al., 2022). Aunque se conozca la eficiencia de estas mezclas en el manejo de Cercosporiosis, otra opción sería la aplicación de Acibenzolar-S-metil, que proporciona un control mayor al 50% de la Cercosporiosis en plantas de café (Patrício et al., 2008). En las regiones húmedas también podrían usarse productos más ecológicos, como la aplicación temprana de cobre (de Lima et al., 2022).
Algunas medidas de manejo integrado aplicables al cultivo de café para el control de Cercosporiosis comienzan con su monitoreo constante mediante el análisis de suelo y tejidos y ejecución de varias prácticas culturales (ver el segundo párrafo del ítem manejo de Cercosporiosis). También, dentro del MIE se pueden incluir al uso de biocontroladores, y aplicación temprana de fungicidas especialmente en regiones húmedas. Así mismo, no se debe obviar el uso de cultivares resistentes a la Cercosporiosis, como una de las más herramientas más importantes para su manejo integrado (Ogundeji et al., 2019).
5. Desafíos actuales y futuros
Entre las enfermedades que más afectan los cafetos a nivel mundial está la Roya, situándose como la más importante a nivel mundial, seguida de Mal de hilachas y Cercosporiosis. Así como su orden de importancia, existe una correlación inversa con el conocimiento generado a partir del estudio de estas enfermedades, encontrando basta información sobre la roya, pero muy poco sobre las otras dos, especialmente sobre Mal de hilachas. Por ejemplo, se conoce poco o nada sobre los cultivares resistentes y la diversidad del agente causal en café. De hecho, hasta hace poco se conoce que el agente causal de Mal de hilachas no solo sería C. noxium, sino también C. chavesanum. Todo eso sin duda dificulta la implementación de estrategias de manejo efectivas para la enfermedad.
A pesar de que en esta revisión se ha abordado de forma general a la Roya, Mal de hilachas y Cercosporiosis en el cultivo de café, uno de los principales objetivos fue elucidar el ciclo de cada una de ellas. Esto ha hecho que nos demos cuenta de que aún faltan investigaciones, enfocadas principalmente en la interacción entre tejidos de café y los fitopatógenos Ceratobasidium spp. y C. coffeicola. De hecho, hasta ahora se desconoce la variabilidad genética de ambos agentes causales, ni la importancia de sus estructuras fúngicas en el cultivo de café, lo que podría ser investigado en los siguientes años. También, sobre la Roya hay preguntas sin resolver, como ¿cuáles son los hospederos alternos de H. vastatrix?
Otro de los desafíos para tener en cuenta está la evaluación de la respuesta de cultivares comerciales y genotipos promisorios de café a las enfermedades en estudio, especialmente a Mal de hilachas y Cercosporiosis tanto en condiciones de invernadero como de campo. Así mismo, la optimización de reguladores biológicos (biocontroladores) o químicos (fungicidas sintéticos), regulación de la sombra ejercida por especies arbóreas (SAF) o por la misma arquitectura o densidad poblacional de los cafetos, incorporación de abonos orgánicos o inorgánicos, e implementación de sistemas de riego, también estarían dentro de los retos investigativos en el cultivo de café, si se desea aumentar de manera sostenible el rendimiento de cerezas en dicho agroecosistema. Es importante el diseño e implementación de prácticas de manejo agroecológico que promuevan la generación de interacciones ecológicas beneficiosas que contribuyan a la protección de los cafetos a mediano y largo plazo (Castillo et al., 2022). Finalmente, es crucial actualizar las técnicas de control ecológicas y respetuosas con el medio ambiente, y comprender cómo funcionarán en el futuro cambio climático, haciendo con que mejore la percepción de los agricultores sobre las interacciones entre los servicios de regulación y el cambio climático (Harelimana et al., 2022).
6. Conclusiones
Entre las enfermedades que afectan negativamente los cafetos tanto a cielo abierto como bajo un sistema agroforestal, están Roya (H. vastatrix), Mal de hilachas (C. noxium) y Cercosporiosis (C. coffeicola). Esas enfermedades producen síntomas en tejidos aéreos de cafetos, reduciendo su rendimiento de granos en hasta 90%. Aunque H. vastatrix es catalogado como uno los fitopatógenos más importantes en el cultivo de café, otros como C. noxium y C. coffeicola podrían fácilmente ser también clasificados como factores bióticos significativos, especialmente en regiones lluviosas. Aún se desconoce el papel de algunas de las estructuras de C. noxium y C. coffeicola en los procesos de sobrevivencia, diseminación, infección, colonización y reproducción dentro de un cafetal. El manejo sugerido de las tres enfermedades es mediante la integración de medidas que principalmente buscan reducir el uso de fungicidas sintéticos i.e. seleccionar cultivares resistentes, monitorear constantemente las enfermedades usando herramientas convencionales o técnicas de agricultura de precisión, usar o desarrollar sistemas de pronóstico o predicción de las enfermedades, optimizar la sombra dentro de los SAF, suministrar la ventilación asociada a la disposición de los cafetos, realizar podas, mantener un programa de fertilización adecuado y manejo de arvenses, usar biocontroladores, y usar fungicidas especialmente en regiones húmedas.