1. Introducción
El psílido del tomate Bactericera cockerelli Sulc. (Hemiptera: Triozidae), es considerado una de las plagas más importantes en solanáceas y otros cultivos de importancia agrícola (Vereijssen, 2020). La especie es originaria de Norteamérica y actualmente se distribuye desde Canadá, Estados Unidos, México, y varios países de Centroamérica, hasta Nueva Zelanda y Australia (Walker et al., 2015; Olaniyan et al., 2020) probablemente por la movilización de material vegetal contaminado a través del comercio internacional (Thomas et al., 2011). El insecto, provoca daño directo en los cultivos por su herbivoría al succionar la savia de las plantas (Molki et al., 2019). En altas infestaciones, el daño secundario puede ser causado por la excreción de azúcares que promueven el crecimiento de hongos en forma de fumagina, la cual bloquea la luz solar y reduce la fotosíntesis (Prager et al., 2018). Aunado a lo anterior, esta especie es vector de la bacteria Candidatus Liberibacter solanacearum (CaLso) la cual provoca pérdidas significativas por la reducción del rendimiento y calidad del producto. Este patógeno es el agente causal del “permanente” del tomate, “zebra chip” en papa y el “variegado del chile” (Delgado-Ortiz et al., 2019; Workneh et al., 2020).
El manejo del complejo vector-patógeno se realiza principalmente mediante aplicaciones constantes de insecticidas químicos, sin embargo, la mayoría de estos compuestos son costosos y su uso excesivo puede contribuir al incremento de la resistencia al ingrediente activo, además provocan efectos adversos en organismos no objetivo (Szczepaniec et al., 2019).
Las estrategias para alterar el comportamiento y desarrollo de B. cockerelli pueden reducir el aumento de la población y por lo tanto limitar sus daños en los cultivos, además de contribuir al manejo de CaLso al reducir la cantidad de adultos infecciosos (Avila et al., 2019).
Las plantas solanáceas pueden producir una amplia gama de metabolitos secundarios que pueden afectar a las poblaciones de artrópodos (Panizzon et al., 2022), los mecanismos de resistencia en especies silvestres de tomates son asociados con la presencia de tricomas foliares (glandulares o no glandulares) y con el tipo de sustancia que estos almacenan como acilazúcares, metilcetonas y sesquiterpenos (Marchant et al., 2020; Wang et al., 2021; Moghe et al., 2023), los cuales actúan como defensas físicas y químicas que afectan negativamente el comportamiento y la aptitud biológica de los herbívoros (Rodríguez-López et al., 2020; Paudel et al., 2022).
Mora et al. (2022), en la selección de 52 especies silvestres de Solanum (papas), obtuvieron como resultado la identificación de una accesión resistente a Candidatus Liberibacter solanacearum y varias muestras tolerantes. La accesión resistente fue S. berthaultii que dentro de sus cualidades presenta densos tricomas glandulares en la superficie adaxial (12 tricomas/mm2) y abaxial (7 tricomas/mm2) de hojas; además de sugerir que esta característica pueda ser la responsable de la reducción de la fecundidad y supervivencia de B. cockerelli.
Diversos artículos mencionan la resistencia de diferentes especies silvestres de tomate a diversas taxas de artrópodos fitófagos (lepidópteros, hemípteros y ácaros) con base en el efecto antibiótico y antixenótico ocasionado por los tricomas glandulares foliares, principalmente del tipo IV y VIc y a los aleloquímicos que contienen (Eigenbrode et al., 2019; Savi et al., 2019; Garzón-Tiznado et al., 2020; Wang et al., 2021; Paudel et al., 2022; Almeida et al., 2023).
En cuanto a la respuesta conductual de B. cockerelli, frente a la defensa manifestada por los tipos de tricomas de la planta huésped, se ha estudiado solo en algunas especies del género Solanum. Levy & Tamborindeguy (2014) demostraron que S. habrochaites es repelente y tóxico para los psílidos en comparación con Solanum lycopersicum debido a la presencia de tricomas glandulares tipo IV y VIc.Dawood & Snyder (2020), asocian estos efectos antagónicos de S. habrochaites a distintos sesquiterpenos como lo son el 7-epi-zingibereno, 9-hidroxi zingibereno y 9-hidroxi,10,11-epoxi-zingibereno.
Los estudios sobre especies de tomate resistentes a B. cockerelli son reducidos y se enfocan principal mente a distintas accesiones de S. habrochaites, por lo que aún existe el potencial de evaluar otras especies silvestres. El objetivo del presente estudio es conocer el efecto de antibiosis y antixenosis producido por especies silvestres y cultivares comerciales de tomate hacia B. cockerelli y su relación con la presencia y tipo de tricomas foliares.
2. Metodología
Obtención de Bactericera cockerelli. Los insectos utilizados en el presente estudio se obtuvieron de una cría de B. cockerelli con infección positiva a CaLso, establecida en jaulas entomológicas con un suministro constante de plantas de tomate S. lycopersicum cv. Floradade como dieta. Esta cría se ha mantenido desde el año 2019 en las instalaciones de la Universidad Autónoma Agraria Antonio Narro, Saltillo, Coahuila a una temperatura de 23 ± 1 °C; con fotoperiodo de 14:10 horas (luz/oscuridad) (Levy et al., 2011).
Obtención y preparación del material vegetal. Se emplearon especies silvestres de tomate, las cuales fueron donadas por el Tomato Genetics Resource Center (TGRC) de la Universidad de California, Davis, E.E.U.U. Los cultivares comerciales fueron adquiridos a través de un proveedor de insumos agrícolas (Tabla 1).
Tabla 1 Especies de Solanum utilizadas en los bioensayos
| Especies | Accesión/Cultivar |
|---|---|
| Solanum lycopersicum | cv. Floradade |
| cv. Rio Grande | |
| Solanum habrochaites | LA0407 |
| Solanum pimpinelifolium | LA3158 |
| Solanum arcanum | LA2157 |
| Solanum peruvianum | LA3640 |
Se germinaron 30 semillas de cada especie silvestre y de los cultivares comerciales, en charolas de poliestireno con 100 cavidades y 11 cc de volumen en cada alvéolo. Como sustrato se utilizó una mezcla húmeda de peat moss y perlita (50:50 v/v). Cuando las plántulas alcanzaron aproximadamente 20 cm de altura medida desde los cotiledones y presentaron de 3 a 4 hojas verdaderas, se realizó el trasplante en bolsas de plástico con una mezcla de sustrato peat moss y perlita (70:30 v/v). Las plantas fueron fertilizadas diariamente con diferentes porcentajes de la solución Steiner (1961), de acuerdo con Roque et al. (2021).
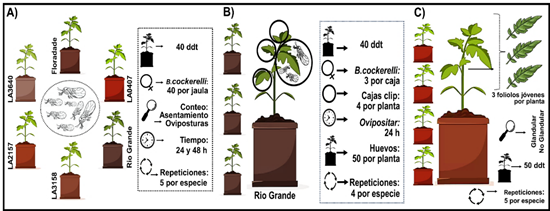
Evaluación de la antixenosis. Para este ensayo se fabricaron 5 jaulas entomológicas de 60×60×60 cm. A cada jaula se le colocó una planta de cada especie en su interior con una distribución aleatoria. Posteriormente a cada jaula se le introdujeron 40 hembras jóvenes de B. cockerelli obtenidas de la cría (Figura 1A), previamente sexadas bajo las características morfológicas de la terminalia de los adultos (Vargas-Madríz et al., 2013). Las hembras se colocaron sobre la base de una caja petri ubicada en el centro interior de la jaula. Las jaulas permanecieron bajo invernadero en las condiciones previamente mencionadas. El diseño experimental constó de cinco jaulas como repeticiones, con la distribución de los genotipos completamente al azar. Se contabilizó el número de hembras posadas y huevos ovipositados en cada genotipo a las 24 y 48 horas después de la infestación.
Evaluación de la antibiosis. Se realizó una prueba de no elección (Figura 1B) para contabilizar huevos ovipositados y para comparar la tasa demográfica de B. cockerelli entre las distintas especies genotipo de tomate conforme a la metodología propuesta por Rodríguez-López et al. (2020) con algunas modificaciones.
Se utilizaron cuatro plantas de cada genotipo con un desarrollo de 40 días después del trasplante (ddt). A cada planta se le colocaron cuatro cajas clip (Luna-Cruz et al., 2011) de manera aleatoria a las cuales se les introdujeron tres hembras recién copuladas (12 hembras por planta) durante un periodo de 24 horas. Transcurrido el tiempo los insectos fueron retirados y se contabilizaron las oviposiciones. Posteriormente se realizó una cohorte de cincuenta huevos por planta. A partir de ello se contabilizó diariamente el número de huevos eclosionados, ninfas en desarrollo en cada instar y los adultos emergidos.
Para verificar la fertilidad de los adultos sobrevivientes, se confinó una pareja de B. cockerelli durante 48 h, dentro de una caja clip en plantas de la misma especie correspondiente a la que emergieron con un desarrollo de 40 ddt, conformando cuatro cajas por tratamiento. Al transcurrir el tiempo estipulado, se retiraron los insectos y se realizó un conteo de los huevos ovipositados. Finalmente se observó diariamente el desarrollo del huevo hasta la eclosión.
Figura 1. Diseños experimentales de los ensayos de (A) antixenosis, (B) antibiosis, y (C) caracterización de tricomas.
Caracterización cuantitativa y cualitativa de los tricomas foliares. Se utilizó la metodología propuesta por de Oliveira et al. (2018), con algunas modificaciones. Se seleccionaron cinco plantas de cada especie genotipo con desarrollo de 50 ddt. A cada planta se le tomó una muestra de tres foliolos pertenecientes a la tercera hoja debajo del ápice, haciendo un total de 15 foliolos por tratamiento (Figura 1C). Se realizaron microfotografías mediante microscopio electrónico de barrido (JCM-6000, JEOL, Tokio, Japón). Se conformaron discos foliares de aproximadamente 10 mm de diámetro de cada foliolo, los cuales se adhirieron en el portaobjetos para fotografiarlas. Se contabilizó el número de tricomas glandulares y no glandulares de la superficie adaxial presentes en un área de 1 mm2. Para mantener la homogeneidad en los conteos, únicamente se consideró la lámina foliar excluyendo las nervaduras y los márgenes de la hoja. Los tricomas presentes en lo foliolos de cada especie silvestre/cultivar se clasificaron conforme a la literatura de Channarayappa et al. (1992).
Análisis estadísticos. Los datos obtenidos en las pruebas de antixenosis, antibiosis y la cuantificación de cada tipo de los tricomas foliares, fueron sometieron a un análisis de varianza (ANOVA) y para la separación de medias utilizando se realizó la prueba de Tukey (p = 0,05) con el programa estadístico SAS versión 9.1; además de realizarse un análisis de correlación de Pearson con el programa estadístico SAS versión 9.1.
3. Resultados y discusión
En la prueba de antixenosis el comportamiento de las hembras de B. cockerelli difirió entre las especies silvestres/cultivares comerciales. Los insectos mostraron una preferencia de asentamiento significativamente mayor hacia S. lycopersicum cv. Floradade, a las 24 y 48 h (39,34% y 36,19% respectivamente) en comparación con los demás tratamientos. En contraste, S. habrochaites fue la que presentó la menor cantidad de asentamientos a las 24 h sin diferencia estadística con S. arcanum. En cambio, a las 48 h, S. habrochaites presentó numéricamente el menor número de asentamientos, aunque sin diferencias significativas con S. arcanum y S. peruvianum (Tabla 2).
En cuanto a la preferencia de oviposición, los resultados muestran diferencias significativas entre las especies/cultivares comerciales. S. habrochaites registró estadísticamente el menor número de oviposturas a las 24 y 48 horas (7,66 ± 1,15 y 14,67 ± 7,50 huevos/planta respectivamente) después de la liberación. Los resultados coinciden con lo reportado por Levy & Tamborindeguy (2014) quienes compararon el asentamiento de B. cockerelli entre S. lycopersicum y S. habrochaites, encontrando que más del 87% de los adultos prefirieron el cultivar comercial para asentamiento y oviposición. En contraste, estos autores no observaron oviposturas en S. habrochaites, esto puede deberse a que en este estudio se utilizó una accesión diferente.
Tabla 2 Medias de asentamientos y oviposición de B. cockerelli en las especies silvestres/cultivares de tomate en condiciones de libre elección
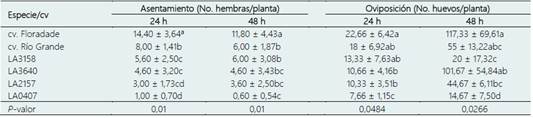
LA3158: S pimpinellifollium, LA3640: S. peruvianum, LA2157: S. arcanum y LA0407: S. habrochaites. * Medias con la misma letra en cada columna no son estadísticamente diferentes (Tukey; p < 0,05).
Tabla 3 Número de individuos en las diferentes etapas de desarrollo de B. cockerelli en las especies silvestres y cultivares comerciales
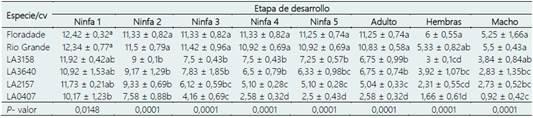
LA3158: S pimpinellifollium, LA3640: S. peruvianum, LA2157: S. arcanum y LA0407: S. habrochaites. *Medias con la misma letra en cada columna no son estadísticamente diferentes (Tukey; p < 0,05).
En el efecto de antibiosis, la supervivencia de B. co ckerelli hasta el estado adulto fue estadísticamente distinta a las demás especies y cultivares (Tabla 3), los cultivares Floradade y Rio Grande presentaron alrededor del 88% de supervivencia, seguido de las especies S. pimpinellifolium y S. peruvianum con 56%. S. arcanum manifestó un 40%, mientras que S. habrochaites presento el menor porcentaje con 24%. Supervivencias semejantes, han sido manifes tadas en otras especies silvestres como S. cheesmaniae accesión ˋVI037238ˊ y S. pimpinellifolium accesión ˋVI010049ˊ con 33,46% y 35,91% de individuos vivos que alcanzaron el estado adulto respectivamente. Rodríguez-López et al. (2020); reportan que en la accesión ˋABL 10-4ˊ de S. pimpinellifolium, se ha asociado a una supervivencia reducida de T. vaporariorum en etapas tempranas del desarrollo del insecto; mientras que la alta supervivencia en etapas tardías de desarrollo se asocia a una adaptación a la producción de acilazúcares de las ninfas que sobrevivieron en las primeras etapas. Mayo-Hernández et al. (2019) sugieren que B. cockerelli prefiere estable cerse y desarrollarse en plantas que favorezcan su desarrollo y crecimiento, como Floradade; y evita las plantas que no proporcionen una condición óptima como las especies silvestres. La proporción sexual de B. cockerelli sobrevivientes se mantuvo en promedio de 1: 0,9 hembras - machos.
A su vez, la especie silvestre que más prolongó el tiempo de desarrollo de los estadios inmaduros para completar el ciclo completo fue S. habrochaites con casi 23 días, la tendencia fue similar en S. arcanum y S. pimpinellifollium con alrededor de 21 días; similar a lo reportado por Cerna-Chávez et al. (2018), 22 días de duración total del ciclo biológico en un cultivar comercial; aunque esto es posiblemente debido a las condiciones en que se realizó ese experimento. En los dos cultivares comerciales el ciclo biológico del insecto se completó en menor tiempo, con un promedio de 19 días y siendo estadísticamente diferentes a los demás tratamientos (Tabla 4). Yang et al. (2010) mencionan que, a una temperatura de 26 °C, el desarrollo de las ninfas es precoz aproximadamente con 19,6 días. Sin embargo, S. peruvianum (LA3640) resultó ser la especie que más acortó la duración total del ciclo, con un promedio de 17 días (Tabla 4). Liu & Trumble (2007) sugieren que el hospedero es un factor clave que altera el tiempo de desarrollo del psílido. Yang & Liu (2009) encontraron que los estadíos inmaduros B. cockerelli se desarrollaron más rápido (24 días) cuando se alimentaron de berenjena; sin embargo, cuando la dieta es de pimiento el ciclo total se incrementó a 26 días.
La fertilidad de las hembras que se desarrollaron desde huevo hasta la etapa adulta, en cada uno de los genotipos difirieron estadísticamente (Tabla 5). En el cultivar Floradade y Rio Grande la media cercana a los 45 huevos, con una media de eclosión de 43 ninfas aproximadamente. En el caso de la especie S. pimpinellifolium y S. peruvianum la media fue de aproximada a 40 huevos de los cuales solo cerca de 34 eclosionaron. La tendencia manifestada por estas tres especies coincide con lo reportado por Yang & Liu (2009) quienes encontraron una tasa media de 47 huevos. En S. arcanum se presentó solo la mitad de los huevos que, en las dos especies anteriores, de los cuales solo eclosionaron 12 ninfas. Por último, la oviposición más baja se presentó en S. habrochaites, con solo 2 huevos de los cuales ninguno eclosiono. Este resultado concuerda con lo reportado por Avila et al. (2019), quienes en S. habrochaites solo encontraron un huevo, el cual no eclosiono.
Tabla 4 Tiempo de desarrollo (días) de los estadios inmaduros de B. cockerelli en especies silvestres y cultivares comerciales
| Especie/cv | Ninfa 1 | Ninfa 2 | Ninfa 3 | Ninfa 4 | Ninfa 5 | Ciclo Completo |
|---|---|---|---|---|---|---|
| Floradade | 4,5 ± 0,53bc | 3,62 ± 0,52bc | 37,5 ± 0,46a | 3,5 ± 0,53a | 3,62 ± 0,52b | 19,00 ± 1,19c |
| Rio Grande | 4,00 ± 0,1c | 4,00 ± 0,5abc | 3,63 ± 0,52a | 3,75 ± 0,46a | 3,87 ± 0,35ab | 19,25 ± 1,03c |
| LA3158 | 4,87 ± 0,35ab | 4,00 ± 0,53abc | 4,13 ± 0,64a | 4,12 ± 0,64a | 3,86 ± 0,35ab | 21,00 ± 0,75b |
| LA3640 | 4,25 ± 0,46bc | 3,13 ± 0,83c | 3,5 ± 0,53a | 3,5 ± 0,76a | 3,5 ± 0,93b | 17,87 ± 1,73d |
| LA2157 | 5,25 ± 0,46a | 4,37 ± 0,52ab | 3,87 ± 0,35a | 4,00 ± 0,1a | 4,00 ± 0,53ab | 21,50 ± 1,19ab |
| LA0407 | 5,37 ± 0,52a | 4,62 ± 0,74a | 4,13 ± 0,35a | 4,12 ± 0,35a | 4,62 ± 0,51a | 22,87 ± 0,99a |
| p - valor | 0,0001 | 0,0001 | 0,0679 | 0,042 | 0,0059 | 0,0001 |
LA3158: S pimpinellifollium, LA3640: S. peruvianum, LA2157: S. arcanum y LA0407: S. habrochaites. *Medias con la misma letra en cada columna no son estadísticamente diferentes (Tukey; p < 0,05).
Tabla 5 Oviposturas y número de eclosiones en los distintos genotipos de tomate
| Especie/cv | Huevos | Eclosión |
| Floradade | 45,07 ± 0,76a | 43,25 ± 1,22a |
| Rio Grande | 45,92 ± 2,85a | 43,90 ± 1,98a |
| LA3158 | 39,38 ± 0,67b | 33,89 ± 0,34b |
| LA3640 | 40,22 ± 0,08b | 33,91 ± 0,19b |
| LA2157 | 19,83 ± 0,76c | 11,83 ± 0,28c |
| LA0407 | 2,50 ± 0,08d | 0,0 ± 0,0d |
| p - valor | 0,0001 | 0,0001 |
LA3158: S pimpinellifollium, LA3640: S. peruvianum, LA2157: S. arcanum y LA0407: S. habrochaites. *Medias con la misma letra en cada columna no son estadísticamente diferentes (Tukey; p < 0,05).
En la mayoría de las especies genotipo de tomate, se observó la presencia de un tipo de tricoma no glandular junto con un tipo glandular, a excepción de S. habrochaites el cual presento dos tipos de tricomas glandulares (Figura 1).
La mayor densidad de tricomas no glandulares se observó en S. peruvianum con tricomas tipo II (80,7 ± 2,73), seguido de la variedad S. pimpinellifolium el cual presentó tricomas del tipo Vb (57,5 ± 2,4). Del mismo modo S. arcanum, mostró la presencia de tricomas tipo II, al igual que S. peruvianum, aunque en menor cantidad que este (23 ± 0,54). En los cultivares comerciales Floradade y Rio Grande, se encontró la presencia de tricomas tipo Vb (33,8 ± 2,1). Lo anterior concuerda con lo reportado por Fernández-Muñoz et al. (2003) quienes reportaron que el cultivar comercial ‘Moneymaker’ presenta tricomas no glandulares del tipo V (17,3 ± 1,2), y escasos tricomas glandulares del tipo VIa (3,5 ± 0,2).
Para los tricomas glandulares, la mayoría de las especies presentaron tricomas tipo VIa, teniendo mayor cantidad de estos los cultivares comerciales. Por otro lado, S. habrochaites fue la única accesión que mostró la presencia de tricomas glandulares tipo IV (113,86 ± 48,1) y VIc (27,3 ± 2,3).
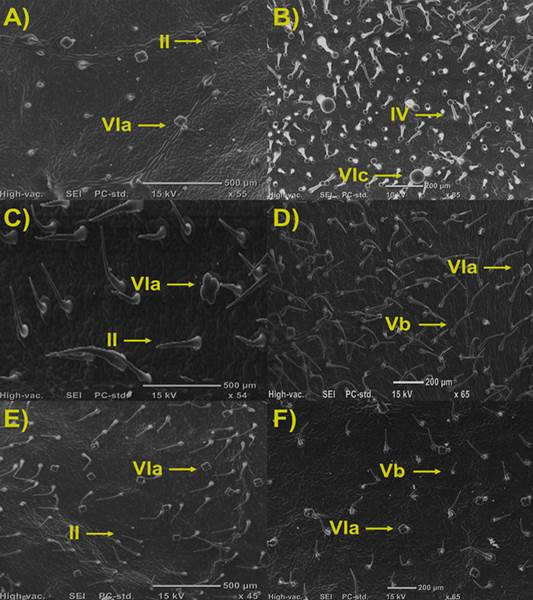
Figura 1 Densidad y tipos de tricomas en hojas de Solanum spp. A) S. Arcanum. B) S. habrochaites. C) S. peruvianum. D) S. pimpinellifolium. E) lycopersicum cv. Rio Grande. F) lycopersicum cv. Floradade. Tricomas no glandulares: II y Vb; Tricomas glandulares: IV, VIa y VIc.
Rakha et al. (2017) determinaron que altas densidades de tricomas tipo IV, presentes en algunas especies silvestres como S. galapaguense se asocian con la producción de acilazúcares, los cuales reducen de forma significativa la cantidad de huevos, ninfas y adultos de mosca blanca. Marchant et al. (2020) aluden que las plantas de tomate cultivadas también pueden producir acilazúcares, pero en niveles muy bajos. Bai & Lindhout (2007) mencionan que los cultivares comerciales poseen menos del 5% de la variación genética con la cual contaban sus parientes silvestres, es decir el 95% de esa variación, se ha perdido en el transcurso del tiempo durante el proceso de domesticación. Es por ello que son considerados más susceptibles al daño causado por insectos fitófagos.
Alba et al. (2009), utilizando la variedad silvestre S. pimpinellifolium, observaron que la araña roja, se cubrían progresivamente con los exudados tóxicos liberados por tricomas del tipo IV, a medida que deambulan por la hoja. Por lo tanto, los autores señalan que no solo la secreción sino también la densidad y distribución del tricoma tipo IV, podrían ser importantes para afectar negativamente las poblaciones de los artrópodos.
La presencia de tricomas glandulares del tipo VIa ejerció una correlación negativa altamente significativa en cuanto al asentamiento de las hembras y significativa para las oviposturas de las mismas, a las 48 horas. Del mismo modo, se encontró una fuerte correlación conjunta entre tricomas glandulares del tipo VIa con tricomas tipo IV y VIc. En cuanto a la presencia de tricomas no glandulares y el afecto antixenótico, se encontró que tricomas del tipo II, III y Vb, ejercieron una correlación negativa no significativa (Tabla 6).
En esta investigación, la incidencia de B. cockerelli correlacionada inversamente con la presencia de tricomas glandulares, sugiere que los mismos, limitan o previenen el establecimiento de los psílidos. Sánchez-Peña et al. (2006) reportaron que plantas de tomate con mayor número de tricomas del tipo IV y VI manifiestan una correlación negativa con el asentamiento de Bemisia. A su vez, Bleeker et al. (2012) encontraron que la abundancia de tricomas del tipo VI se correlaciona negativamente con la preferencia y oviposición de Bemisia tabaci (biotipo Q), Tetranychus evansi, Manduca sexta y Leptinotarsa decemlineata.
Por otra parte, De Oliveira et al. (2018) señalan que los aleloquímicos presentes en los tricomas del tipo IV y VIc de un cruce interespecífico entre S. habrochaites var. hirsutum accesión PI-127826 y S. lycopersicum cv. Redenção, tienen efectos antagónicos sobre el comportamiento y la biología de Tetranychus urticae. De forma semejante, Dawood & Snyder (2020) demostraron que el 7-epi-zingibereno, 9-hidroxi zingibereno y 9-hidroxi,10,11-epoxi-zingibereno, que se encuentra en las secreciones de tricomas glandulares de ciertas accesiones de S. habrochaites, son compo nentes altamente repelentes hacia la araña roja.
Particularmente, la no preferencia que manifestó B. cockerelli hacia S. arcanum en nuestro estudio, no puede ser atribuida a la presencia de tricomas glan dulares y por ende a la excreción de compuestos químicos que actúen como repelentes. McDowell et al. (2011) reportan que tanto la diversidad como la cantidad de tricomas en esta especie son extrema damente limitadas. Sin embargo, Rossi et al. (1998), Nombela et al. (2003) y Jablonska et al. (2007) manifiestan que S. arcanum posee distintos factores de resistencia como el gen Mi; presente en la epidermis, en las capas del mesófilo o en ambas, lo que confieren resistencia a organismos de diferente taxón como: Meloidogyne arenaria, M. incognita, y M. javanica, Macrosiphum euphorbiae y Bemicia tabaci haplotipos B y Q. Se plantean distintas posibilidades sobre la forma en que Mi confiere resistencia, no obstante, estos mecanismos siguen sin estar claros, además estos podrían diferir para cada tipo de plaga (Heinz & Zalom, 1995).
Tabla 6 Correlación del tipo de tricomas y el efecto de antixenosis
| Especie/cv | II | III | IV | Vb | VIa | VIc | VII | A48 | OVI48 | |
| Especie/cv | 1.00 | |||||||||
| II | -0,19NS | 1,00 | ||||||||
| III | -0,39NS | -0,25NS | 1,00 | |||||||
| IV | 0,65** | -0,26NS | -0,20NS | 1,00 | ||||||
| VB | -0,24NS | -0,39* | -0,30NS | -0,30NS | 1,00 | |||||
| VIA | -0,83** | -0,31NS | 0,53** | -0,58** | 0,22NS | 1,00 | ||||
| VIC | 0,65** | -0,26NS | -0,20NS | 0,99** | -0,30NS | -0,58** | 1,00 | |||
| VII | 0.37* | 0,08NS | -0,19NS | -0,19NS | -0,29NS | -0,18NS | -0,19NS | 1,00 | ||
| A48 | -0,69** | -0,15NS | 0,08 NS | -0,48** | 0,42* | 0,65** | -0,48** | -0,14NS | 1,00 | |
| OVI48 | -0,44* | 0,17NS | 0,08 NS | -0,39* | 0,18NS | 0,41* | -0,38* | -0,17NS | 0,68** | 1,00 |
A48: Efecto de antixenosis a las 48hr; OVI48: Oviposturas a las 48hr; NS: No significativo; **: Altamente significativo; *: Significativo.
Estas investigaciones respaldan la idea de que el grado de repelencia puede diferir entre los metabolitos exudados por las plantas y los factores de resistencia que poseen. Dichos compuestos parecen repeler a los insectos antes de posarse sobre el huésped. Bleeker et al. (2012) plantean la hipótesis de que los metabolitos secundarios son señales utilizadas por los artrópodos para reconocer plantas tóxicas, lo que indica que el insecto percibe la planta como un huésped inadecuado para sí mismo o su descendencia. Sin embargo, es necesario investigar los mecanismos involucrados en la repelencia y toxicidad.
4. Conclusiones
De acuerdo con los resultados, una alta densidad de tricomas glandulares del tipo IV y VIc presentes en S. habrochaites proporcionan altos niveles de resistencia a B cockerelli al reducir los niveles de asentamiento, aumentar su nivel de mortalidad y por alargar su ciclo biológico. Por otro lado, S. arcanum mostró un buen nivel de resistencia hacia este in secto, sin embargo, no pueden ser atribuidos a la presencia de tricomas glandulares. En contraste los cultivares comerciales Floradade y Rio Grande, fueron preferidos por B. cockerelli para ovipositar, alimentarse y desarrollarse. Por lo tanto, los resultados sugieren que los mecanismos de defensa de las cuatro especies silvestres de tomate, particularmente los de S. habrochaites contra B. cockerelli incluyen la antixenosis y la antibiosis. Estas accesiones son fuentes potenciales de factores de resistencia que pueden usarse en programas de mejoramiento con fines de resistencia para cultivares comerciales de tomate. Estudios posteriores pueden ser enfocados en la transducción de genes provenientes de S. arcanum y S. habrochaites en cultivares comerciales, ya que ambas especies manifestaron distintos mecanismos de defensa al alterar negativamente el comportamiento, desarrollo y fertilidad de B. cockerelli.