1. Introducción
El maracuyá (Passiflora edulis) es una enredadera frutal leñosa perenne que pertenece a la familia Passifloraceae. Originaria de América tropical (Brasil), es un cultivo frutal muy apreciado para el consumo en fresco y con fines industriales debido a sus diversos usos en jugos, jaleas y helados (Zhang et al., 2021). Es un producto de gran importancia económica gracias a su calidad y alto rendimiento industrial (Faleiro et al., 2020), consumido en todo el mundo por su atractivo aroma y sabor (Li et al., 2021). Las dos principales variedades sembradas a nivel mundial de Passiflora edulis son el maracuyá amarillo (Passiflora edulis f. flavicarpa) y el morado (Passiflora edulis f. edulis) (Roda et al., 2017).
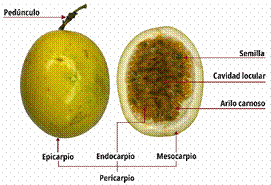
La especie de maracuyá más cultivada y conocida es el maracuyá amarillo (Pasiflora edulis f. flavicarpa Degener), el cual representa alrededor del 95% de la producción comercial mundial de maracuyá (Carro, 2013). Es adecuado para altitudes bajas y es menos productivo a mayor altitud debido a su sensibilidad a las bajas temperaturas. El fruto pesa alrededor de 60 g. Como se puede apreciar en la Figura 1 y la Figura 2, tiene forma redonda u ovalada con manchas moteadas de color amarillo, y adquiere un tono dorado cuando madura. Su pulpa es jugosa y gelatinosa, con un color que puede variar entre amarillo y naranja, mientras que las semillas son pequeñas, duras y de color marrón (Thokchom & Mandal, 2017). En cambio, el maracuyá morado es cultivado a mayor altitud. Los frutos tienen un diámetro de 4-5 cm, son de color púrpura intenso cuando están maduros y pesan 35-45 g cada uno. Las semillas son de color negro. Esta variedad es conocida por su calidad en cuanto a sabor y contenido en nutrientes (Marciel et al., 2018).
El maracuyá es una fruta que cuenta con un alto valor nutritivo y medicinal en general. Es una rica fuente de vitamina C, fibra dietética y proteína, además de contener cantidades considerables de hierro, potasio, sodio, magnesio, azufre y cloruros (Molina-Hernández et al., 2019). También posee grandes propiedades antioxidantes, flavonoides, antiinflamatorias, antibacterianas, antifúngicas y antienvejecimiento (Biswas et al., 2021). Otros autores han reportado que el maracuyá posee otras actividades biológicas, como gastroprotectora, analgésica, antidiarreica, antidiabética y antiproliferativa, que están relacionadas con su composición específica en términos de composición bioactiva (Siebra et al., 2018).
La composición del maracuyá se compone de 36% jugo, 51% cáscara y 11% semillas (Joy, 2010). La cáscara y las semillas, consideradas subproductos, también muestran grandes beneficios debido a sus propiedades antioxidantes, capacidad antimicrobiana y acción hepatoprotectora, además de ser una fuente de fibra dietaria y pectina (López et al., 2021). La cáscara del maracuyá contiene fibras que pueden ser un sustrato para las bacterias entéricas y contribuir a mantener la salud intestinal (Silva et al., 2014). En cambio, las semillas de maracuyá son fuentes de ácidos grasos esenciales, principalmente ácido linoleico (55-6%), ácido oleico (18-20%) y ácido palmítico (10-14%), que pueden utilizarse en las industrias alimentaria y cosmética (Zeraik et al., 2010). El aceite crudo obtenido a partir de las semillas es una rica fuente de compuestos bioactivos (Dos Santos et al., 2021).
Por ende, el objetivo de esta investigación es brindar información actualizada sobre el maracuyá, sus variedades principales y los subproductos que se originan a partir de su procesamiento. Centrándose en su composición nutricional y en los compuestos bioactivos que contiene, así como en los posibles usos, procesamientos y beneficios de los subpro ductos generados por el maracuyá, además del biocontrol de plagas y aplicación de fertilizantes orgánicos en cultivos de maracuyá.
2. Composición Nutricional
El maracuyá es conocido por sus altos niveles de fibra, vitamina A, E y C, lo que contribuye a regular la digestión, reducir el colesterol, favorecer la absorción del hierro, reforzar el sistema inmunológico y actuar como antioxidante (Pardo-Jumbo et al., 2017). Además, es una buena fuente de riboflavina y niacina, a la vez que aporta bajas cantidades de grasa, lo que los convierte en alimentos de bajo valor energético (He et al., 2020).
De la misma manera, varios autores han indicado que los subproductos del maracuyá, la cáscara y semillas, tienen el potencial de proporcionar cantidades significativas de varios macronutrientes (lípidos, fibra) y micronutrientes (K, Fe, Mg, Cu, Mn, Ca y Zn); siendo adecuados para usarse en el desarrollo de nuevos productos alimenticios (Fonseca et al., 2022).
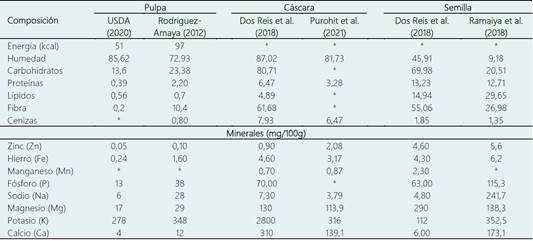
Con el fin de recopilar y resumir la información proporcionada por diversos autores en los últimos años, se han proporcionado dos tablas. La Tabla 1, la cual se enfoca en la composición proximal del maracuyá variedad amarilla (Passiflora edulis f. flavicarpa), mientras que la Tabla 2 se centra en la composición proximal del maracuyá variedad morada (Passiflora edulis f. edulis). Ambas tablas abordan principalmente la composición proximal y el contenido de minerales en la pulpa, la cáscara y las semillas de cada variedad.
2.1 Maracuyá variedad amarilla
2.1.1 Pulpa
El maracuyá crudo está compuesto por un 73% de agua, un 22% de carbohidratos, un 2% de proteína y un 0,7% de grasa (Biswas et al., 2021). Este fruto se caracteriza por ser un alimento de alta acidez, con un pH de 3,10 ± 0,054 y una acidez de 3,48 ± 0,069%, debido al predominio de dos ácidos, el cítrico y el málico. Además, contiene 12,43 ± 0,15 °Brix de sólidos solubles (García-Mogollon et al., 2015).
Se han informado diferentes valores de vitamina C en el maracuyá. Por ejemplo, Pertuzatti et al. (2015), reportaron 41 mg de vitamina C en 100 g de jugo de maracuyá natural, mientras que Septembre-Malaterre et al. (2016) reportaron 44,4 mg/100 g de vitamina C. También hay valores más bajos, como los reportados por Prasertsri et al. (2019), con 16-20 mg/g de vitamina C. Además, la pulpa del maracuyá presenta 2,46 mg/100 g de niacina y 0,131 mg /100 g de Riboflavina (Rodriguez-Amaya, 2012). En cuanto a los minerales, el potasio es el más abundante en la pulpa del maracuyá con 2176,9 mg/100g, seguido del magnesio (76,8 mg/100g), sodio (75,3 mg/100g), calcio (47,1 mg/100g) y hierro (7,1 mg/100g) (Morais et al., 2017).
2.1.2 Cáscara
La cáscara del maracuyá es rica en vitaminas, minerales y fibra dietética, especialmente fibras solubles, que proporcionan beneficios como el control glucémico y la prevención de enfermedades cardiovasculares (Nascimento et al., 2020). El análisis proximal de la cáscara indica que contiene una fibra dietaría total de 63,40%, carbohidratos de 23,41%, ceniza de 7,50%, proteínas de 4,82% y grasas de 0,87% (Duarte et al., 2016).
2.1.3 Semilla
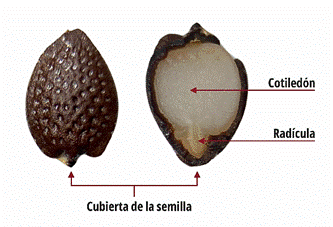
Las semillas están compuestas de 7,38±0,07% de humedad, 1,27±0,02% ceniza, 30,39±0,04% de lípidos y 48,73% de carbohidrato y fibra (Malacrida & Jorge, 2012).
Tabla 1 Composición proximal del maracuyá variedad amarilla (Passiflora edulis f. flavicarpa) (g/100 g de peso seco)
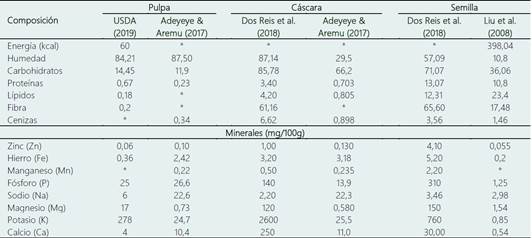
Son una buena fuente de proteínas, con una cantidad alta de proteína del 10,8 ± 0,60%. Además, contienen cantidades considerables de minerales como sodio (2,980 ± 0,002 mg/g), magnesio (1,540 ± 0,001 mg/g), potasio (0,850 ± 0,001 mg/g) y calcio (0,540 ± 0,002 mg/g) (Liu et al., 2008).
2.2 Maracuyá variedad morada
2.2.1 Pulpa
En el caso de la variedad morada, Dos Reis et al. (2018), en su investigación encontraron que la pulpa contiene 6,53 ± 0,23% de proteína. Por su parte, Ramaiya et al. (2019), reportaron 1,18 ± 0,11% de ceniza, 6,95 ± 0,73% de carbohidratos, 12,7 ± 0,3% de humedad y 1,09 ± 0,04% de lípidos.
Los jugos extraídos de la pulpa de Passiflora edulis son una rica fuente de fibra, proteína y carbohidratos. Una taza de 247 mL de jugo de fruta de Passiflora edulis proporciona aproximadamente un 24% de potasio, entre el 60% y 80% de magnesio, más del 80% de fósforo y el 90% de hierro recomendado en la dieta en términos de minerales (Ramaiya et al., 2019). El fósforo es el mineral más abundante en la pulpa del maracuyá morado con 265,45 mg, seguido del potasio (100,22 mg), el sodio (13,15 mg), el calcio (10,83 mg) y el hierro (1,22 mg) (Granados et al., 2017).
2.2.2 Cáscara
Según el análisis proximal de la cáscara de maracuyá (Passiflora edulis) realizado por Klinchongkon et al. (2015), destacan que los carbohidratos constituyen el 79,44 ± 0,22%, mientras que la humedad es del 9,43 ± 0,05%, la grasa bruta del 0,36 ± 0,04%, la proteína bruta del 3,87 ± 0,23% y la ceniza del 6,91 ± 0,07%. Además, se estudió el uso de la cáscara de maracuyá como fibra dietética, y se informó que el rendimiento de material insoluble en alcohol de la cáscara seca fue de aproximadamente el 82,4%, de los cuales el 81,9% correspondió al componente de fibra dietética, siendo la celulosa el componente principal. Varios estudios han reportado que la cáscara de maracuyá contiene alrededor del 15% al 20% de pectina (Seixas et al., 2014).
2.2.3 Semilla
Ramaiya et al. (2018) se centró en la composición aproximada y el contenido mineral de las semillas comestibles de Passiflora edulis, donde se encontró que el contenido de humedad era del 9,18 ± 0,34%, mientras que el contenido de ceniza era del 1,35 ± 0,01%. Las semillas presentaban un mayor contenido de proteína (12,71 ± 0,10%) y de fibra dietética total (43,76 ± 0,64%), con una fracción mayoritaria de fibra dietética insoluble del 72% al 74% y una fracción de fibra dietética soluble del 12,31 ± 0,08%. El contenido de lípidos era del 29,65 ± 0,41%, lo que indica que la semilla es rica en contenido de aceite.
3. Componentes bioactivos
El maracuyá es una fruta con un alto contenido nutracéutico que incluye ácido fenólico, flavonoides y carotenoides. Las antocianinas son los compuestos mayoritarios dentro del grupo de flavonoides, mientras que el β-caroteno es el componente principal de los carotenoides. Además, el maracuyá también contiene provitamina A (González-Gallego et al., 2014). Estos compuestos tienen actividades biológicas que pueden ser beneficiosas para la salud, como efecto protector contra enfermedades degenerativas y crónicas, mutagénesis y carcinogénesis inhibidores. También se ha demostrado que estos compuestos tienen actividades antivirales, antialérgicas, antiplaquetarias y antiinflamatorias (Morais et al., 2016).
Tabla 2 Composición proximal del maracuyá variedad morada (Passiflora edulis f. edulis) (g/100 g de peso seco)
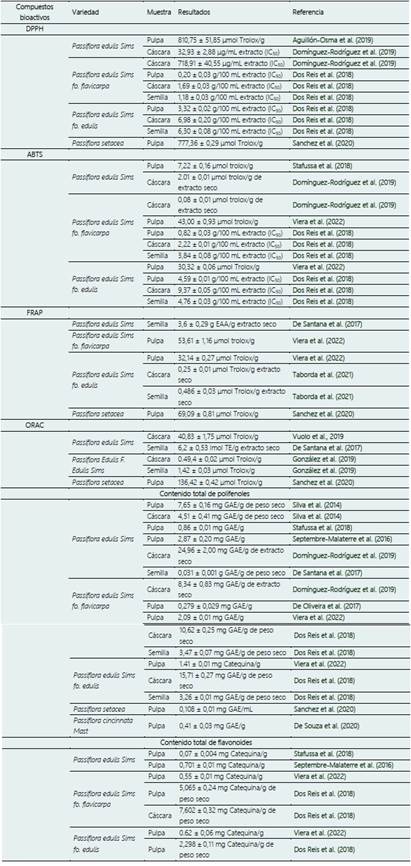
La presencia de fitoconstituyentes en el maracuyá, como alcaloides, fenoles, flavonoides glucosílicos y compuestos cianogénicos, lo convierten en una fruta beneficiosa para el tratamiento y prevención de diversas enfermedades, como la ansiedad, la diabetes, las enfermedades cardiovasculares, las convulsiones, el asma, la artrosis y el cáncer (Biswas et al., 2021). Estos compuestos antioxidantes proporcionan beneficios a la salud al combatir el daño celular causado por los radicales libres (Rojas-Llanes et al., 2014). Por consiguiente, la Tabla 3 presenta de manera simplificada los resultados de diversos tipos de análisis de los compuestos bioactivos presentes en varias variedades de maracuyá y sus subproductos.
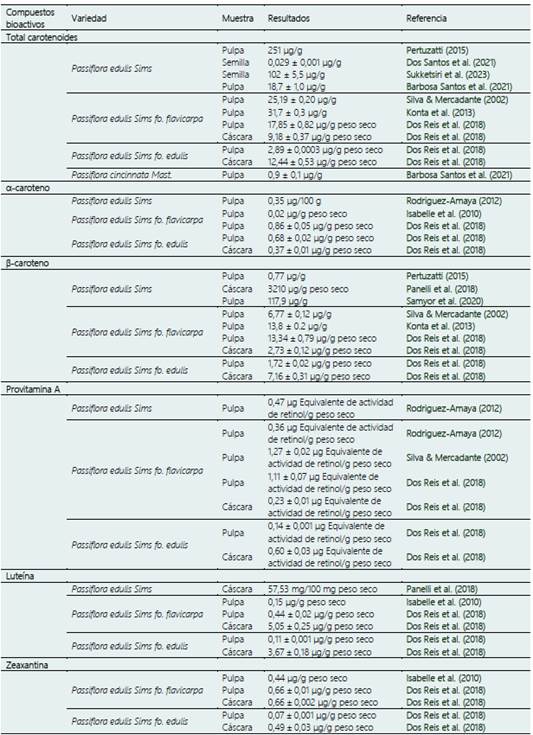
En el maracuyá de encuentran 13 carotenoides, entre los que destacan el ζ-caroteno, Luteína, Zeaxantina, β-Criptoxantina, Licopeno y β-Caroteno. Estos compuestos tienen propiedades antioxidantes y pueden ayudar a secuestrar el oxígeno singlete e interactuar con los radicales libres, fortaleciendo el sistema inmunológico. Además, se pueden utilizar como colorantes alimentarios naturales (Rodrigues-Amaya et al., 2008). Por lo tanto, la Tabla 4 presenta de manera simplificada el perfil de carotenoides presentes de diversas variedades de maracuyá y sus subproductos.
4. Subproductos del maracuyá
El número de estudios publicados sobre el uso de residuos industriales, también conocidos como subproductos, como fuentes para nuevas líneas de proceso ha aumentado considerablemente en los últimos años. Entre los diferentes subproductos, el uso de residuos de frutas o plantas trae consigo beneficios económicos y disminuyen el daño al medio ambiente (Oliveira et al., 2016). Estos estudios han demostrado que la mayoría de los residuos de frutas contienen altos niveles de vitaminas, minerales, compuestos antioxidantes y fibras, que promueven efectos positivos para la salud, previniendo cáncer, diabetes y enfermedades cardiovasculares (Silva et al., 2016).
A pesar de que el zumo de fruta de maracuyá es una fuente importante de minerales y vitaminas, produce grandes cantidades de subproductos (semillas y cáscara) que representan el 65% al 70% del peso de la fruta y que comúnmente se desechan; sin embargo, la cáscara de maracuyá posee una alta concentración de pectina, lo que ha recibido bastante atención recientemente debido a sus beneficios para la salud (Canteri et al., 2012). Las semillas representan el 4% al 12% del maracuyá y contienen alrededor de un 30% de aceite (Malacrida & Jorge, 2012). A pesar de los esfuerzos para la reutilización de residuos industriales, grandes cantidades de residuos de maracuyá siguen siendo infrautilizadas; por lo tanto, es urgente buscar medios viables para transformar estos coproductos en productos útiles productos de alto valor añadido (Seixas et al., 2014).
Se realizó un análisis de color CIELab de la fruta y sus subproductos del maracuyá (Passiflora edulis f. flavicarpa), como se observa en la Figura 3, para esquematizar de esta manera las posibles aplicaciones industriales.
4.1 Cáscara de maracuyá
La pectina es un polisacárido originario de la pared celular de muchas plantas, principalmente frutas y verduras (Christiaens et al., 2015). Se conoce por su amplio uso en la industria alimentaria debido a su capacidad de gelificar, dar viscosidad y consistencia a los productos alimenticios (Kanse et al., 2017). La mayoría de las pectinas comerciales se extraen de las cáscaras de cítricos como el limón y la naranja. Sin embargo, con el crecimiento de las aplicaciones, se han presentado fuentes alternativas (Kulkarni & Vijayanand, 2010).

Figura 3 Análisis de color CIELab en fruta y subproductos del maracuyá (Passiflora edulis f. flavicarpa); (A) Epicarpio; (B) Mesocarpio; (C) jugo del fruto; (D) semillas secas; (E) cáscara seca; (F) harina de la cáscara de la fruta.
La pectina de la cáscara de maracuyá presenta menor grado de esterificación (68,0%), contenido en ácidos galacturónicos (72,0%) y masa molar que la pectina comercial (Silva et al., 2023).
Las fibras presentes en los residuos de frutas también pueden contener apreciables cantidades de pigmentos, antioxidantes u otras sustancias con efectos positivos para la salud, entre los cuales se destacan la reducción del riesgo de padecer enfermedades cardiovasculares, el mejoramiento de la función gastrointestinal y la digestión de los lípidos, contribuyendo así al control del peso y también a reducir el riesgo de desarrollar algunos tipos de cáncer y enfermedades en pacientes inmunodeprimidos (Marques et al., 2016).
La harina producida a partir de cáscara de maracuya presenta granulometría heterogénea, alto contenido en carbohidratos, carotenoides y compuestos fenólicos totales, con una elevada capacidad antioxidante (Macedo et al., 2023). La harina de hecho es fuente de minerales y vitaminas, carotenoides y fibras (Cazarin et al., 2014); con propiedades antidiabéticas y antiobesidad, debido a que es rico en pectina (Janebro et al., 2008). Se ha logrado identificar la presencia de 22 sustancias en la harina de cáscara de maracuyá, abarcan diversas clases de componentes, como ácidos orgánicos, azúcares, quinonas, terpenos glicéridos fenilpropanoides y aminoácidos (Macedo et al., 2023). La harina de maracuyá se puede utilizar para enriquecer productos como pan, pasteles, galletas y barritas de cereales, mejorando sus cualidades nutricionales y tecnológicas (De Souza et al., 2008).
4.2 Semillas de maracuyá
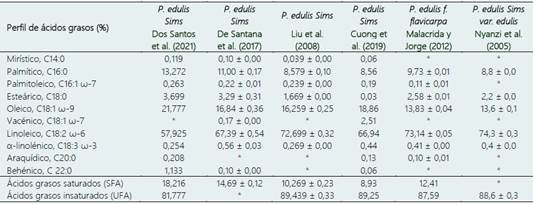
En los últimos años, las semillas de maracuyá han despertado interés para la producción de aceite, principalmente debido a la presencia de compuestos bioactivos (Viganó & Martìnez 2015). Las investigaciones han encontrado que las semillas de maracuyá contienen alrededor de 30% de aceite, como ácidos linoleico, oleico y palmítico como los principales ácidos grasos presentes (Malacrida & Jorge, 2012). El ácido linoleico representa alrededor del 72%-73%, seguido del ácido oleico (13%-16%) y del ácido palmítico (8%-9%) (Liu et al., 2009). Como se puede apreciar en la Tabla 5, se compara el perfil de ácidos grasos del aceite extraído de semillas de diversas variedades de Passiflora edulis.
En cuanto a los compuestos menores que se encuentran en el aceite de semilla de maracuyá, su color rojo a naranja lo proporcionan los carotenoides. Dentro de este grupo de compuestos bioactivos, el principal es el b-caroteno, precursor esencial del retinol y la vitamina A, cuyo consumo se ha re lacionado con la potenciación del sistema inmunitario (Lai et al., 2014).
Las semillas se han utilizado para producir aceite por prensado mecánico convencional, debido a su alto contenido en ácidos grasos insaturados en la industria alimentaria, farmacéutica y cosmética (Fonseca et al., 2022). Las semillas contienen aceite con varios compuestos con potencial aplicación como principios activos. Por ejemplo, el aceite de semilla de maracuyá ha demostrado ser una fuente prometedora de esteroles, fenoles, carotenos y tocoles (Piombo et al., 2006). Además de poseer características fisicoquímicas adecuadas como aceite comestible. El presentar una actividad antioxidante relativamente alta puede ser aplicado en la industria farmacéutica (Le et al., 2023). Según Ferreira et al. (2011), el aceite de semilla del maracuyá podría utilizarse como fuente de ácidos grasos esenciales y utilizarse en la prevención de trastornos cardiovasculares como enfermedades coronarias, la aterosclerosis y la hipertensión arterial.
4.3 Hojas de maracuyá
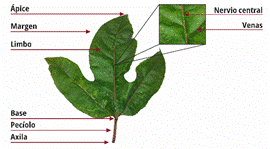
Las hojas son consideradas insignificantes, sin embargo, contienen nutrientes que efectos beneficiosos para la salud. Las hojas de maracuyá son trilobuladas con lóbulos curvos, agudos o acuminados, y, cuando son adultas, adquieren forma dentada, con la base redondeada, subtruncada o cuneiforme; brillante en la superficie adaxial y trinervada (Salles, 2017). Posee hojas alternas, de hasta 13 × 15 cm, verde brillante o verde amarillento por encima, verde más pálido y apagado por debajo, con dos glándulas en el ápice del pecíolo; estípulas lineares de aproximadamente 1 cm de longitud (Taïwe & Kuete, 2018) (Figura 4).
Se ha informado que las hojas del maracuyá son muy apreciadas y ampliamente utilizadas en Estados Unidos y países europeos debido a sus propieda des medicinales (Yuan et al., 2017). El extracto de las hojas muestra actividad antidiabética, antioxidante, antitumoral, antiinflamatoria e hipolipemiante, lo que las hace muy valiosas (Sunny et al., 2020). Ingale & Hivrale (2010) demostraron que las hojas del maracuyá también se pueden utilizar como sedantes, ansiolíticos, antidepresivos, hepatoprotectores, protectores pulmonares, antihipertensivos, antimicrobianos y analgésicos.
Hojas de maracuyá se utilizan en tratamiento de los síntomas del alcoholismo, la ansiedad, la migraña, el nerviosismo y el insomnio; tónico cardiaco, diurético suave, estimulante digestivo y tratamiento de las infecciones urinarias (He et al., 2020). Contienen una variedad de compuestos que le confieren propiedades medici nales. Se ha descrito la presencia de ácido ascór bico, taninos, alcaloides, sulforafanos, carotenoides, flavonoides y triterpenoides en su composición (He et al., 2020). Entre estos compuestos, los flavonoides y los triterpenoides son especialmente importantes debido a su actividad antibacteriana, antioxidante y antihemolítica (Bandara et al., 2018).
Se ha encontrado que las hojas de P. edulis reporta un contenido de fenoles totales de 2,81 g GAE/100g (Caicedo & Saquinaula, 2023), mayores a los obtenidos por Salles (2017) de 1,94 ± 0,09 g GAE/100 g y de De Silva et al. (2013), 0,83 ± 0,07 g GAE/100 g. Para la deter-minación de la actividad antioxidante basada en el método DPPH de las hojas de P. edulisTrevisan et al. (2021) obtuvo como resultado una concen-tración de 314,0033 μg/mL, Rojas et al. (2010) obtuvo una concentración menor de 124 ug/ml. mientras que De Silva et al. (2013), obtuvo una concentración mayor de 1100 μg / mL. Además, las concentraciones de los tres principales flavonoi des presentes en las hojas son vitexina (0,05 mg/g), isovitexina (0,05 mg/g) e isoorientina (0,03 mg/g).
5. Otras formas de aprovechamiento
5.1 Abono orgánico
El aprovechamiento del abono orgánico ha sido objeto de estudio en los últimos años, siendo efectivo en mejorar la fertilidad del suelo y el crecimiento de las plantas. Por lo que los residuos de maracuyá, al contener altos niveles de nutrientes esenciales para el desarrollo de las plantas, como nitrógeno, fósforo y potasio, se convierten en una buena opción de uso agronómico (Reguengo et al., 2022). La aplicación de estos residuos como abono mejora la retención de agua en el suelo y aumenta la actividad biológica, lo que se traduce en un incremento de la producción agrícola (Jara-Samaniego et al., 2017). Esto sugiere que los residuos de fruta son un recurso valioso para la agricultura sostenible, y su uso como abono puede contribuir a reducir la dependencia de los fertilizantes químicos, mejorando así la salud del suelo y del medio ambiente en general (Dahunsi et al., 2021).
5.2 Alimento para animales
La versatilidad de los residuos del maracuyá no solo se limita a su uso en la alimentaria, sino que también se extiende al ámbito ganadero, donde numerosos estudios respaldan la idea de que estos residuos pueden desempeñar un papel fundamental como alimento para animales. Según Perondi et al. (2014), la adición de residuos del maracuyá a la dieta de cerdos mejoró la digestibilidad de la proteína y la eficiencia en la utilización de los nutrientes. Ferreira et al. (2021) encontró que la incorporación de residuos del maracuyá en la dieta de conejos aumentó la ganancia de peso, la calidad de la carne, y estado antioxidante de conejos en crecimiento. Estos Estudios no solo resaltan la viabilidad de utilizar los residuos del maracuyá en la alimentación animal, sino que también respaldan la importancia de explorar a fondo las diversas aplicaciones de estos subproductos en beneficio de la salud y productividad de los animales. Castro et al. (2023) presenta un alimento balan ceado para cuyes a partir de residuos de cáscara de maracuyá, siendo ricas en proteínas, carbohidratos, aminoácidos y pectina, lo cual de terminó en un aumento significativo del peso, mayor rentabilidad y mayor accesibilidad para los clientes en comparación de otros alimentos balanceados.
5.3 Biocombustibles
La conversión de los residuos de maracuyá en biocombustibles es una alternativa sostenible y eficiente para reducir la dependencia de los combustibles fósiles y reducir la cantidad de residuos generados (Moneruzzaman et al., 2021). Además, los biocombustibles a base de residuos de frutas cumplen con los estándares de calidad requeridos para su uso como combustible (Demirbas, 2008). La utilización de residuos de maracuyá en la producción de biocombustibles tiene un impacto positivo en el medio ambiente, al disminuir la emisión de gases de efecto invernadero y mejorar la calidad del aire (Uçkun et al., 2014).
5.4 Películas biodegradables
Las películas biodegradables han sido ampliamente estudiadas en las últimas décadas y han sido señaladas como una opción para reemplazar los envases petroquímicos (Asrofi et al., 2021). La pectina es un heteropolisacárido natural complejo abundante en subproductos de frutas cítricas como el maracuyá y puede aplicarse en la producción de diversos productos como películas biodegradables y renovables (Mellinas et al., 2020). La pectina partir de cáscara de maracuyá tiene un contenido de ácido galacturónico del 62,92%, un grado de esterificación del 50,74% y un peso molecular bajo. Además, su utilización en la elaboración de películas afecta las propiedades mecánicas y a la permeabilidad al vapor de agua de las películas, así como a la actividad antibacteriana (Nguyen et al., 2023). Moro et al. (2017) indica que la adición de cáscara de maracuyá influye en los parámetros físicos de las películas de almidón obtenidas por extrusión termoplástica, logrando una mejor resistencia mecánica de Young, menor permeabilidad al vapor de agua, alargamiento intermedio a la rotura, índice de solubilidad en agua y ángulo de contacto. Florentino et al. (2022) señala que una película biodegradable con adición de pectina de maracuyá resultó lisa, homogénea, amarillenta, resistente y flexible, y tiene buena estabilidad térmica, además de presentar baja solubilidad y permeabilidad al vapor de agua.
6. Biocontrol de plagas
Las plagas constituyen un elemento decisivo en las producciones agrícolas, éstas limitan los rendimientos de las cosechas, su presencia se debe a factores como la zona, la época del año y la gestión de la plantación (Del Pilar et al., 2007). En consecuencia, obligan al productor agrícola a aumentar las aplicaciones químicas para proteger sus cultivos y evitar pérdidas (Viguera et al., 2017). A pesar de la gran demanda que generan frutas como el maracuyá, uno de los factores limitantes para su desarrollo corresponde al ataque de varios insectos plagas debido a que provocan daño en el desarrollo de la planta y por ende reducen el rendimiento (Menacé et al. 2019).
Las principales plagas identificadas por los productores en el cultivo de maracuyá fueron la mosca del ovario (Dasiops sp.) identificada por el 55% de ellos y el grajo o chinche patón (Leptoglossus sp. y Corythucha gossypii) con el 26% de representatividad; en menor medida otras plagas tales como: los ácaros (Tetranichus sp.), los pulgones (Aphis gossipii, Myzus persicae), los trips (Thrips tabaci Lindeman, Frankliniella auripes Hood, Frankliniella occidentalis Perg., Neohydatothrips signifer Priesner) y el gusano defoliador (Agraulis sp. Además, las principales enfermedades identificadas en el cultivo de maracuyá fueron la antracnosis (Colletotrichum gloesporioides), identificada por el 83% de los productores, la mancha parda (Alternaria passiflorae), la secadera (Fusarium sp.), la bacteriosis y un mínimo porcentaje la roña (Cladosporium sp.) (Romero-Ramirez et al., 2019)
Para planificar estrategias de control de plagas, es importante conocer cómo se dispersan las poblaciones de plagas en el tiempo y espacio (Paz & Arrieche, 2017), ya que estos microorganismos son los causantes de la muerte en los cultivos. Por ello, se debe llevar un control en las plantaciones, los cuales deben comenzar por un manejo correcto desde la semilla, estas se deben desinfectar con hipoclorito de sodio; además de llevar un control de riego; exponer al sol periódicamente solo durante las horas más frescas del día; los canales de riego deben estar limpios y libres de restos de tierra (Machado et al., 2017). Además de la aplicación de cebos tóxicos y urea principalmente; en estas preparaciones también se utilizan insecticidas como Tedion y Clorpirifos. Los otros ingredientes activos de los plaguicidas que utilizan son Cipermetrina (14%), Dimetoato (12%), Metil paratión (9%), y Lambdacihalotrina (7%) y mínimamente Monocrotofos. Cabe resaltar que varios de estos productos son altamente tóxicos, como el Carbofuran, Monocrotofos y Metil paratión (Romero-Ramirez et al., 2019).
Para reducir el riesgo al usar productos químicos en la actualidad se ha optado por alternativas amigables con la naturaleza, como los controladores biológicos que se refieren a organismos vivos o productos derivados de ellos que contribuyen a disminuir las pérdidas y daños causados tanto por plagas como enfermedades, además que ayuda a la conservación de la entomofauna (García, 2020). Los agentes que realizan control biológico, se reproducen de manera rápida, actuando de diferentes maneras resistiendo en cualquier condición ambiental, siendo eficientes en el crecimiento de la planta, el parasitismo y por otro lado la antibiosis; aumenta los mecanismos de defensa, además de fomentar a resistencia al ataque de hongos fitopatógenos (Poalacin, 2015).
Investigaciones recientes han comprobado que el biocontrol en el cultivo de maracuyá resulta ser eficiente y de bajo costo. Por ejemplo, Macias (2021), estudió el efecto de Trichoderma sobre enfermedades en el cultivo de maracuyá, encontró que dos de sus tratamientos, 5 y 6 con dosis de 1,00 y 1,50 kg/ha de Trichoderma obtuvieron los mejores resultados, ya que no presentó plantas afectadas en el cul tivo de maracuyá; coincidiendo con Alarcón (2016), quien realizó una investigación similar pero en con diciones de invernadero, es tableció como componentes de manejo integrado para Fusarium oxysporum F. sp. passifloracea, observando un buen control, inhibiendo la actividad del hongo a nivel de crecimiento y de reproducción.
Niño & Mogollón (2018) encontraron que el porcentaje de incidencia de antracnosis causado por Colletotrichum spp. en maracuyá (Passiflora edulis) fue reducido de manera considerable cuando se aplicaron los tratamientos que incluyeron inducto-res de resistencia como fosfito de potasio, caldo Bordelés y Trichoderma spp, los cuales se comportaron de manera similar en comparación con el tratamiento de control químico, además de su bajo costo. Mientras que Urbina & Gonzales (2021), para la enfermedad Antracnosis, causada por Colletotrichum gloeosporioides para el control en el cultivo de maracuyá, usó Trichoderma harzianum y Bacillus subtilis, obteniendo que la aplicación combinada de estos antagonistas no generó un control significativo sobre la incidencia y severidad de la enfermedad, pero en aplicaciones por separado, presentan un comportamiento favorable en la producción de fruta sana de maracuyá.
7. Fertilización orgánica
La producción de maracuyá se ve influenciada por factores como el clima, el suelo y las prácticas agrícolas, incluyendo la fertilización y el riego, que son cruciales para lograr un alto rendimiento del cultivo (Silva et al., 2015). Durante las fases de desarrollo y brotación del maracuyá, se requieren grandes cantidades de nutrientes, siendo el nitrógeno (N) el más absorbido por este cultivo (Silva et al., 2016). Por lo que se buscan alternativas agrícolas que permitan mejorar el rendimiento utilizando recursos naturales. Los biofertilizantes se destacan como una opción, siendo productos de la fermentación aeróbica o anaeróbica de materia orgánica, a veces complementados con minerales. Estos pueden ser utilizados en la agricultura con diversos fines (Mahapatra et al., 2022).
Para mejorar la calidad de la producción de mara cuyá, se ha explorado el uso de biofertilizantes. Un ejemplo es el biofertilizante obtenido de la fermentación de estiércol fresco de bovino, el cual ha demostrado ser efectivo para mitigar los efectos de la salinidad en los sustratos y el agua de riego utilizada en la producción de plantas de maracuyá (Dias et al., 2013). Además, se ha observado que puede influir en la calidad de la semilla, aumentándola en plantas regadas con agua salina, aunque afecta negativamente a las plantas regadas con agua no salina (Dantas et al., 2015). Los estudios también muestran que el uso de biofertilizante bovino proporciona características de calidad superiores a las requeridas por el mercado frutícola, incrementando el número de frutos por planta y la productividad (Aguiar et al., 2017). Asimismo, la aplicación de fertilizante orgánico en dosis elevadas puede dar lugar a interacciones antagónicas y estimulantes de los nutrientes, causando un desequilibrio que se refleja en una disminución del crecimiento vegetativo (Joseph-Adekunle, 2019). Sin embargo, es importante tener en cuenta que, aunque los biofertilizantes tienen efectos prometedores, no reemplazan completamente la necesidad de fertilización nitrogenada en la calidad postcosecha del maracuyá amarillo (Diniz et al., 2022).
En la actualidad, existe un enfoque global para adoptar prácticas agrícolas sostenibles con el objetivo de mitigar el impacto ambiental y preservar los recursos naturales (Nascimento et al., 2016). En este contexto, se destaca la viabilidad de fomentar la utilización de residuos agrícolas disponibles como sustratos para la producción de plántulas, emergiendo como una alternativa económicamente viable. Esta práctica no solo reduce los costos asociados a la adquisición de sustratos o materias primas para su formulación, sino que también contribuye a minimizar el impacto ambiental derivado de la disposición inapropiada de residuos (Meneghelli et al., 2017). Es por ende que investigaciones más recientes han evaluado las aplicaciones de residuos orgánicos en el cultivo de maracuyá, con el objetivo de comparar sus resultados con los obtenidos mediante el uso de fertilizantes convencionales. Un ejemplo claro de este enfoque se encuentra en el estudio de Antunes et al. (2022), su investigación se centró en la formulación de sustratos orgánicos sostenibles utilizando milicompost, combinado con diversas proporciones de residuos orgánicos locales como fibra de coco en polvo, gliricidia y virutas de pasto elefante. Siendo así los sustratos formulados con un 50% de milicompost y fibra de coco, junto con otro 50% de milicompost y Gliricidia sepium, ser adecuados para la producción de plántulas de maracuyá de calidad, maximizando así el uso del milicompost como sustrato. En otro estudio, Bocoli et al. (2020), emplearon bokashi de salvado de arroz con compost orgánico para evaluar su efecto en la germinación y crecimiento inicial de plántulas de maracuyá en un tubo del invernadero.
Se observó que el tratamiento con un 16% de bokashi mostró un mayor crecimiento en las plántulas de maracuyá en comparación con otros tratamientos. Además, da Silva et al. (2023) llevaron a cabo una evaluación de diferentes formulaciones de sustratos orgánicos con el objetivo de seleccionar aquella que proporcionara mayor vigor a las plántulas de maracuyá. Utilizando proporciones variables de fibra de coco, vermiculita, estiércol bovino y bokashi, concluyeron que las plántulas con mejor desempeño fueron aquellas cultivadas con fibra de coco y vermiculita, ambas con un 5% de bokashi. En base a estos resultados, se recomienda el uso de estos residuos orgánicos como fertilizantes para la producción orgánica de maracuyá.
8. Retos actuales y futuros
El maracuyá ha sido objeto de intensas investigaciones en los últimos años, abarcando aspectos cruciales como su morfología, agricultura, composición nutricional y perfil de compuestos bioactivos. Aunque, existen diversas variedades de la fruta, los estudios se han centrado principalmente en dos: la variedad amarilla y la morada. Se ha demostrado que ambas comparten un perfil nutricional similar, siendo la variedad amarilla objeto de un mayor número de publicaciones científicas, como se evidencia en la Figura 5. No obstante, la variedad morada posee un potencial destacado como insumo para el desarrollo de alimentos funcionales, lo cual ha impulsado una cantidad significativa de investigaciones en los últimos años.
Los subproductos del maracuyá, la cáscara y la semilla, presentan un enorme potencial para generar valor agregado y abordar los problemas de desnutrición, contribuyendo así a la seguridad alimentaria y nutricional. Su implementación en líneas de producción podría reducir la contaminación y maximizar la utilización completa de la fruta. Es tos subproductos no solo tienen aplicaciones en la industria alimentaria, sino también en otros sectores, como la producción de abono na tural de calidad, películas biodegradables, suplementos alimenticios para mascotas y biocombustibles ecológicos. Como se observa en la Figura 6, se muestra una variedad de productos procesados derivados de la pulpa, cáscara y semilla del maracuyá.
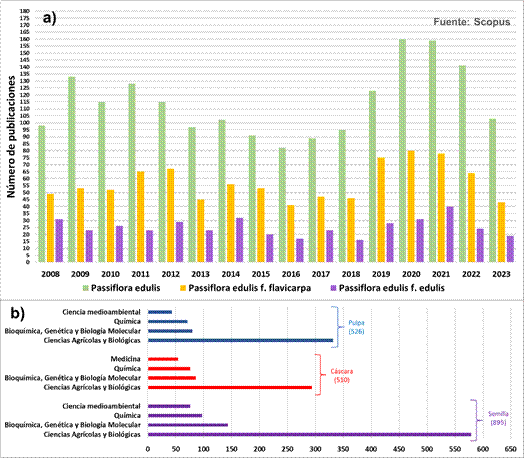
Figura 5 Número de publicaciones de artículos científicos desde 2008 hasta 2023 sobre el maracuyá y sus variedades. (a) Información obtenida de la base de datos Scopus (criterios de búsqueda: KEYWORDS: '' Passiflora edulis', '' Passiflora edulis f. flavicarpa'' y “Passiflora edulis f. edulis''; tipo de DOCUMENT TYPE: ''ALL''). (b) Información obtenida de la base de datos Scopus (criterios de búsqueda: ARTICLE TITLE, ABSTRACT, KEYWORDS: ''Passiflora edulis'' y ARTICLE TITLE, ABSTRACT, KEYWORDS: “subject areas”).
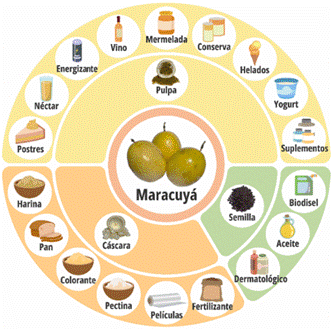
Figura 6 Diferentes productos procesados que se pueden obtener a partir de la pulpa y los subproductos del maracuyá (Passiflora edulis).
El cultivo de maracuyá enfrenta desafíos significativos, como el control de plagas y la gestión de fertilizantes. Por ende, se busca la implementación de estrategias de biocontrol que destaquen como una solución para reducir el uso de pesticidas químicos, garantizando así la calidad del producto final y la salud del ecosistema. Asimismo, en el contexto de los cultivos orgánicos, la aplicación de fertilizantes orgánicos es crucial para mantener la salud del suelo y satisfacer la creciente demanda de productos cultivados de manera sostenible. Es esencial enfocar las investigaciones futuras en la mejora de fórmulas de fertilizantes orgánicos adaptadas específicamente a las necesidades del cultivo de maracuyá.
En resumen, los retos actuales y futuros en el estudio del maracuyá incluyen la optimización de la utilización de subproductos, el desarrollo de estrategias de biocontrol de plagas y la mejora de prácticas agrícolas mediante el uso de fertilizantes orgánicos. Estos desafíos no solo contribuirán al avance científico en este campo, sino que también tendrán un impacto positivo en la sostenibilidad, la salud y la economía asociadas con el cultivo de esta fruta versátil.
9. Conclusiones
Las investigaciones científicas sobre el maracuyá amarillo y maracuyá morado han destacado su impresionante potencial en términos de propiedades nutricionales y funcionales, lo que lo convierte a ambos en una opción ideal para una alimentación saludable y un recurso valioso en la agroindustria.
Adicionalmente, se ha resaltado la importancia de los subproductos del maracuyá, como la cáscara, las semillas y las hojas, debido a su contenido proteico elevado, compuestos fenólicos y una amplia variedad de compuestos bioactivos con propiedades antioxidantes. Estos subproductos del maracuyá no solo tienen diversas aplicaciones en la industria alimentaria y farmacéutica, sino también en otros fines, como es su aplicación en películas biodegradables, procesamiento de abono natural de alta calidad, suplementos alimenticios para mascotas y biocombustibles ecológicos, contribuyendo así a una economía circular sostenible y a la reducción del impacto ambiental.
En relación con lo agronómico, la implementación de estrategias de biocontrol para el manejo de plagas en los cultivos de maracuyá se revela como una necesidad urgente. La adopción de métodos sostenibles y eficientes para controlar las plagas no solo preserva la calidad del producto final, sino que también contribuye a la salud del ecosistema circundante. Asimismo, la aplicación de fertilizantes orgánicos en los cultivos de maracuyá no solo contribuye a la salud del suelo y la sostenibilidad a largo plazo, sino que también responde a las preferencias del consumidor por productos cultivados de manera ecológica.
Por lo tanto, se recomienda encarecidamente la aplicación de los subproductos del maracuyá, no solo de la variedad amarilla, sino también de la variedad morado, como insumo o materia prima. De esta manera, se aprovecharía en su totalidad las propiedades nutricionales y funcionales de estos insumos, promoviendo así la creación de nuevos productos y contribuyendo significativamente a la reducción del impacto ambiental.