1. Introducción
La industria del salmón creció en los últimos 30 años siendo Chile, Noruega, Escocia y Canadá los principales productores a nivel mundial (Luthman et al. 2019). Este crecimiento se ha dado con el desarrollo de infraestructura, tecnología, investigación y con la implementación de estrategias de manejo sanitario para la cría de estos animales a gran escala (Poblete et al., 2019).
Por el contrario, aunque la demanda de esta carne también ha ido en aumento, también es de conocimiento público las problemáticas económicas y medio ambientales que enfrenta este sector (Opstad et al., 2022). El uso de insumos químicos como los antimicrobianos aumentó durante la última década en países como Chile (Quiñones et al., 2019), aun cuando estas cifras no son exactas debido a los bajos reportes respecto a cantidades usadas en un área y tiempo determinado (Millanao et al., 2018); mientras que se redujo considerable mente en Noruega y Canadá (Trueman et al., 2022; Morrison & Saksida, 2013), la principal razón se debe a enfermedades que son de difícil control y uso sin prescripción de un profesional.
Los antimicrobianos son medicamentos empleados principalmente para el tratamiento de infecciones bacterianas en algunas fases de cultivo (Vincent et al., 2019; Leung et al., 2020), de manera profiláctica y en menor proporción como promotores de crecimiento (Sobral et al., 2018). Sin embargo, aunque son regulados en muchos países persiste la preocupación por el continuo uso desmedido que ha conllevado a un aumento en poblaciones de bac terias resistentes o multi-resistentes (Lulijwa et al., 2020) y, por lo tanto, un fallo en el control de estas enfermedades, así como efectos no deseados en el ser humano y medio ambiente (Preena et al., 2020).
Ante este escenario, el llamado es a su uso racional bajo una estricta supervisión veterinaria en conjunto con la implementación de otro tipo de alternativas para el control de las infecciones, medidas más eficientes de bioseguridad y el enfoque de una “Una Sola Salud” que permita la integración de va rios sectores profesionales en el desarrollo de estrategias de mitigación y mayor investigación en este tema específicamente en el sector acuícola (Collignon & McEwen et al., 2019; Lozano-Muñoz et al., 2021; Watts et al., 2017).
En Chile se han realizado diferentes estudios con relación al uso de antimicrobianos, las publicaciones se analizaron en el documento “Use of antimicrobials in Chilean Salmon farming: Facts, myths and perspectives”, con la misión de describir el uso de antimicrobianos en la salmonicultura chilena, siendo una revisión con enfoque imparcial que aclara la información disponible mal fundamentada o sin aplicación actual (Avendaño‐Herrera et al., 2023). Se requiere compilar estudios globales y actualizados del uso de antimicrobianos en salmonidos, por tal motivo, el objetivo de la presente revisión es consolidar y analizar la información disponible sobre efectos de la resistencia antimicrobiana en la industria mundial del salmón y los efectos reportados en la salud del ser humano, los impactos en el medio ambiente y las perspectivas para el futuro con relación a este tema de importancia para el concepto “Una Salud”.
2. Antimicrobianos usados en la acuicultura a nivel mundial
A nivel mundial pocos países controlan la cantidad de antimicrobianos utilizados, dificultando la estimación del uso de esos productos en la acuicultura y su reglamentación (Smith, 2008). En la producción de organismos acuáticos la implementación de tratamientos está regulada por la legislación de organizaciones gubernamentales locales, en algunos países son estrictas y pocos antimicrobianos están autorizados para la acuicultura (Figura 1) (Watts et al., 2017).
En 1963 la FAO y la OMS crearon La Comisión del Codex Alimentarius, esta agencia establece niveles de tolerancia, con el objetivo de garantizar que no existan residuos que excedan los niveles de tolerancia permitidos y que se utilicen medicamentos no aprobados, pero cada país debe tener entidades encargadas de apoyar la regulación, por ejemplo, en los Estados Unidos La Administración de Drogas y Alimentos (FDA), Canadá cuenta con La Agencia de Inspección de Alimentos (CFIA), La Autoridad Australiana de Pesticidas y Medicamentos Veterinarios (APVMA), y en Sur América los países realizan el control principalmente en los Ministerios de Salud e instituciones adjuntas al Ministerio (Okocha et al., 2018).
Comparando las legislaciones, se encuentran dife rencias, por ejemplo, los limites europeos se expre san en µg kg y para los Estados Unidos (EEUU) es en mg kg. Los documentos de reglamentación en Europa tienen mayores detalles con relación a especies, limites, tiempos de retiro y moléculas antimicrobianas que en la legislación de EEUU (Ferri et al., 2022).
En Europa desde el 2001 fue prohibido por UE Veterinary Medicinal Products Directive el uso profiláctico de antimicrobianos, esta medida se encuentra incluida en Directive 2001/82/EC (European Council, 2001). La Agencia Europea de Medicamentos (EMA) permite el uso de oxitetraciclina y clortetraciclina (75 mg kg-1 10 días), también Florfenicol (10 - 15 mg kg-1 10 días) en países como Grecia, España, Italia y Croacia, pero no se registra el uso de Doxiciclina, Enrofloxacina y Lincomicina (Rigos et al., 2021).
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) y El Departamento de Agricultura (USDA) permiten el uso de oxitetraciclina para baños de 2 a 6 horas a dosis de 200 - 700 mg L-2 y para suministro oral 10 mg kg-1 de peso vivo de biomasa durante 10 días consecutivos y también se permite el uso de florfenicol dosis de 10 mg kg-1 durante 10 días y 12 días de retiro (Ferri et al., 2022). A pesar de la reglamentación, la FDA indica que con los datos de venta de antimicrobianos solo se puede calcular la cantidad total de producto que ingresa al mercado, pero no se puede determinar el uso, ni las cantidades implementadas en la acuicultura (Caputo et al., 2022).
La legislación de países en desarrollo como Brasil, Vietnam, Chile, Filipinas y Tailandia se han adaptado a parámetros de las leyes de la Unión Europea y Los Estados Unidos, con el objetivo de fortalecer los mercados de exportación de productos de la acuicultura (Ferri et al., 2022). Esto aunado a las exigencias de La Organización de las Naciones Unidas para la Alimentación y la Comisión del Codex Alimentarius de la Organización Mundial de la Salud (FAO/OMS) de controlar y monitoreo de la inocuidad de los alimentos (Okocha et al., 2018).
En Vietnam por ejemplo, el Ministerio de Agricultura y Desarrollo Rural es el ente regulador del uso de antimicrobianos y productos químicos en la acuicultura, este país prohíbe 23 compuestos, en la lista se encuentra la enrofloxacina, polimixinas y colistina, y entre los 33 antimicrobianos aprobados por la ley de Vietnam para usar en la producción de organismos acuáticos se incluyen ampicilina, amoxicilina, florfenicol, tetraciclinas y trimetropim, fármacos importantes implementados en humanos (Chi et al., 2017).
Expertos de instituciones públicas y privadas de Egipto, Zambia, Uganda, Kenia, Bangladesh y Vietnam fueron entrevistados con el objetivo de desarrollar una tipología que clasificara las intervenciones para reducir el uso indiscriminado de antimicrobianos, lo relevante es que los profesionales mencionaron la existencia de marcos legislativos y reglamentación para el control de medicamentos acuícolas en el marco de leyes de salud animal o pesca, sin embargo, aun el uso de antimicrobiano es ampliamente aceptado en los sistemas de producción animal principalmente para la prevención y tratamiento de enfermedades infecciosas de origen bacteriano (Ibrahim et al., 2020) y, además, como promotores de crecimiento, aunque es una práctica debatida y poco aceptada (Mo et al., 2017).
La aplicación de antimicrobianos dentro de los sis temas acuáticos se basa en las actuales condiciones de cultivo intensivo con altas densidades (Luu et al., 2021) y al estrés generado por la manipulación de los animales que favorecen la proliferación de patógenos oportunistas, aunque la cantidad y el límite máximo de residuo o tolerancia permitidos varía de un país a otro (Gazal et al., 2020).
El método de administración más común es a través del alimento (Mo et al., 2017). Esta práctica no se considera eficiente ya que los peces no metabolizan adecuadamente los compuestos antimicrobianos por lo que se estima que hasta el 75% de las concentraciones suministradas suelen ser excretadas al agua en las heces, lo que genera efectos nocivos al ambiente acuático por su acumulación en el sedimento y, a la salud humana y animales por su facilidad de dispersarse en los sistemas de agua (Santos & Ramos, 2018; Okocha et al., 2018). Otras formas de aplicación de los antimicrobianos son por medio de baños de inmersión, bioencapsulación y en casos específicos, por inyección intramuscular o intraperitoneal (Ibrahim et al., 2020).
En cuanto a la dosificación empleada se observan diferentes rangos dependiendo de la clase de antimicrobiano y del criterio considerado, por ejemplo, Liu et al. (2017) reportan que en China las dosis usadas para suministrar antimicrobianos orales mezclados con el alimento son inferiores a 30 mg de antimicrobiano por kg de peso corporal, sin embargo, algunos antimicrobianos son usados a dosis de más de 50 mg por peso vivo, es el caso de la dosis del cloranfenicol que se encuentra entre 20 a 100 mg/kg de peso corporal y furazolidona de 100 a 200 mg/kg de peso corporal. Chi et al. (2017) re portan en su estudio realizado en provincias del norte de Vietnam el uso de compuestos de venta para humanos que son mezclados en el alimento de los peces y camarones cuya dosificación calculada es similar a la empleada para los seres humanos.
En este contexto, cuando se realiza una revisión de las cifras disponibles en la literatura se encuentra que el consumo global de antimicrobianos para el año 2017 se estimó en 10259 toneladas (con un rango de intervalo de error entre 3166 - 44727 to neladas) con la predominancia de cuatro países como China (57,9%), India (11,3%), Indonesia (8,6%) y Vietnam (5%) (Schar et al., 2020). La tendencia de los últimos años es un aumento progresivo del número de toneladas que sobrepasan incluso las cantidades empleadas en el área clínica humana (Cabello et al., 2020), se estima que entre el año 2017 y el 2030 el consumo de antimicrobianos en la acuicultura aumente un 33%, es decir de 10259 ton a 13600 respectivamente (Schar et al., 2020).
Una determinación exacta sobre los antimicrobianos usados a nivel mundial es difícil debido a las diferencias en las regulaciones dispuestas por cada país (Figura 2), los bajos reportes realizados a las instituciones de control y las tecnologías implementadas en los sistemas de cultivo (Okocha et al. 2018). En Europa, específicamente en Noruega se reporta una reducción en la cantidad de antimicrobianos usados entre 1987 a 2014 pasando de 48 toneladas/año a media tonelada/año con 6 tipos de antimicrobianos autorizados para este sector, los cuales son ácido oxolínico, florfenicol, sulfadiazina, flumequina, oxitetraciclina y otras combinaciones de sulfas (trimetropim-sulfonamida) (Lulijwa et al. 2020).
Liu et al. (2017) reportó en su estudio realizado en China que entre los años de 1996 a 2013 el uso de 20 antimicrobianos pertenecientes a aminoglucósidos, betalactámicos, macrólidos, anfenicoles, sulfonamidas, nitrofuranos, quinolonas y tetraciclinas, siendo la ciprofloxacina, norfloxacina y sulfafurazol los compuestos más empleados, sin embargo, a nivel normativo sólo 13 antimicrobianos habían sido autorizados.
En otros países asiáticos como Bangladesh y Tailandia el rango de compuestos reportados entre los años de 1990 a 2007 varía entre 14 a 21, respectivamente, siendo los medicamentos más usados en Bangladesh tetraciclinas y sulfonamidas (Chi et al. 2017) y en Tailandia cloranfenicol, nitrofuranos y betalactámicos (excepto amoxicilina) (Lulijwa et al. 2020). En Vietnam, la lista incluye tetraciclinas, betalactámicos, anfenicoles, fluoroquinolonas, lincomicinas y sulfonamidas (Chi et al. 2017).
En América, específicamente en los países de Chile y Brasil se usan en un alto porcentaje el florfenicol y la oxitetraciclina, aunque se reportan al menos 16 tipos de antimicrobianos autorizados para su uso (Lulijwa et al. 2020).
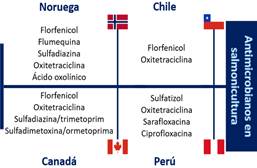
Figura 2 Principales antimicrobianos reportados por su uso en países productores de salmónidos. Extraído y modificado de Liu et al. (2017), Chi et al. (2017), Lulijwa et al. (2020), Mo et al. (2017) y Pepi & Focardi (2021).
3. Antimicrobianos usados en la industria de salmónidos
La producción acuícola en Noruega se ha caracterizado por la industria de salmónidos, en 1989 este país cultivo el 70% (118000 toneladas) de la producción mundial de salmón del atlántico, durante esta expansión productiva se presentaron enfermedades y por lo tanto fue necesario el uso de medicamentos y productos químicos (Tilseth et al., 1991). Desde ese mismo año, en Noruega se exige de manera obligatoria receta médica para usar antimicrobianos en la acuicultura (Grave et al., 2008). Se estima que el uso de antimicrobianos en Noruega oscila entre 0,02 y 0,39 g/tonelada de biomasa cosechada (Watts et al., 2017).
Grave et al. (1996) reportan los medicamentos usados en la salmonicultura de Noruega durante 1980 a 1994, observaron que la oxitetraciclina fue el fármaco con mayor dosificación (800 mg/kg de peso corporal), seguido de furazolidona (600 mg/kg de peso vivo). Otro dato relevante, las ventas anuales de antimicrobianos utilizados para controlar enfermedades en salmón del atlántico, entre 1989 a 1994 fue de 62741 kg de ácido oxolínico, seguido por oxitetraciclina (22059 kg), flumequina (18362 kg), trimetropin/ sulfadiazina (13701 kg), furazolidona (1672 kg) y florfenicol (70 kg) (Figura 1). Los primeros indicadores de distribución y uso del florfenicol en la producción de salmón se registran en el año de 1993. El ácido oxolínico fue el antimicrobiano con mayor número de prescripciones en la industria de salmónidos de Noruega, seguido por el florfenicol durante el año 2000 al 2005 (Grave et al., 2008).
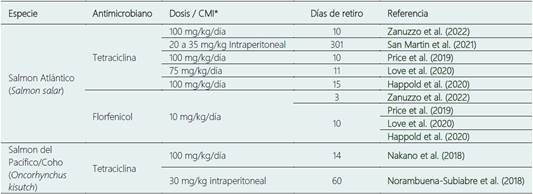
En Chile, otro de los países líderes en producción de salmónidos, se estima que el uso de antimicrobianos en promedio es de 660 g/tonelada de biomasa cosechada (Watts et al., 2017), pero para el 2019 la cifra se redujo a 338 g/tonelada (Miranda et al., 2018). El florfenicol y la oxitetraciclina son los antimicrobianos de mayor uso (Figura 2), con una proporción de 98,7% y 1,25% respectivamente y son usados principalmente para tratar la Septicemia Rickettsial Salmonídea (SRS) (Ramírez et al., 2022). En 1994 fue aprobado el uso del florfenicol (Miranda & Rojas, 2007), y la dosis recomendada para el suministro de este antimicrobiano es de 10 mg/kg de peso corporal una vez al día por 10 días consecutivos (Burridge et al., 2010). Antimicrobia nos como el ácido oxolínico y flumequina están prohibidos en Chile (Miranda et al., 2018).
En Estados Unidos, los únicos medicamentos apro bados para uso en acuicultura son oxitetraciclina, florfenicol y sulfadimetoxina/ormetoprima. Love et al. (2020) realizaron un estudio en 8 empresas productoras de salmón en los estados de Washington y Maine, en el primer estado se reportó el uso de florfenicol, sulfadimetoxina/ormetoprima, oxitetraciclina, este último medicamento fue el único reportado en el estado de Maine, y la metodología para suministrarlos fue mezclarlos en el alimento a dosis de 10, 50, 75 mg/kg de peso corporal respectiva mente, fueron usados para tratar furunculosis, vibrio, mixobacterias y otras enfermedades, los investigadores no indican días de retiro, pero si el tiempo de tratamiento, para florfenicol y oxitetraciclina la duración fue de 10 días y para sulfadimetoxina/ormetoprima fue de 5 días.
En Canadá están autorizados el florfenicol, oxitetraciclina, sulfadiazina/ trimetoprim y sulfadimetoxina/ ormetoprima (Ojasanya et al., 2022).
Sin embargo, la vacunación al 100% de los peces en fase de agua dulce ha reducido la necesidad de tratamiento a casi cero para furunculosis, vibriosis y yersiniosis, pero para enfermedades como la tena cibaculosis se han usado sulfadimetoxina/ ormetoprima, sulfadiazina/ trimetoprim y florfenicol. En reproductores existen informes del uso de eritromicina, inyectada vía intramuscular para evitar transmisión vertical a las ovas de la enfermedad bacteriana del riñón (Morrison & Saksida, 2013).
En Brasil las entidades regulatorias permiten solo el uso de florfenicol y oxitetraciclina para tratar enfermedades en la industria de salmónidos (Guidi et al., 2018). Asimismo, Vilca et al. (2021) sugieren que en las granjas acuícolas del lago Titicaca en Perú, donde se produce el salmónido (Oncorhynchus mykiss), se han usado antimicrobianos como la oxitetraciclina, sulfatizol, ciprofloxacina y sarafloxacina.
4. Efectos del uso de antimicrobianos en el cultivo de salmones
El uso continuo e indiscriminado de antimicrobianos ha provocado en primera medida efectos ampliamente conocidos como la resistencia a los antimicrobianos (RAM) (Mog et al., 2020; Cabello et al., 2013); En el medio acuático, de todas las bacterias acuáticas el 90% muestran resistencia a por lo menos un antimicrobianos y aproximadamente el 20% son resistentes a múltiples antimicrobianos (Pepi & Focardi, 2021).
En la salmonicultura, diferentes estudios ya han demostrado la RAM de bacterias, como por ejemplo las bacterias del género Pseudomonas que es considerado el grupo bacteriano más diverso y ecológicamente importante (Oberlé et al., 2022).
Estas bacterias generan resistencia en la salmonicultura, en diferentes eslabones de la cadena productiva. En agua de cultivo y alevinos de salmón se ha reportado RAM de P. fluorescens a oxitetraciclina (Miranda & Zemelman, 2002), en aislados de filetes de trucha se presenta Pseudomonas que son resistentes a florfenicol en concentraciones inhibitorias mínimas (CIM) de 32 - 128 µg/ml (Oberlé et al., 2022), en las bandas transportadoras de las plantas de procesamiento de salmón se reportó RAM de aislados de Pseudomonas a antimicrobianos como el florfenicol y ácido oxolínico (Thomassen et al., 2022). Los efectos van más que provocar RAM, también el uso excesivo de antimicrobianos afecta los biomarcadores relacionados con el estrés y daños hepáticos. En grupos de salmones alimentados con dietas que contenían oxitetraciclina (100 mg/kg de peso corporal) se han observado efectos de incremento significativo en el porcentaje de hígado a peso corporal (índice hepatosomático), actividad de la alanina aminotransferasa (ALT), los niveles de glutatión total (tGSH) en grupos de salmones alimentados con dietas que contenían oxitetraciclina, comparados con grupos alimentados sin antimicrobiano, por lo tanto se puede sugerir que el uso excesivo de oxitetraciclina en salmones induce al estrés oxidativo, provocando daños en los tejidos (Nakano et al., 2018).
En truchas arcoíris también se han observado efectos de la oxitetraciclina (100 mg/kg de peso corporal) sobre el estrés oxidativo, animales tratados con este antimicrobiano registran aumentos significativos en los niveles de malondialdehído, que es un índice de peroxidación lipídica, y disminución de superóxido dismutasa, catalasa, y la actividad de la glutatión peroxidasa, así como una disminución en el nivel de glutatión en la sangre, el hígado, los riñones y el bazo, pero además los resultados mostraron supresión de parámetros del sistema inmune, como el hematocrito, recuento de leucocitos, proteínas plasmáticas, inmunoglobulinas y actividad fagocítica (Yonar, 2012). No solo hay reportes de efectos adversos de la oxitetraciclina, también estudios han informado los efectos de la sulfametazina en truchas, a diferentes dosis (100, 200 y 400 mg/kg de peso corporal) tiene efectos en la reducción de eritrocitos, leucocitos, hemoglobina, proteínas plasmáticas e inmunoglobulinas (Saglam & Yonar, 2009).
Los antibióticos usados comúnmente en la salmonicultura también afectan las comunidades de microbiota intestinal en los peces. El alto uso de florfenicol y oxitetraciclina en Chile, tiene como consecuencia la selección de bacterias multirresistentes en microbiota intestinal de salmones cultivados en la fase marina, confirmándose mediante la presencia de genes de RAM (Higuera-Llantén et al., 2018). En truchas alimentadas con dietas que contenían oxitetraciclina (35 mg/kg de peso corporal) por 7 días, el microbioma intestinal de los peces fue significativamente alterado, existiendo una disminución de microorganismos benéficos para la salud y bienestar de los peces como Mycoplasma y Bacillus, pero los grupos oportunistas aumentaron su presencia en el sistema digestivo de los peces tratados con antimicrobiano (Payne et al., 2022). A pesar de que el uso de antimicrobianos en peces causa atrofia en hígado e intestino, no se reportan efectos negativos en los indicadores de desempeño productivo de los peces (Wang et al., 2022). La oxitetraciclina no altera la hidrólisis digestiva, ni la absorción de aminoácidos, nitrógeno y azufre en salmón, por lo tanto y a pesar de los efectos en la microbiota y cambios en tejidos del sistema diges tivo, el animal se desarrolla de manera adecuada para la producción (Refstie et al., 2006), sin em bargo, se debe pensar en el bienestar del animal (Payne et al., 2022).
Además, de los efectos como el estrés oxidativo y daños en órganos del animal como el hígado (Nakano et al., 2018), también se espera que los antimicrobianos se acumulen y persistan por un periodo de tiempo en los tejidos, por lo que es conveniente realizar tiempo de retiro antes de ser destinados para con sumo tal como se lleva a cabo en otras especies animales (Xu et al., 2021; Norambuena-Subiabre et al., 2018).
Por lo tanto, la cuantificación de los residuos presentes de estas moléculas en el tejido muscular del salmón se han estudiado con el objetivo de determinar las concentraciones mínimas inhibitorias de un principio activo específico que permitan evaluar su efectividad durante un tratamiento (Price et al., 2018; Price et al., 2019), otros estudios se enfocan en realizar seguimientos a largo plazo de los tiem pos de retiro (Tabla 1), para asegurar la salud del ser humano y también con el fin de monitorear las concentraciones de contaminantes a las que pueden estar expuesto el consumidor (Chiesa et al., 2019; Love et al., 2020).
5. Antimicrobianos usados en la salmonicultura: Efectos y estrategias para la salud humana
En los seres humanos, los principales riesgos para la salud son el desarrollo de bacterias resistentes a las terapias antimicrobianas, aumentando los casos de morbilidad y mortalidad por enfermedades infecciosas y, la alteración del microbiota intestinal (Figura 3) por consumo de carnes y pescados con residuos de estos medicamentos (Millanao et al., 2018; Sobral et al., 2018). También se han reportado efectos de toxicidad relacionados con la presentación de reacciones alérgicas de hipersensibilidad (Graham et al., 2014; Chen et al., 2019) y el desarrollo de mutaciones celulares (Treiber & Beranek-Knauer et al., 2021). Con el objetivo de reducir la exposición de los humanos a residuos de antimicrobianos se efectúan unos tiempos de retiro para ciertos compuestos administrados durante una fase de cultivo permitiendo así su eliminación de los tejidos del animal como sangre y músculo (Yang et al., 2021). Aun así, se permite legalmente un determinado valor residual en productos alimenticios destinados para consumo llamados límite máximo de residuos (Mog et al., 2020) que cuando se exceden constituyen un riesgo para la salud pública (San Martin et al., 2021).
La salud pública está en riesgo cuando los residuos de antimicrobianos persisten en el músculo de los peces. Por lo tanto, se implementan estrategias como la denominada límites máximos de residuos (LMR), para medicamentos veterinarios en productos comestibles de origen animal (European Medicines Agency (EMA), 2022).
El Codex Alimentarius regula los LMR para antimicrobianos, se recomienda para oxitetraciclina en musculo y piel de pescado LMR de 200 µg/kg (San Martin et al., 2021). Países como Canadá y Chile, han adoptado el LMR establecido por el Codex para oxitetraciclina, sin embargo, cada país puede definir sus propios valores de LMR, por ejemplo, Estados Unidos de América tienen LMR para oxitetraciclina de 2000 µg/kg de musculo y piel de pescados (United Stated Department of Agriculture (USDA), 2022). La comunidad europea ha establecido LMR de 100 µg/kg (Commission Regulation (EU), 2010). Mientras que países de la comunidad euroasiática ha establecido LMR de 10 µg/kg (BCGlobal, 2022) para este antimicrobiano. La sulfadiazina aprobada en Canadá para usar en salmónidos se establece LMR de 100 µg/kg en todos los tejidos comestibles comercializados (Dinh et al., 2020).
Las entidades regulatorias también establecen tiempos de retiros obligatorios, esto hace referencias al periodo durante el cual el pescado no puede ser cosechado o colectado para su comercialización después de algún tratamiento (Luu et al., 2021), para salmónidos los tiempos de retiro TR van a depender de los LMR por cada antimicrobiano, el método de administración, dosis suministrada, y también se debe contemplar la temperatura de cultivo (San Martin et al., 2021). La legislación en diferentes países establece TR de 15 días para oxitetraciclina y florfenicol posterior a la última dosis suministrada independientemente de la especie producida (Rairat et al., 2022).
Sin embargo, por la fisiología de los peces estar estrechamente relacionada con la temperatura, debido a que son poiquilotérmicos o ectotérmicos (Blair & Glover, 2019), la absorción y eliminación de los medicamentos dependerá de la temperatura del agua (Yang et al., 2020), y los TR varían dependiendo del sistema de producción y las condiciones climáticas. Los salmónidos son peces cultivados en temperaturas bajas (< 18 °C) (Gamperl et al., 2020), y por lo tanto se han realizado estudios que evalúan los TR en días-grado, de esta forma al suministrar oxitetraciclina en salmones vía intraperitoneal, se determinó que el TR para LMR 100 y 10 µg/kg fueron 1159 a 5390 días-grado, esto se logra aproximadamente entre 110 a 190 y 193 a 499 días respectivamente (San Martin et al., 2021).
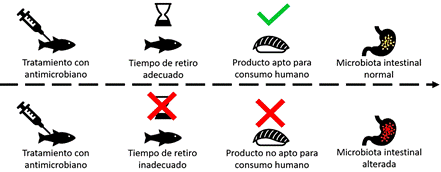
Figura 3 Comparación del efecto en la microbiota intestinal por consumo de pescado libre de antimicrobianos o que contiene residuos de antimicrobiano.
Estudios anteriores mencionan que el florfenicol a una dosis de 10 mg/kg de peso corporal suministrado por vía intravenosa fue encontrado 21 días después en musculo y 27 días después en hígado (Horsberg et al., 1996). Aunque estos residuos que son consumidos en la carne de los animales constituyen una forma indirecta de contaminación, existen formas directas a través de heces de animales, las cuales son empleadas en procesos de fertilización de cultivos y, aguas tomadas de fuentes hídricas que permanecen en contacto con efluentes y materia orgánica de cultivos de piscifactoría o producciones pecuarias (Serwecinska, 2020; Bacanli & Başaran, 2019). En Perú, específicamente en el lago Titicaca, lugar donde se realiza el cultivo de trucha (Oncorhynchus mykiss), en el agua superficial y en la toma de agua potable de ciudades aledañas al lago, fue detectada la presencia de residuos de antimicrobianos, como ciprofloxacina, clortetraciclina y sarafloxacina en concentraciones de hasta 652,7, 87,4 y 78,2 ng/L, respectivamente, los autores indican que los sistemas de depuración no eliminan los residuos de los antibióticos, suponiendo un 80% de riesgo para la población de la ciudad de Puno (Vilca et al., 2021).
Por lo tanto, la producción de salmones, el medio ambiente y el microbiota animal alrededor de esta industria, se convierten en un eslabón que facilita la transferencia horizontal de genes y resistomas ani males de resistencia a los antimicrobianos con microorganismos patógenos y no patógenos de importancia en humanos (Cabello et al., 2013; Bacanli & Başaran, 2019; Menkem et al., 2019). Se debe realizar estudios sobre tasas de diseminación y degradación de antimicrobianos disponibles como residuos en el medio ambiente, así como las concentraciones y tiempo necesario para estimular la adquisición de resistencia en bacterias (Serwecinska, 2020). En Chile se ha estudiado, por ejemplo, la depleción de residuos de Oxitetraciclina en trucha (Oncorhynchus mykiss) y salmón (Salmo salar) en condiciones de campo (San Martin et al., 2021). De igual forma en Perú donde se cultiva trucha, evaluaron la disemi nación y degradación de productos veterinarios usados en piscifactorías de salmónidos (Vilca et al., 2021).
Los efectos de antimicrobianos usados en la acuicultura se han enfocado en el consumidor final, pero también es necesario considerar los peligros asociados a la medicación en los alimentos, ya sea en personal de las fábricas de balanceados o en las granjas acuícolas (Mog et al., 2020), Los trabajadores están expuestos directamente a los antimicrobianos en la cadena de producción de salmón, cuando no se implementan buenas prácticas de producción acuícola (Neis et al., 2023; Love et al., 2020).
Los trabajadores de fábricas de alimento balanceado y operarios de producción en campo están en contacto con residuos de polvo que contiene antimicrobianos, siendo inevitable la ingestión y adherencia de medicamentos en la piel, donde se altera la microbiota normal y existe selección de bacterias con RAM, generando además alergias y toxicidad (Lulijwa et al., 2020).
Además de las estrategias ya mencionadas como LMR y TR, también se ha incrementado el interés de la industria de salmones por el desarrollo de vacunas y uso de productos naturales que tienen diferentes efectos, con el objetivo de aportar a estrategia de One Health.
Existen casos de éxito en el desarrollo de vacunas, por ejemplo, contra enfermedad bacteriana del agua fría, producida por Flavobacterium psychrophilum. Los resultados en truchas arcoíris muestran fuerte protección en los grupos vacunados comparado con el grupo control no vacunado, al momento de ser desafiados con cepas aisladas de Flavobacterium sp. (Bruce et al., 2020).
También el uso de productos naturales se ha usado como estrategia alternativa al uso de antimicrobia nos comúnmente comercializados y que ponen en riesgo el enfoque de “One Health”. Estudios con plantas medicinales y aromáticas indican que ex tractos hidroalcohólicos de orégano (Origanum vulgare), menta (Mentha piperita) y verdolaga (Portulaca oleracea ssp. sativa) tienen características antimicrobianas contra Moritella viscosa, Tenacibaculum finnmarkense y Aliivibrio wodanis agentes patógenos del Salmón del Atlántico (Slimestad et al., 2022). En truchas (Oncorhynchus mykiss) suplementadas con ajo (Allium sativum) durante 14 días y posteriormente desafiadas de manera experimental con Aeromonas hydrophila, se observó que en dosis de 0,1 g de ajo en polvo / 100 g de alimento la mortalidad fue de 8%, por el contrario, en animales no suplementados con ajo la mortalidad fue de 88%, esto indica que existen productos alternativos para prevenir enfermedades en salmónidos (Nya et al., 2009). Un producto fotogénico extraído del fruto de olivo fue suministrado en la alimentación de (Salmon salar) como inmunomodulador, al momento del desafío experimental por 12 días se observaron resultados de sobrevivencia de 96% en animales tratados con producto del olivo y 60% en animales no tratados, esto se debió principalmente a la activación de leucocitos, actores principales en la respuesta inmune (Salomón et al., 2021).
La estrategia planteada desde el enfoque “One Health” es combinar la salud humana, animal y ambiental, para abordar la amenaza urgente, implementando métodos con estándares internacionales en cada país productor de salmón, donde se incluyan el uso controlado de antimicrobianos (Lozano-Muñoz et al., 2021). Para disminuir la susceptibilidad de los salmónidos a las enfermedades se debe mejorar la salud y el bienestar, si esta estrategia se adopta evitarían al teraciones en la flora normal del agua de produc ción, mitigando costos económicos y ambientales del uso excesivo de antimicrobianos en la salmoni cultura, esperando que este enfoque limite o pre venga los efectos negativos tanto en la acuicultura como en la salud humana (Cabello & Godfrey, 2019).
6. Efectos del uso de antimicrobiano en el medio ambiente
La administración de antimicrobianos por medio de alimento medicado facilita la contaminación del entorno acuático a través de heces (Lozano-Muñoz et al., 2021) y pienso no consumido por el animal, el cual, se acumula en el sedimento debajo de las jaulas de cultivo (Figura 4) (Miranda et al., 2018), que posteriormente terminan como lixiviados acuícolas que conducen a consecuencias ambientales negativas (Nagaraju et al., 2023) y finalmente movilizarse hacia zonas lejanas a kilómetros del sistema productivo (Buschmann et al., 2012).
Adicionalmente, las aguas residuales de la producción constituyen otro medio importante a través del cual los antimicrobianos alcanzan cuerpos de agua y facilitan el contacto de estos compuestos con pro ductos pesqueros para consumo humano (Griboff et al., 2020). En una investigación en granjas acuícolas de siete estados en la Malasia peninsular se encontraron residuos de 23 antimi crobiano en el agua en una concentración total de 1,099x10-6 ng/L con una mayor frecuencia de detec ción de tetraciclinas (83%), sulfonamidas (Maki et al., 2006) y quinolonas (69%) (Thiang et al., 2021).
En Perú los sedimentos del lago Titicaca donde se cultiva Trucha, fueron encontrados residuos de 8 antimicrobianos de 9 estudiados, entre los que se identificó están Clortetraciclina 0,36 ± 0,15 mg/kg, Oxitetraciclina 1,57 ± 2,13 mg kg, Tetraciclina 0,12 mg kg, Enrofloxacina 1,62 ± 1,52 mg/kg, Ciprofloxaciona 1,98 ± 1,45 mg kg, otros antimicrobianos encontrados fueron Sarafloxacina, Sulfatiazo y Sulfametazina (Vilca et al., 2021). Un estudio realizado en Estados Unidos permitió establecer que en los sedimentos bajo las jaulas de producción de salmón la oxitetraciclina permaneció por 60 días, en una de las granjas que fue estudiada se usaron 186 kg de oxitetraciclina y los sedimentos colectados 31 días después a 30 metros de profundidad contenían 0,5 y 4 µg/g (Figura 4) (Capone et al., 1996).
En Chile, los antimicrobianos florfenicol y flumequina son incorporados en el alimento para el suministro en producciones de salmón (Jara et al., 2021), Investigadores afirman que el 5% de los pellets de alimento no consumidos se pueden depositar en los sedimentos bajo los sistemas usados para el cultivo de salmónidos (Cabello et al., 2013; Miranda et al., 2018). Un estudio de laboratorio con sedimentos marinos esterilizados colectados a 90 metros en mar abierto de Chile, muestran que flumequina tiene mayor afinidad por las partículas de sedimento que el florfenicol, la absorción en partículas es de 24 ± 7% y 11 ± 5% respectivamente (Jara et al., 2022). La presencia de antimicrobianos en los sedimentos se debe a su característica natural de ser hidrofóbico (Chen & Zhou, 2014), pero además por tener afinidad con la materia orgánica de los sedimentos (Zhou et al., 2016), por tal motivo existe una fuerte polaridad de los grupos iónicos moleculares que inducen a niveles elevados de absorción (Vilca et al., 2021).
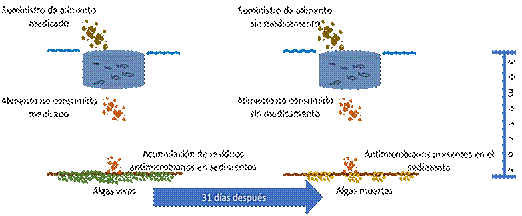
Figura 4 Efecto del residuo de antimicrobiano en los sedimentos 31 días después de suministro a 30 metros de profundidad.
El alimento medi cado no aprovechado por los peces del cultivo también tiene otros efectos, debido a que este puede ser consumido por salmones silvestres, otras especies de peces y/o moluscos en áreas circun dantes que conlleva a daños en el microbiota intes tinal del organismo porque afecta la diversidad y composición de estos microorganismos (Ramírez et al., 2022). Otros estudios han reportado que en las redes alimentarias marinas bentónicas se han registrado desechos de la producción de salmones (Ortiz et al., 2021), por lo tanto, la presencia de antimicrobianos en aguas y sedimentos no solo afecta a vertebrados, también al resto de biota del ecosistema acuático (Vilca et al., 2021). Por ejemplo, las algas que tienen gran importancia como productores primarios (Fu et al., 2017), se ven afectadas a la exposición prolongada de antimicrobianos y existe un riesgo tóxico aun cuando los agentes antimicrobianos están en concentraciones bajas (Azanu et al., 2018). Las microalgas no solo son sensibles (Figura 4), sino que también pueden afectar organismos de nivel trófico superior, mediante la bioacumulación y transferencia a través de la cadena alimenticia (Wilson et al., 2003). El impacto de loscompuestos químicos, también ejerce una presión de selección sobre comunidades bacterianas nativas presentes en el sedimento marino de un área determinada, de tal forma que favorecen el desarrollo de microorganismos con resistencia a los antimicrobianos (Millanao et al., 2018; Monteiro et al., 2016; Maki et al., 2006; Yuan et al., 2019).
La presión de selección que ejercen los residuos de antimicrobianos presentes en el sedimento sobre ciertas comunidades de bacterias es relevante porque podrían afectar el rol que desempeñan en los ciclos biogeoquímicos (Miranda et al., 2018; Kumar et al., 2019). Incluso se ha demostrado que en asociación con metales pesados también se puede producir un fenómeno de resistencia cruzada en medios como aguas residuales y suelo con bacterias patógenas de importancia clínica como Pseudomona aeruginosa y Escherichia coli (Nguyen et al., 2019).
Estudios en diferentes partes del mundo permiten llegar a una misma conclusión, concentraciones de antimicrobiano presentes en la columna de agua, sedimento marino o a través del pescado destinado a consumo, han conllevado a la expresión de resistencia por parte de diferentes grupos bacterianos (Preena et al., 2020; Hemamalini et al., 2021; Shen et al., 2020).
Reverter et al. (2020) recopilaron la información existente de alrededor del 93% (representan alrededor de 40 países) de la producción acuícola mundial respecto a aislamientos de bacterias resistentes a los antimicrobianos realizados en animales en ambientes acuáticos, en los resultados calculados encontraron 28 países con índices de resistencia a múltiples antimicrobianos superiores a 0,2, lo que indicaba una alta contaminación por estos compuestos; el promedio global obtenido fue de 0,25.
7. Retos actuales y perspectivas futuras
Para evitar infecciones y por lo tanto el uso de an timicrobianos es necesario realizar modificaciones en los procesos actuales de producción acuícola, principalmente reducir la sobreproducción y las densidades que afectan la integridad sanitaria de los lotes de salmón cultivado, esto además de disminuir problemas de salud humana y menguar el impacto negativo de la piscicultura sobre el ambiente (Cabello & Godfrey, 2023).
En los últimos años se han publicado diferentes tipos de información relacionada al uso de antimicrobianos en la salmonicultura, principalmente en Chile, se han planteado diversas discusiones alrededor de la problemática existen autores que mencionan que el uso excesivo de antimicrobianos tiene que ser regulado y no se deben menospreciar los impactos negativos de esta práctica comúnmente implementada a nivel mundial (Cabello et al., 2023). Otros autores fuertemente criticados por la literatura científica reciente indican que el uso de antimicrobianos en la salmonicultura se ha disminuido y que los efectos de resistencia en los peces y en la humanidad se ha visto diezmada (Avendaño‐Herrera et al., 2023). Se requiere que los autores de revisiones sean críticos con la literatura que se encuentra disponible para evitar mal informar a los lectores de los documentos actuales.
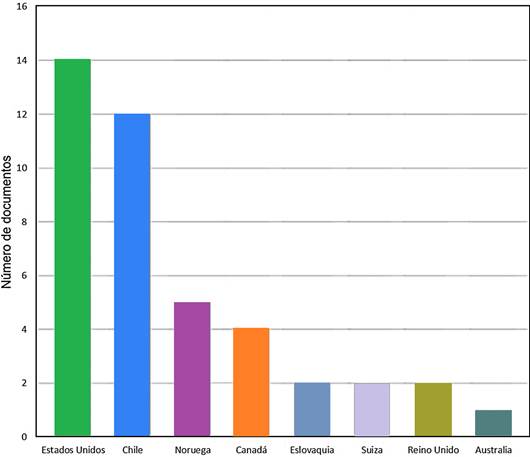
Es importante además establecer mediante análisis bibliométrico el comportamiento de las publicaciones en los resientes años y que esto permita determinar los focos de investigaciones futuras, para fortalecer la literatura y el conocimiento científico que impacte la humanidad. Un breve análisis bibliométrico usando la ecuación de búsqueda (TITLE-ABS-KEY(antimicrobial) AND TITLE-ABS-KEY (salmon) AND TITLE (resistance)) permite evidenciar solo 34 artículos publicados a partir de 1994 a 2023, Los países con mayor número de publicaciones es Estados Unidos de América con 14 documentos, y seguido por Chile con 12 publicaciones, la lista de productividad científica tiene estrecha relación con los países que mayor productividad de salmón registran estadísticamente (Figura 5).
El interés por realizar estudios sobre uso de antimicrobianos en la salmonicutura, ha incrementado desde el primer documento publicado en 1994 pasando por 5 en 2018 y 2022. Durante este periodo y el mayor autor es Cabello Felipe, vinculado al New York Medical College, Valhalla, United States. Este autor Preocu pado por la situación ha planteado desde una línea del tiempo las perspectivas pasadas, actuales y futuras, lo demuestra su artículo más citado que cuenta con 1647 registros, publicado en el 2006 que se enfoca en el uso de antimicrobianos en la salmonicultura, efectos en la salud humana, animal y el medio ambiente (Cabello, 2006).
Al utilizar la herramienta Connected papers (https://www.connectedpapers.com/) para analizar esta información, se puede observar que el mayor número de conexiones acumuladas para este artículo es en el 2011 con 23 conexiones de un total de 40 conexiones de similitud (Figura 6), en el grafico se pueden observar que los nodos de mayor tamaño son lo que mayor cantidad de citas tienen, el color es el año de publicación siendo los más oscuros recientemente publicados y los artículos mayor similitud están unidos con fuertes líneas y se agrupan de clúster.
Para tener una idea de la perspectiva futura se utilizó la misma ecuación de búsqueda mencionada anteriormente, y los datos obtenidos fueron analizados con el programa VOSviewer 1.6.19. Se realizó un análisis de coocurrencia utilizando las palabras de autor. En la Figura 7 se muestra el gráfico Network visualization y en la Figura 8 se registra el gráfico Overlay visualization.
En el mapa de coocurrencia con palabras de autor representado en Network visualization se observan 12 clústeres. El nodo de mayor tamaño puede representar el foco de los artículos publicados con el tema de “resistencia antimicrobiana”; a este tema central se vinculan diferentes palabras claves, principalmente con relación directa a la palabra “Salmon del Atlántico”, que durante el desarrollo de esta revisión se mostró como una de las especies con mayor impacto sobre el tema del uso de antimicrobianos y los efectos sobre la salud humana y ambiental.
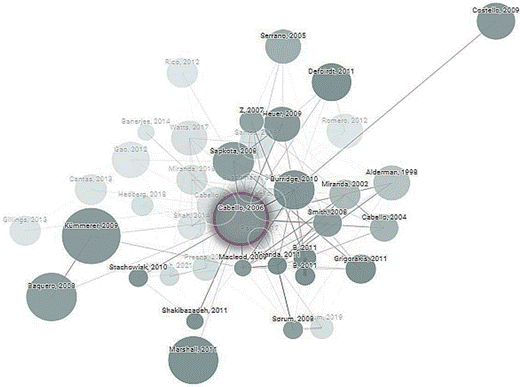
Figura 6 Evaluación de similitud del artículo con mayor citación publicado por el autor más relevante según la ecuación de búsqueda implementada. Tomado y modificado de https://www.connectedpapers.com/.
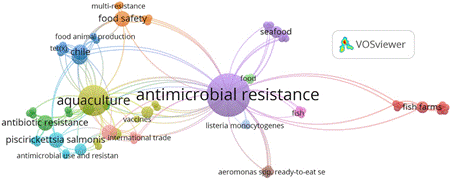
Figura 7 Mapa de red (Network visualization) de la coocurrencia de palabras de autor del uso de antimicrobianos en salmonicultura y la resistencia.
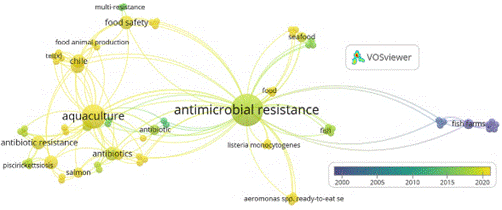
Figura 8 Evolución temporal de palabras claves de autor en publicaciones sobre uso de antimicrobianos en la salmonicultura y relación con resistencia.
En el clúster verde encontramos otra palabra que puede ser remplazada a la palabra inicial, y se traduce como resistencia antibióticos, esto básicamente es debido a la manera en cómo se denomina en algunos países los medicamentos usados en contra de las bacterias. En el clúster azul observamos que se presenta a Chile, esto debido a que es uno de los países potencia en producción de estas especies y por tanto con interés en investigación, diferentes autores mencionan a Chile en los estudios y se desarrollan diversidad de estudios sobre el tema. El clúster verde claro presenta la palabra clara (food) y esto permite evidenciar que en el futuro se deben aunar esfuerzos para fortalecer la productividad científica y obtener información relacionada a los efectos del uso de los antimicrobianos en los alimentos para el consumo humano, teniendo en cuenta el concepto “One Health” que se encuentra dentro de las palabras claves de coocurrencia por autor.
En la Figura 8 se observa como las palabras claves de autor se van presentando a medida que avanza el tiempo, en los nodos de color amarillo se observan palabras usadas actualmente y se observa la tendencia de que palabras como Chile toman gran fuerza, producción de alimentos animal y seguridad alimenticia hacen parte de ese grupo de palabras que tienen reciente interés, esto nos puede indicar que debemos fortalecer la investigación y los estudios en la calidad nutricional de los productos cárnicos de origen acuático y que se hace necesario fortalecer la investigación en temas de seguridad alimentaria, principalmente en este caso se menciona la inocuidad de los productos, para reducir la resistencia a los antimicrobianos a nivel mundial y reducir el impacto ambiental por parte de las granjas productoras de salmón.
Por lo anterior, se evidencia que la implementación de otras herramientas como alternativas al uso de antimicrobianos, actualmente las investigaciones se están esforzando por determinar aspectos positivos de los productos naturales, extractos de plantas, fitoterapéuticos, probióticos entre otros como soluciones a los problemas sanitarios en la salmonicultura. Finalmente, y no menos importantes estrategias como la vacunación tienen relevancia para reducir el uso de antimicrobianos en la prevención de enfermedades en la producción de salmónidos, estas metodologías para el desarrollo de vacunas se deben estudiar a mayor profundidad para tener mejores resultados.
8. Conclusiones
Esta revisión permite concluir que los antimicrobianos más usados en la salmonicultura son florfenicol y oxitetraciclina, existe regulación a nivel mundial, que depende específicamente de cada territorio, se logra identificar que los principales países productores como lo son Noruega, Chile, Canadá y Estados Unidos, también tienen gran relevancia en la producción de información científica, que permite establecer ciertos puntos importantes para el abordaje de este tema.
Los efectos del uso de antimicrobianos ya no solo implican la RAM, también se convirtió en problemas con trasfondo en todos los niveles, las cadenas tróficas acuáticas, la salud humana y el ecosistema en general se ven afectados por el uso indiscriminado de antimicrobianos, a pesar de las reglamentaciones vigentes, se hace cada vez más importante el control y el fortalecimiento del conocimiento entre las comunidades sobre el uso responsable de estos productos.
Las estrategias identificadas fueron el establecimiento de LMR y TR dependiendo de los antimicrobianos y de las condiciones de cada región, sin embargo, es necesario que las autoridades pertinentes realicen controles para cumplir con la reglamentación actual, pero sobre todo es importante enfocar las estrategias desde la mirada “One Health”, que reúna la salud humana, animal y ambiental.