Introducción
La Leucemia Linfática Aguda (LLA) representa la enfermedad maligna pediátrica más frecuente, que representa al menos el 25% de los casos de cáncer infantil. El pico de prevalencia de ALL se encuentra entre los 2 y 9 años. Hay un ligero predominio masculino, y los caucásicos tienen un riesgo doble mayor en comparación con los afroamericanos. El cambio de linaje de Leucemia Linfática Aguda a Leucemia Mieloide Aguda (LMA) representa aproximadamente 6 a 9% de los casos recidivados, y se observa con mayor frecuencia en pacientes infantiles, para quienes no se dispone de un tratamiento estándar adecuado 1.
En contraste, la conversión de AML a ALL es extremadamente rara en niños; Además, solo 3 de estos casos han sido reportados en adultos 2.
En los casos que muestran una recaída con el cambio de linaje, la mayoría de los clones leucémicos tienen una morfología diferente, un linaje fenotípico y características moleculares distintas. En general, el tiempo entre el diagnóstico inicial y la recaída con el cambio de linaje es de 1 a 4 años 3.
A continuación se presentará el caso de un paciente de varón de 9 años con Diagnóstico inicial de LLA- B de Muy Alto Riesgo, que recae con LMA tras 1 año 9 meses de recibir tratamiento con Quimioterapia (Inducción, Consolidación, Intensificación y Mantenimiento) y radioterapia profiláctica. Con el objetivo de evaluar el momento de la enfermedad y las posibles causas del cambio del de Linaje comparando con otros reportes de casos y revisión de la literatura al respecto.
Presentación del caso
Un niño de 6 años de edad, caracterizado por dolor en miembros inferiores, fiebre y petequias, con hepatomegalia, sin esplenomegalia ni linfadenopatías, ni historia médica previa. Tuvo un hemograma con los siguientes hallazgos: hemoglobina de 6 g/dl (por lo que recibió soporte transfusional de paquete globular), conteo de plaquetas 23x109/L, leucocitos de 127900x109/L (blastos 95%). En médula ósea los hallazgos fueron de blastos de características linfoides en un 88%. En Citometría de flujo los linfoblastos tipo B mostraron positividad para CD45, CD19, cyCD79, CD81, CD38, CD10, CD20, CD9; negativo a cyMPO, CD7, cyCD3 (fig. 1); en la que se encuentra una población en estadio Pre B y una subpoblación común. En el análisis citogenético de blastos de la médula ósea mostraron características de cariotipo normal 46XX en [20 metafases]. El estudio molecular revela que no hubo alteración en ningún gen. Fue diagnosticado de Leucemia Linfática Aguda tipo B (LLA-B) de alto riesgo (AR) y comienza quimioterapia de inducción IA con vincristina/daunorubicina por 4 semanas. Posteriormente a esta primera parte de la quimioterapia de Inducción fue evaluada la médula ósea, encontrándose 7% de blastos en mielograma, y con enfermedad mínima residual (EMR) negativa en inmunofenotipo. Continuó con la quimioterapia de inducción IB (ciclofosfamida, citarabina, mercaptopurina, vincristina, Asparaginasa), y posterior a ella se obtuvo una médula ósea con 12% de infiltración por linfoblastos B, y con EMR positiva (0.1% de linfoblastos B patológicos) en inmunofenotipo, con lo que aumentó el riesgo de la enfermedad a LLA-B de Muy Alto Riesgo (MAR). Continuó con el tratamiento de consolidación (metrotexate, leucovorina, vincristina, mercaptopurina, y quimioterapia intratecal triple con corticoide, metrotexate y citarabina, total: 19); intensificación (vincristina, doxorubicina, ciclofosfamida, L Asparaginasa, citarabina, tioguanina, vincristina), además 10 sesiones de radioterapia, con lo que alcanza remisión morfológica. Finalmente quimioterapia de mantenimiento por 10 meses con interrupción por leucopenia severa; donde se realiza un mielograma y se obtiene una médula ósea con infiltración de 10% de blastos, y por Citometría de flujo: médula ósea infiltrada por blastos mieloides (34.56%) con diferenciación granulo monocítica con expresión de: CD45+, CD34+, CD117-/++, HLA-DR-/++, CD13-/++, CD38-/++, CD66c-/++, CD64+, CD7neg, CD19neg, CD10neg, CD20neg (fig. 2). Por lo que fue diagnosticado con Leucemia mieloide Aguda (LMA). Familiar (padre) decide que paciente pasará a tratamiento paliativo y ya no aceptará más estudios, a pesar de que tiene una hermana HLA compatible.
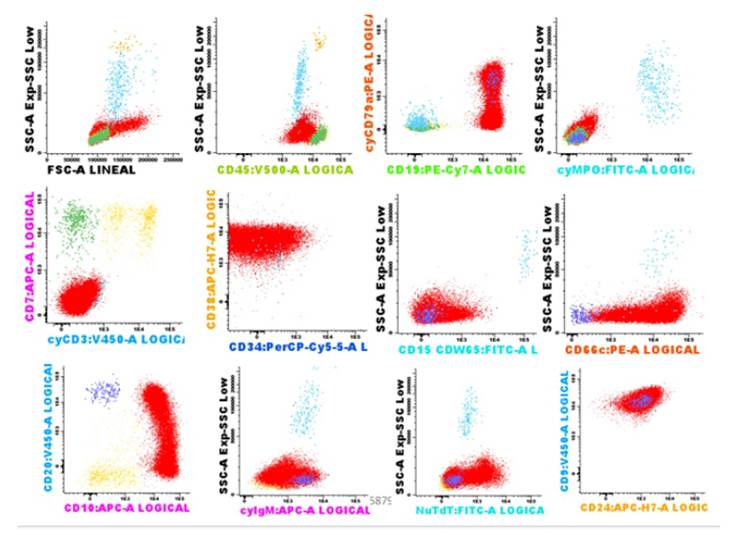
Fig. 1 Inmunofenotipo de LLA-B debut: linfoblastos patológicos: 82.64%, CD45+/++, CD19++, cyCD79a-/++, CD81+/++, CD34-/+, CD38++, CD15/CDw65-/+d, CD66c-/++, CD10++/+++, CD20-/++, cyIgM-/+, nuTdT-/++, CD24-/+, CD9++; negativo a cyMPO, CD7,cyCD3
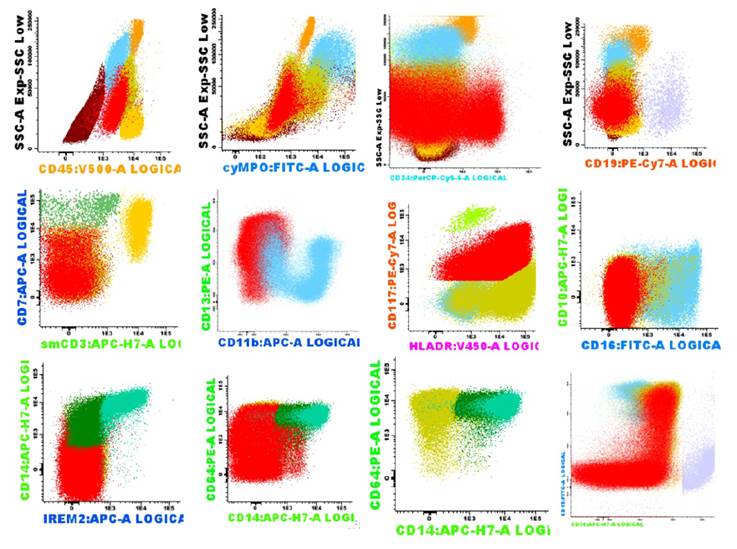
Figura. 2 inmunofenotipo del cambio de linaje a Leucemia Mieloide Aguda: población de Precursores Mieloides patológicos con diferenciación a línea granulo-monocítica que representan el 34.56% del total evaluado (blastos mieloides 21.14%, monoblastos 10.14%, promonocitos 3.28%), que expresaron blastos mieloides: CD45+, CD34+ (38%), CD117+/++, HLA-DR+/++, CD7-/+, CD13-/++, CD38-/++, CD66c-/++, CD64+, CD19neg, CD10neg, CD20neg.
Discusión
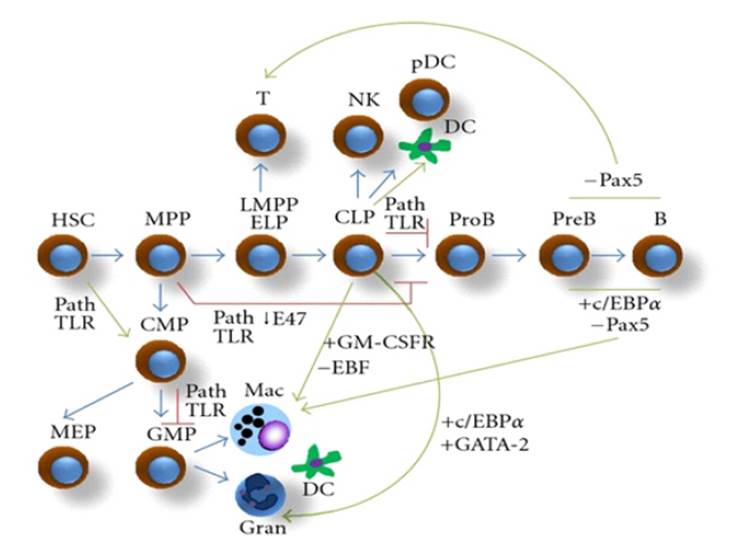
Se han sugerido varias hipótesis para explicar la conversión del linaje en la leucemia aguda, pero su mecanismo preciso sigue sin estar claro. Una revisión de algunos mecanismos conocidos de plasticidad fisiológica puede ayudar a comprender la biología celular y molecular detrás de este fenómeno (Figura 3), que se ha definido como la capacidad de cambiar el destino celular sin alterar el genotipo. Por lo tanto, las modificaciones epigenéticas podrían ser de gran importancia para regular las conversiones de células fenotípicas en respuesta a los cambios en el microentorno 4.
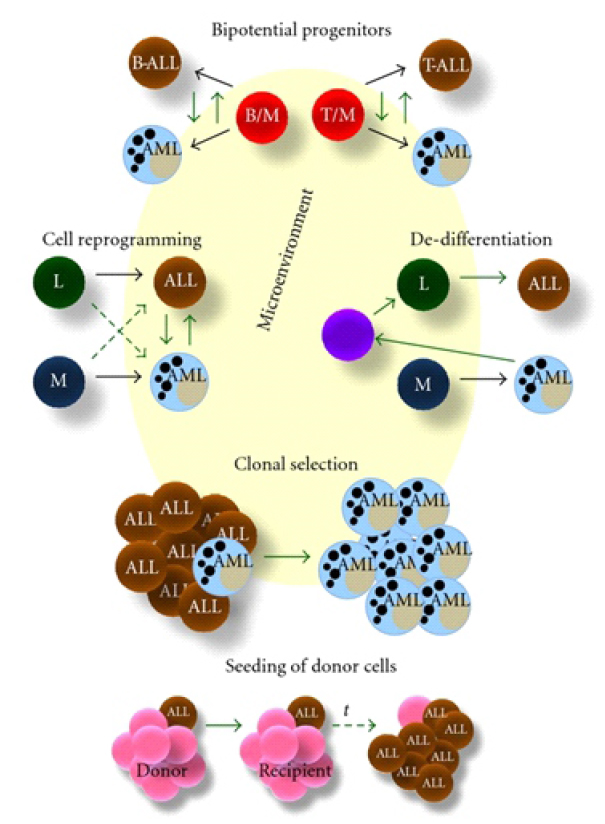
Los posibles mecanismos de cambio de linaje en leucemias agudas son (Figura 4): El microentorno puede influir en todos los mecanismos propuestos al modular la plasticidad del genoma de las células y cambiar el resultado de la leucemia en la recaída. Los progenitores bipotenciales podrían ser responsables de las interconversiones del destino de las leucemias linfoide-mieloides mixtas. Los cambios genéticos y epigenéticos en los factores de transcripción de células totalmente comprometidas o en desarrollo son la base de la reprogramación celular. Durante la desdiferenciación, se produce un cambio celular en un estado diferenciado que a su vez vuelve a una etapa más primitiva y menos comprometida. La selección clonal se basa en la existencia de una enfermedad oligoclonal y en la selección de un clon distinto y quimiorresistente. En la siembra de leucemia de células de donantes después de aloinjertos de médula ósea, un primer "golpe" puede tener lugar en un donante seguido de un segundo "golpe" en el receptor, junto con una selección clonal a tiempo 5.
En la presentación de nuestro caso, el cambio de linaje surgió al año y 9 meses del diagnóstico de LLA-B, en recaída luego de la fase de mantenimiento, donde a nivel de morfológico no hubo diferencia de blastos, más bien un cambio de marcadores para la expresión de LMA que no se expresaron en el debut de LLA-B, pérdida de CD10. Pui et al. 6 anteriormente sugirió que la pérdida de CD10 podría estar relacionada con la transformación maligna de células madre pluripotentes después de la erradicación de la línea de células madre original con quimioterapia, pero la importancia precisa de este hallazgo sigue siendo desconocida.
Inicialmente el estudio de cariotipo y el panel molecular de nuestro paciente fueron normales y sin hallazgo de alteración de algún gen respectivamente. Tal vez si se hubiese hallado alteración en los genes AF4- MLL de los cromosomas 4 y 11, se estaría hablando de la capacidad de transformación competa de un linaje a otro, ya que está interrelacionada con el compromiso de linaje linfoide 7.
Hubiese sido importante que se completen estudios citogenéticos y moleculares al cambio de linaje de LLA-B a LMA de nuestro paciente; ya que el paciente recibió tratamiento durante su quimioterapia con antracíclicos y éstos se relacionan con la generación de LMA. Como lo describe Bracho F, y colaboradores en “Gen MLL y leucemia en niños”: En estos pacientes se ha encontrado una incidencia entre 70 a 90% de alteraciones en el 11q23, especialmente amplificaciones y translocaciones, siendo éstas las más frecuentes en los pacientes pediátricos. 8.
Nuestro paciente está dentro de la estadística de cambio de linaje de LLA-B a LMA que es más común, además de ser paciente pediátrico, como lo describe Park M. y colaboradores 9.
Existen diferentes mecanismos que podrían explicar el cambio de linaje entre leucemia linfática aguda a leucemia mieloide aguda y visceversa (siendo esta última menos común). Los estudios secuenciales fenotípicos y citogenéticos arrojan información valiosa sobre los mecanismos de recidiva leucémica, con posibles implicaciones para la selección individualizada del tratamiento. Faltan datos de estudio en nuestro paciente para definir la causa del cambio de linaje, sin embargo podríamos hablar de posibles factores que pudieron haber influenciado en el cambio de linaje son: progenitores bipolares, selección clonal, Quimioterapia