INTRODUCCION
En China, a fines del 2019, se reportaron casos graves de neumonía, identificando como agente causante un nuevo virus denominado Severe Acute Respiratory Syndrome CoronaVirus 2 (SARS-CoV-2). Esta enfermedad fue denominada COVID-19 (del inglés Coronavirus Disease 2019), de presunto origen zoonótico y con la capacidad de propagarse de persona a persona, hasta ser declarada pandemia por la Organización Mundial de la Salud el 11 de marzo de 2020 1-3).
China (específicamente Wuham-Hubei) fue el primer foco de infección, notificándose más de 80 mil casos confirmados y una tasa de letalidad de 5.3%. En marzo del mismo año se diseminó en Europa, siendo Italia y España los países más afectados, con 13.6 y 7.0% de casos fatales respectivamente (61.8 y 58.3 muertos por 100 mil habitantes). En el mes de Abril el foco de la pandemia se trasladó a América, siendo Estados Unidos de Norteamérica, Brasil, México y Perú los países más afectados. Para noviembre de 2020 en Argentina y Colombia se han incrementado significativamente los infectados y fallecidos por SARS-CoV-2 y en Europa se registra una segunda ola de contagios, mayor a la primera 3,4).
En Perú se confirmó el primer caso el 6 de marzo de 2020 y los primeros fallecimientos el 19 del mismo mes, incrementándose rápidamente el número de casos, en los siguientes 4 meses se constituyó en uno de los países más afectados por la pandemia en el mundo. Hasta el 12 de Noviembre se han reportado 930 mil casos y 35067 fallecidos (tasa de letalidad de casos 3.77% y 109.5 muertes por 100 mil habitantes) 4-6.
La forma grave de COVID-19 se presenta en aproximadamente el 20% de los infectados y el 5% desarrolla síndrome de distrés respiratorio agudo y necesita cuidados intensivos y soporte ventilatorio avanzado 1,7-9. Se han identificado factores de riesgo para desarrollo de la forma grave de COVID-19 y mayor riesgo de mortalidad, entre los que destacan el género masculino, edad avanzada, hipertensión arterial (HTA), obesidad, diabetes mellitus, enfermedades respiratorias y/o cardiovasculares crónicas. Reportándose también como factores asociados a severidad diversas manifestaciones clínicas, resultados de laboratorio y hallazgos radiológicos 10-13.
El hospital nacional Edgardo Rebagliati Martins, perteneciente al Seguro Social de Salud (EsSalud), es considerado uno de los centros de referencia para COVID-19 en Perú y viene atendiendo un importante número de pacientes hospitalizados con alto porcentaje de fallecimientos y necesidad de soporte ventilatorio 14. Por lo que el presente estudio busca determinar los factores (epidemiológicos, clínicos, de exámenes auxiliares y tratamiento) asociados a mortalidad en pacientes con enfermedad grave por SARS-Cov-2 en un hospital terciario de Lima.
MATERIALES Y MÉTODOS
La investigación fue desarrollada en el Hospital Nacional Edgardo Rebagliati Martins, ubicado en el distrito de Jesús María en Lima-Perú. Hospital de referencia de EsSalud, con 1600 camas hospitalarias que adecuó su oferta para recibir en sus dos terceras partes a pacientes con COVID-19.
Se realizó un estudio observacional retrospectivo, en pacientes hospitalizados entre marzo y mayo del 2020, con diagnóstico de COVID-19 clasificado como enfermedad grave. Todos los pacientes fueron confirmados por pruebas TR-PCR (reacción en cadena de polimerasa con transcriptasa reversa a tiempo real) para SARS-CoV-2.
Se calculó un tamaño de muestra de 149 participantes por cada grupo, considerando un reporte previo donde se reporta que de los pacientes graves (desarrollaron SDRA o fallecieron) el 27% tenían HTA, en comparación al 13% de los que no tuvieron esta condición 11, proporción de perdidas 10%, razón entre grupos 1:1, potencia 90% y con un nivel de confianza de 95%.
Los criterios de inclusión fueron edad mayor de 18 años, TR-PCR positiva y enfermedad grave por COVID-19 (Saturación periférica de Oxígeno previo al inicio de oxigenoterapia menor a 93% o compromiso pulmonar > 30% en la tomografía pulmonar). Se excluyeron a los pacientes en los cuales no se logró conocer su evento final (referidos o altas voluntarias), causa de fallecimiento no relacionada a COVID-19 y pacientes que tuvieron seguimiento incompleto.
Se revisaron los datos de la historia clínica electrónica de los pacientes, sin realizar ninguna modificación de los procesos de atención del hospital. Se consideraron factores epidemiológicos: edad, sexo, comorbilidades previas como HTA, diabetes, obesidad o enfermedad pulmonar crónica. Entre los factores clínicos se revisó tiempo de enfermedad, disnea, saturación al ingreso y qSOFA (del inglés quick Sequential Organ Failure Assessment). Entre los exámenes auxiliares al ingreso hospitalario se evaluaron recuento de leucocitos, monocitos, linfocitos, proteína C reactiva (PCR), transaminasas, deshidrogenasa láctica (DHL), dímero D, fibrinógeno, análisis de gases arteriales, patrones radiológicos pulmonares y porcentaje de compromiso pulmonar según total severity score (TSS) 13) (en tomografía espiral multicorte sin contraste o radiografía simple de tórax). Entre los factores de tratamiento se evaluó medicación recibida por el paciente durante su hospitalización (de duración mayor a 48 horas), agrupándolos en: “fármacos contra COVID-19” recomendados en el país al momento de realizar el estudio (azitromicina, hidroxicloroquina e ivermectina), uso de corticoides, anticoagulación y ventilación mecánica (VM) invasiva. Se consideró como evento de interés al paciente fallecido, y como variable de tiempo a los días de estancia hospitalaria.
Los datos fueron codificados y procesados en SPSS versión 25.0 realizándose un análisis descriptivo de las variables estudiadas, utilizando prueba de Kolmogorov-Smirnov para evaluar la distribución normal. Además, se calcularon frecuencias, medidas de tendencia central y medidas de dispersión. En el análisis bivariado se determinaron los Hazard ratio (HR) de los factores asociados a mortalidad utilizando modelos de regresión de cox, y para el análisis multivariado se aplicó regresión de cox con método de selección hacia adelante condicional, ingresando al modelo estadístico aquellas variables cuyo valor p sea menor a 0,20 y/o tengan significancia clínica.
El proyecto fue autorizado por el Departamento de Emergencia del hospital y aprobado por comité de Ética en Investigación para COVID 19 de EsSalud (ÉTICA.IETSI-20MAY2020). Se cumplió con el principio de confidencialidad de los pacientes, recolectando los datos necesarios, después fueron anonimizados y los registros previos borrados. No se obtuvo consentimiento informado debido a que la fuente de datos fue secundaria (historia clínica y registros hospitalarios) y no hubo ninguna intervención con el paciente.
RESULTADOS
Entre marzo y mayo de 2020 se hospitalizaron 945 pacientes con COVID-19 (sospechoso o confirmado) en el hospital evaluado. Se revisaron 462 pacientes con PCR-RT positivo en hisopado nasofaríngeo, 58 fueron ambulatorios, 28 no correspondían a forma grave de enfermedad, 6 salieron de alta voluntaria y 25 tuvieron datos incompletos.
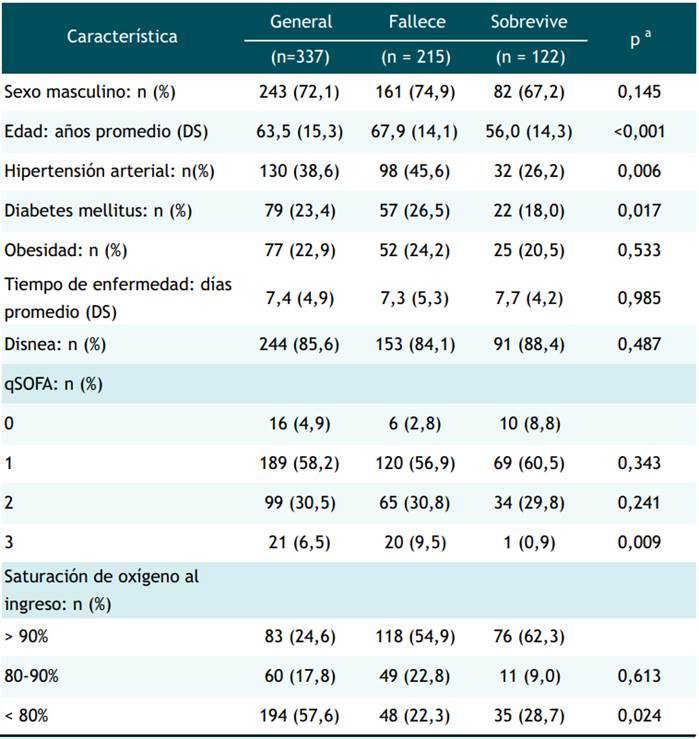
Se incluyeron 337 pacientes con enfermedad grave por COVID-19, fallecieron 215 (63.8%) y egresaron del hospital con mejoría 122 (36.2%). Fueron de sexo masculino 243 (72.11%) y edad promedio de 63.59 años (DS 15.3, rango 23 y 99). Acudieron a la Emergencia refiriendo en promedio 7.4 días de enfermedad (DS 4.9, rango 1 y 35). 54.68% registraron un tiempo de enfermedad mayor a 7 días. Habiéndose registrado disnea y fiebre como síntomas más frecuentes; HTA, diabetes mellitus tipo 2 y obesidad como antecedentes más importantes (Tabla 1).
Tabla 1 Características clínicas de los pacientes con enfermedad grave por SARS-CoV-2 atendidos en un hospital de referencia, Lima Perú.
a: Regresión de cox
Tabla 2 Resultados de exámenes auxiliares en pacientes con enfermedad grave por SARS-CoV-2 atendidos en un hospital de referencia, Lima Perú.
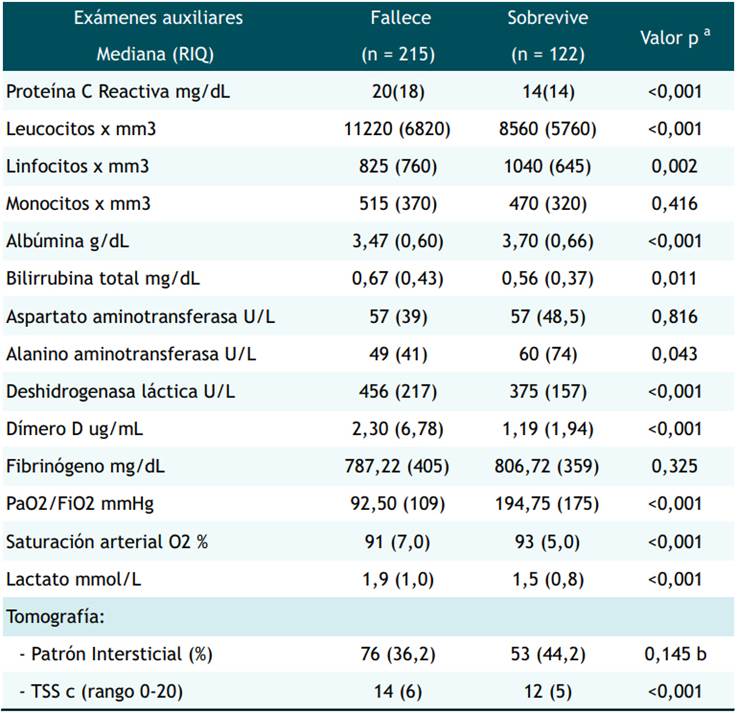
a: Prueba U de Mann Whitney; b: Chi cuadrado; c: Total severity score
Respecto a los exámenes de laboratorio, se encontraron diferencias entre el grupo de fallecidos y sobreviviente, entre los valores cuantitativos de: proteína C reactiva (PCR) (valor p<0.001), leucocitos (valor p<0.001), linfocitos (valor p=0.002), albumina (valor p<0.001), Bilirrubina total (valor p=0.011), deshidrogenasa láctica (DHL) (valor p<0.001), dímero D (valor p<0.001), PaO2/FiO2 (valor p<0.001), Saturación de oxígeno (valor p<0.001) y Lactato (valor p<0.001). Y en relación al score de severidad tomográfica (TSS) se encontró diferencias significativas (valor p<0.001). (Tabla 2)
Respecto al tratamiento, se empleó “fármacos contra COVID-19” en 74.5% de los pacientes, la asociación hidroxicloroquina más azitromicina fue la más utilizada, administrándose en el 72% de los que posteriormente fallecieron y en el 79% de los que sobrevivieron (p=0.179). En cuatro casos se utilizó oseltamivir y en tres casos ivermectina.
Se administró corticoides en el 61.4% de casos que fallecieron y 44.3% de los que sobrevivieron (p=0.154); el corticoide administrado fue metilprednisolona 49.0%, hidrocortisona 5.9% y prednisona 0.3% del total de casos. La dosis de metilprednisolona fue de 80-500 mg diarios, hidrocortisona 300 a 500 mg diarios y prednisona 1 mg/kg/dia, entre 3 y 10 días de duración.
Se utilizó anticoagulación en 60.9% de los casos fallecidos y 42.62% de los sobrevivientes (p=0.065), usando enoxaparina en 97.8% con una duración entre 3 a 14 días, a dosis profiláctica (1 mg/Kg de peso/24 horas) en el 66.7% del total de casos y en el 33.3% restante anticoagulación plena (1 mg/Kg de peso/12 horas). En 9 casos se utilizó heparina no fraccionada.
Se emplearon antibióticos en 320 pacientes (94.96% del total), siendo los más utilizados inicialmente ceftriaxona 80%, cefepime 9%, pipercilina/tazobactam 8%, meropenem 8%, vancomicina 3.4%. Iniciando con monoterapia en el 85% de casos.
En relación a soporte ventilatorio, 136 pacientes ingresaron a ventilación mecánica invasiva, 48.84% de los casos que posteriormente fallecieron y 25.41% de los sobrevivientes (p=0.884). 35 pacientes ingresaron a Unidad de cuidados intensivos (UCI) (10.4%) los demás permanecieron en áreas críticas del servicio de emergencia. Luego de recibir tratamiento en salas de emergencia o UCI, fueron a salas generales de medicina 55 pacientes (16.32% del total). La mediana de hospitalización fue 10.32 días (entre 1 y 110 días).
Tabla 3 Factores asociados a mortalidad en pacientes con enfermedad grave por SARS-CoV-2 atendidos en un hospital de referencia, Lima Perú.
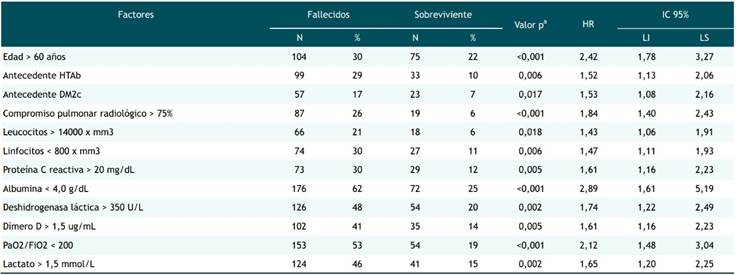
a: Regresión de Cox, b: HTA hipertensión arterial, c: DM2 diabetes mellitus tipo 2
Los factores asociados a mortalidad en el análisis bivariado (Tabla 3) fueron a) epidemiológicos: edad mayor de 60 años (HR: 2.415 IC95%: 1.781-3.274), HTA (HR: 1.522 IC95%: 1.127-2.056) y diabetes mellitus (HR: 1.527 IC95%: 1.079-2.161); b) exámenes auxiliares: leucocitosis > 14000 (HR: 1.427 IC95%: 1.064-1.914), linfopenia < 800 (HR: 1.467 IC95%: 1.114-1.931), PCR > 20 (HR: 1.605 IC95%: 1.155-2.230), albúmina < 4.0 (HR: 2.889 IC95%: 1.608-5.189), Dimero D > 1.5 (HR: 1.608 IC95%: 1.158-2.233), DHL > 350 (HR: 1.744 IC95%: 1.221-2.491), PaO2/FiO2 < 200 (HR: 2.118 IC95%: 1.475-3.041), lactato > 1.5 (HR: 1.645 IC95%: 1.204-2.247), patrón radiológico TSS > 15 en tomografía (HR: 1.842 IC95%: 1.398-2.427). No se encontró diferencia significativa entre los factores clínicos ni de tratamiento evaluados.
Tabla 4 Análisis multivariado de factores asociados a mortalidad en pacientes con enfermedad grave por SARS-CoV-2 atendidos en un hospital de referencia, Lima Perú.
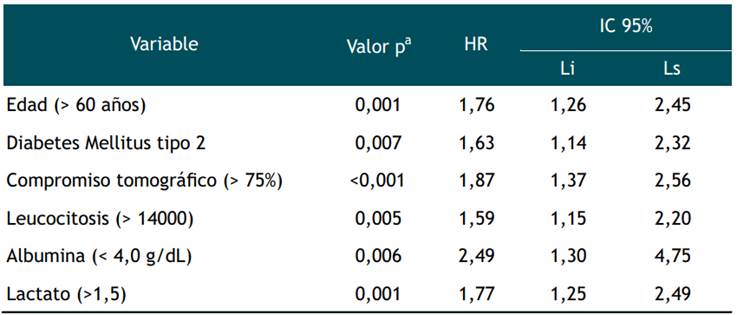
a: Regresión de cox múltiple con método de selección condicional hacia adelante
En el análisis de supervivencia multivariado (Tabla 4) se encuentran como factores asociados a mortalidad en COVID-19 grave a: edad > 60 años (HR: 1.755 IC95%: 1.256-2.453), diabetes mellitus tipo 2 (HR: 1.625 IC95%: 1.140-2.318), leucocitos > 14000 (HR: 1.590 IC95%: 1.150-2.200), albumina < 4.0 (HR: 2.486 IC95%: 1.302-4.746), lactato > 1.5 (HR: 1.766 IC95%: 1.254-2.485) y compromiso pulmonar en tomografía (TSS > 15) (HR: 1.873 IC95%: 1.370-2.561).
DISCUSIÓN
El presente estudio encontró como factores asociados a mortalidad en pacientes con COVID-19 grave, a la edad mayor de 60 años, la Diabetes mellitus tipo 2, mayor compromiso pulmonar, leucocitosis, hipoalbuminemia y lactato elevados al ingreso hospitalario. En el contexto de la etapa inicial de desarrollo de la pandemia en un país latinoamericano, con alto índice de contagio y elevadas tasas de mortalidad. Esto se diferencia de los factores de riesgo ya demostrados para desarrollar enfermedad grave por COVID-19.
La edad es un factor de riesgo demostrado para enfermedad grave y mortalidad, con un riesgo incrementado por cada año de incremento de la edad. Asimismo, la edad mayor a 60 años se asocia con un incremento de mortalidad en 1.90 veces; esto se explica por la disminución de mecanismos anti-inflamatorios e incremento de los pro-inflamatorios con edad más avanzada 15-17.
Los pacientes con diabetes mellitus desarrollan un curso clínico grave y tienen una mayor mortalidad, siendo considerado uno de los factores de riesgo más importantes 18. Un meta-análisis que incluyó 16.000 pacientes, encontró que los diabéticos tienen 2.16 veces mayor probabilidad de desarrollar enfermedad grave por COVID-19 y el doble de probabilidades de morir debido a ella 19. La diabetes y la infección por SARS COV-2, tienes vías patogénicas comunes, Dos de los receptores de coronavirus, la enzima convertidora de angiotensina 2 (ACE2) y la DPP4 también son transductores de las vías metabólicas que regulan la homeostasis de la glucosa, la fisiología renal, cardiovascular y la inflamación 19,20).
La variación en la presentación de las imágenes tomográficas de acuerdo al tiempo de evolución de la enfermedad, guarda relación con el estado de gravedad. Se han definido 4 etapas: I (0-4 días) donde se encuentran opacidades en vidrio deslustrado, II (5-8 días) donde se encuentra un patrón de empedrado loco “crazy paving”, III (9 a 13 días) donde se muestra consolidación y IV (más de 14 días) donde se aprecia una reducción gradual de la consolidación. Los pacientes recuperados de COVID-19 experimentaron la mayor gravedad de la enfermedad pulmonar en las tomografías obtenidas en el día 10, es decir en la fase de consolidación 21. Se ha demostrado la asociación entre porcentaje de compromiso pulmonar y severidad de la enfermedad, asociándose a mayor mortalidad 13).
En lo referente a leucocitosis, un meta-análisis que incluyó 6,320 pacientes procedentes de 62 artículos, encontró que los niveles elevados de leucocitos se asociaron a enfermedad severa (OR 2.62; IC 1.72-3.97), a una mayor probabilidad de ingreso a una UCI (OR 29.1, IC 2.9-291.8) y a una mayor mortalidad (OR 6.25, IC 2.05-19) 22 probablemente relacionado a sobreinfección bacteriana.
Los niveles disminuidos de albúmina, hallazgo frecuente en los pacientes con forma grave de COVID-19, sugieren que la función sintetizadora del hígado está afectada significativamente; un meta-análisis de 45 estudios reporta que este parámetro de laboratorio se asocia a una mayor severidad de la enfermedad y a una peor evolución de los casos críticos 23.
El lactato elevado en nuestro estudio es un factor independiente asociado a mortalidad, similar lo reportado en hospitales de India y Alemania, donde los niveles elevados de lactato fueron predictores de mortalidad a las 24 horas de admisión a UCI y mortalidad en pacientes con COVID-19 (p<0.01), esto se asocia a estados de hipoperfusión tisular y choque distributivo 24-27.
La presencia de disnea es un factor asociado a enfermedad grave por COVID-19 28,29, sin embargo, algunos autores describen ausencia de disnea en injuria pulmonar severa, incluso en aquellos que fueron intubados e ingresados a ventilación mecánica, postulándose alteraciones a nivel del sistema nervioso central o las fibras C pulmonares responsables de la percepción de hipoxemia o por el shunt intrapulmonar debido a vasoplejía o fenómenos trombóticos intravasculares (hipoxemia silenciosa o “feliz”) 31,32.
La saturación periférica de oxígeno, se asocia a gravedad de enfermedad 17,33, sin embargo no se encontró sigficancia en el presente estudio, quizás porque era un criterio de ingreso a hospitalización y al estudio. La presencia de 2 o más puntos de qSOFA no resultó significativo. Esto difiere de los reportes que encuentran asociación entre una mayor puntuación SOFA y mortalidad OR 1.30 (IC 1.11-1.53) por cada punto de incremento en China 34 y 19% HR por un punto de incremento (IC 5-34) en España 16. El uso de qSOFA se explica por su fácil aplicación al ingreso hospitalario, ya que no incluye resultados de exámenes auxiliares.
Otros factores clínicos y epidemiológicos (reportados como asociados a enfermedad grave y mortalidad en COVID-19) como sexo masculino 1,7, tiempo de enfermedad mayor a 7 días, hipertensión arterial 20,30, obesidad y otras patologías cardiovasculares, resultaron no significativos en el presente estudio. Probablemente porque la mayoría de pacientes incluidos ya tenía este factor al haber desarrollado enfermedad grave.
La relación Pa02/Fi02 16,24,25 ha sido descrita como factor pronóstico en COVID-19, sin embargo, los valores iniciales evaluados, no muestran significancia. Otras variables de laboratorio como la linfopenia y elevaciones de proteína C reactiva, deshidrogenasa láctica (DHL) y dímero D se asociaron a formas severas de enfermedad y a una mayor mortalidad asociada 3,9,10,23, en la presente investigación a pesar de tener asociación en el análisis bivariado, no resultaron significativas en el multivariado.
Al momento de la realización del trabajo no se tenía evidencia suficiente sobre el beneficio de los corticoides ni la dosis adecuada en la enfermedad grave por COVID-19, se dejaba a criterio clínico su indicación 35. Las revisiones sistemáticas, que evaluaban el uso de metilprednisolona a dosis altas (mayores a 1 mg/Kg/día) habían incluido pocos pacientes, mencionaban que podría existir reducción la mortalidad (HR 0,41; IC 95%: 0,20 a 0,83) 35,36.
El estudio RECOVERY (Randomised Evaluation of COVid-19 thERapY) publicado en junio del 2020, realizado en más de 11500 pacientes de 175 hospitales del Reino Unido, demostró que el uso de 6 mg diarios de dexametasona disminuyó la mortalidad en un tercio en pacientes con soporte ventilatorio (RR: 0.64; 95% CI, 0.51 to 0.81) y en un quinto en aquellos que recibieron suplemento de oxígeno ( RR: 0.82; 95% CI, 0.72 to 0.94) de manera adicional se encontró que no hubo beneficio en aquellos pacientes que no requirieron oxigeno suplementario (RR 1.19; 95% CI, 0.91 to 1.55) 37. En nuestro estudio se emplearon dosis altas de corticoides, sin demostrar beneficio en la mortalidad.
La anticoagulación no demostró relación con mortalidad en COVID grave, sin embargo, es bien conocida la relación entre inflamación, hipoxia y el estado protrombótico reflejado en aumento de fibrina, los productos de degradación de la fibrina, el fibrinógeno y los dímeros D, promovidos por la infección SARS-CoV-238. Así pues, también existen diversos estudios donde se observa el aumento de la incidencia de enfermedad tromboembólica a pesar de la anticoagulación profiláctica en sus diferentes presentaciones, Embolia pulmonar (EP) principalmente39 o trombosis venosa profunda (TVP)40, estudios realizados principalmente en pacientes hospitalizados en UCI.
Diversos estudios han demostrado la necesidad y beneficio de la ventilación mecánica invasiva en pacientes con enfermedad grave por COVID-19 3,10,12, sin embargo son muchos los factores que influyen como el tiempo de evolución, la severidad y el equipamiento adecuado. En el presente estudio, a pesar de incrementarse el número de ventiladores mecánicos, no fueron suficientes para disminuir la mortalidad.
Entre las limitaciones del estudio esta recolección retrospectiva de datos y la falta de registro de índice de masa corporal en todos los pacientes (subregistro importante). Sólo se evaluaron los valores iniciales clínicos y de laboratorio, no se hizo seguimiento de los mismos. El colapso del sistema de salud obligó a adecuar ambientes de hospitalización y la falta de ambientes de cuidados críticos hizo que se amplíen las salas de emergencia para brindar soporte ventilatorio a muchos pacientes; sin embargo, los recursos no fueron suficientes para atender a todos los pacientes según su necesidad. La mayoría de pacientes acudían con más de 7 días de enfermedad (avanzada) por el aislamiento obligatorio instaurado o por la negativa de hospitalización a los pacientes que tenían saturación de oxígeno > 93% en el triaje de ingreso. Al inicio de la pandemia no estaban disponibles todos los medios diagnósticos para los pacientes, estos se fueron adaptando paulatinamente, de acuerdo al desarrollo de esta.
Finalmente podemos concluir que los factores asociados a mortalidad en pacientes con enfermedad grave por SARS-CoV-2 en un hospital terciario de Perú son edad mayor de 60 años, el antecedente de diabetes mellitus tipo 2, compromiso pulmonar mayor a 75%, leucocitosis al ingreso mayor a 14000 x mm3, albúmina menor de 4 g/dL y lactato mayor de 1.5 mmol/L.















