INTRODUCCIÓN
La terapia fotodinámica (PDT), se ha desarrollado como una alternativa para el tratamiento del cáncer, se ha descrito que no tiene efectos secundarios, ni riesgo alguno sobre los tejidos, destruye las células por necrosis o apoptosis, y puede utilizarse para la destrucción localizada de tejido vivo con crecimiento anormal1,2. Por lo tanto, otras enfermedades como las infecciones bacterianas, fúngicas y víricas, que tienen en común las características de la proliferación celular descontrolada y presencia de células microbianas infecciosas, que podrían tratarse con PDT, denominadose terapia fotodinámica antimicrobiana (aPDT por sus siglas en inglés) o Inactivación foto-dinámica (PDI en inglés)3,4.
Por otra parte, se conoce que gérmenes como el S. mutans y C. albicans pueden crear condiciones para formar biofilms5, lo cual, produce una interface sólido-líquida entre una superficie y un medio acuoso, proporcionando un entorno ideal para la fijación y crecimiento de los microorganismos6,7. Por consiguiente, los biofilms son generales en la Naturaleza y se encuentran prácticamente en todo cuerpo natural de agua en el mundo4,8 y también en superficies como plástico, vidrio7,9 y dientes10,11.
Asimismo, se sabe que la resistencia de las bacterias a los antibióticos sigue aumentando, por lo que se debe buscar una alternativa que controle eficazmente los patógenos sin provocar resistencia a los medicamentos. Por este motivo, existe una búsqueda constante de terapias alternativas con sustancias derivadas de plantas y otros compuestos con propiedades antibacterianas. En este sentido, uno de los métodos alternativos es la terapia fotodinámica antimicrobiana (aPDT)12, cuyo efecto en el siguiente principio: la luz visible activa una molécula esencialmente no tóxica, el llamado fotosensibilizador (PS), para producir especies reactivas de oxígeno que pueden matar bacterias. Sin selectividad a la oxidación. El azul de metileno y el azul de toluidina son colorantes utilizados en técnicas de tinción histológica. Se han presentado varios estudios13-17 donde se han evaluado la efectividad de estas tinciones los resultados son diversos debido a las diferentes metodologías empleadas, así mismo mecanismo de foto activación entre otros diferentes enfoques.
El presente estudio tiene como objetivo evaluar el efecto fotodinámico de Azul de metileno (MB) y Azul de toluidina (TBO), sobre biofilms de S. mutans y C. albicans, realizado en vitro, en el laboratorio de la facultad de ciencias de la salud de la Universidad Andina del Cusco.
MATERIALES Y METODOS
Diseño de estudio
Se diseñó un estudio experimental in vitro donde analizaron muestras de biofilm de S. mutans y C. albicans en placas de esmalte las cuales se les aplico terapia fotodinámica de dos soluciones fotosensibles, para comparar los efectos de este sobre el crecimiento microbiano de los biofilms.
El presente esquema determina el diseño del experimento de posprueba con grupos control negativo y positivo:
G1X1O1
G2X2O2
G3X3O3
G0-- O4
Población y muestra
La población estuvo compuesta por 61 muestras de biofilms de cepas S. mutans ATCC®25175TM y C. albicans ATCC®10231TM cultivadas en placas de esmalte de 4 x 4mm, desarrollados en un frasco hermético el cual se denominó “Biorreactor”.
La muestra de 61 biofilms se dividieron de la siguiente manera: (G1)Grupo 1(MB): 26 biofilms en los que se aplicó solución de azul de metileno (MB) al 0,01%(X1), (G2)Grupo 2(TBO): 26 biofilms en los que se aplicó solución de azul de toluidina (TBO) al 0,05%(X2), (G3) Grupo 3(CONTROL POSITIVO): 3 biofilms en los que se les aplicó Gluconato de clorhexidina (CHX) al 0,12% como control positivo(X3), (G0)Grupo 0(CONTROL NEGATIVO): 3 biofilms en los que no se les aplico terapia alguna las cuales fueron grupo control negativo.
Variable del estudio
Se consideró como variable principal (dependiente) el crecimiento microbiano del Biofilm de S. mutans y C. albicans (UFC), La variable efecto fotodinámico (independiente) fue la aplicación de solución de MB al 0,01%, TBO al 0,05%, ambas irradiadas con Laser terapéutico 660nm para producir el efecto fotodinámico, CHX al 0,12% como grupo control positivo.
Procedimiento
Cultivo planctónico Cepas bacterianas: Las cepas bacterianas utilizadas en el grupo de desarrollo de biofilm denominado “de fisura o coronal”6,18) fueron S. mutans ATCC®25175TM y C. albicans ATCC®10231TM, se utilizó dos cultivos los cuales fueron agar sangre enriquecido y agar Saburaud 4% glucosado (®VM906938006 MERK) respectivamente para el crecimiento planctónico de las cepas en placas Petri (2 por cada cepa).
Procedimiento de elaboración del fotosensibilizador: Se preparó las sustancias MB (Azul de metileno (C.I. 52015) ®FN1006150636 MERK) polvo preparado a 0,005g en 50 ml de agua destilada para dar una concentración de 0,01% y TBO (Azul de toluidina (C.I.52040) ®CAS N° 6586-04-5 BIOLAB REAGENT) polvo preparado a 0,025g en 50ml de agua destilada para dar una concentración de 0,05% puras
Preparación de los bloques de esmalte: 61 bloques de esmalte fueron preparados a partir de 40 piezas dentarias las cuales fueron 25 premolares y 15 molares extraídos anteriormente y almacenados, fueron rehidratados con glicerina al 93% por una hora y luego sumergidos en solución de timol al 0,5% durante 1 hora a temperatura ambiente, las piezas dentarias se cortaron con una máquina de marca Derek motors DRK-150 los cuales se completaron en bloques de 4x4mm de esmalte, el grosor de los bloques es de 1.5mm aproximadamente, la medición se hizo con un calibrador digital de la marca TRUPER(0,01mm-0,0005”). Se procuró que no existiera tejido de dentina en cada bloque, verificando que sea tejido puro en cada caso. Para el proceso de eliminación de residuos superficiales o barro producto del corte se sumergió las placas en EDTA trissódico al 17% (MAQUIRA®80322400049), durante dos minutos y seguidamente NaCl al 0,9% (BRAUN MEDICAL), durante un minuto19, luego de la desinfección se esterilizaron las muestras sumergidas en el caldo infusión Cerebro Corazón (BHI, por su siglas en inglés Brain Heart Infusion de marca ISO 6880®VM879793923 MERK) y se separaron tres muestras de esmalte que sirvieron como control negativo durante 48 horas a 37 °C como verificación de condiciones de pureza e inocuidad20.
Procedimiento de cultivo bacteriológico y elaboración del biofilm: Para el desarrollo de biofilm de fisura se realizó inicialmente el cultivo planctónico en placas Petri en Agar sangre de la cepa S mutans ATCC®25175TM y en Agar Sabouraud (®VM906938006 MERK) de la cepa Cándida Albicans ATCC®10231TM. Luego se procedió a pasar las cepas a medio liquido de 2ml de infusión BHI a tres muestras por cepa, se dejó crecer a 37° durante 48 horas. Luego de las 48 horas Se inoculo los 10µl de la muestra que mostró mayor crecimiento bacteriano (de acuerdo al estándar Mc Farland 0,5) tanto de la cepa S mutans como de la cepa Cándida en un solo frasco de infusión de 30 ml BHI el cual llamamos Biorreactor. Para el desarrollo del biofilm de fisura se prepararon 61 bloques de esmalte en saliva artificial de la marca Salival®, Perú, para la formación de película adquirida durante 2 horas, antes de sumergirlas en la infusión de 30 ml BHI del biorreactor antes mencionado. Todos los bloques fueron sumergidos en el biorreactor. Se mantuvo a una temperatura de 37°C y agitación del medio para simular el movimiento o flujo de sustancias en boca. El proceso duro de 72 a 96 horas para el desarrollo del biofilm por completo (Figura 1).
Procedimiento de foto activación: Se retiró los bloques de esmalte del biorreactor para proceder a sumergirlos durante 1 minuto en la solución de MB y TBO dividiendo las muestras a 26 unidades de forma aleatoria para cada fotosensibilizador, del mismo modo se separó 3 bloques para control negativo que fueron sumergidos en NaCl al 0,19% y 3 bloques para control positivo sumergidos en 30ml de Gluconato de clorhexidina al 0,12% puro (PERIOGARD COLGATE ®0PEXP05). Luego de este proceso se retiraron las muestras de las soluciones y se procedió a colocar en una placa Petri (Figura 2) de acuerdo a cada grupo (Grupo 1 y Grupo 2) para la irradiación de laser de luz roja con longitud de onda 660nm ±10nm (100mW±20%) de la Marca DMC modelo Therapy EC. Con emisión de luz continua.

Figura 2: Muestras luego de sumergirlas en las soluciones colocadas en una placa Petri listas para irradiación
El tiempo de irradiación fue de acuerdo a indicaciones del fabricante de 9J/cm2 por 90 segundos, a una distancia de 0.5cm cubriendo ambos lados del bloque de esmalte (Figura 3).

Figura 3: Irradiación de laser de luz roja con longitud de onda 660nm ±10nm (100mW±20%) de la Marca DMC modelo Therapy EC
La manipulación del bloque se realizó con pinzas estériles en autoclave al 134°C con una P° de 200 kPa, para evitar contaminación alguna. Seguidamente se colocó cada bloque de esmalte en un tubo de ensayo de sellado hermético con solución de infusión de BHI, para crecimiento de cultivo pos irradiación, a 37° por 48 horas. Luego de esto se homogenizó la muestra en un vórtex y se procedió al cultivo en placas Petri con medio enriquecido de agar Mueller-Hinton (®VM779137714 MERK). Para la cepa Streptococcus mutans (Figura 4) y placas Petri con Agar Ogye ((®VM 897178940 MERK), para la cepa Cándida (Figura 5), mediante el método empleado fue el de diluciones seriadas. Posteriormente se analizó los resultados de 2 a 5 días de cultivo, donde se realizó el conteo de unidades formadoras de colonia (UFC) de acuerdo a la observación directa y conteo de unidades de acuerdo a las características y la morfología de las cepas.
Análisis estadístico
Todos los datos fueron analizados en el programa SPSS Statistics 24 (IBM, Licencia institucional Universidad Andina del Cusco). Se planteó el análisis previo de la distribución normal de las UFC mediante Prueba de Shapiro-Wilks (p>0,05). En el análisis descriptivo para las variables de interés se calcularon promedios y deviaciones estándar, se dividieron las muestras en bases logarítmicas mostrando Log 10 en base 3, para poder compararlos más específicamente de acuerdo a la cantidad de UFC. Se utilizaron prueba de t de Student para datos independientes por pares de acuerdo a la especie bacteriana o cepa, se consideró que el valor de p<0,05 es estadísticamente significativo.
Del mismo modo se hizo comparaciones por pares con el control positivo y Anova de un factor para probar la hipótesis planteada, tomando en cuenta el control negativo, control positivo, grupo MB y TBO.
Aspecto ético
La presente investigación está adherida a las normas de Helsinki para la investigación en sujetos por pares de acuerdo a la especie bacteriana o cepa tos humanos. Sin embargo no se contemplan aspectos éticos en vista que el análisis en su totalidad fue desarrollado por cepas ATCC o de referencia, así mismo el desarrollo del biofilm fue desarrollado in vitro, logrando así los objetivos del presente estudio.
En cuanto a los bloques de esmalte, se recolectaron piezas extraídas por colegas odontólogos que las tenían almacenadas lo cual se consideró como material inerte que de acuerdo a las normas éticas el retiro de las piezas dentaria no fue en perjuicio del paciente sino todo lo contrario (caries, infección o motivos terapéuticos ortodónticos), salvaguardando el principio de Beneficencia de estos. No fue posible solicitar consentimiento para el uso de sus muestras en vista de que el tratamiento fue realizado anteriormente.
RESULTADOS
Se muestra que el efecto fotodinámico de Azul de metileno (MB) y Azul de toluidina (TBO) in vitro, reduce el crecimiento bacteriano comparado con el control negativo y control positivo (Gráfico 1). Asi mismo la C. albicans y el Streptococcus mutans mostraron menor crecimiento en el grupo TBO en comparación con el Control positivo (p<0,05), (Tabla 1)
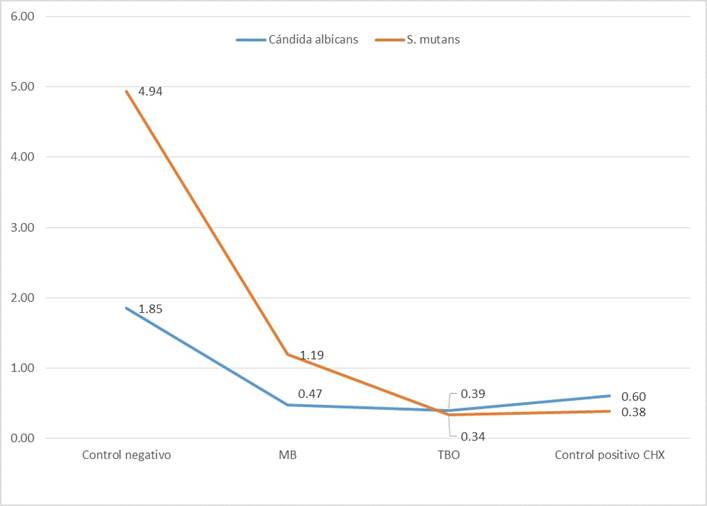
Gráfico 1 Medias de Crecimiento Bacteriano de S. mutans y Cándida albicans, pos irradiación de MB, TBO, control Negativo y CHX (control positivo) log 10 3
Tabla 1 Prueba estadística T de Student por pares de crecimiento microbiano de Cándida albicans y Streptococcus mutans pos irradiación de solución fotosensible MB y TBO con CHX (control positivo) log10 3.
| Sustancia fotosensible | |||
|---|---|---|---|
| (Media ± Ds) UFC | p-valor* | ||
| Cándida Albicans | MB 0,01% (n=6) | 0,47 ±0,121 | 0.159 |
| CHX 0,12 % (n=3) | 0,60 ±0.1 | ||
| TBO 0,05% (n=4) | 0,39 ±0.097 | 0.039 | |
| CHX 0,12 % (n=3) | 0,60±0.1 | ||
| Streptococcus mutans | MB 0,01% (n=19) | 1,19±0.84 | 0.216 |
| CHX 0,12 % (n=2) | 0,38±0.023 | ||
| TBO 0,05% (n=2) | 0,34±0.001 | 0.001 | |
| CHX 0,12 % (n=2) | 0,38±0.023 | ||
* T de student, MB: Azul de Metileno al 0,01% CHX: Gluconato de clorhexidina al 0,12% TBO: Azul de toluidina 0,05%, UFC(x10 3 )
Al hacer el análisis de los grupos de las dos soluciones fotodinámicas se encontró que no existen diferencias para la Cándida (p>0,05), pero si se encontró diferencias estadísticas en el crecimiento bacteriano Streptococcus mutans donde el TBO tiene mejor efecto esta bacteria en comparación con el MB (Tabla 2)
Tabla 2 Prueba estadística T de Student por pares de crecimiento bacteriano de Cándida albicans y Streptococcus mutans pos irradiación de solución fotosensible MB comparado con TBO expresado en log10 3
| Sustancia fotosensible | |||
|---|---|---|---|
| (Media ± Ds) UFC | p-valor* | ||
| Cándida Albicans | MB | 0.471±0.121 | 0.282 |
| TBO | 0.390±0.09 | ||
| Streptococcus mutans | MB | 1.188±0.840 | 0.001 |
| TBO | 0.337±0.001 | ||
* T de student; MB: Azul de Metileno al 0,01% CHX: Gluconato de clorhexidina al 0,12% TBO: Azul de toluidina 0,05%, UFC(x103)
DISCUSIÓN
La formación de biofilm sobre la superficie de las piezas dentarias le confiere a las bacterias que lo conforman una resistencia superlativa a la acción de antimicrobianos18,21, dentro de los tratamientos convencionales el tratamiento de elección en la actualidad es el enjuague bucal con contenido de clorhexidina al 0,12%, estudiado por Takenaka et al22, el cual indicó que existen pruebas sólidas para determinar el buen efecto antibiofilm o propiedad antibiopelicula de la CHX, este estudio es corroborado por varios autores23-26 quienes demostraron el efecto antibiofilm del CHX sobre todo sin combinaciones. En el presente estudio se determinó el efecto de la CHX como control positivo sobre el cual se desarrolló la comparación de las diferencias de efectos de las sustancias fotosensibles MB y TBO donde se halló diferencias estadísticas en el crecimiento bacteriano luego de la aplicación de CHX y TBO en biofilm de Streptococcus y Cándida (p<0,05). Asimismo, el TBO tuvo mayor efecto en la reducción del crecimiento bacteriano que el control positivo (CHX) (p<0,05).
Las dosis empleadas de las sustancias fotosensibles fueron de 0.01% de MB8,27,28, referente a la concentración utilizada29 realizo un estudio en el cual determino que la efectividad antibacteriana del MB no depende de la concentración, sin embargo se recomienda esta concentración como la más efectiva. El TBO fue utilizado en una concentración de 0,05%30,31 estas soluciones utilizadas son fotoactivadas con Luz laser rojo de baja potencia. El efecto de la luz láser se determina cuando un fotosensibilizador es estimulado por su longitud de onda óptima y se convierte del estado de baja energía a un estado triple de vida media alta y altamente energizado, lo que resulta en una reacción entre el fotosensibilizador, las moléculas ambientales y el oxígeno extracelular que conduce a la producción de oxígeno singlete y otros radicales libres que causan daño tisular32, en el presente estudio se utilizó laser de baja potencia con longitud de onda 660nm ±10nm (100mW±20%) demostrando la efectividad de este en el crecimiento bacteriano de las cepas del biofilm, en los diversos estudios32 mencionados se puede evidenciar diferentes longitudes de onda sin embargo todas coinciden en luz visible con una longitud de onda equivalente30 o cercana33 (630nm), El efecto antimicrobiano se da por la producción de Especies Reactivas de oxigeno donde oxigeno singlete es el principal responsable en la muerte de las células microbianas33,34.
El MB es una de las sustancias más utilizadas en la terapia fotodinámica, existen estudios donde ya se aplica la concentración utilizada en diversos tratamientos como coadyuvante al tratamiento periodontal35,36, sin embargo todavía aparecen estudios in vitro donde se muestra mejor efectividad de otras sustancias fotosensibilizadores32,33, de todas formas está demostrado su efecto fotodinámico en contra de las bacterias componentes de biofilm37,38 sin embargo se necesitan más estudios para evidenciar su verdadera potencia antibiofilm.
En el presente estudio se determinó que el TBO presenta mejor efecto antimicrobiano sobre el S Mutans en el grupo Log 10 3 de UFC (p<0,05), el mismo resultado se presenta en el estudio de Misba39 que determinó una reducción de bioformación de 49% para el TBO en comparación del 39% de MB.
Darmani y col.40 encontró reducción en el crecimiento de microorganismos como S mutans por efecto de TBO,30 encontró una reducción de crecimiento de S mutans es mejor pero a una irradiación de 180J/cm2 en comparación con el nuestro que solo 9J/cm2=90 segundos. Otro estudio33, utilizo una dosis de 5J/cm2.. Existe evidencia para determinar que la concentración de la irradiación de la Luz podría aumentar el efecto del fotosensibilizador32, no existe evidencia de la efectividad de la Luz laser roja y Otras fuentes de luz como el led azul.
Todos los hallazgos deben interpretarse con cautela, una de las limitaciones en el estudio fue el recuento directo de las UFC realizadas por el especialista, que, al no contar con un equipo contador de colonias, se sujeta a error humano.
Se concluye que tanto el MB y TBO muestran en laboratorio, una disminución en el crecimiento de las cepas del biofilm, el TBO mostró mejor efecto a la reducción de crecimiento del S. mutans y C. albicans frente al control positivo y MB.