Introducción
La Artritis Reumatoide (AR) es una enfermedad autoinmune y crónica que causa la inflamación de las articulaciones sinoviales, principalmente periféricas. Se estima que a nivel mundial la prevalencia es de 0.5%1 mientras que en el Perú se ha establecido una prevalencia en población urbana de 0.51 % y 0.25% para AR y AR temprana respectivamente2. Esta enfermedad puede producir discapacidad física permanente y aumento en el riesgo de muerte, cáncer, infecciones, osteoporosis, y enfermedades cardio-metabólicas3. Debido a su alta prevalencia, los altos costos que implica su tratamiento, el impacto en la calidad de vida que genera , sus secuelas y la exposición que representa para el desarrollo de otras enfermedades, la Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud) priorizó el desarrollo de una guía de práctica clínica (GPC) para brindar recomendaciones basadas en evidencias sobre el diagnóstico, tratamiento y monitoreo inicial de la AR tomando en consideración el contexto y desafíos propios de la población de EsSalud. El presente artículo resume el proceso y contenido de dicha GPC.
Materiales y Métodos
El procedimiento seguido para la elaboración de la presente GPC está detallado en sus versiones “in-extenso” y anexos, la cual puede descargarse de la página web del IETSI de EsSalud (http://www.essalud.gob.pe/ietsi/guias_pract_clini.html). A continuación, se presenta un resumen de la metodología desarrollada.
Conformación del grupo elaborador de la guía (GEG): El GEG incluyó metodólogos y médicos reumatólogos considerados expertos en el tema.
Formulación de preguntas: Se formularon 10 preguntas clínicas (Tabla 1), cada una de las cuales pudo tener una o más preguntas PICO (Population, Intervention, Comparator, Outcome). A su vez, cada pregunta PICO pudo tener uno o más desenlaces (o outcomes) de interés.
Búsqueda y selección de la evidencia: Para cada pregunta PICO, durante diciembre 2017 a julio 2019, se buscaron revisiones sistemáticas (RS) publicadas como artículos científicos (mediante búsquedas sistemáticas en PubMed y Central) o realizadas como parte de una GPC previa (mediante una búsqueda sistemática de GPC) (Material suplementario 1). Se seleccionaron RS de calidad aceptable después de haber sido evaluadas con la herramienta A MeaSurement Tool to Assess systematic Reviews-II (AMSTAR-II)4, de las cuales se escogió una RS para la toma de decisiones, la cual fue actualizada cuando el GEG lo consideró necesario. Cuando no se encontró ninguna RS de calidad aceptable, se realizó una búsqueda de novo de estudios primarios.
Evaluación de la certeza de la evidencia: Para cada desenlace en cada pregunta PICO, se evaluó la certeza de la evidencia siguiendo la metodología de Grading of Recommendations Assessment, Development, and Evaluation (GRADE) según la cual, la evidencia puede ser de alta, moderada, baja, o muy baja certeza (Tabla 2)5. Esta evaluación se presenta en tablas de resumen de evidencias (Summary of Findings - SoF) de GRADE (Material suplementario 2).
Formulación de las recomendaciones: El GEG revisó la evidencia seleccionada para cada pregunta clínica en reuniones periódicas, y formuló recomendaciones fuertes o condicionales (Tabla 1) usando los marcos Evidence to Decision (EtD) de la metodología GRADE6,7. Para ello, se tuvo en consideración: 1) Prioridad del problema, 2) Exactitud de la prueba, 3) Beneficios y daños, 4) Importancia de los desenlaces, 5) Balance, 6) Uso de recursos, 7) Equidad, 8) Aceptabilidad, y 9) Factibilidad. Luego de discutir estos criterios para cada pregunta, el GEG formuló las recomendaciones por consenso o por mayoría simple.
Puntos de buena práctica clínica: El GEG formuló puntos de buena práctica clínica (BPC), usualmente en base a su experiencia clínica. Los puntos BPC se presentan en la Tabla 1 y su justificación se encuentra disponible en la versión “in-extenso” de la presente GPC (http://www.essalud.gob.pe/ietsi/guias_pract_clini.html).
Revisión por expertos externos: La presente GPC fue revisada en reuniones con médicos especialistas representantes de otras instituciones y tomadores de decisiones. Asimismo, su versión “in-extenso” fue enviada por vía electrónica a expertos externos para su revisión (mencionados en la sección de agradecimientos). El GEG tuvo en cuenta los resultados de estas revisiones para modificar las recomendaciones finales.
Aprobación de la GPC: La presente GPC fue aprobada para su uso en EsSalud, con Resolución N° 132 - IETSI - ESSALUD - 2019.
Actualización de la GPC: La presente GPC tiene una vigencia de tres años. Al acercarse al fin de este período, se procederá a realizar una RS de la literatura para decidir sobre su actualización.
Tabla 1 Lista de recomendaciones y puntos de buena práctica clínica
| Enunciado | Tipo * | Certeza ** | ||
| Diagnóstico | ||||
| Pregunta 1: En los pacientes con artralgia, ¿cuáles son las características clínicas que determinan un alto riesgo para progresión de Artritis Reumatoide? | ||||
| Rec1.1 | En aquellos pacientes que consultan por artralgia y que no tienen evidencia de artritis clínica u otro diagnóstico que explique la misma, se considerará como artralgia clínicamente sospechosa (ACS) para progresión hacia AR, si cumple por lo menos 3 criterios de ACS establecidos por la EULAR. | Recomendación condicional a favor | Baja (⊕⊕⊝⊝) | |
| Para clasificar a un paciente con ACS para progresión hacia AR, debe cumplir 3 criterios de ACS establecidos por el EULAR, siendo al menos uno de ellos, un criterio de examen físico. | BPC | |||
| Los pacientes que cumplan la definición de ACS deben ser referidos a un hospital que cuente con un médico especialista en Reumatología. | BPC | |||
| Los pacientes con artralgia que han sido clasificados como ACS pero que no tienen evidencia de artritis, deberán ser monitorizados cada 3 meses por un periodo de al menos 2 años por consulta externa de reumatología. | BPC | |||
| Los pacientes que no cumplan con los criterios de ACS establecidos por el EULAR, pero donde el médico aún persista con la sospecha de ACS; deberán ser monitorizados cada 3 meses por mínimo 1 año por consultorio externo de reumatología. | BPC | |||
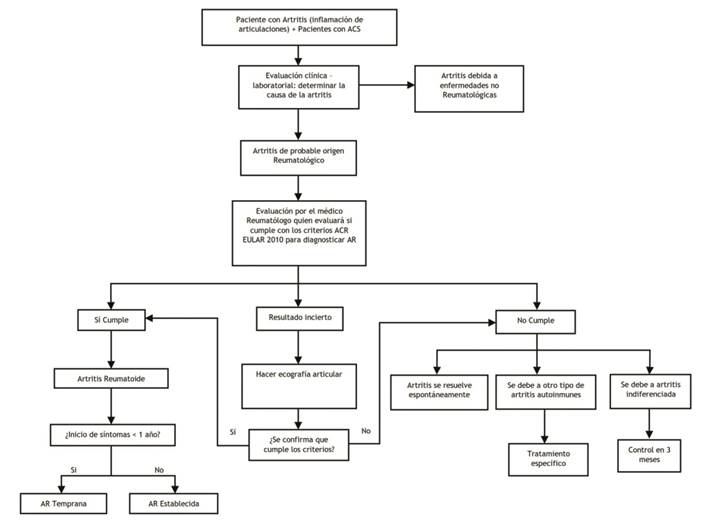
| Pregunta 2: En los pacientes con artritis temprana ¿cuál es la mejor herramienta diagnóstica para confirmar Artritis Reumatoide? | ||||
| Se establecerá como definición de caso de artritis, a aquel paciente que presente hinchazón en alguna articulación, y que además este asociado a dolor articular o rigidez articular. | BPC | |||
| Todos los pacientes que acudan por artritis deben ser evaluados clínicamente y con exámenes de auxiliares, para descartar una etiología no reumatológica como causa principal de la artritis. | BPC | |||
| Los pacientes con artritis y con sospecha de etiología reumatológica deben ser evaluados por un médico reumatólogo, idealmente dentro de las 6 semanas de la aparición de los síntomas. | BPC | |||
| Rec2.1 | En aquellos pacientes que consultan por artritis se recomienda usar los criterios de clasificación de AR del ACR/EULAR 2010 | Recomendación fuerte a favor | Moderado (⊕⊕⊕⊝) | |
| Los pacientes con artritis que no alcancen el puntaje del ACR/EULAR 2010 para ser clasificados como AR, pero donde el médico aún persista con una alta sospecha clínica, se podría considerar el uso de ecografía articular para realizar el conteo de articulaciones inflamadas. | BPC | |||
| Los pacientes que no alcancen el puntaje de del ACR/EULAR 2010 para ser clasificados como AR, pero donde el médico aún persista con una alta sospecha clínica, se podrá usar los criterios de clasificación de AR del ACR de 1987. | BPC | |||
| Los pacientes con AR, que tengan menos de 1 año de enfermedad, serán catalogados como pacientes con AR Temprana; mientras que los pacientes que tengan más de 1 año de enfermedad serán catalogados como pacientes con AR Establecida. | BPC | |||
| Todo paciente con diagnóstico de AR, debe ser manejado por un médico especialista en reumatología. | BPC | |||
| Pregunta 3: En los pacientes con diagnóstico de Artritis Reumatoide, ¿cuál es el mejor índice para estratificar la actividad de la enfermedad? | ||||
| Rec 3.1 | En paciente con AR, se sugiere usar la escala CDAI como herramienta para evaluar la actividad de la enfermedad. | Recomendación condicional a favor | Baja (⊕⊕⊝⊝) | |
| En pacientes con AR que asisten a centros de primer o segundo nivel de atención, donde no se cuenta con un médico reumatólogo, considerar utilizar la escala RAPID III para la evaluación de la actividad de la enfermedad. | BPC | |||
| Tratamiento Médico | ||||
| Pregunta 4: En pacientes con Artritis Reumatoide, ¿qué estrategia de tratamiento se debería usar: la estrategia Treat-To-Target (T2T) o el tratamiento usual? | ||||
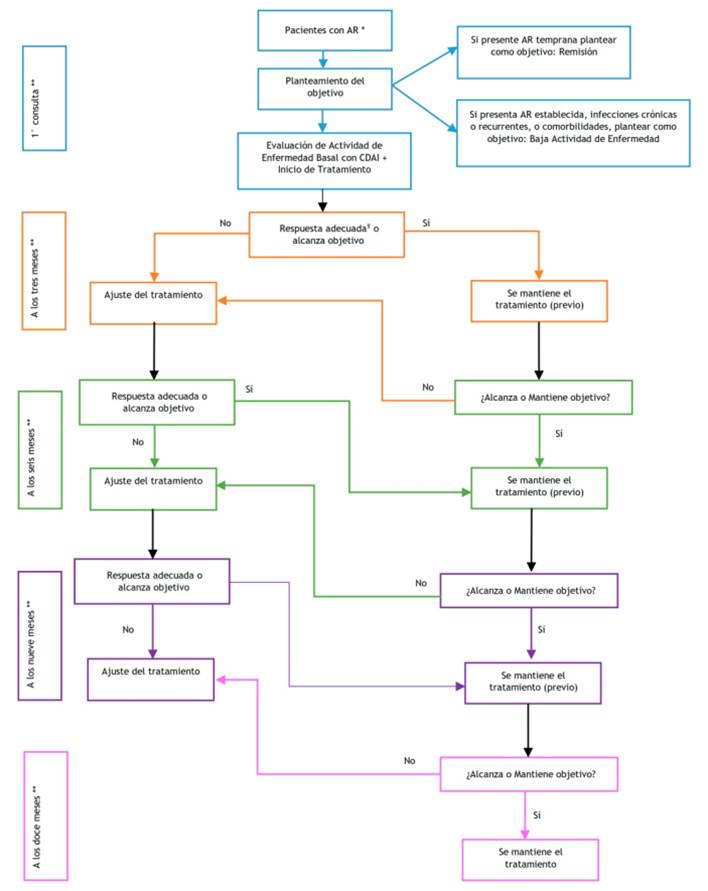
| Rec 4.1 | Para el manejo terapéutico de pacientes con Artritis Reumatoide, se sugiere utilizar la estrategia T2T. | Recomendación condicional a favor | Muy Baja (⊕⊝⊝⊝) | |
| En pacientes con Artritis Reumatoide temprana, el objetivo del tratamiento debe ser: “remisión clínica”. | BPC | |||
| En pacientes con Artritis Reumatoide establecida, con comorbilidades y/o infecciones crónicas o recurrentes, el objetivo del tratamiento puede ser: “baja actividad de enfermedad”. | BPC | |||
| En pacientes con Artritis Reumatoide que inicien tratamiento con la estrategia T2T, las evaluaciones médicas se programarán cada mes hasta alcanzar el objetivo terapéutico. | BPC | |||
| En cada evaluación médica, se evaluará la actividad de enfermedad según la escala recomendada. | BPC | |||
| La necesidad de cambio o ajuste del tratamiento se evaluará, en base al índice de actividad de la enfermedad cada 3 meses. | BPC | |||
| El cambio o ajuste del tratamiento se dará con un mínimo de 3 meses de inicio o ajuste de tratamiento previo. | BPC | |||
| El cambio o ajuste de tratamiento se dará cuando no se haya evidenciado una mejoría de al menos el 50% a los 3 meses, o no se haya alcanzado el objetivo del tratamiento a los 6 meses de inicio o cambio de tratamiento | BPC | |||
| En pacientes con AR que hayan alcanzado remisión, se debe mantener el tratamiento con FARME por un tiempo no menor a 2 años y luego iniciar desescalamiento del mismo. | BPC | |||
| Pregunta 5: En pacientes con diagnóstico de Artritis Reumatoide ¿se debería iniciar el tratamiento con monoterapia o terapia combinada con FARMEsc? | ||||
| En pacientes con diagnóstico de AR, de debe iniciar la terapia con FARMEsc tan pronto como sea posible, idealmente dentro de los primeros 3 meses de iniciada la enfermedad. | BPC | |||
| Rec5.1 | En pacientes con AR sin tratamiento previo con FARME, se recomienda iniciar tratamiento con monoterapia basada en FARMEsc. | Recomendación fuerte a favor | Baja (⊕⊕⊝⊝) | |
| Rec5.2 | En pacientes con AR sin tratamiento actual con FARME, pero con antecedente de tratamiento previo favorable con FARMEsc, se sugiere iniciar tratamiento con monoterapia basada en FARMEsc. | Recomendación condicional a favor | Muy Baja (⊕⊝⊝⊝) | |
| Rec5.3 | En pacientes con AR sin tratamiento actual con FARME, con antecedente de tratamiento previo con FARMEsc y respuesta inadecuada a los mismos, se sugiere iniciar tratamiento con terapia combinada basada en FARMEsc. | Recomendación fuerte a favor | Baja (⊕⊕⊝⊝) | |
| Pregunta 6: En pacientes con Artritis Reumatoide en los que se decide administrar monoterapia con FARMEsc ¿Cuál FARMEsc es más clínicamente efectivo y seguro? | ||||
| Rec 6.1 | En pacientes con diagnóstico de AR, se recomienda iniciar monoterapia con MTX como tratamiento de primera elección. | Recomendación fuerte a favor | Baja (⊕⊕⊝⊝) | |
| En los pacientes con AR que nunca han recibido FARMEsc y se inicie monoterapia con MTX, la dosis inicial debe ser 7.5 a 10 mg por semana, e ir aumentando paulatinamente 5 mg por mes, hasta llegar a una dosis máxima de 25 a 30 mg/semanales, según tolerancia y actividad de la enfermedad. | BPC | |||
| En los pacientes con AR sin ningún tratamiento actual con FARME, pero con antecedente de haber recibido algún FARMEsc; se sugiere iniciar MTX con una dosis inicial de 15 mg por semana, e ir aumentando 5 mg por mes, hasta llegar como máximo a 25 a 30 mg/semanales, según tolerancia y actividad de la enfermedad. | BPC | |||
| En pacientes con AR que estén usando monoterapia oral con MTX, cuando la dosis del mismo sea > 15 mg/semanales y existan efectos adversos gastrointestinales, se podría pasar a MTX subcutáneo para optimizar adherencia y biodisponibilidad del tratamiento. | BPC | |||
| Antes de iniciar el tratamiento con MTX, se debe realizar una valoración clínica basal de factores de riesgo para toxicidad del mismo, pruebas de transaminasas (TGO y TGP), urea, creatinina, radiografía de tórax y hemograma. | BPC | |||
| Las mujeres en edad fértil deben recibir consejería y coordinar con su médico un método anticonceptivo eficaz. El uso de MTX está contraindicado en el embarazo, por tal motivo si la paciente llegara a concebir, se debe interrumpir el uso de MTX y reevaluar el caso de manera multidisciplinaria. | BPC | |||
| Rec 6.2 | Cuando se inicie el tratamiento con MTX, se debe añadir siempre ácido fólico a una dosis mínima de 5 mg por semana. | Recomendación fuerte a favor | Baja (⊕⊕⊝⊝) | |
| Si al inicio del tratamiento con MTX, la respuesta no es la adecuada y/o es poco tolerado; valorar cambiar la dosis inicial o partir la dosis total diaria, cambiar la velocidad del incremento de la dosis, aumentar la dosis de ácido fólico, y evaluar la co-medicación que pueda alterar los niveles séricos de MTX. | BPC | |||
| Se suspenderá la administración de MTX si las transaminasas sobrepasan 2 veces el valor normal. Luego de una evaluación de posibles causas de hepatotoxicidad; se podrá reinstaurar la medicación cuando los valores de las transaminasas se hayan normalizado, con una vigilancia estrecha de TGP/TGO y con una dosis menor a la anterior. | BPC | |||
| Rec 6.3 | En aquellos pacientes que tengan contraindicación para usar MTX, o tengan que suspenderlo indefinidamente por los efectos adversos; se sugiere iniciar monoterapia con LEF o SSZ, como terapias alternativas de segunda elección. | Recomendación condicional a favor | Baja (⊕⊕⊝⊝) | |
| En los pacientes en los que se decide iniciar terapia con LEF, la dosis inicial debe ser desde 20 mg por día. | BPC | |||
| En los pacientes en los que se decida administrar SSZ, la dosis mínima inicial debe ser de 500 mg dos veces por día en la primera semana, luego ir aumentando 500 mg por semana, como máximo hasta 3 gramos por día según tolerancia. | BPC | |||
| Pregunta 7: En pacientes con Artritis Reumatoide en los que se decide administrar terapia combinada, ¿Cuál terapia combinada con FARMEsc es la más clínicamente efectiva y segura? | ||||
| Rec 7.1 | En pacientes con diagnóstico de AR, se sugiere utilizar una terapia combinada doble o triple, cuando exista una respuesta inadecuada a la terapia a los 3 meses o cuando no se haya alcanzado el objetivo del tratamiento a los 6 meses | Recomendación condicional a favor | Muy baja (⊕⊝⊝⊝) | |
| Rec 7.2 | En pacientes con diagnóstico de AR, en los que se decide iniciar terapia combinada doble, se sugiere usar terapias basadas en MTX como las de primera elección: MTX más SSZ o MTX más LEF o MTX más HCQ | Recomendación condicional a favor | Muy baja (⊕⊝⊝⊝) | |
| Rec 7.3 | En pacientes con diagnóstico de AR, en los que se decide iniciar terapia combinada triple, se sugiere usar: MTX más HCQ más SSZ | Recomendación condicional a favor | Baja (⊕⊕⊝⊝) | |
| Se debe vigilar la toxicidad ante el uso de FARMEsc especialmente a nivel hematológico, hepático y pulmonar | BPC | |||
| En los pacientes en los que se decide usar HCQ, la dosis no debe ser > 5mg/kg; y si se decide usar CQ la dosis no debe ser > 2.3mg/kg. | BPC | |||
| En los pacientes en los que se decide usar HCQ o CQ, se debe realizar siempre una evaluación oftalmológica basal y luego del quinto año de tratamiento si es que no existen factores de riesgo. Si existen factores de riesgo para enfermedad macular (enfermedad renal con tasa de filtración glomerular disminuida, uso de tamoxifeno, ingestión de dosis mayores a 5mg/kg de HCQ y mayores a 2.3mg/kg de CQ), las evaluaciones oftalmológicas deben realizarse anualmente | BPC | |||
| Se puede considerar la reducción de la dosis de alguno de los FARMEsc en terapias combinadas, en el contexto de toxicidad hepática siempre y cuando no haya compromiso significativo de la eficacia del tratamiento. | BPC | |||
| Pregunta 8: En pacientes con Artritis Reumatoide, ¿el uso de Corticoides Sistémicos es clínicamente efectivo y seguro? | ||||
| Rec 8.1 | En pacientes con diagnóstico de AR, que inicien tratamiento con FARMEsc o cambien el tratamiento a otro esquema de FARMEsc por respuesta inadecuada, se sugiere el uso de CS a bajas dosis en las mañanas (prednisona ≤ 7.5 mg/día), idealmente durante 2 a 3 meses, y no por más de 6 meses. | Recomendación condicional a favor | Baja (⊕⊕⊝⊝) | |
| Se debe evaluar siempre las comorbilidades subyacentes y los factores riesgo de complicaciones del uso de CS en los pacientes con AR. | BPC | |||
| Si se decide iniciar CS, pero el paciente tiene comorbilidades importantes que podrían verse exacerbadas por el uso de CS, se deberá realizar un monitoreo y manejo estrecho de las comorbilidades con los médicos especialistas respectivos. | BPC | |||
| Si luego de 3 meses el paciente sigue usando CS se deberá valorar el uso de suplemento de vitamina D, calcio y terapia con anti-resortivos. | BPC | |||
| La metilprednisolona parenteral y el uso de dosis altas de corticoides sistémicos podrían ser usados en pacientes con actividad severa y/o compromiso sistémico o extraarticular, luego de lo cual se debería utilizar una estrategia para de-escalar la dosis y no prolongar su uso por más de 6 meses. | BPC | |||
| Pregunta 9: En pacientes con Artritis Reumatoide, ¿el uso de Corticoides Locales Intraarticulares es clínicamente efectivo y seguro? | ||||
| Rec 9.1 | En pacientes con AR activa en los que se ha iniciado terapia con FARME, se está cambiando de terapia, o tengan alguna articulación persistentemente inflamada, se sugiere el uso de corticoide intraarticular. | Recomendación condicional a favor | Muy Baja (⊕⊝⊝⊝) | |
| En articulaciones grandes se dará la dosis de 40-50 mg de acetonida de triamcinolona o equivalentes | BPC | |||
| En articulaciones medianas se dará la dosis de 20-25 mg de acetonida de triamcinolona o equivalentes | BPC | |||
| En articulaciones pequeñas se dará dosis de 10-15 mg de acetonida de triamcinolona o equivalentes | BPC | |||
| No se debería realizar más de tres infiltraciones IA por año | BPC | |||
| Pregunta 10: En pacientes con Artritis Reumatoide que alcanzaron la remisión clínica, ¿Se debería utilizar la ecografía como método para confirmar la remisión clínica? | ||||
| Rec 10.1 | En pacientes con Artritis Reumatoide, se sugiere realizar ecografía articular tipo Doppler para confirmar remisión. | Recomendación condicional a favor | Muy Baja (⊕⊝⊝⊝) | |
| En la evaluación ecográfica de pacientes con Artritis Reumatoide en remisión clínica se debería utilizar las técnicas ecográficas recomendadas por EULAR y las definiciones de líquido sinovial, hipertrofia sinovial y tenosinovitis, desarrolladas por OMERACT | BPC | |||
| En la evaluación ecográfica de pacientes con Artritis Reumatoide en remisión clínica se debe considerar al menos 7 articulaciones: muñeca, 2º y 3º metacarpofalángicas, 2º y 3º falanges proximales y 2º y 5º MTF del lado dominante, según la escala US7. | BPC | |||
| Para la determinación de actividad de enfermedad se debe utilizar la escala semicuantitativa (grado 0 a 3) propuesta por OMERACT que se presenta en la tabla 4 y considerar positivo cuando que el puntaje obtenido en la evaluación sea ≥ 1. | BPC | |||
| La evaluación ecográfica, debe incluir ecografía en escala de grises y l hallazgo de sinovitis de grado mayor o igual a 1 debe según la escala semicuantitativa propuesta por OMERACT que se presenta en la tabla 4, debe ser considerado como sinovitis positiva y tomarse en cuenta en la confirmación de remisión. | BPC | |||
* Recomendación ® o punto de BPC (BPC)
** La certeza de la evidencia solo se establece para las recomendaciones, mas no para los puntos de BPC
ACS: Artralgia Clínicamente Sospechosa, AR: Artritis Reumatoide, CDAI: Clinical Disease Activity Index, RAPID III: Routine Assessment of Patient Index Data, FARMEsc: Fármacos Modificadores de Enfermedad sintético convencional, MTX: Metotrexate, SSZ: Sulfasalazina, LEF: Leflunomida, HCQ: Hidroxicloroquina, CQ: Cloroquina.
Tabla 2 Significado de los niveles de certeza de la evidencia y de la fuerza de la recomendación
| Categorías | Significado |
|---|---|
| Certeza de la evidencia | |
| (⨁⨁⨁⨁) Alta | Es muy probable que el verdadero efecto sea similar al efecto estimado. |
| (⨁⨁⨁◯) Moderada | Es moderadamente probable que el verdadero efecto sea similar al efecto estimado, pero es posible que sea sustancialmente diferente |
| (⨁⨁◯◯) Baja | Nuestra confianza en el efecto es limitada. El verdadero efecto podría ser sustancialmente diferente al efecto estimado |
| (⨁◯◯◯) Muy baja | Nuestra confianza en el efecto es pequeña. El verdadero efecto probablemente sea sustancialmente diferente al efecto estimado |
| Fuerza de la recomendación | |
| Recomendación fuerte | El GEG considera que todos o casi todos los profesionales que revisan la evidencia disponible seguirían esta recomendación. En la formulación de la recomendación se usa el término “se recomienda” |
| Recomendación Condicional | El GEG considera que la mayoría de los profesionales que revisan la evidencia disponible seguirían esta recomendación, pero un grupo de profesionales podría optar por no aplicarlas en alguna población particular, siempre que sea justificado. En la formulación de la recomendación se usa el término “se sugiere” |
Tabla 3 Criterios de Artralgia clínicamente sospechosa (ACS) de progresar a AR
| Nº | Criterios de Artralgia clínicamente sospechosa (ACS) de progresar a AR (*) |
| 1 | Síntomas articulares de inicio reciente (duración <1 año) |
| 2 | Síntomas localizados en articulaciones metacarpofalángicas (MCF) |
| 3 | Duración de la rigidez matinal (≥ a 60 min) |
| 4 | Síntomas más severos se presentan al inicio de la mañana |
| 5 | Presencia de un familiar de primer grado con AR |
| 6 | Dificultad para hacer puño |
| 7 | Prueba de compresión positiva de las articulaciones MCF |
(*) Para considerar ACS el paciente debe presentar al menos tres de los siete criterios de EULAR.
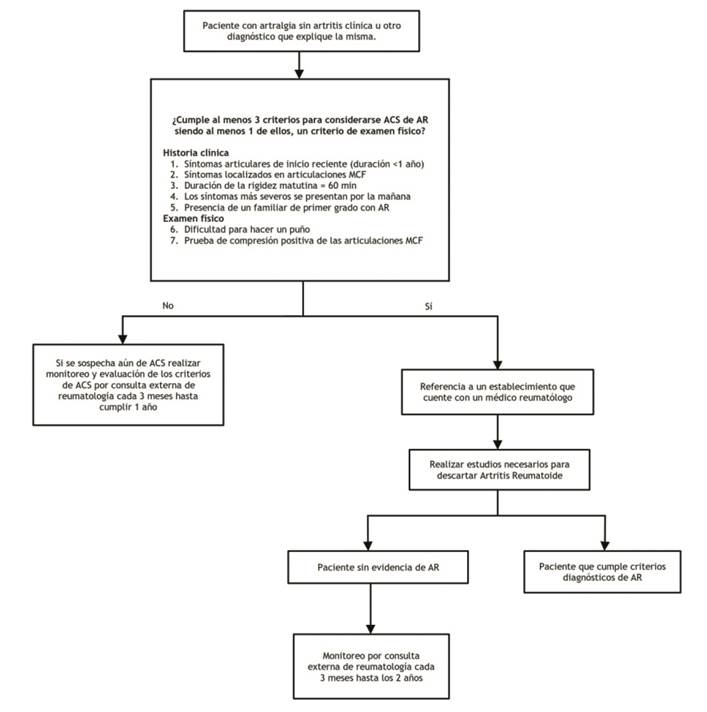
Figura 1 Flujograma para identificación de los pacientes con Artralgia Clínicamente Sospechosa (ACS) de progresión a AR
Resultados y Discusión:
La presente GPC aborda 10 preguntas clínicas, en base a las cuales se formularon 16 recomendaciones (5 fuertes y 11 condicionales), 45 BPC, y 3 flujogramas dos de diagnóstico y uno de manejo) (Tabla 1, Figura 1, Figura 2 y Figura 3). En el presente artículo se exponen las recomendaciones emitidas y un resumen del razonamiento seguido para cada una, mientras que la justificación de los BPC se encuentra en la versión “in-extenso” (http://www.essalud.gob.pe/ietsi/guias_pract_clini.html). Los datos numéricos para cada desenlace se exponen en las tablas de SoF (Material suplementario 2).
Pregunta 1: En los pacientes con artralgia, ¿cuáles son las características clínicas que determinan un alto riesgo de progresar a artritis reumatoide (AR)?
La fase clínica de la AR puede implicar la presencia de síntomas inespecíficos (como las artralgias)8 sin una traducción clínica (o tumefacción articular). La artralgia clínicamente sospechosa (ACS), es aquella que tiene ciertas características (determinadas habitualmente por la experiencia del clínico) que aumentarían el riesgo para un inminente desarrollo de una AR9 y su detección podría favorecer el diagnóstico y manejo precoz de la AR previniendo consecuencias adversas10,11; por ello se hace necesario una definición adecuada para su detección y evitar la heterogeneidad en su uso12.
Evidencia: Se realizó una búsqueda sistemática, encontrando solo un estudio observacional de la European League Against Rheumatism (EULAR)13 en el cual se preseleccionaron siete criterios clínicos (Tabla 3), los cuales al ser aplicados a 139 (78 con ACS y 61 con artralgia sin ACS) con ACS, según diferentes criterios definidos por expertos clínicos , se encontró que la presencia de al menos dos de los siete criterios tenía una sensibilidad de 98,4% y una especificidad de 53,8% para detectar ACS; mientras que con la presencia de al menos tres criterios la sensibilidad fue de 90,2% y la especificidad ascendió a 74,4%; y con la presencia de al menos cuatro criterios la sensibilidad disminuyó a 70,5% y la especificidad ascendió a 93,6%.
Recomendación-1.1: El GEG consideró que el balance entre sensibilidad y especificidad de presentar al menos tres de los siete criterios de EULAR era adecuado para detectar ACS, por ende, emitió una recomendación a favor de su uso. Debido a que la certeza de la evidencia fue baja, se emitió una recomendación condicional.
Pregunta 2: En los pacientes con artritis temprana ¿cuál es la mejor herramienta diagnóstica para confirmar AR?
La definición de la AR se realiza a través del cumplimiento de criterios de clasificación diagnóstica (debido a que no hay una prueba única que la confirme). Estos criterios deben usarse en la práctica clínica para detectar formas precoces de enfermedad (deben tener una adecuada sensibilidad, pero conservando su especificidad, cuando se comparan con definiciones “estándares” que definen la presencia de AR). Diferentes propuestas de criterios se han efectuado a lo largo el tiempo, como la realizada por el American College of Reumathology (ACR) en 1987 (ACR87) o la más reciente del año 2010, dado por la coalición ACR/EULAR14 por lo que debe establecerse si son adecuados para definir presencia de AR
Evidencia: Se realizó una búsqueda sistemática y se encontró 13 RS, de las cuales se seleccionó la de Radner 201415, por ser la más reciente y evaluar los desenlaces buscados. Dicha RS meta-analizó cinco estudios con diferentes estándares de referencia para la definición de presencia de AR y se encontró que los criterios del ACR/EULAR del 2010 tuvieron una sensibilidad de 82% y especificidad de 61% Así mismo, se meta-analizó otros ocho estudios que compararon los criterios ACR/EULAR del 2010 contra los criterios de ACR 1987 y halló que los criterios ACR/EULAR del 2010 tenían mayor sensibilidad (+11%) y comparable especificidad (-4%) a los criterios de ACR87.
Recomendación-2.1: La evidencia sugiere que los criterios de ACR/EULAR del 2010 tendrían una adecuada sensibilidad respecto a definiciones estándares para definir presencia de AR y mayor sensibilidad respecto a la definición tradicional del ACR87, por ende, se emitió una recomendación a favor de su uso. Debido a que la certeza de la evidencia fue moderada, se emitió una recomendación fuerte.
Pregunta 3: En los pacientes con diagnóstico de AR, ¿cuál es la mejor escala para estratificar la actividad de la enfermedad?
La medición de la actividad de la enfermedad mediante escalas es una herramienta útil en el manejo de la AR, debido a que cuantifica y clasifica el estado clínico del paciente (en categorías de remisión, actividad baja, moderada y alta) y permiten en base al resultado tras su aplicación, tomar decisiones sobre el tratamiento. Existen diversas escalas que pueden ser usadas. Entre ellas la Clinical Disease Activity Index (CDAI), Disease Activity Score 28 (DAS28), y Simplified Disease Activity Index (SDAI) y Routine Assessment of Patient Index Data 3 (RAPID-3) y la Patient Activity Scale-II (PAS-II) han sido recientemente recomendadas16.
Evidencia: Se realizó la búsqueda sistemática de RS que evaluaran las escalas habitualmente usadas dentro de nuestro contexto: CDAI, DAS28, y SDAI y se hallaron dos RS que analizaron los desenlaces de interés. La RS de Gaujoux-Viala 201217 reportó un índice kappa (reproducibilidad/concordancia) similar entre DAS28 y SDAI (0,68), y entre DAS28 y CDAI (0,67) para identificar baja actividad de la enfermedad. También encontró una correlación similar al comparar la escala CDAI vs. DAS28 (coeficiente 0,89) y SDAI vs DAS28 (coeficiente 0,91). Así mismo, la RS de Anderson 201218 encontró que el tiempo de evaluación promedio que usa el médico fue de menos de dos minutos con el CDAI, de aproximadamente dos minutos con el SDAI, y de tres a cinco minutos con el DAS28.
Recomendación-3.1: La evidencia no mostró diferencias significativas entre las escalas; sin embargo, el GEG consideró que la escala CDAI, es una de las más usadas y aceptadas por los reumatólogos en nuestro contexto, no incluye estudios de laboratorio, (a diferencia de SDAI y DAS28), requiere menor tiempo para su ejecución y es la más factible de implementar. Por ende, se emitió una recomendación a favor del uso de CDAI. Debido a que la certeza de la evidencia fue baja, se emitió una recomendación condicional.
Pregunta 4: En pacientes con AR, ¿se debería usar la estrategia Treat-To-Target (T2T) o el tratamiento usual?
A diferencia del manejo usual , la estrategia T2T involucra establecer un objetivo claro en el tratamiento de la AR (remisión clínica idealmente o baja actividad de la enfermedad alternativamente), y evaluar estricta y frecuentemente dicho objetivo con las escalas de actividad aceptadas, para ajustar el tratamiento de acuerdo a los resultados obtenidos (según un protocolo establecido)19.
Evidencia: La búsqueda sistemática arrojó cinco RS, y se seleccionó la realizada por la GPC NICE 20183 por ser la de mayor calidad metodológica. Esta RS encontró que la estrategia T2T se asoció con mayor probabilidad de alcanzar remisión, calidad de vida (medido por la escala SF12 en su componente físico) y menor probabilidad progresión radiológica (medido por le score Sharp Van der Heijde), en comparación con el manejo usual. No se encontraron diferencias en otros desenlaces como baja actividad de enfermedad definida por DAS28, mejoría en la capacidad funcional y calidad de vida en el componente mental (escala SF 12).
Recomendación-4.1: Debido a que la evidencia señala mayores beneficios con el uso de T2T, el GEG emitió una recomendación a favor de su uso. Así mismo, debido a que el tamaño de los efectos encontrados fue pequeño y la certeza de la evidencia fue muy baja, se emitió una recomendación condicional.
Pregunta 5: En pacientes con AR ¿se debería iniciar el tratamiento con monoterapia o terapia combinada con fármacos modificadores de la enfermedad sintéticos convencionales (FARMEsc)?
Los fármacos modificadores de la enfermedad sintéticos se dividen en dos grupos: los dirigidos (FARMEsd) y los convencionales (FARMEsc). Estos últimos están disponibles en nuestro contexto y los más usaos actualmente son el Metotrexate (MTX), Leflunomida (LEF), hidroxicloroquina/cloroquina (HCQ/CQ) y Sulfasalazina (SSZ); también se encuentran en este grupo otros medicamentos como: azatioprina (AZA), ciclosporina (CsA) y sales de oro; actualmente relegados por los primeros debido a su mejor perfil de seguridad. La elección de iniciar esquemas de tratamiento debe ser personalizadas según el perfil de cada paciente, pero es necesario tener recomendaciones sobre las drogas con mejor perfil de efectividad y seguridad.
Evidencia: De un total de once RS encontradas, se seleccionaron cuatro20-23 por ser las más recientes. Estas incluyeron pacientes sin tratamiento previo con FARMEsc y con tratamiento previo tanto exitoso como fallido.
En pacientes nunca antes tratados con FARMEsc o con monoterapia previa exitosa, la monoterapia (MTX o SSZ o LEF) tuvo similar eficacia que las terapias combinadas (MTX+SSZ o MTX+LEF) para remisión, funcionalidad, control de actividad de la enfermedad, respuesta y progresión radiológica20-22,24. En cuanto a seguridad, la monoterapia con MTX tuvo una similar incidencia de abandono por eventos adversos que las terapias combinadas; sin embargo, la terapia con MTX + LEF incrementó el riesgo de hepatotoxicidad20. En pacientes con falla previa a tratamiento con monoterapia , los estudios reportaron mayor eficacia de las terapias combinadas con respecto a las monoterapias para los desenlaces remisión20, respuesta21,22 y actividad de la enfermedad25. No se halló evidencia para eventos adversos.
Recomendación-5.1 y 5.2: La evidencia señala que, en pacientes nunca antes tratados o con tratamiento previo exitoso con FARMEsc, la monoterapia es similar a la terapia combinada, por lo que se emitió una recomendación a favor de la monoterapia en ambas poblaciones. Sin embargo, la fuerza de la recomendación fue diferente para ambas poblaciones. Para los pacientes nunca antes tratados, a pesar de que la evidencia fue de certeza baja, se emitió una recomendación fuerte, porque se consideró que la monoterapia sería más más aceptable para una buena adherencia de los pacientes sin tratamiento previo, además de ser menos costosa que la terapia combinada. Por otro lado, en pacientes con tratamiento previo exitoso con FARMEsc, se emitió, una recomendación condicional, debido a que la certeza de la evidencia fue muy baja.
Recomendación-5.3: En pacientes con falla previa a tratamiento con monoterapia de FARMEsc, las terapias combinadas resultaron más efectivas que la monoterapia, por ende, se emitió una recomendación a favor de su uso. A pesar que la certeza de evidencia fue baja, se emitió una recomendación fuerte, debido a ser la única opción disponible en pacientes en los que la monoterapia ha fallado.
Pregunta 6: En pacientes con AR en los que se decide administrar monoterapia con FARMEsc ¿Cuál FARMEsc es más clínicamente efectivo y seguro?
Los FARMEsc más frecuentemente utilizados actualmente son el MTX, SSZ y LEF; sin embargo, la elección del tipo de FARME puede variar dependiendo de su perfil de eficacia y seguridad por lo que se deben tener recomendaciones al respecto.
Evidencia: Se realizó una búsqueda sistemática, y se encontraron 17 RS, de las cuales se seleccionaron seis20,24,26-29 debido a que tenían una mejor calidad metodológica.
La evidencia encontrada señala que las monoterapias con MTX, LEF o SSZ son similares en términos de remisión20, respuesta en la actividad de la enfermedad26 y funcionalidad27, así como en efectos adversos28. También se halló que la suplementación con ácido fólico, disminuye la frecuencia de eventos adversos causados por MTX28.
Recomendación-6.1: Debido a que la evidencia no señala diferencias entre las monoterapias, el GEG emitió una recomendación a favor del uso del MTX, dado que es el de menor costo. A pesar de que la certeza de la evidencia fue baja, el GEG consideró que el bajo costo del MTX aumentaría la equidad en comparación con los otros fármacos, por ende, se decidió emitir una recomendación fuerte.
Recomendación-6.2: Dado que se halló que el ácido fólico disminuiría la frecuencia de eventos adversos por MTX, el GEG emitió una recomendación a favor de su uso con una dosis mínima de 5mg por semana (dosis señalada por consenso del GEG). A pesar de la baja certeza de la evidencia, se consideraron su bajo costo y bajo riesgo de eventos adversos importantes, y se emitió una recomendación fuerte.
Recomednación-6.2: Se tomó en cuenta a los pacientes que no pueden recibir MTX por diversas razones, y se emitió una recomendación a favor del uso de monoterapia con LEF o SSZ como terapias alternativas debido a que tienen similar balance de beneficios y daños que MTX. Sin embargo, como representan un mayor costo, se emitió una recomendación condicional.
Pregunta 7: En pacientes con AR en los que se decide administrar terapia combinada, ¿Cuál terapia combinada con FARMEsc es la más clínicamente efectiva y segura?
La evidencia disponible recomienda la utilización de un FARMEsc en monoterapia como terapia inicial; sin embargo, en los pacientes resistentes a la terapia inicial o pacientes de pobre pronóstico, es usual requerir tratamientos basados en combinación de fármacos30, por lo que se hace necesario tener recomendaciones sobre el mejor perfil e efectividad y seguridad en estos esquemas.
Evidencia: Se realizó una búsqueda sistemática y se encontró una RS que respondía la pregunta31; sin embargo, no valoraba todos los desenlaces priorizados por lo que se realizó una búsqueda de ensayos clínicos aleatorizados (ECA), encontrando tres estudios32-34 que respondían a la pregunta.
Estos estudios encontraron que la terapia combinada doble de MTX+SSZ es superior que la terapia combinada de hidroxicloroquina HCQ+SSZ y que la terapia de HCQ+MTX en términos de actividad de la enfermedad a los seis meses32,33, especialmente en pacientes con factores de pobre pronóstico o en respuesta inadecuada a la monoterapia; asimismo, se señala que la terapia combinada triple de MTX+SSZ+HCQ es superior a las terapias combinadas dobles MTX+SSZ o MTX+HCQ para el desenlace remisión, pero es similar para el desenlace erosión radiográfica31.
En cuanto a seguridad, los estudios señalan que ambas, terapias dobles o triples, tienen la misma frecuencia de eventos adversos, pero se reporta un mayor riesgo de hepatotoxicidad con el uso de terapias combinadas con LEF, especialmente en combinación con dos FARMEsc35.
Recomendación-7.1: En pacientes con respuesta inadecuada al tratamiento a los 3 meses, o en pacientes que no hayan alcanzado el objetivo del tratamiento a los 6 meses, se emitió una recomendación a favor del uso de terapia doble o triple debido a que ambas mostraron ser eficaces y seguras. El GEG señaló que se debe tener en cuenta factores de pobre pronóstico y de antecedentes de tratamiento previo con FARMEsc al momento de elegir una u otra. Puesto que la certeza de la evidencia fue muy baja, se emitió una recomendación condicional.
Recomendación-7.2: Se evidenció que el balance de beneficios y daños de las terapias combinadas dobles con MTX fue mejor que las otras combinaciones, por ende, se emitió una recomendación a favor del uso de terapias que incluyan al MTX en quienes se decida iniciar terapia combinada doble. Debido a la muy baja certeza de la evidencia, se emitió una recomendación condicional.
Recomendación-7.3: La evidencia señala que la terapia combinada triple es superior que la terapia doble, por ende, se emitió una recomendación a favor del uso de terapia triple con MTX+HCQ+SSZ, en pacientes en los que falla la terapia doble. Debido a que la certeza de la evidencia es muy baja, se emitió una recomendación condicional.
Pregunta 8: En pacientes con AR, ¿el uso de Corticoides Sistémicos (CS) es clínicamente efectivo y seguro?
Los corticoides tienen un reconocido efecto antiinflamatorio; sin embargo, no son considerados FARMEs sino terapias “puente” en el manejo de la AR, pudiendo tener beneficios cuando se asocian a los FARMEs, aunque también tiene eventos adversos conocidos, especialmente si se usan por periodos largos.
Evidencia: En la búsqueda sistemática, se encontraron 12 RS, de las cuales se seleccionaron cinco20,36-39, por ser las de mejor calidad metodológica. En cuanto a efectividad, estos estudios encuentran que los CS son superiores al placebo (o no tratamiento) en términos de remisión de enfermedad, respuesta37 y progresión radiológica39. Sin embargo, en cuanto a seguridad, se encontró que aumentan el riesgo de eventos cardiovasculares40 y de infecciones41, y se ha reportado disminución de densidad mineral ósea (DMO)42, especialmente cuando son administrados por largo tiempo.
Recomendación-8.1: El GEG consideró que los beneficios de los CS eran superiores a los daños, por lo que se emitió una recomendación a favor de su uso a bajas dosis y por un máximo de 6 meses (límite señalado por consenso por el GEG). Debido a la baja certeza de la evidencia y a la presencia de daños a largo plazo, se emitió una recomendación condicional
Pregunta 9: En pacientes con AR, ¿el uso de Corticoides Locales Intraarticulares (CLI) es clínicamente efectivo y seguro?
Los corticoides locales pueden administrarse como inyecciones intraarticulares y son usados ampliamente para controlar la inflamación de manera local, pueden usarse al inicio de la enfermedad mientras los FARMES hacen su efecto (que usualmente actúan más lento) o a lo largo de la misma si existen articulaciones activamente inflamadas.
Evidencia: Se realizó una búsqueda sistemática, en la cual no se halló ninguna RS, pero se encontraron cuatro ECA, de los cuales se seleccionaron dos por presentar los desenlaces de interés.
En cuanto a efectividad, el ECA Conaghan 200343 realizado en 42 pacientes con AR reporta que los CLI + MTX oral ofrecen menor duración de rigidez matutina, mayor disminución de actividad de enfermedad (usando escala análoga visual el dolor como una medida indirecta) así como menor cantidad de articulaciones inflamadas, comparado con MTX oral en monoterapia. Asimismo, el ECA de Haugeberg 201044 realizado en 40 pacientes con AR no encuentra, diferencias en la DMO del conjunto de articulaciones de la mano entre el grupo que recibió CLT + MTX y grupo que solo recibió MTX.
En cuanto a seguridad, algunos estudios observacionales señalan la existencia de efectos adversos locales (infecciones en el lugar de inyección, degeneración de epidermis, calcificaciones intraarticulares, necrosis vascular) y sistémicos (hiperglucemia post inyección, síndrome de Cushing, supresión de cortisol sérico temporal) con el uso CLI45,46.
Recomenadción-9.1: El GEG consideró que los beneficios del uso de CLI eran superiores a los daños, por ende, se emitió una recomendación a favor de su uso. Debido a que la evidencia es escasa, de muy baja certeza y existen reportes de daños adversos a largo plazo, se emitió una recomendación condicional.
Pregunta 10: En pacientes con AR y remisión clínica, ¿Se debería utilizar la ecografía para confirmar el estado de remisión?
La ecografía musculo esquelética con escala de grises (EG) y doppler poder es una herramienta útil para para diagnóstico, pronóstico o evaluación del objetivo terapéutico en pacientes con AR siendo superior a la evaluación clínica para detectar sinovitis (inflamación articular); sus defunciones e interpretación ya han sido recomendados47,48.
Evidencia: Se realizó una búsqueda sistemática, encontrando tres RS, de los cuales se seleccionó la RS de Han 201649 por reportar los desenlaces de interés, en dicho estudio se comparó el riesgo de recaída y daño estructural en pacientes con remisión clínica y sinovitis detectada por ecografía Doppler versus pacientes con remisión clínica, pero sin sinovitis demostrada por ecografía Doppler y se encontró 13 estudios concluyendo que los pacientes con remisión clínica y sinovitis detectada mediante Doppler tienen más probabilidad de recaída y de daño estructural progresivo, respecto a los que no la presentaban.
Recomendación-10.1: A pesar de que la evidencia hallada no responde directamente la pregunta planteada, el GEG reconoce que estos hallazgos son relevantes y justifican el uso de ecografía Doppler para la confirmación de remisión de la enfermedad, por lo que emitió una recomendación a favor de su uso. Debido a que la evidencia es indirecta y de muy baja certeza, se emitió una recomendación condicional.