INTRODUCCIÓN
La hemofilia es un trastorno hemorrágico congénito, poco común, complejo de diagnosticar y tratar. Esta enfermedad está vinculada al cromosoma X, originado por la deficiencia del factor VIII de coagulación (FVIII) (hemofilia A) o del factor IX (FIX) (hemofilia B). La deficiencia es el resultado de mutaciones o cambios en uno de los genes que da las instrucciones para producir las proteínas de los factores de la coagulación1.
La consecuencia principal de esta enfermedad es la discapacidad, y con ello el deterioro progresivo de la calidad de vida desde una edad muy temprana, con limitaciones en el campo laboral y sector productivo. El abordaje integral de esta enfermedad permite mejorar la calidad de vida, la inclusión social y productividad de los ciudadanos 2. Lamentablemente, la hemofilia requiere de un manejo interdisciplinario y complejo, generando el incremento de los costos en el diagnóstico y tratamiento de la hemofilia.
La Dirección de Guías de Práctica Clínica, Farmacovigilancia y Tecnovigilancia del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) del Seguro Social del Perú (EsSalud) elaboró la guía de práctica clínica (GPC) basada en evidencias para el diagnóstico, y tratamiento de hemofilia, cuyas recomendaciones y puntos de buena práctica clínica (Tabla 1) serán aplicadas por profesionales de la salud en EsSalud. El presente artículo es un resumen de dicha GPC.
METODOLOGÍA
El proceso para la elaboración de la presente GPC está detallado en su versión “in-extenso”, que se encuentra disponible la página web del IETSI de EsSalud (https://ietsi.essalud.gob.pe/guias-de-practica-clinica-2). En resumen, se siguieron las siguientes acciones para la elaboración de la GPC:
Conformación del grupo elaborador de la guía local (GEG): Se conformó un GEG, que incluyó metodólogos y médicos especialistas en hematología.
Formulación de preguntas: En concordancia con los objetivos y alcances de esta GPC, el GEG formuló 9 preguntas clínicas (Tabla 1), cada una de las cuales pudo tener una o más preguntas PICO (Population, Intervention, Comparator, Outcome). A su vez, cada pregunta PICO albergó uno o más desenlaces de interés.
Búsqueda de GPC: Se realizó una búsqueda sistemática de GPC en diferentes repositorios y base de datos. Se encontraron 6 GPC sobre el tema de interés con una adecuada calidad metodológica; sin embargo, no fueron consideradas debido a su antigüedad y a diferencias con el contexto; por ello, se decidió elaborar una GPC de novo.
Búsqueda y selección de la evidencia: Para cada pregunta PICO, se realizó la búsqueda y selección de la evidencia. Para ello, durante el 2021 se buscaron revisiones sistemáticas (RS) realizadas como parte de una GPC previa (mediante la búsqueda sistemática de GPC realizada en el punto anterior) o publicadas como artículos científicos (mediante búsquedas sistemáticas en PubMed) (Material Suplementario 1). Cuando se encontraron RS de calidad aceptable, se escogió una RS para la toma de decisiones, la cual fue actualizada cuando el GEG lo consideró necesario. Cuando no se encontró ninguna RS de calidad aceptable, se realizó una búsqueda de novo de estudios primarios.
Evaluación de la certeza de la evidencia: La certeza de la evidencia para cada desenlace de cada pregunta PICO pudo ser alta, moderada, baja, o muy baja (Tabla 2). Para evaluar la certeza de la evidencia, se siguió la metodología de Grading of Recommendations Assessment, Development and Evaluation (GRADE) y se usaron tablas de resumen de evidencias de GRADE (Material Suplementario 2) 3. Finalmente, se determinó el nivel de certeza de la recomendación más bajo los desenlaces críticos.
Formulación de las recomendaciones: El GEG revisó la evidencia seleccionada para cada pregunta clínica en reuniones periódicas, y formuló recomendaciones fuertes o condicionales (Tabla 2) usando la metodología GRADE. Para ello, se tuvo en consideración: 1) Beneficios y daños de las opciones, 2) Certeza de la evidencia, 3) Valores y preferencias de los pacientes, 4) Uso de recursos, 4) Impacto en la equidad, 5) Aceptabilidad por parte de los profesionales de salud y pacientes; y 6) Factibilidad de las opciones en los establecimientos de salud de EsSalud. Luego de discutir estos criterios para cada pregunta, el GEG formuló las recomendaciones por consenso o por mayoría simple. Asimismo, para ciertas preguntas que no pudieron ser contestadas con la evidencia actual, el GEG formuló puntos de buenas prácticas clínicas (BPC), basados en la GPC de consenso de la Federación Mundial de Hemofilia (FMH 2020) 4) y del Ministerio de Salud de Chile 2019 5.
Revisión por expertos externos: La presente GPC fue revisada en reuniones con médicos especialistas representantes de otras instituciones y tomadores de decisiones. Asimismo, su versión in-extenso fue enviada por vía electrónica a expertos externos para su revisión (mencionados en la sección de agradecimientos). El GEG tuvo en cuenta los resultados de estas revisiones para modificar las recomendaciones finales.
Actualización de la GPC: La presente GPC tiene una vigencia de tres años. Al acercarse al fin de este período, se procederá a realizar una RS de la literatura para su actualización, luego de la cual se decidirá si se actualiza la presente GPC o se procede a realizar una nueva versión.
RECOMENDACIONES
La presente GPC abordó 9 preguntas clínicas, en base a las cuales se formularon 5 recomendaciones (1 recomendación fuerte y 4 recomendaciones condicionales), 51 puntos de buena práctica clínica, y 2 flujogramas (ver Tabla 1 y Figuras 1 y 2).
A continuación, se expondrán las recomendaciones para cada pregunta clínica, así como un resumen del razonamiento seguido para llegar a cada recomendación. No se incluyó las justificaciones de los puntos de BPC, las cuales se puede leer en el documento in-extenso.
Para cada pregunta, los detalles sobre la búsqueda sistemática se exponen en el Material Suplementario 1. El balance de beneficios daños en forma de tablas Summary of Findings (SoF), así como la justificación en extenso de cada decisión en forma de tablas Evidence to Decision (EtD), se exponen en el Material Suplementario 2.
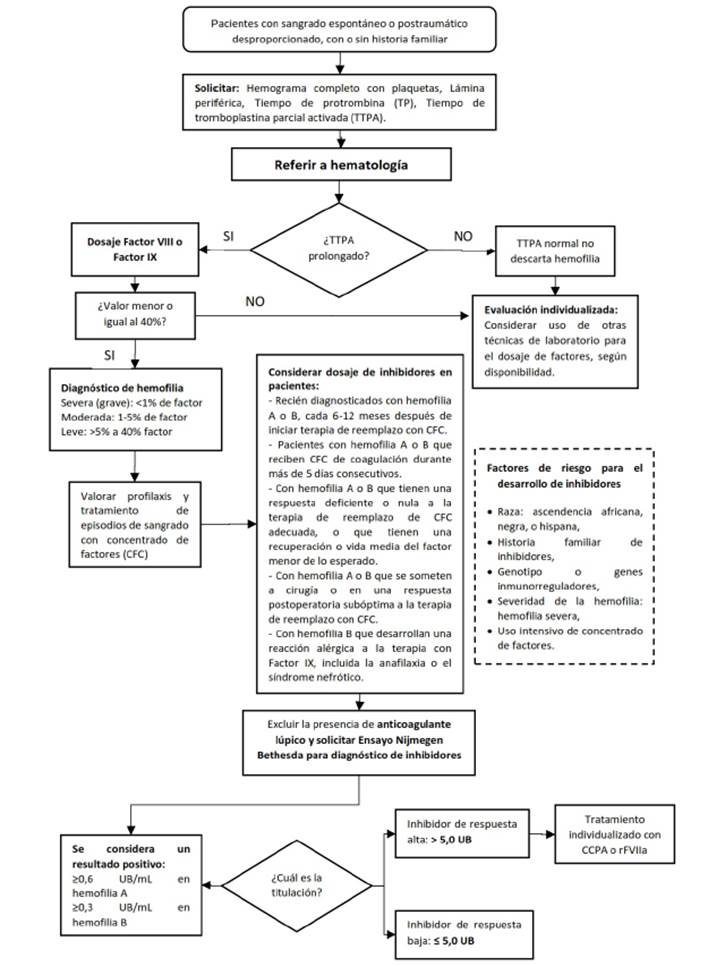
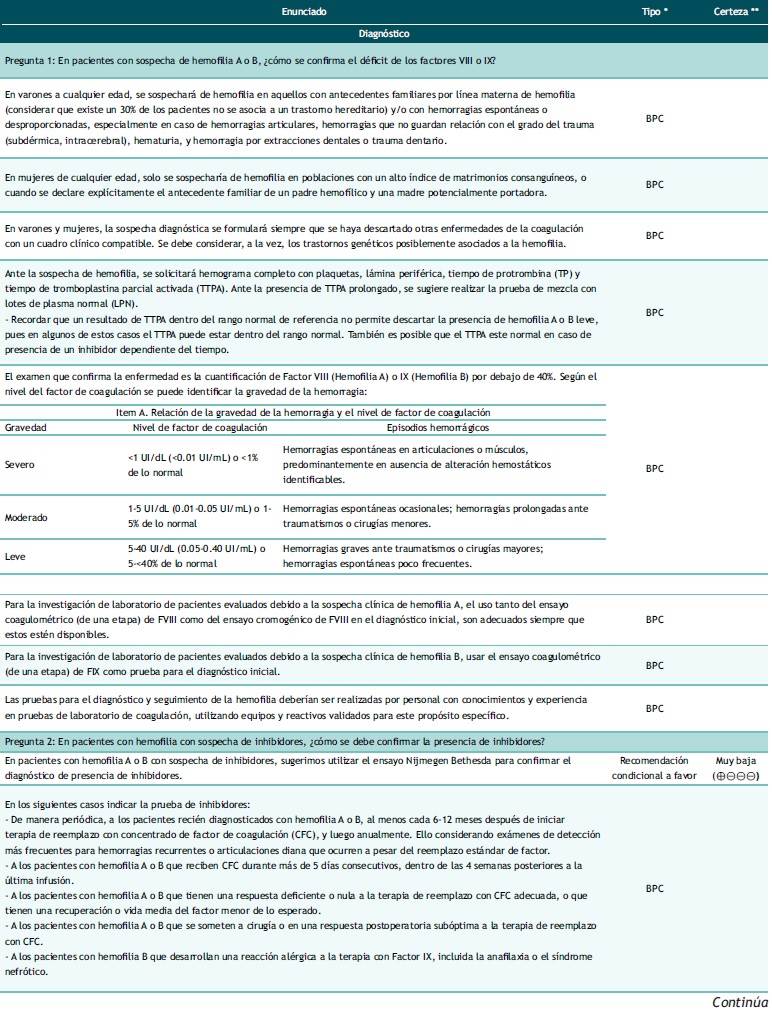
Pregunta 1: En pacientes con sospecha de hemofilia A o B, ¿cómo se confirma el déficit de los factores VIII o IX?
El diagnóstico de hemofilia A o B parte de la sospecha clínica por la presentación de hemorragias espontáneas o desproporcionadas, que afecta principalmente a varones jóvenes 4. Ante estas manifestaciones clínicas es necesario realizar pruebas de laboratorio que incluyen un hemograma completo y un perfil de coagulación, así como la cuantificación de los niveles de los factores de coagulación 5.
Existen dos metodologías de laboratorio comúnmente utilizadas para la valoración de factores de coagulación: el método coagulométrico y el método cromogénico 6,7. Para esta pregunta se realizó una búsqueda sistemática que no encontró estudios que compararan ambos métodos, y cumplan con los criterios de inclusión. Por ello, el GEG decidió emitir ocho puntos de BPC adoptados de las recomendaciones de las GPC de la Federación Mundial de Hemofilia (FMH) 6 y del Ministerio de Salud de Chile 8, ver Tabla 1.
Pregunta 2. En pacientes con hemofilia con sospecha de inhibidores, ¿cómo se debe confirmar la presencia de inhibidores?
Uno de los aspectos más desafiantes del manejo de la hemofilia es el cuidado de un paciente que desarrolla un inhibidor (un anticuerpo dirigido contra el factor infundido que inhibe la función del factor) 9. Las personas que desarrollan inhibidores tienden con el tiempo a no responder a los concentrados de factor de coagulación de reemplazo para tratar el sangrado o para proporcionar profilaxis contra el sangrado 10. Para el dosaje de anticuerpos se dispone de dos ensayos: el ensayo Bethesda clásico y el ensayo Nijmegen Bethesda que es una metodología modificada de la primera 11. Un resultado preciso del dosaje de inhibidores, permitiría una intervención oportuna con el inicio de terapia con agentes bypass 12.
Evidencia: En la búsqueda sistemática se encontró una RS 13, la cual se eligió por tener una calidad metodológica aceptable.
Hallazgos: La precisión diagnóstica para el valorar la presencia de inhibidores con las pruebas de Nijmegen Bethesda y Bethesda varía sobre la base de los títulos de anticuerpos. A menor título de inhibidores el ensayo Nijmegen podría tener una mayor exactitud, y a títulos más altos ambas pruebas podrían ser intercambiables.
Balance y fuerza: La exactitud de las pruebas para valorar la presencia de inhibidores sería similar para ambas pruebas. Sin embargo, podría ser mayor para Nijmegen Bethesda en el contexto de títulos bajos de anticuerpos. Por tal motivo, se emitió una recomendación a favor del uso del ensayo Nijmegen Bethesda. Puesto que la certeza de la evidencia es muy baja, esta recomendación fue condicional.
Además, se consideró relevante emitir cinco puntos de BPC adoptados de las recomendaciones de las GPC de la FMH 6, ver Tabla 1.
Pregunta 3. En pacientes con hemofilia A o B, ¿cuál es la herramienta de elección para valorar la salud articular?
Los instrumentos de la valoración de la salud articular, tanto gennerales como específicos para la hemofilia, permiten evaluar la naturaleza de las discapacidades físicas y las limitaciones funcionales, y su impacto en la vida de las personas con hemofilia y sus familiares 2.
Para esta pregunta se realizó una búsqueda sistemática, sin encontrar estudios que cumplan con los criterios de inclusión. Por ello, se decidió emitir cuatro puntos de BPC adoptados de las recomendaciones de las GPC de la FMH 6, ver Tabla 1.
Pregunta 4. En pacientes con hemofilia A o B, ¿cuál es el estudio de imágenes de elección para la valoración de sangrado?
Para la valoración del sangrado en los pacientes con hemofilia, es necesario el estudio mediante imágenes, con la finalidad de identificar la zona del sangrado, tomar las medidas terapéuticas necesarias para reducir el sangrado, y evaluar el compromiso del estado articular 6. Para esta pregunta, se evaluó las subpoblaciones de pacientes con hemofilia con sospecha de sangrado articular, y de pacientes con hemofilia con sospecha de sangrado intracraneal o intraabdominal o intramuscular.
Subpoblación de pacientes con hemofilia con sospecha de sangrado articular
Evidencia: En la búsqueda sistemática se encontró una RS 14, la cual se utilizó como cuerpo de la evidencia para esta pregunta.
Hallazgos: La RS incluida encontró que la exactitud diagnóstica (área bajo la curva, sensibilidad y especificidad para evaluar la sospecha del sangrado) fue óptima para la prueba diagnóstica mediante ecografía, permitiendo identificar hipertrofia sinovial y hemosiderina, hemartrosis, quistes subcondrales y líquidos en las articulaciones; esto teniendo como prueba de referencia la resonancia magnética nuclear (RMN).
Balance y fuerza: La exactitud diagnostica de la prueba de imágenes con ecografía fue muy óptima. Por ello, la dirección fue a favor de su uso. Puesto que la certeza de la evidencia fue muy baja, esta recomendación fue condicional.
Subpoblación de pacientes con hemofilia con sospecha de sangrado intracraneal o intraabdominal o intramuscular
Para esta subpoblación se realizó una búsqueda sistemática, sin embargo, no se encontraron estudios que cumplan con los criterios de inclusión. Por ello, se consideró relevante emitir dos puntos de BPC adaptados de las recomendaciones de las GPC de la FMH 6, ver Tabla 1.
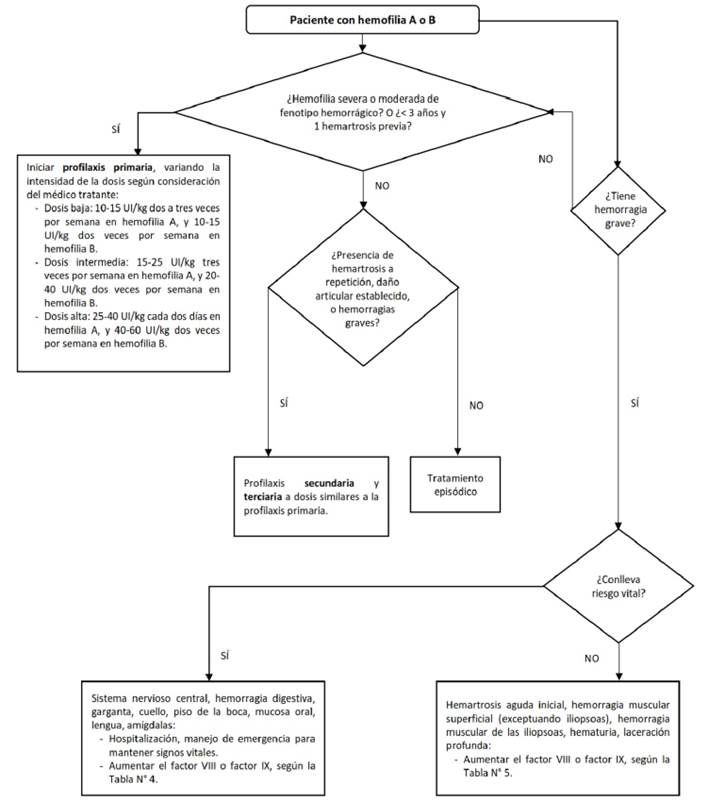
Pregunta 5. En pacientes con hemofilia A o B, ¿cómo debe ser el tratamiento profiláctico?
La terapia episódica se refiere a la administración del factor de coagulación como respuesta ante la presencia de sangrado 6,15. Por otro lado, la terapia profiláctica se define como la administración intravenosa periódica de factor de coagulación en ausencia de hemorragia, con la finalidad de reducir el riesgo de hemorragia y sus complicaciones 16. Las recomendaciones de las guías disponibles se basan principalmente en consensos de expertos o revisiones sistemáticas con serias limitaciones. Las GPC de países de ingresos bajos o medios como el Perú 2 y Colombia 17 recomiendan el uso de la terapia episódica, considerando que los costos y cargas de la profilaxis son altos. En ese sentido, con esta pregunta clínica se busca actualizar la evidencia disponible, y evaluar los efectos y costos del tratamiento con factor de coagulación en pacientes con hemofilia.
Para esta pregunta se evaluaron por separado los pacientes con hemofilia sin inhibidores y con inhibidores.
Subpoblación de pacientes con hemofilia A o B sin inhibidores
Evidencia: En la búsqueda sistemática se encontraron dos RS 18,19. Una fue excluida debido a su antigüedad (realizada hace más de 9 años). Se eligió una debido a su adecuada calidad metodológica 18, la cual fue actualizada, encontrando cuatro ECA adicionales 20-23.
Beneficio: La evidencia incluida mostró que el tratamiento profiláctico redujo la tasa anualizada de sangrado, la tasa anualizada de hemorragia articular, el puntaje de salud articular con hemofilia 2.1, y el riesgo de hallazgos radiográficos, en comparación con el tratamiento episódico. Por otro lado, el efecto del tratamiento profiláctico en la puntuación de Pettersson y la calidad de vida aún es incierto, en comparación con el tratamiento episódico.
Daños: La frecuencia de los eventos adversos (desarrollo de inhibidores, infección relacionada con dispositivos de acceso venoso central) fue similar entre el tratamiento profiláctico y episódico
Balance y fuerza: Debido a que el tratamiento profiláctico presentó beneficios, sin daños significativos, se emitió una recomendación a favor de su indicación. Puesto que la certeza de la evidencia fue baja y los costos de implementación son grandes, se estableció que se debe realizar la valoración individualizada del paciente (teniendo en cuenta el fenotipo hemorrágico, estado articular, farmacocinética individual, la autoevaluación y preferencias del paciente), previo a la instauración del tratamiento profiláctico en el paciente; emitiéndose una recomendación condicional.
Subpoblación de pacientes con hemofilia A o B con inhibidores
Evidencia: En la búsqueda sistemática se encontró una RS 24, la cual se incluyó por tener adecuada calidad metodológica.
Beneficio: La evidencia incluida mostró que el tratamiento profiláctico redujo la tasa anualizada de sangrado y de hemorragia articular, comparado frente al tratamiento episódico. Para la valoración del puntaje de salud articular con hemofilia 2.1, Puntuación de Pettersson, y el riesgo de hallazgos radiográficos se consideraron los resultados descritos para paciente con hemofilia A o B sin inhibidores. Por otro lado, el efecto del tratamiento profiláctico en el mejoramiento de la calidad de vida aún es incierto en comparación con el tratamiento episódico.
Daños: La frecuencia de los eventos adversos (eventos tromboembólicos o complicaciones graves) no se reportó en los estudios incluidos.
Balance y fuerza: Debido a que el tratamiento profiláctico presentó beneficios, aunque no se reportaron los daños, se emitió una recomendación a favor de la indicación del tratamiento profiláctico. Puesto que la certeza de la evidencia fue baja y los costos de implementación son grandes, se estableció que se debe realizar la valoración individualizada del paciente (teniendo en cuenta el fenotipo hemorrágico, estado articular, farmacocinética individual, la autoevaluación y preferencias del paciente), previo a la instauración del tratamiento profiláctico en el paciente; emitiéndose una recomendación condicional.
Además, se consideró relevante emitir seis puntos de BPC adoptados de las recomendaciones de las GPC de la FMH 6, ver Tabla 1.
Pregunta 6. En pacientes con hemofilia A o B, ¿se debe utilizar el modelo de atención integral?
El modelo de atención integral involucra el trabajo conjunto de un equipo de diversos especialistas, incluyendo: especialistas en Hematología, enfermería, especialistas musculoesqueléticos, especialistas en laboratorio, especialistas psicosociales, y los cuidadores del paciente y la familia 6. Estos se suelen organizar en un centro de atención de hemofilia y tienen como finalidad mejorar el proceso de abordaje de los pacientes con hemofilia, optimizar los procesos y mejorar desenlaces a mediano y largo plazo 25. Por su parte el modelo clásico no integral, se sustenta en la atención centrada en el especialista en hematología, sin involucrar un sistema coordinado de atención y con la priorización de la mejora de objetivos netamente clínicos 26.
Evidencia: En la búsqueda sistemática se encontró una RS 27, la cual fue considerada debido a su adecuada calidad metodológica.
Beneficios: La evidencia incluida mostró que la frecuencia de mortalidad, días perdidos de trabajo, visitas a las salas de emergencia, y daño articular disminuyeron con el uso del modelo de atención integral comparado con el modelo no integrativo.
Daños: No se reportaron desenlaces respecto a los daños, pero los expertos coincidieron en que estos probablemente sean triviales.
Balance y fuerza: Los beneficios sobre la mortalidad, visitas a las sales de emergencia, días perdidos y daño articular fueron grandes con el uso del modelo de atención integral; y los daños probablemente sean triviales. Por ello se optó por emitir una recomendación a favor del uso de este modelo. Puesto que la certeza de evidencia fue muy baja, esta recomendación fue fuerte.
Además, se consideró relevante emitir diez puntos de BPC adoptados de las recomendaciones de las GPC de la FMH 6, ver Tabla 1.
Pregunta 7. En pacientes con hemofilia A o B, ¿cómo debe ser el manejo de las hemorragias graves que conllevan riesgo vital inmediato?
Las hemorragias en los pacientes con hemofilia pueden subclasificarse en hemorragias que conllevan riesgo vital y hemorragias que no conllevan riesgo vital (8). Las hemorragias que conllevan riesgo vital son aquellas que amenazan a corto plazo la vida del paciente con hemofilia y que requieren una reposición inmediata de factores de coagulación 6. Las opciones terapéuticas disponibles en EsSalud son los concentrados de factores VIII y IX; sin embargo, la evidencia no es clara respecto a las dosis que deberían utilizarse.
Para esta pregunta se realizó una búsqueda sistemática, no obstante, los estudios encontrados no valoraron las intervenciones disponibles en el sistema de salud. Por este motivo, se decidió emitir tres puntos de BPC adoptados de las recomendaciones de las GPC de la FMH 6, ver Tabla 1.
Pregunta 8. En pacientes con hemofilia A o B, ¿cómo debe ser el manejo de las hemorragias que no conllevan riesgo vital inmediato?
Las hemorragias espontáneas se pueden dar en diferentes órganos conllevando un riesgo no vital inmediato. Independientemente del tejido que haya sido afectado, este debe ser evaluado por un especialista, en caso se requiera un tratamiento en concreto para el tratamiento de hemorragias relacionadas con tejidos específicos. Para poder detener la hemorragia, prevenir su recurrencia, limitar sus complicaciones y finalmente restaurar, de ser posible, la función del tejido u órgano a su estado previo a la hemorragia, es necesaria su atención inmediata con concentrados de factor de coagulación y dar la oportuna rehabilitación 6. En ese sentido, esta pregunta clínica busca evaluar cuál es la mejor opción de manejo de las hemorragias con concentrado de factor de coagulación (CFC).
Para esta pregunta se realizó una búsqueda sistemática, no obstante, los estudios encontrados no se ajustaron a la pregunta PICO. Por este motivo, se decidió emitir cinco puntos de BPC adoptados de las recomendaciones de las GPC de la FMH 6, ver Tabla 1.
Pregunta 9. En pacientes con hemofilia A o B, ¿cómo debe ser el manejo antes, durante y después de una intervención quirúrgica?
Las cirugías y procedimientos quirúrgicos en pacientes con hemofilia deben contemplar el riesgo de sangrado. En tal sentido, será fundamental considerar la administración previa de concentrados de factor VIII o IX y de agentes bypass 6. De la misma manera, la monitorización de las pérdidas y la cuantificación de los requerimientos sanguíneos 28. En un paciente con hemofilia con un abordaje adecuado, el objetivo será mantener sus pérdidas y requerimientos sanguíneos en rangos similares a los de un paciente no hemofílico con una necesidad mínima adicional de concentrado de factores y agentes bypass 29. Para lograr este objetivo, la administración de concentrados de factor dependerá del tipo de procedimiento a realizarse, sea cirugía mayor o menor 2.
Para esta pregunta se realizó una búsqueda sistemática, no obstante, los estudios encontrados no se ajustaron a la pregunta PICO. Por este motivo, se decidió emitir siete puntos de BPC adoptados de las recomendaciones de las GPC de la FMH 6, ver Tabla 1.
Tabla 1 Lista de recomendaciones y puntos de Buena Práctica Clínica
* Recomendación basada en evidencias, (R) o punto de buena práctica clínica BPC (BPC) basada en consenso.
** La certeza de la evidencia solo se establece para las recomendaciones, mas no para los puntos de BPC.
Tabla 2 Significado de los niveles de certeza de la evidencia y de la fuerza de la recomendación
| Calidad de la evidencia | Significado |
|---|---|
| Alta (⊕⊕⊕⊕) | Es muy probable que el verdadero efecto sea similar al efecto estimado. |
| Moderada (⊕⊕⊕⊝) | Es moderadamente probable que el verdadero efecto sea similar al efecto estimado, pero es posible que sea sustancialmente diferente. |
| Baja (⊕⊕⊝⊝) | Nuestra confianza en el efecto es limitada. El verdadero efecto podría ser sustancialmente diferente al efecto estimado. |
| Muy baja (⊕⊝⊝⊝) | Nuestra confianza en el efecto es pequeña. El verdadero efecto probablemente sea sustancialmente diferente al efecto estimado. |
| Fuerza de la recomendación | |
| Recomendación fuerte (a favor o en contra) | El GEG cree que todos o casi todos los profesionales que revisan la evidencia disponible seguirían esta recomendación. En la formulación de la recomendación se usa el término “se recomienda” |
| Recomendación condicional (a favor o en contra) | El GEG cree que la mayoría de los profesionales que revisan la evidencia disponible seguirían esta recomendación, pero un grupo de profesionales podrían no seguirla. En la formulación de la recomendación se usa el término “se sugiere” |