INTRODUCCIÓN
El ácido desoxirribonucleico (ADN) es alterado por agentes físicos, químicos o biológicos, los cuales por su alta afinidad para interaccionar con el material genético conducen a una variedad de efectos adversos, que incluyen apoptosis o muerte celular, división o proliferación celular alterada y mutagénesis que pueden terminar en carcinogénesis1,2. Los agentes químicos como los fármacos son altamente utilizados en diferentes tratamientos médicos, muchas veces no son evaluados en razón a sus reacciones adversas y toxicidad que van más allá de la relación riesgo/beneficio adecuado, y sobre todo su acción carcinogénica y genotóxica, añadiendo su uso indiscriminado; convirtiéndolos en peligro para la salud humana3.
Ranitidina es un fármaco altamente utilizado en la cicatrización de úlceras gástricas y duodenales, actúa como antagonista de receptores de histamina tipo 2 (H2) al inhibir la producción de ácido gástrico, aumentar el pH gastrointestinal y reducir el flujo sanguíneo hepático4. Sin embargo, la ranitidina es una molécula inestable capaz de reaccionar en condiciones de análisis estándar para formar niveles excesivos de N-nitrosodimetilamina (NDMA), así mismo, estudios previos han demostrado que las aminas de la ranitidina pueden formar NDMA por nitrosación endógena cuando se exponen a un pH del estómago (5.
La NDMA se clasifica según la Agencia Internacional para la Investigación del cáncer (IRAC) como probable carcinógeno, a su vez muchos estudios han reportado los efectos cancerígenos asociado a la NDMA6,7. Se ha demostrado su actividad carcinógena asociada con mayor probabilidad de presentar cánceres gastrointestinales, vejiga, tiroides y próstata, evaluadas en muchas especies de animales8,9. Sin embargo, es discutible si la NDMA causa cáncer directamente o simplemente aumenta la susceptibilidad al cáncer. La toxicidad genética incluye metilación del ADN, fragmentación del ADN, anomalías cromosómicas y mutación7.
Para detectar el daño del ADN por un fármaco se hace uso de diferentes bioensayos tal como el test de micronúcleos, ampliamente utilizado por su bajo costo, rápida, interpretación sencilla, alta sensibilidad (91 %) y validez. A su vez, es utilizado comúnmente para probar la genotoxicidad in vivo e identificar rupturas a nivel de los cromosomas (clastogénicos) y alteraciones a nivel del aparato mitótico (aneugénicos) en las células tratadas10. En la médula ósea, comprenden el 50 % de eritrocitos inmaduros del total de eritrocitos, y pueden distinguirse de forma clara y específica a partir de eritrocitos maduros porque aún contienen ARN en su citoplasma, dado que, durante la madurez, las células precursoras de eritrocitos pierden su núcleo, sin embargo, retienen el micronúcleo desarrollado durante la etapa10). Además, los eritrocitos inmaduros también se forman micronúcleos, sin embargo, representan sólo una pequeña proporción y frecuentemente son descartados por la selección esplénica; por el contrario, los micronúcleos aumentan significativamente por inducción de agentes citotóxicos, por ejemplo, la ciclofosfamida, un agente alquilante que ha demostrado muchos efectos secundarios, incluida la toxicidad genética11.
Existen un número limitado de estudios sobre una asociación significativa entre la exposición en el uso de ranitidina y su genotoxicidad in vivo a nivel de formación de micronúcleos12,13. Por ello, debido a sus efectos adversos y su toxicidad, la investigación buscó comprobar si ranitidina afecta el material genético (ADN) de los eritrocitos policromáticos (EPC) de la médula ósea de ratas albinas (Rattus norvegicus, cepa Holtzman) mediante el test de micronúcleos, en comparación con el efecto de la ciclofosfamida.
MATERIALES Y MÉTODOS
Materiales
Se utilizaron ratas albinas machos (Rattus norvegicus) de cepa Holtzman de seis semanas de edad con un peso medio de 90 g, adquiridos del Instituto Nacional de Salud. Se aclimataron por cinco días en el Laboratorio de Genética de la Universidad Nacional de Trujillo, bajo condiciones de temperatura ambiental (23 ± 2 ºC) y humedad relativa (50 ± 10 %) con periodo de luz y oscuridad, alimentados con ratonina y agua sin restricción14. Se adquirió una forma farmacéutica de ranitidina (CSPC Ouyi Pharmaceutical Co., China) con número de registro Y20190007953.
Tratamiento y vías de administración
Los ejemplares de Rattus norvegicus (cepa Holtzman) se distribuyeron en cuatro grupos de trabajo con cinco especímenes cada uno. Se administraron por vía intraperitoneal durante 15 días; el grupo control negativo se administró 0,5 ml de solución salina fisiológica (SSF), el grupo control positivo se administró 50 mg/kg ciclofosfamida (GP Pharm, Argentina) a partir del 12° día; así mismo, dos grupos experimentales se administraron 2 y 4 mg/kg de ranitidina cada uno15. Finalizando el último día de cada uno de los grupos, se prepararon los especímenes para el test de micronúcleos.
Obtención de los preparados citológicos de médula ósea
Se preparó de acuerdo a la técnica de Kasamoto et al.16 adaptada de acuerdo a la investigación. Los especímenes fueron sometidos al procedimiento de eutanasia, se extrajeron quirúrgicamente los fémures, se recortó el músculo y ambos extremos del fémur para recolectar las células de la medula ósea. Se obtuvo la médula ósea en 10 ml de SSF por centrifugación a 1000 r/min por 10 minutos. Se removió el sobrenadante y el pellet fue fijado en alcohol: ácido acético 3:1 (Solución de Carnoy) por 10 minutos; luego, se resuspendió y centrifugó a 1000 r/min por 10 min17. A partir del sedimento, se realizó el frotis en portaobjetos de vidrio y se tiñó con giemsa al 5 % durante 30 minutos.
Análisis citológico: Test de micronúcleos
Los preparados citológicos fueron analizados con un microscopio óptico binocular (Olympus, CX31-100AS, USA) con objetivo 100 X y se identificó a los eritrocitos policromáticos (EPC) normales y eritrocitos policromáticos micronucleados (EPCMN) en un total de 2000 EPC por espécimen según los criterios de identificación de micronúcleos por Tripodi et al.18 . El daño del ADN se determinó mediante el índice de genotoxicidad que se basa en la relación (1):
Análisis estadístico
Los datos obtenidos se estimaron las medias y desviación estándar para frecuencias de EPCMN mediante el software Minitab versión 18, se realizó las comparaciones estadísticas entre tratamientos a través de la prueba no paramétrica de Kruskal-Wallis, con un nivel de significancia de p < 0.0519.
RESULTADOS
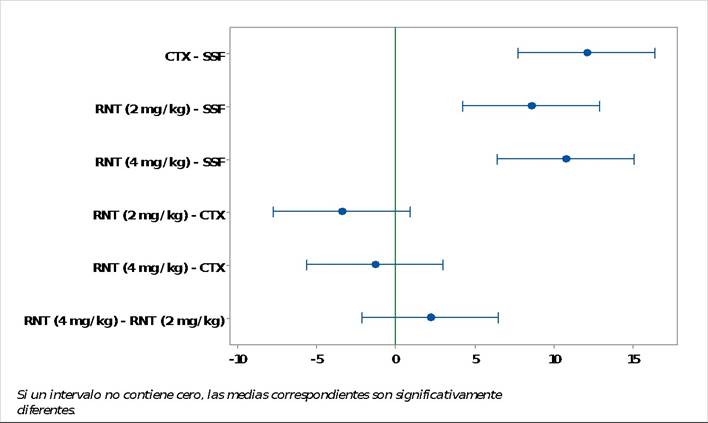
Se evaluó el efecto de ranitidina sobre el ADN de eritrocitos policromáticos de las ratas albinas (Rattus novergicus, cepa Holtzman) mostrando variación del tamaño de los micronúcleos en los administrados con ranitidina y ciclofosfamida; sin embargo, no había variación en los especímenes administrados con solución salina fisiológica (Figura 1).
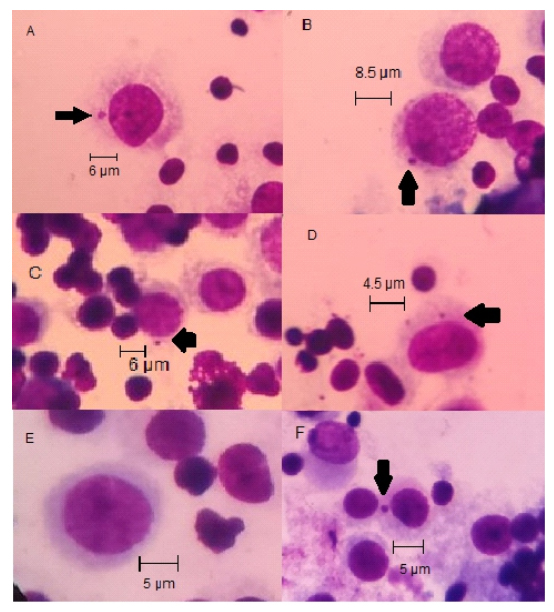
Figura 1 Fotomicrografías de los micronúcleos (flecha) a 1000 X de EPC de médula ósea de Rattus novergicus (cepa Holtzman) administrado con ranitidina 4 mg/kg (A y B,), 2 mg/kg (C y D), control negativo con solución salina (E) y control positivo con ciclofosfamida (F).
En la Figura 2, se muestra una elevada frecuencia de los micronúcleos a 242 ± 10 y 285 ± 10 de los grupos administrados con ranitidina (RNT) con 2 mg/kg y 4 mg/kg, respectivamente, a su vez no existe diferencia significativa con los valores obtenidos por la ciclofosfamida; en cambio, se obtuvo una menor cantidad de 70 ± 6 en el grupo de control negativo con solución salina fisiológica.
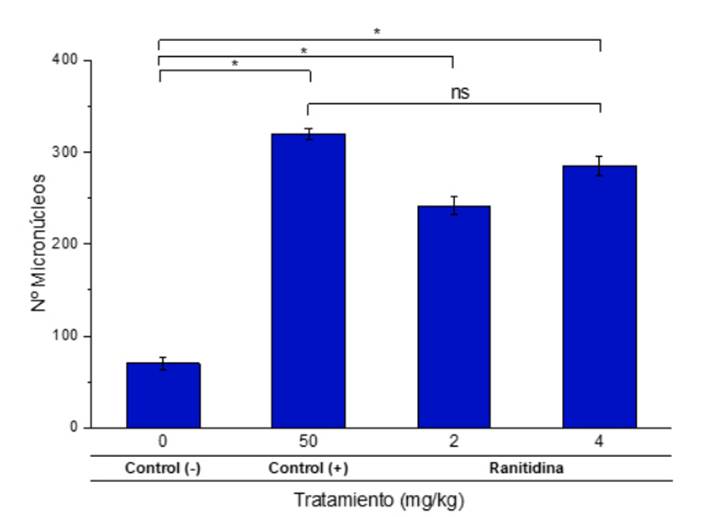
Figura 2 Número de micronúcleos en los EPC de médula ósea de Rattus novergicus (cepa Holtzman) administrados con ranitidina. El asterisco indica indican diferencia significativa entre los grupos indicados (*, p<0.05) y ns - diferencia no significativa entre los grupos (p>0.05).
En la Figura 3, se obtuvo un alto índice de genotoxicidad (IG) de 12,10 ± 0,49 y 14,26 ± 0,51 % en los tratamientos con 2 mg/kg y 4 mg/kg de ranitidina, respectivamente; en cambio, presentaron diferencias significativas (p<0,05) con el control negativo (3,52 ± 0,32 %). Así mismo, la dosis de ciclofosfamida (50 mg/kg) presentó un IG de 15,99 ± 0,32; por lo que no mostró diferencia significativa con respeto a los tratamientos con ranitidina (Figura 4).
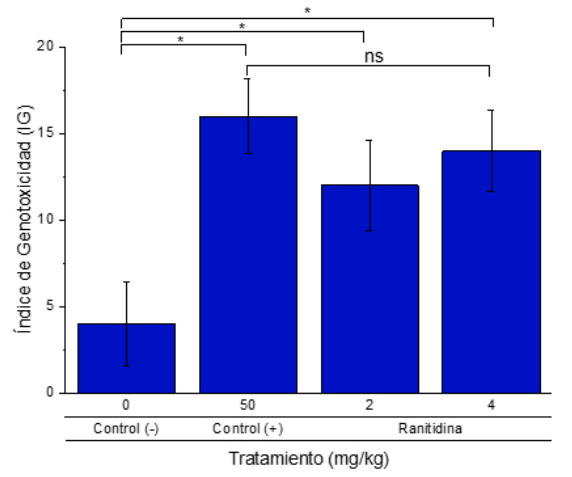
Figura 3 Índice de genotoxicidad de los EPC de médula ósea de Rattus novergicus (cepa Holtzman) administrados con Ranitidina. El asterisco indica indican diferencia significativa entre los grupos indicados (*, p<0.05) y ns - diferencia no significativa entre los grupos (p>0.05).
DISCUSIÓN
El efecto clastogénico genera pequeños micronúcleos producto de roturas de fragmentos cromosómicos y aneuploidogénico, produciendo grandes micronúcleos por la falta de migración de cromosomas completos debido a los cambios en las proteínas del huso mitótico, cinetocoro, control en anafase e hipometilación de secuencias centroméricas o paracentroméricas21.
Normalmente, estos micronúcleos pueden formar espontáneamente como un mecanismo para la eliminación de ADN extra o en el desarrollo normal de células progenitoras, sin embargo su aumento significativo es debido mayormente por agentes clastógenos o aneugenos22. Así mismo, entre las dosis administradas de ranitidina (2 y 4 mg/kg) se observó un aumento del 15 % del número de micronúcleos, esto sugiere que a mayores concentraciones podría aumentar la frecuencia de micronúcleos.
El alto índice de genotoxicidad (IG) obtenidos fueron mayor a los que obtuvo Maleek et al., que reportó hasta 4,76 % de IG a 2 mg/kg de ranitidina, lo cual puede diferir de acuerdo a su fuente de fabricación y estabilidad del fármaco15. A su vez, otros resultados similares fueron obtenidos por Monarca et al., que encontró valores de IG hasta 12,6 % de micronúcleos en células madre del polen expuesta a nitrosaminas derivados del caucho23.
El daño del ADN en los EPC de R. norvegicus por el efecto de los derivados que pueden formarse a partir de la ranitidina, evidencian a este fármaco como un potencial genotóxico indirectamente, a su vez que podría ser un alto riesgo para las células humanas debido a la estructura del ADN que es la misma en todas las especies y más aún de los especímenes utilizados que comparten el material genético a un 99 % de similitud con el hombre24. Si bien es cierto, NDMA es uno de estos derivados y es clasificado como una nitrosamina cancerígena potencial, su formación es causado durante el proceso de fabricación o a medida que la ranitidina se degrada, además se ha demostrado que el aumento de la temperatura (20 a 40 ºC) puede generar NDMA12.
Se describe la relación entre el número de micronúcleos y el efecto citogenético que podría ser usada como diagnóstico temprano del daño genotóxico, a su vez estos resultados obtenidos en la investigación permitirían advertir a la población acerca de sus riesgos para la salud causado por ranitidina.
La ranitidina administrada en 4 mg/kg produce genotoxicidad de 14,26 ± 0.51 % en la formación de micronúcleos de eritrocitos policromáticos en las células de la medula ósea de Rattus norvegicus cepa Holtzman e influye en la variación de la frecuencia y tamaño de los micronúcleos. Esta investigación aporta en un modelo biológico para describir efecto genotóxico de la ranitidina en células de mamíferos como aplicación biomédica para estudios preventivos para evaluar en su uso indiscriminado de fármacos.