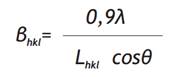INTRODUCCIÓN
Listeria monocytogenes es un patógeno transmitido por los alimentos que causa una enfermedad llamada listeriosis, que puede ser fatal en personas inmunodeprimidas 1. Listeria monocytogenes es un patógeno intracelular facultativo transmitido por los alimentos que es resistente a diversas condiciones de estrés En toda la cadena alimentaria, desde la producción hasta el almacenamiento y el consumo, Listeria monocytogenes es extremadamente difícil de controlar 2. Debido a la aparición de resistencia a los antibióticos en cepas de Listeria monocytogenes aisladas de los alimentos, los brotes futuros pueden ser más difíciles de controlar 3.
La nanotecnología es un punto de investigación de la ciencia moderna y ahora proporciona una plataforma sólida para desarrollar aplicaciones novedosas y diversas. El tamaño de las nanopartículas (NP) no suele ser superior a 100 nm. Se cree que su eficacia bactericida se debe a la combinación de su pequeño tamaño y gran superficie, lo que permite una estrecha interacción con las membranas microbianas 4. Dado que el modo de acción de Np está principalmente en contacto directo con la pared celular bacteriana y la membrana celular, se reduce la posibilidad de que NP produzca resistencia bacteriana a fármacos (5.
Las NP de óxido metálico se usan ampliamente, con diversas aplicaciones que incluyen desde recubrimientos para superficies, medio ambiente, alimentación, textilería, biodiagnóstico, optoelectrónica, bioingeniería y agricultura 6. Las NP de óxido metálico más conocidas son el dióxido de silicio (SiO2), óxido de plata (AgO), óxido de aluminio (Al2O3), óxido de hierro (Fe3O4), dióxido de titanio (TiO2), óxido de magnesio (MgO), óxido de calcio (CaO), óxido de cobre (CuO), y óxido de zinc (ZnO)2; esto debido a sus aplicaciones en productos para el cuidado personal y el entorno doméstico 7,8.
El ZnO es un óxido de metal inorgánico, debido a su estabilidad y mayor vida útil que los agentes antibacterianos, ha mostrado propiedades antibacterianas y tiene un valor de aplicación potencial en la conservación de alimentos 9. La acción bactericida de Np-ZnO se les atribuye a los mecanismos de acción de las Np-ZnO que incluyen desde daño a la membrana a través de la producción de especies reactivas de oxígeno, internalización celular de Np, adhesión y penetración a través de la membrana celular 10. Al producir especies reactivas de oxígeno (ROS), incluido el peróxido de hidrógeno, las bacterias son inhibidas por una variedad de factores letales (H2O2), radicales hidroxilos (OH-) y superóxido (O2 -)11. Los radicales libres se generan debido a la interacción entre la membrana y el Np-ZnO para producir radicales libres de oxígeno tóxicos que causarán un daño secundario a la membrana, dificultan la función de las proteínas, dañan el ADN y provocan una producción excesiva de radicales libres 12.
La fuerte respuesta adaptativa a los antibióticos y desinfectantes químicos ha dado lugar a la aparición de cepas de Listeria monocytogenes resistentes, que plantea un gran desafío para la prevención de infecciones generadas por esta bacteria. Es por ello, que el presente trabajo pretende determinar la concentración mínima inhibitoria de nanopartículas de óxido de zinc sobre el crecimiento de Listeria monocytogenes ATCC 7644, con la finalidad de justificar su uso y evitar la generación de más cepas bacterianas multiresistentes.
EL ESTUDIO
Síntesis de nanopartículas de ZnO
Se preparó por separado, 100 mL de soluciones precursoras de zinc di-hidratado (AZD) y de Hidróxido de sodio (NaOH), ambas disueltas en etanol absoluto a molaridades de 0,1 M y 0,14 M, respectivamente. La dilución de AZD en etanol se realizó por agitación magnética (magnetic stirring) y por reflujo a 150°C durante una hora, hasta observarse una solución transparente y homogénea. La solución de NaOH se preparó bajo agitación ultrasónica por dos horas a temperatura ambiental. Para la obtención de las ZnO-Np, se agregó lentamente la solución de NaOH sobre la solución de AZD bajo suave agitación magnética a temperatura ambiental durante 10 minutos, tiempo suficiente para la formación de nanopartículas de ZnO coloidales. Para verificación visual de obtención de las nanopartículas se irradió con una lámpara UV, observando como respuesta una fluorescencia amarilla o verde. Para la obtención de ZnO-Np en polvo, se usó n-heptano con una relación de 2:1 a fin de lograr su precipitación; seguido de una centrifugación de 5,000 rpm durante cinco minutos. Finalmente, fueron secadas en una estufa a 80°C durante una hora con el fin de evaporar el solvente y eliminar cualquier impureza.
Caracterización estructural y morfología
La estructura cristalina fue evaluada mediante difracción de rayos X (DRX), usando un difractómetro Bruker ECO Advance con cátodo de Cu (λ = 1,54056 Å), dentro del rango 2θ de 25° a 75° con tamaño de paso de 0,02°. Para la identificación de los picos de difracción, estos se compararon con la base de datos PDF-ICCD (International Center forDiffraction Data). La morfología de las nanopartículas de ZnO fue determinada con un microscopio electrónico de barrido TESCAN, modelo VEGA 3 LMU aplicando un voltaje de aceleración de 20 kV. Previamente, las muestras fueron recubiertas con una capa fina de carbón con un DC Sputtering-SPI para evitar efectos de carga de electrones. Adicionalmente, se hizo un análisis multipuntual por energía dispersiva de rayos X (EDS) a lo largo de una microfibra, empleando un detector Rx Quantax 200 - Bruker.
El tamaño promedio del cristalito de las nanopartículas es de 34,5 nm, el cual fue determinado por la ecuación de Scherrer (Cullity, 1978) (Ec. 1):
Con λ = 0,154056 nm; siendo L hkl la medida del ensanchamiento de pico (en radianes) medido a una intensidad igual a la mitad de la intensidad máxima del pico de difracción (FWHM); θ es el ángulo en el cual se satisface la ley de Bragg para el valor particular de λ.
Curva de crecimiento de Listeria monocytogenes ATCC 7644
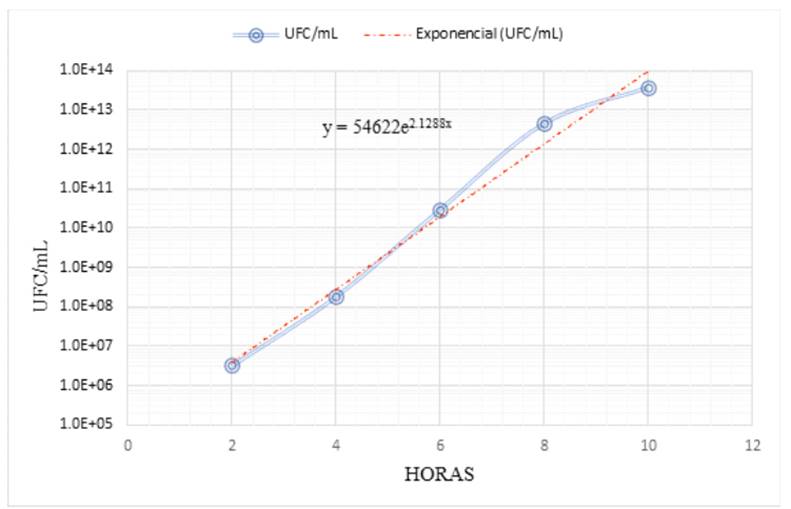
Se sembró 1 mL de una suspensión de Listeria monocytogenes ATCC 7644 PK/5 (equivalente al tubo 0,5 de Mac Farland 1,5 x 108 UFC/mL) en 99 mL de Caldo BHI en un biorreactor aireado, a 37 °C durante 24 horas y se determinó la concentración de la población microbiana cada dos horas por el método de recuento en placa. Con estos recuentos se obtuvo la fase logarítmica media. Para finalizar la suspensión bacteriana se diluyó al centésimo en NaCl (0,85 %), para obtener una concentración de 1,5x106 cel/mL.
Obtención de la concentración mínima inhibitoria de las nanopartículas de Óxido de Zinc
Se realizó por la técnica de macrodilución, en tubos de 13 x 100 mm cada uno y se procedió de la siguiente manera: por cada repetición se preparó una batería de trece tubos correspondientes a 10 diluciones experimentales y tres controles (positivo, negativo y blanco). La concentración de la solución stock (8 mg/mL) se diluyó utilizando el método de diluciones seriadas al medio, transfiriendo 1 mL de Np-ZnO a 1 mL de caldo Müller Hinton doble concentrado, obteniendo finalmente una concentración del tubo 1 al 10 de 4; 2; 1; 0,5; 0,25; 0,12; 0,06; 0,03; 0,01; 0,007 mg/mL de Np-ZnO, respectivamente. Luego, se añadió 0,1 mL de la suspensión bacteriana estandarizada, a cada tubo, se mezcló e incubó a 37 °C por 24 horas. El crecimiento bacteriano en los tubos se evidenció por la turbidez del caldo y la concentración más baja de nanopartículas de ZnO que inhibió el crecimiento de prueba se tomó como la concentración mínima inhibitoria (CMI). El control positivo fue el cultivo de L. monocytogenes sin nanopartículas de óxido de zinc, mientras que el control negativo fue una solución de Np-ZnO con caldo Müller Hinton doble concentrado y el control blanco tuvo únicamente medio de cultivo.
HALLAZGOS
En la Figura 1 se muestra la curva corregida de la fase logarítmica de crecimiento de Listeria monocytogenes ATCC 7644, se obtuvo la fase logarítmica media a las 4 horas de incubación.
Síntesis, caracterización estructural y morfología de nanopartículas de óxido de zinc (ZnO-Np). Para la producción de nanopartículas de ZnO se usó acetato de zinc di-hidratado (AZD) [Zn(CH3COO)2.2H2O], 99,99 %, hidróxido de sodio (NaOH), 99 %, monoetanolamina y etanol absoluto, 99,9% (Merck).
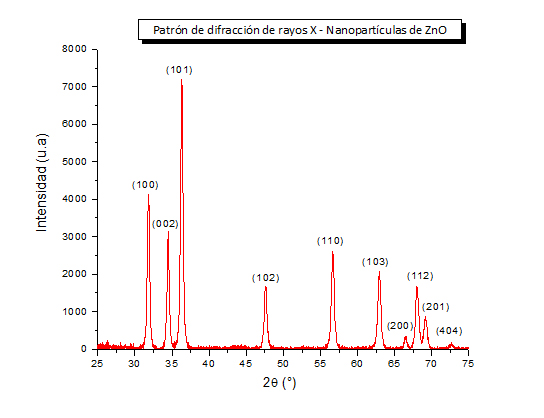
En Figura 2 se muestra el patrón de difracción de las nanopartículas de ZnO sintetizadas y con un recocido a 400 °C. Se pueden observar los picos de difracción característicos de una estructura hexagonal tipo wurtzita.
En la Figura 3, se muestra una imagen de microscopía electrónica de barrido (MEB) de las nanopartículas de ZnO con tendencia a una geometría esférica de diámetro promedio de 90 nm. La menor división mostrada en la escala indicada en la parte inferior de la imagen es de 50 nm.
En la Tabla 1 se muestran los resultados de la concentración mínima inhibitoria que se obtiene con 0,06 Np-ZnO (mg/mL).
Tabla 1 Evaluación de la actividad inhibitoria de las Np-ZnO sobre el crecimiento de Listeria monocytogenes ATCC 7644.
| Repeticiones | Concentraciones de las Np-ZnO (mg/mL) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 4 | 2 | 1 | 0,5 | 0,25 | 0,12 | 0,06 | 0,03 | 0,01 | 0,007 | |
| 1 | - | - | - | - | - | - | - | + | + | + |
| 2 | - | - | - | - | - | - | - | + | + | + |
| 3 | - | - | - | - | - | - | - | + | + | + |
Lectura a las 24 horas.
(+) Presencia de turbidez
(-) Ausencia de turbidez.
DISCUSIÓN
Las nanopartículas se ha reportado un efecto inhibitorio en una amplia gama de bacterias que incluyen patógenos tales como Klebsiella pneumoniae, Staphylococcus aureus, Staphylococcus epidermidis, Salmonella enteritidis, Streptococcus mutans, Streptococcus pyogenes, Campylobacter jejuni, Escherichi coli, Listeria monocytogenes, Bacillus subtilis, y Enterococcus faecalis (5,13. En la actividad antibacteriana estudios de Yamamoto et al.4, Zhang et al.9, Xie et al.10 informan que las Np-ZnO actúan principalmente a través de dos vías letales que se relacionan y en muchos casos simultáneamente, siendo la primera el daño a la membrana, interrupción del potencial e integridad y la segunda la producción de especies reactivas de oxígeno 14.
Estudios han reportado que las Np-ZnO son capaces de unirse a las membrana, el daño se genera cuando se adhieren electrostáticamente a la pared celular y a la membrana celular bacteriana, la carga positiva de éstas facilita su unión a la superficie de las bacterias cargadas negativamente, lo que lleva a una alteración del potencial, y despolarización; interactúan con los lípidos de membrana rompiendo la integridad de la membrana, producen un desequilibrio en el transporte, deterioro en la respiración, interrupción de la transducción y/o lisis celular 4,15.También podría ser por la toxicidad de iones metálicos libres que surge de la disolución de los metales en la superficie de las Np. La liberación de iones de zinc tiene un efecto significativo en la inhibición del transporte activo, así como en el metabolismo de los aminoácidos y la disrupción del sistema enzimático16.
Otros efectos incluyen la inhibición directa de enzimas esenciales específicas, la inducción de especies reactivas de nitrógeno (NRS) y la inducción de muerte celular programada17. Los radicales libres son producidos debido a las interacciones de la membrana con las Np-ZnO generando radicales tóxicos de oxígeno 4,9. El peróxido de hidrógeno (H2O2), radicales hidroxilos (OH) y superóxido (O2 -), actualmente son considerados los determinantes más efectivos, debido a que causan, a través del estrés oxidativo, severo daño a todas las macromoléculas de la célula, peroxidación de los lípidos, alteración de las proteínas, inhibición de enzimas y daño al ARN y ADN. Por ello a este estrés oxidativo se le ha determinado que posee un potencial bactericida. La producción de ROS ha sido revelada por varios estudios, ocasionan una fuga del contenido intracelular debido al daño oxidativo a las proteínas y lípidos, también se ha determinado que dicho estrés oxidativo posee un débil potencial mutagénico, que ocasiona inhibición de las enzimas respirato (18.
En su investigación Xie et al. (10) describe alteraciones en la morfología celular de Campylobacter jejuni y del género Helicobacter tratadas con Np-ZnO, las Np se adhirieron a la superficie y llevaron a un cambio de la estructura de C. jejuni, lo que resultó en superficies celulares irregulares, formación de ampollas en la membrana y un aumento de la permeabilidad de la membrana 19.
Los resultados obtenidos en la presente investigación mostraron que la concentración de 0,06 mg/mL de Np-ZnO de 90 nm (tamaño promedio) son la mínima necesaria para inhibir el crecimiento de Listeria monocytogenes ATCC 7644. Asimismo, es necesario precisar que de acuerdo a otras investigaciones como la de Xie et al. 10 las pruebas antibacterianas mostraron que 0,03 mg/ml de Np-ZnO de 30 nm (tamaño promedio) eran suficientes para inactivar a C. jejuni, mientras que la concentración de Np fue de 0,4 mg/ml para E. coli O157: H7 y S. enterica serovar Enteritidis, indicando claramente un mayor nivel de susceptibilidad de C. jejuni a las Np-ZnO 15,20. Finalmente es importante tener en cuenta que la efectividad de las Np-ZnO depende significativamente del método de síntesis, concentración elegida (dosis), tamaño de partícula y tiempo de tratamiento 15,20.
La concentración mínima inhibitoria (CMI) resultante para las nanopartículas de óxido de zinc (Np-ZnO) de 90 nm de tamaño promedio fue de 0,06 mg/mL, suficiente para controlar significativamente el crecimiento contra Listeria monocytogenes ATCC 7644.