INTRODUCCIÓN
La infiltración gastrointestinal se presenta en el 50-60% de pacientes con linfomas no Hodgkin (LNH) al momento de la autopsia. Sin embargo, los linfomas gástricos primarios (LGP) representan solo el 1-4% de los tumores que afectan estas localizaciones1. La gran mayoría de los LGP son de estirpe de células B1. Los linfomas de células T (LCT) del tracto gastrointestinal son raros; los LCT gástricos primarios son aún más raros y representan solo el 2.5-10% de los LGP1,2. La mayoría de casos reportados de LCT gástricos primarios se asocian a infección por HTLV-1 y/o virus del Epstein-Barr (VEB).
Reportamos el primer caso de LCT gástrico primario, no asociado a HTLV-1 ni VEB, complicado con metástasis cutánea y perforación gastrointestinal.
No existen publicaciones previas respecto a algún LCT gástrico primario complicado con perforación y neumoperitoneo. Sin embargo, se ha descrito que la perforación antes de la terapia es característica de 2 tipos de linfoma gastrointestinal primario: el linfoma maligno con eosinofilia (LME) y el linfoma inmunoblástico3. El LME es una variante inusual de LCT que es más común en intestino delgado, mientras que el LCT inmunoblástico es un subtipo raro de LCT maduras periféricas4,5.
REPORTE DE CASO
Mujer de 45 años residente en Ferreñafe, sin antecedentes de relevancia, quien inicia con lesiones dolorosas friables en paladar y odinofagia. Un mes después, se agrega diarrea sin moco ni sangre de escaso volumen, asociada a pujo, tenesmo y ocasionalmente periodos de estreñimiento. Un mes después del inicio de la diarrea, nota edema blando maleolar bilateral, y un mes después de esto, aparecen lesiones descamativas de 1 cm en espalda, que subsecuentemente aumentaron de tamaño y se extendieron a todo el cuerpo. Seis meses después del inicio de los síntomas, presenta dolor epigástrico intenso que posteriormente generaliza a todo el abdomen y asocia a vómitos porráceos, acudiendo al Hospital Regional Lambayeque (HRL). Refería pérdida de 20 kilos en los últimos 6 meses.
Paciente en regular estado general, afebril, estable hemodinámicamente. Peso 40 kg, talla 1.51 m. En boca lesiones blanquecinas en placa de 2 x 3 cm, sobre base eritematosa. Piel seca y pálida; lesiones en placas descamativas marrones de 1 x 2 cm, con halo periférico eritematoso en dorso, abdomen y extremidades; entre éstas, otras pequeñas lesiones papulares eritematosas (Figura 1). Edema blando maleolar bilateral. Aparato respiratorio, cardiovascular, genitourinario, neurológico: sin alteraciones. Abdomen: plano, dolor difuso a la palpación.
Ante una paciente consuntiva, con dolor abdominal y cambios en la consistencia de las deposiciones, se planteó el diagnóstico de neoplasia y/o tuberculosis gastrointestinal. La analítica mostró anemia microcítica hipocrómica (hemoglobina 8 g/dl), trombocitosis (760 000 /mm3), linfopenia (792 /mm3) e hipoalbuminemia (1.97 mg/dl). La lámina periférica evidenció: trombocitosis; neutrofilia relativa (89%), granulaciones tóxicas sin blastos ni células inmaduras ni eosinofilia. Las serologías para VIH, HTLV-1, VEB, VDRL/RPR, hepatitis B y C fueron negativos. La deshidrogenasa láctica, calcio y ácido úrico sérico, TSH y T4-libre fueron normales. La ecografía abdominal mostró líquido libre (1000 ml) en cavidad abdominal. La radiografía de tórax (Figura 2) y tomografía toraco-abdominal-pélvica mostraron signos de neumoperitoneo. No se evidenció compromiso tumoral pulmonar ni ganglionar. La endoscopía alta mostró candidiasis esofágica, mucosa irregular y úlcera penetrada a nivel de unión antro-corporal (Figura 3).
Quince días después del ingreso se realizó laparotomía exploratoria, reportándose úlcera gástrica perforada de 4 cm y dos tumoraciones: una de 9 cm en tercio medio de cuerpo gástrico y otra de 4 x 5 cm en borde mesentérico de colon transverso; resto de estómago con múltiples úlceras, engrosamiento y edema de sus paredes. La histopatología de la biopsia por congelación de la úlcera fue positiva para “neoplasia maligna de estirpe epitelial”, procediéndose a gastrectomía subtotal Billroth II y colectomía transversa. La histopatología de la biopsia cutánea fue compatible con “metástasis cutánea de carcinoma pobremente diferenciado con células en anillo de sello de probable origen gastrointestinal e infección por Sarcoptes scabei” (Figura 4).
En el postoperatorio, la paciente recibió nutrición parenteral. Cinco días después de la laparotomía, la histopatología de biopsia quirúrgica mostró: “neoplasia maligna de células redondas” en borde de úlcera gástrica perforada con varios grupos ganglionares gástricos comprometidos por neoplasia. Un mes después de la cirugía, la inmunohistoquímica confirmó LCT gástrico primario estadio clínico IV por compromiso dérmico (Figura 5). Los resultados de los marcadores fueron: CD20 (─), CD3 (+), CD4 (+), CD8 (+), CD56 (─), CD25 (+). Cinco días después, inició quimioterapia (ciclofosfamida 750 mg/m2, doxorrubicina 50 mg/m2, vincristina 1.4 mg/m2, prednisona 50 mg/m2) siendo luego dada de alta para continuar quimioterapia ambulatoria. A mediados de diciembre del 2019 la paciente falleció.
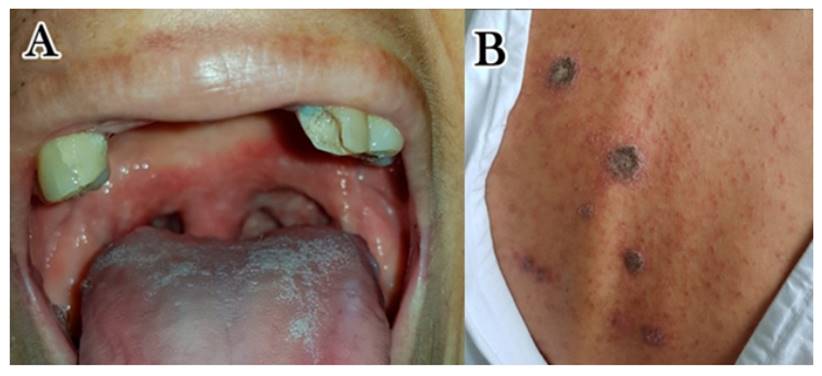
Figura 1 A: En lengua se observa pápulas y placas blanquecinas de tamaño variable, sobre base eritematosa, sin lesiones satélite. B: En el dorso de la paciente se aprecian placas marrones descamativas de 2 x 3 cm; entre éstas, se presentan otras lesiones papulares eritematosas de menor tamaño.
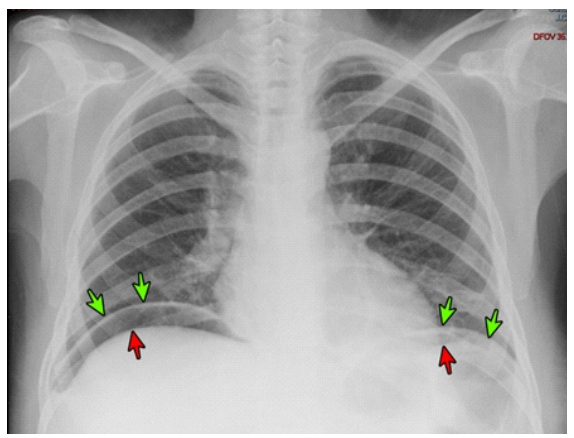
Figura 2 Radiografía de tórax muestra imágenes radiolúcidas (flechas rojas) en forma de hoz debajo de hemidiafragmas (flechas verdes) sugerente de neumoperitoneo.
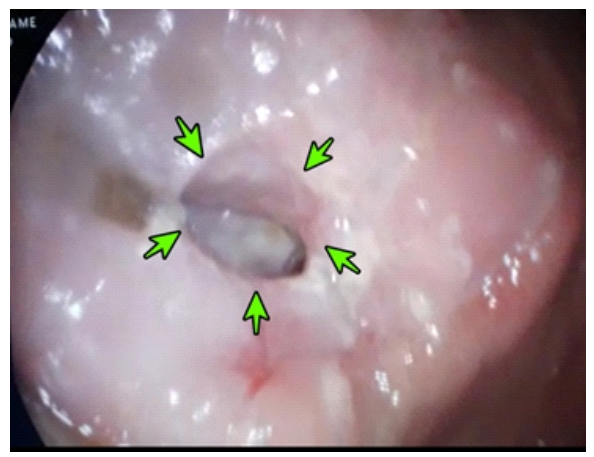
Figura 3 Endoscopía alta muestra úlcera penetrada (delimitada por flechas verdes) a nivel de unión antro-corporal.
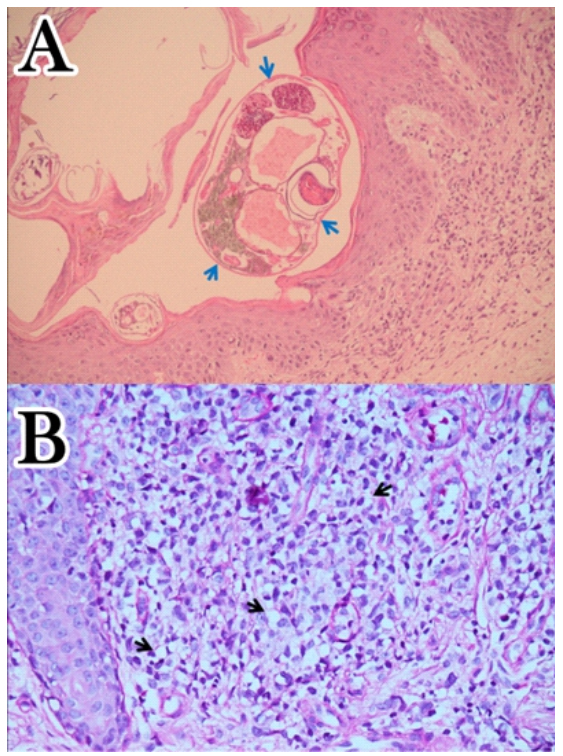
Figura 4 Microfotografías a 40X, muestra: biopsia cutánea. A: En estrato corneo Sarcoptes scabiei (flechas azules). Tinción Hematoxilina & Eosina. B: Infiltración de células atípicas vacuoladas con aspecto de anillo de sello (flechas negras) en dermis superficial. Tinción PAS (Periodic Acid-Schiff).
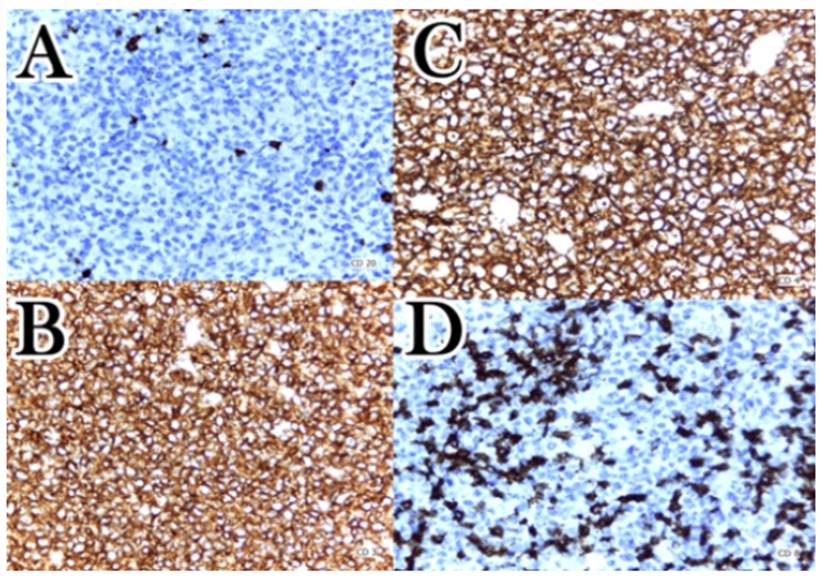
Figura 5 Microfotografías a 40X, muestra: borde de úlcera gástrica. Linfocitos atípicos medianos a grandes, ligeramente pleomórficos con citoplasma basófilo y abundantes figuras mitóticas. Se disponen formando patrón difuso o en sábana. La inmunohistoquímica muestra: antígenos CD20 negativo (A), CD3 positivo (B), CD4 positivo (C) y CD8 positivo (D).
DISCUSIÓN
Según Dawson, se considera linfoma “primario” del tracto gastrointestinal si hay lesiones digestivas al momento de la presentación inicial y además: 1) no hay linfadenopatías superficiales, 2) no hay linfadenopatías mediastinales, 3) el recuento leucocitario total y diferencial son normales, 4) los únicos ganglios linfáticos afectados son los de la vecindad inmediata, 5) hígado y bazo están libres de enfermedad 6. Tokiota, además de los criterios anteriores agrega: ausencia de neoplasia en médula ósea (aspirado y biopsia) 1. Nuestra paciente cumplió con estas condiciones, excepto con la última.
El HTLV-1 tiene un rol importante en la patogenia e incidencia de LCT primarios del tracto gastrointestinal7. La asociación de LCT gastrointestinales con HTLV-1 es más frecuente en regiones endémicas2, como el Perú8. El VEB, es más común que el HTLV-1 y se asocia con linfoma gástrico de células B, pero raramente con LCT9,10. Nuestra paciente fue HTLV-1 y VEB negativos (─).
El LCT gástrico primario fue descrito por primera vez por Weis et al. en 198610. Las características clínico-patológicas de LCT gástrico no han sido completamente dilucidadas1,11. La mayoría de series sobre LCT gástricos han sido publicadas en Asia1,2,11.
Tokioka y col. reportaron 16 pacientes con linfoma primario del tracto digestivo, de las cuales 10 (62%) fueron de origen de células B y 6 (38%) de estirpe de células T. De los 6 pacientes con LCT primario de origen gastrointestinal, los sitios primarios fueron: estómago (4 casos), íleo-ciego y duodeno (1 caso cada uno). Las características clínicas de los LCT primarios del tracto digestivo HTLV-1 (+) fueron similares a reportes previos, mientras que los casos HTLV-1 (─) fueron muy distintos. Los casos de LCT y HTLV-1 (+) mostraron manifestaciones leucémicas y compromiso tumoral de la piel a un estadio más avanzado de la enfermedad1. La respuesta a la quimioterapia fue buena en los casos HTLV-1 (─), pero pobre para la enfermedad asociada a HTLV-1 (+). Tres casos HTLV-1 (+) murieron 1 año después del diagnóstico, mientras que 2 casos HTLV-1 (─) sobrevivieron más de un año1. Por el contrario, en nuestra paciente, la respuesta a la quimioterapia no fue adecuada.
Shimada-Hiratsuka y col. describieron 65 casos de linfomas gástricos primarios, 5 casos (7.7%) fueron LCT. De los pacientes con LCT gástricos, 3 fueron hombres y 2 mujeres; las edades fluctuaron entre 44-73 años. De estos 5 casos, 3 casos fueron HTLV-1 (─) y 2 fueron HTLV-1 (+). Un caso procedía de un área endémica y fue HTLV-1 (─) y uno procedía de área no endémica y fue HTLV1 (+)2.
Kawamoto et al. describieron 20 casos de LCT gástrico HTLV-1 (─) en Japón. Reportaron que, la edad media fue 70 años (rango 39-83 años) y el 50% fueron varones. Todos los pacientes presentaron epigastralgia con o sin melena y/o hematemesis; y la ausencia de diarrea persistente o hipoproteinemia severa se observó en 15 casos. El tumor principal se encontró en el cuerpo gástrico en 10 casos (50%), en cardias en 3 casos (15%) y en la transición del cardias al cuerpo en 4 casos (20%); 15 de estos 17 casos (88%) tuvieron tumores en lugares de la curvatura mayor11. La paciente de nuestro caso presentó úlcera penetrada a nivel de cuerpo gástrico que le ocasionó neumoperitoneo.
La mayoría de LCT gastrointestinales son de tipo helper-inductor (CD3 y CD4), pero ocasionalmente se ha descrito casos con fenotipo supresor-citotóxico (CD8)3-5. Nuestra paciente presentó los siguientes marcadores positivos: CD3, CD4, CD8 y CD25 (receptor IL-2 de cadenas alfa), correspondiendo a un fenotipo mixto: helper-inductor, supresor-citotóxico.
La eosinofilia es una respuesta dependiente de células T y ha sido descrita como un rasgo característico de muchos LCT del tracto digestivo2,3,12 incluyendo leucemia/linfoma adulto de células T (ATLL)13,14. Los linfomas asociados a eosinofilia se podrían confundir macroscópicamente e histológicamente con la enfermedad de Crohn, la gastroenteritis eosinofílica y la histiocitosis X10,15 . En nuestra paciente no se encontró eosinofilia periférica ni en el estudio histopatológico.
Este caso corresponde a una rarísima forma de LCT gástrico primario HTLV-1 y VEB negativos. Resulta interesante además por otras razones: 1) lo inusual de la presentación con neumoperitoneo, perforación gástrica, metástasis cutánea, y ausencia de eosinofilia o hipercalcemia, y 2) resalta la importancia de evaluar el estado viral HTLV-1, incluso si procede de un área no endémica.
Aspectos éticos: para la elaboración de este artículo se contó con el consentimiento informado de la paciente y con la autorización del Comité de Ética del HRL.















