Introducción
La Organización Mundial de la Salud (OMS) estima que cada año nacen unos 15 millones de niños pretérmino (<37 semanas de gestación). Oscilando la tasa de nacimientos prematuros entre el 5% y 18% de los recién nacidos. En 2015 aproximadamente un millón de niños menores de 5 años murieron por complicaciones relacionadas con la prematuridad1. Asimismo, el Fondo Internacional de Emergencia de las Naciones Unidas para la infancia (UNICEF), estima que Perú tiene una tasa de mortalidad infantil de 19,6% en menores de cinco años por complicaciones del nacimiento prematuro2.
Según la OMS las complicaciones en prematuros ocasionan un incremento en la morbilidad y mortalidad neonatal, representando un alto costo económico para las familias y la sociedad. Las complicaciones potencialmente mortales en los prematuros son la enterocolitis necrosante (NEC) y la sepsis que están relacionadas con alteraciones en el microbioma intestinal (disbiosis). Además, implica riesgo futuro de asma, atopia, obesidad y enfermedades psicosociales. Por ende, las bacterias entéricas se estiman esenciales para mantener el entorno fisiológico debido a que ejerce efectos protectores, estructurales y metabólicos en el epitelio3.
Los RNP están expuestos a varios factores que afectan el desarrollo de la MI: la hospitalización, la edad gestacional, el uso de antibióticos y la alimentación4. Además, se ha reportado que el factor alimentación tiene gran importancia, afirmando que, la leche materna es el mejor alimento para el prematuro por ser mejor tolerado, y poseer múltiples beneficios por sus componentes bioactivos como oligosacáridos que previenen la colonización de patógenos entéricos, e incluso cuando la leche es de donantes5. En este sentido, Brasil reporta la disminución del 73% de la mortalidad infantil, que atribuye a los bancos de leche humana (BLH); en comparación con las fórmulas artificiales, que se le conceden menos beneficios e incluso se le ha atribuido la incidencia de NEC6. No obstante, Walker et al.7 señaló que la fórmula que contiene prebióticos y probióticos puede ayudar a superar un proceso de colonización inicial inadecuado y establecer un sistema inmune de la mucosa normal.
Por tanto, el objetivo de la presente investigación es determinar la MI en neonatos pretérmino y observar los cambios introducidas por el tipo de lactancia en un hospital de tercer nivel del Perú.
El estudio
Este estudio de enfoque cuantitativo, de diseño observacional - longitudinal. Incluye a recién nacidos pretérmino sin ninguna anomalía gastrointestinal congénita fueron inscritos después de obtener el consentimiento dentro de las primeras 120 h. La recolección de datos fue en un periodo de 8 meses (abril a diciembre) del 2017, en la Unidad de Cuidados Intensivos Neonatales (UCIN) y en la unidad de Neonatología del Hospital Nacional Docente Madre Niño San Bartolomé, Lima-Perú.
Muestra
De los 54 individuos que se obtuvieron muestras para este estudio, solo se tomaron en cuenta 23 neonatos pretérmino (<37ss) que cumplieron con los criterios de inclusión; haber nacido antes de las 37 semanas de gestación, no presentar sepsis en el periodo de estudio y haberse realizado los análisis en los dos tiempos de estudio. La muestra fue dividida en dos grupos de acuerdo con el tipo de alimentación que recibieron hasta el momento del segundo análisis, en un grupo los neonatos alimentados con leche humana (LH) que incluyen los alimentados con leche materna exclusiva y/o leche humana pasteurizada o donada y en el otro los que tomaron lactancia mixta (LM), considerándose a la leche humana y/o fórmula para prematuro.
Recolección de muestras
Las muestras de meconio y heces fueron recolectadas cuando el neonato se encontraba en su incubadora en UCIN o en cuidados intermedios de Neonatología.
El meconio se recolectó desde las primeras horas del nacimiento hasta el quinto día, mientras que la muestra de heces fué el día 30 (± 10 días). Ambas muestras fueron recogidas del pañal del bebé, almacenándose en frascos estériles con la ayuda de paletas estériles, luego fue codificado, manteniéndose en una temperatura de 5ºC para su posterior transporte y análisis.
La identificación, aislamiento y recuento de bacterias se realizó mediante protocolos establecidos en el laboratorio de microbiología de Bioservice SRL, donde se utilizó los medios Baird Parker para Staphylococcus, agar MacConkey para Enterobacteriaceae, en Man Rogosa y Sharpe para Bifidobacterium y Lactobacillus y agar TSC para Clostridium. La identificación presuntiva de las colonias en los agares se realizó mediante evaluación macroscópica, microscópica y pruebas bioquímicas. Luego para el recuento de las colonias cada placa se multiplicó por el factor de dilución y factor de volumen sembrado (UFC/ml = Nº UFC x 10-x x 10), así reportar el número de colonias/ml (UFC/ml).
Instrumentos
Se utilizó fichas para recabar información de la historia clínica como: características sociodemográficas, y datos pre y perinatales; como el peso al nacer, longitud, edad gestacional, tipo de alimentación, uso de nutrición parenteral, uso de antibióticos (la cantidad de antibióticos para cada paciente se midió por días de terapia y se calculó como la suma total del número de días de todos los antibióticos utilizados), etc. Otra ficha para el registro de recolección del primer meconio (con fecha y hora), igualmente para las muestras de heces.
Análisis de datos
La base de datos fue digitada en el programa Microsoft Excel y, posteriormente, fue exportada al paquete estadístico STATA versión 13 para los análisis correspondientes.
Se elaboraron tablas descriptivas con las variables sociodemográficas y clínicas de los neonatos. Donde se mostraron frecuencias para las variables de naturaleza cualitativa mientras que para las variables de naturaleza cuantitativa se mostraron medias y desviaciones estándar.
Por otro lado, las concentraciones de la microbiota en meconio y heces fueron categorizadas según puntos de corte, siendo "ausente" cuando no hubo concentración, "menor" cuando la concentración fue menor a 106 UFC y "mayor" cuando la concentración era mayor o igual a 106 UFC. De esta manera se pudo obtener variables cualitativas que se expresaron en frecuencias en una tabla descriptiva.
Siendo así, para el análisis estadístico inferencial se aplicó la prueba Exacta de Fisher relacionando los distintos tipos de cepas de microbiota en meconio y heces con el tipo de alimentación y las distintas variables cualitativas del estudio. También se ejecutó una comparación de las concentraciones de las cepas de microbiota en meconio y heces de acuerdo al tipo de alimentación recibida mediante la prueba t de student para datos pareados.
Aspectos éticos
El estudio fue aprobado por la Junta de Revisión Institucional de la Universidad Peruana Unión y por el comité de ética del Hospital Nacional Docente Madre Niño San Bartolomé. Esta investigación no incluye experimentos humanos ni el sometimiento de los participantes a un tipo de alimentación, las muestras se distribuyeron de acuerdo con el tipo de alimentación recibida según los protocolos ya establecidos por UCIN y neonatología de la institución de salud.
Hallazgos
Para el análisis de la microbiota intestinal (MI) se utilizaron métodos de cultivos, tanto para describir la MI en muestras de meconio y el desarrollo en heces, en dos grupos de neonatos prematuros; alimentados con LH (n=11) y LM (n=12).
Se presentaron algunos factores que condicionan el estado de la MI entre los cuales podemos observar que el 82,61% de los neonatos fueron prematuros moderados a tardíos y solo el 17,39% fueron muy prematuros. Y al distribuirlos en grupos según tipo de alimentación el grupo LH tuvo neonatos de menor edad gestacional (EG) (32,36 ± 2,98 semanas de EG) mientras que el grupo LM tuvo neonatos mayores (34,25 ± 1,48 semanas de EG). Por otro lado, el uso de antibióticos que fue desigual entre los grupos: los neonatos del grupo LH utilizaron en promedio 11,09 ± 15,21 días mientras que el grupo LM solo estuvo en terapia antibiótica por 3,92 ± 4,25 días (Ver Tabla 1).
Tabla 1 Características demográficas y clínicas de los neonatos pretérmino. Hospital Nacional Docente Madre Niño San Bartolomé, UCIN- Neonatología. 2017.
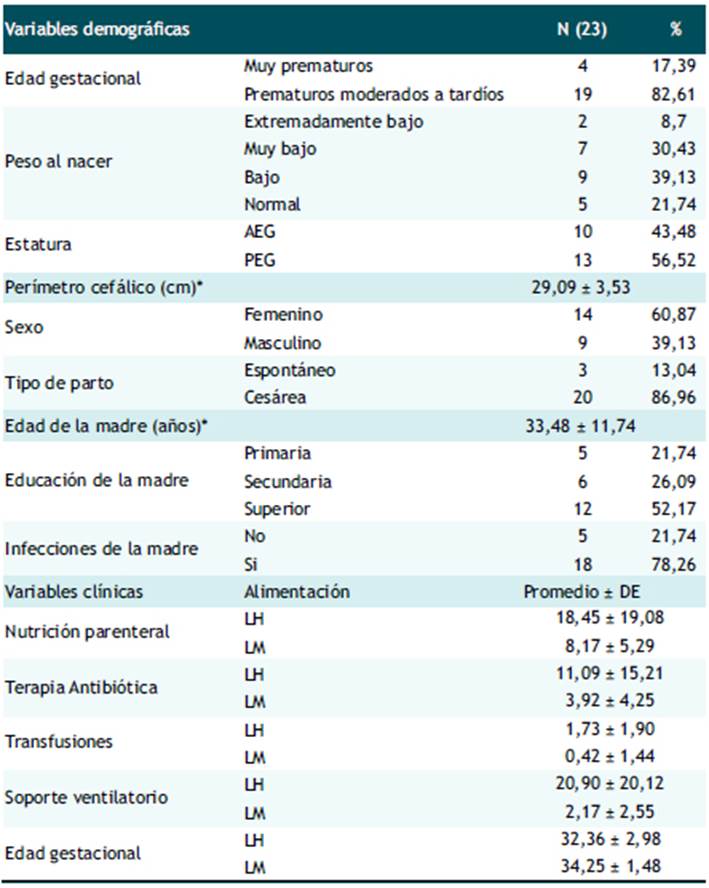
Tabla 2 Prevalencia de géneros en muestras de meconio y heces. Hospital Nacional Docente Madre Niño San Bartolomé, UCIN-Neonatología. 2017.
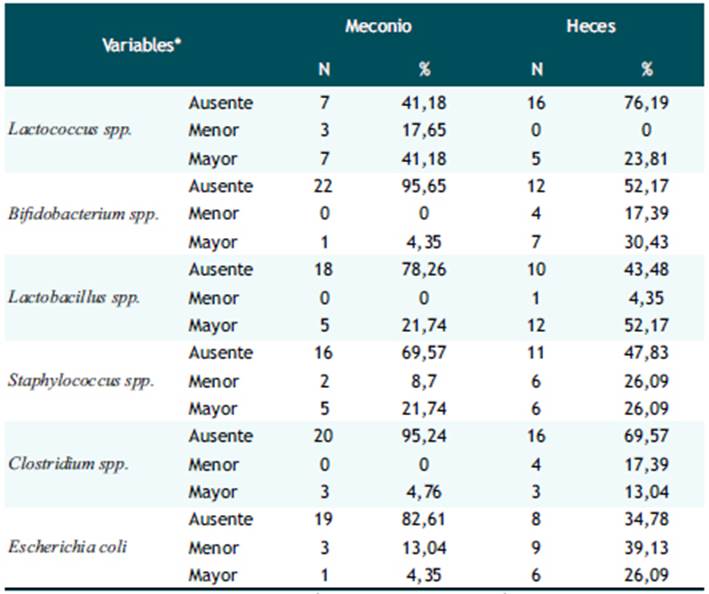
*AUSENTE: sin UFC; MENOR: UFC menor a 106; MAYOR: UFC mayor a 10 6
Los Lactococcus fueron los géneros predominantes en meconio encontrándose en el 58,83% de las muestras, de los cuales el 41,18% tuvieron más de un millón de UFC. Seguido por los Staphylococcus y Lactobacillus que se mostraron en el 30,4 y 21,74% respectivamente, y en ambos géneros el 21,74% tuvo un recuento mayor de un millón de UFC. Mientras que los bifidobacterium estuvieron ausentes el 95,65%, Clostridium en el 95,24% y E. coli en el 82,61% (Ver Tabla 2).
Asimismo, en el 23,81% de las muestras de heces hubo presencia de Lactococcus, mientras que el 56,52% (n=13) tuvieron presencia de Lactobacillus de los cuales 12 obtuvieron un recuento bacteriano mayor de un millón. Por otro lado, el 52,18% de las muestras de heces presentaron Staphylococcus, el 65,22% Escherichia coli y el 30,43% Clostridium. En cuanto a las Bifidobacterium en el 47,83% de las muestras se encontró presencia de este género y en la mayoría observó un recuento > 1 000,000 UFC (Ver Tabla 2).
Tabla 3 Relación entre los géneros y tipo de alimentación en heces. Hospital Nacional Docente Madre Niño San Bartolomé, UCIN-Neonatología. 2017.
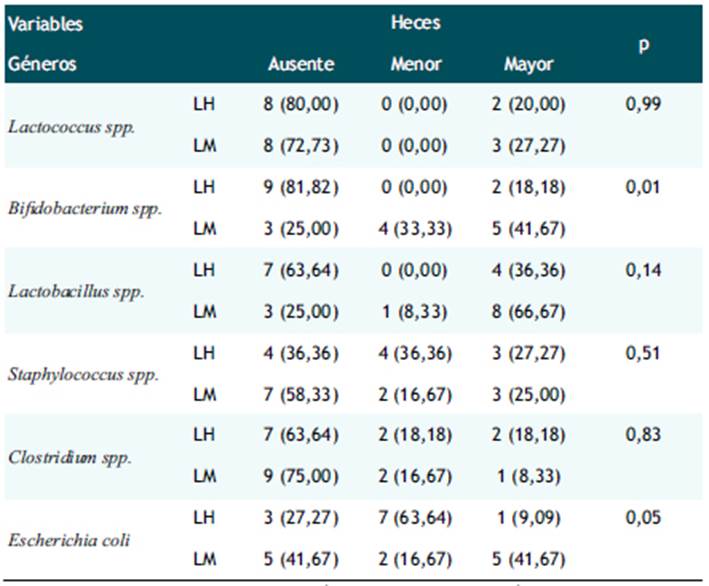
*AUSENTE: sin UFC; MENOR: UFC menor a 106 ; MAYOR: UFC mayor a 10 6
En relación a la concentración del género Lactobacillus fue el más abundante tanto en las heces como el meconio de los neonatos, y también se pudo observar un aumento del meconio a heces. Los géneros de Staphylococcus y Lactococcus también se encontraron abundantemente en el meconio, los cuales disminuyeron en las muestras de heces, por otro lado, en las heces, aumentó la concentración de Bifidobacterium y E coli mientras que Clostridium disminuyó levemente (Ver Figura 1).
Se demostró que existe correlación estadísticamente significativa entre Bifidobacterium y E. Coli con respecto al tipo de alimentación, mientras que Lactococcus, Lactobacillus, Staphylococcus y Clostridium no tienen correlación.
Tabla 4 Cambios en la abundancia de los géneros de la microbiota intestinal. Hospital Nacional Docente Madre Niño San Bartolomé, UCIN- Neonatología. 2017.
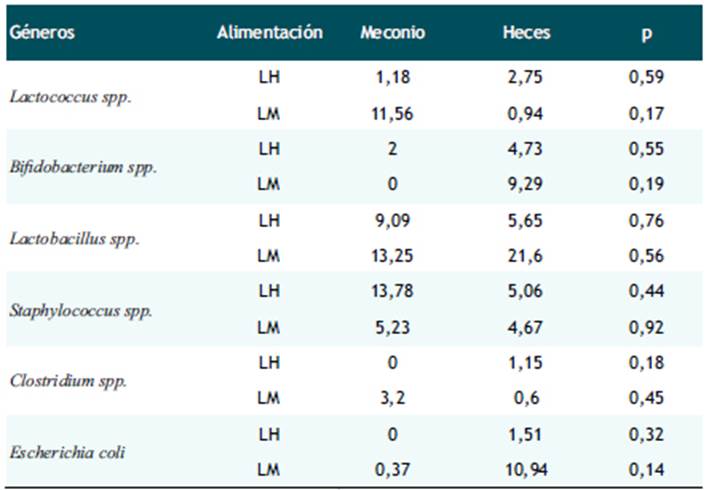
Valores correspondientes a heces y meconio están descritos en concentraciones; P representa la significancia.
Finalmente, en la comparación de las concentraciones (UFC) de los distintos géneros de la microbiota intestinal, en meconio y heces segregados según el tipo de alimentación que recibieron los neonatos, indicó que a pesar de haber una diferencia entre las concentraciones de los géneros en las muestras de meconio y heces no es significativo ver Tabla 4).
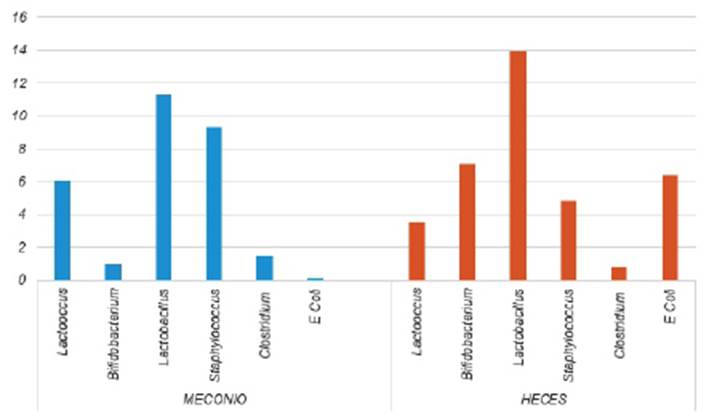
Figura 1 Abundancia de los géneros de la microbiota intestinal (UFC*106). Hospital Nacional Docente Madre Niño San Bartolomé, UCIN- Neonatología. 2017.
Además, se puede observar que el 75% de los neonatos alimentados LM presentaron Bifidobacterium spp., y Lactobacillus spp en heces, mientras que las muestras de LH solo tuvieron una prevalencia del 18,18% y 36,36%, respectivamente. Por otro lado, la prevalencia de E. coli en las heces del grupo LH, fue del 72,73% pero su abundancia fue menor de un millón de UFC a diferencia de los que recibieron LM, donde el 58,34% de las muestras tuvieron E. coli pero su concentración fue mayor de un millón (Ver Tabla 3).
Discusión
El 82,61 % de la población total tuvieron una edad gestacional entre 32 a <37 semanas y solo el 17,39 % tuvieron entre 28 a <32 semanas. Además, el 86,96% (n=20) de los niños nacieron por cesárea. Y el 56,52% recibió profilaxis antibiótica (Ver Tabla 1), siendo así que las características clínicas y demográficas reportan que los neonatos han sido expuestos a factores que influyen en la composición de la microbiota intestinal8.
Una de las limitaciones del estudio incluye el tamaño de muestra, siendo pequeño; por lo tanto, la inferencia con respecto a la causalidad es limitada. Sin embargo, se han encontrado relaciones significativas entre la microbiota intestinal y el tipo de alimentación. En general, se pudo describir mejor los géneros encontrados en muestras de meconio y heces, además su relación con el tipo de alimentación. En su mayoría los estudios con los que se discuten los resultados fueron realizados por técnicas moleculares y solo Moles et al., utilizó dos técnicas (cultivo y molecular).
Entre las bacterias encontradas en el meconio predominó el género Lactococcus (58,52%) seguido de Staphylococcus (30,43%) y Lactobacillus (21,74%). Especies semejantes encontró Moles et al., en España (2013)9 reportando que el género predominante fue Staphylococcus en el 50% de las muestras, asimismo Drell et al., en Estonia (2014)10, describió una prevalencia del 70%. Este predominio de la familia Staphylococcaceae en la MI de los recién nacidos, Adlerberth et al., lo ha relacionado con una mejor condición higiénica durante el parto11 mientras Itani et al.,12 lo relacionó con el parto por cesárea y la edad gestacional siendo que los neonatos <33 ss de EG tienen mayor prevalencia de Staphylococcus (p=0,036). Además, Drell hizo una correlación entre una mayor abundancia del género Staphylococcus y la edad gestacional en neonatos de EBPN concluyendo que, el riesgo de adquirir infecciones a través de la colonización por Staphylococcus es máximo en la primera semana de vida10. Además, según Gosalbes et al., la MI del meconio puede estar agrupada en dos tipos diferentes de acuerdo a la diversidad bacteriana, riqueza y composición, MI menos diversa y dominada por bacterias entéricas se asocia significativamente con un historial de eccema atópico en la madre (P = 0,038), mientras que si es dominada por bacterias ácido lácticas está asociado significativamente con problemas respiratorios en el lactante (P = 0,040)(13).
Por otro lado, los resultados del estudio reportaron que, en las heces, el género más prevalente fue Escherichia coli (65,2%) seguido de Lactobacillus (56,52%) y Staphylococcus (52,17%), resultados similares encontró Moles et al.,9 donde la prevalencia fue de Enterococcus (93%) seguida de E. Coli (71,4%) y Staphylococcus (50%). Las diferencias entre los resultados pueden atribuirse a la metodología de los estudios, siendo que Moles utilizó más recursos y medios de cultivos además del método molecular por lo cual pudo describir todas las bacterias presentes en la MI, mientras que en este estudio se cultivaron una limitada cantidad de géneros bacterianos.
En contraste, Drell et al.10, encontró mayor prevalencia de Enterococcus (aprox. 80%) Staphylococcus (aprox. 65%) y Escherichia (aprox. 40%). Lo que puede estar relacionado según Jiménez et al., con el tipo de alimentación, evidenciando que los bebes alimentados con leche materna tuvieron mayor prevalencia de Staphylococcus Epidermis específicamente, a diferencia de los alimentados con fórmula para prematuro14. Al mismo tiempo, en el presente estudio el 47,83% de las muestras de heces fueron colonizadas por Bifidobacterium spp., prevalencia mayor a la reportada por Moles et al.15, (<10%) y Jacquot, et al.16, (11%) quienes reportaron pocos neonatos colonizados por este género; tales resultados pueden atribuirse según Jacquot a la edad gestacional, señalando que la diversidad bacteriana aumenta más lentamente en neonatos extremadamente prematuros (EG <28 semanas) que en lactantes prematuros moderados (EG 28 semanas). Resultados que pueden ser acogidos en esta investigación, para atribuir la mayor prevalencia y abundancia de Bifidobacterium encontrados a que el 82,61% de los neonatos nacieron con una EG >32 semanas16. Por último, el género Lactobacillus fue el más abundante en ambas muestras de meconio y heces. Resultados que difieren con Drell et al.,10 donde el género más abundante en meconio fue Staphylococcus y en heces Escherichia / Shigella. Estas diferencias halladas se pueden atribuir al país de origen, puesto que la microbiota intestinal puede variar significativamente entre países de bajos ingresos y de altos ingresos17.
La relación entre el tipo de alimentación y MI en heces determinó que los neonatos alimentados con leche mixta, tuvieron mayor prevalencia y abundancia significativa de Bifidobacterium (p= 0,01) y Escherichia Coli (p = 0,05) que los alimentados con leche humana. Resultados similares encontró Cong et al., (2017)18 donde los neonatos alimentados con LM (LME + FPP) adquirieron la mayor abundancia de Bifidobacteriales durante los primeros 30 días de vida. Asimismo, Gregory et al.19, obtuvo mayor abundancia de Enterobacteriales y Bifidobacteriales en neonatos mayores de tres semanas postnatales que tomaron FPP.
Así mismo, Gregory sugiere que la EG (o la madurez intestinal) tuvo tanta influencia sobre la diversidad del microbioma como cualquier régimen dietético19. Del mismo modo, Penders asoció el uso de antibióticos con una disminución del número de Bifidobacterium y Bacteroides8, pudiéndose atribuir también en este estudio, porque los neonatos del grupo LH estuvieron más expuestos al uso de antibióticos (11,09 días en promedio) que los del grupo LM (3,92 días en promedio). Por último, Zhou et al.,20 menciona que Escherichia / Shigella mostró un patrón creciente antes del inicio de la NEC, lo que puede llevarnos a inferir que los neonatos alimentados con fórmula están más expuestos a NEC como se ha sugerido antes6.
Finalmente, no se observaron cambios estadísticamente significativos en el desarrollo de todos los géneros estudiados desde la primera muestra de meconio (<5 días) a la segunda de heces a los 30 días (±10) para ninguno de los dos grupos de alimentación. A diferencia de Drell et al.10 que encontró en su estudio que la prevalencia y abundancia de Escherichia aumentó significativamente (P = 0,04 y P < 0,01, respectivamente) entre una semana y un mes de edad.
Siendo el aumento de la prevalencia de 17% a 41%, valores que presentan una similitud al de este estudio donde la prevalencia aumento de 17% a 65%. También encontró que la abundancia de Staphylococcaceae (el género más abundante perteneciente a esta familia fue Staphylococcus) disminuyó significativamente (P <0,001), a diferencia de este estudio; donde la abundancia de este género también disminuyó, pero no se muestra significativo, pudiendo estar relacionado con la población de estudio (n=50) comparado con la de este estudio (n=23), que además estuvo subdividida en grupos de estudio (LH y LM).
Por otro lado, se pudo observar una tendencia diferente en la MI de acuerdo al tipo de alimentación, los del grupo de LH aumentaron la abundancia (UFC) de Lactococcus y Clostridium mientras que Lactobacillus disminuyeron al contrario del grupo LM, donde aumentó el número de UFC de Lactobacillus y disminuyó Lactococcus y Clostridium. Similar a lo reportado por Gregory19, donde los grupos LME y LHP tuvieron aumento más rápido de Clostridiales en comparación con el grupo FPP; sugiriendo una interacción dinámica entre el hospedador y la selección dietética de miembros específicos del microbioma que se ve alterado por la alimentación.
Los resultados indican que el tipo de alimentación tuvo un efecto significativo sobre los conteos bacterianos y la composición de la microbiota fecal, siendo la E. coli la especies más prevalente, adquiriendo una menor abundancia en los niños alimentados con LH que los alimentados con LM. En general, el análisis del meconio y las heces de los bebés prematuros revelaron baja diversidad de géneros y alta variabilidad interindividual. Asimismo, la identificación y caracterización de estos organismos y su interacción con el huésped deberían conducir a nuevas investigaciones que amplíen el efecto del tipo de alimentación sobre la MI y nuevas terapias que ayuden a disminuir los patógenos asociados con la sepsis y la NEC que lleve a una homeostasis de la MI.
Los neonatos alimentados con leche humana tuvieron una microbiota intestinal con un menor desarrollo de bacterias entéricas, como la Eschericha Coli (p=0,05). Por tanto, hay una tendencia diferente en la microbiota intestinal de acuerdo con el tipo de alimentación.















