Introducción
Parada cardiaca súbita (PCS) y muerte cardiaca súbita (MSC) se refieren al cese súbito de la actividad cardiaca con subsecuente colapso hemodinámico debido a taquicardia ventricular (TV), fibrilación ventricular (FV), actividad eléctrica sin pulso; o asistolia. El evento se denomina PCS (MSC abortada) si alguna intervención restaura la circulación y MSC si el paciente fallece. Sin embargo, por convención, el término MSC describe tanto a la parada cardiaca fatal y no fatal[1]. La MSC se define como la muerte "natural" inesperada por causa cardíaca que ocurre generalmente en menos de una hora desde el inicio de los síntomas en personas sin condiciones previas que parecerían fatales1,2.
La MSC ocurre más frecuentemente en pacientes con enfermedad cardiaca estructural, especialmente, enfermedad arterial coronaria1. La MSC en personas con corazones normales es menos común y explica el 10-15% de casos de MSC3-6. Series recientes muestran un incremento de MSC en individuos jóvenes con corazón normal (hasta 40% de casos)3-5. En estos pacientes, las causas de MSC son variadas y en algunos casos desconocida1,3-6. La identificación de los factores que precipitan una arritmia potencialmente letal y ponen en riesgo a un paciente de sufrir MSC sigue siendo un reto mayor.
Presentamos como viñeta clínica el caso de una mujer de mediana edad que cursó con MSC secundaria a hipokalemia severa e hipertiroidismo. Además, realizamos una revisión sistemática con el objetivo de identificar las causas de MSC asociada a hipokalemia en sujetos de ≥15 a <65 años de edad sin enfermad cardiaca estructural.
Reporte del caso
Viñeta clínica: MSC en un paciente con hipopotasemia severa y tirotoxicosis
Mujer de 42 años, quien refería pérdida involuntaria de 6 kg de peso durante último mes, desde 3 semanas antes de su ingreso a emergencia tomaba tiamazol 30 mg/día por diagnóstico de hipertiroidismo. Aproximadamente 8 días antes de su ingreso, inicia con fiebre, astenia, malestar general y tos. Tres días antes del ingreso se agregó disnea, odinofagia, dolor abdominal, hiporexia, náuseas, vómitos, e ictericia. Negaba diarrea, palpitaciones y consumo alcohol o sustancias ilícitas.
Examen clínico: peso 45 kg, talla 1.5 m, PA 110/70 mm Hg, FR 28 r.p.m., FC 132 l.p.m., temperatura 39.5 °C, SatO2: 92% con oxigeno ambiental. Lucía deshidratada, ictérica, sin exoftalmos. Piel caliente y húmeda, llenado capilar normal. Placas blanquecinas sobreelevadas en paladar, lengua y orofaringe. Tiroides difusamente agrandada, no dolorosa. Ap. respiratorio: taquipnea, murmullo vesicular disminuido y crépitos en tercio medio de hemitórax izquierdo. Ap. cardiovascular: ruidos cardiacos hipercinéticos, no soplos. S. neurológico: alerta, sin déficit focal, tremor en manos, hiperreflexia patelar y aquílea.
Se diagnosticó neumonía e hipertiroidismo. Se inició hidratación parenteral, ceftriaxona 2 g IV cada 24 horas, y levofloxacino 750 mg VO cada 24 horas. Tras su ingreso, se identificó neutropenia febril e hipokalemia severa. Se agregó cloruro de potasio a la solución de hidratación parenteral. Tres días después de su ingreso se diagnosticó agranulocitosis secundaria a tiamazol y muguet oral, por lo que se inició ceftazidima 2 g IV cada 8 horas, amikacina 1g IV cada 24 horas, hidrocortisona 100 mg IV cada 8 horas, propranolol 40 mg VO cada 12 horas, solución de Lugol 5% 6 gotas VO cada 6 horas, fluconazol 150 mg VO cada 24 horas y se suspendió tiamazol. Dos días después, y por mejoría clínica de la neumonía, la paciente fue transferida del Servicio de Emergencia a Medicina Interna. Nueve días después de su ingreso presentó arritmia cardiaca, la evaluación cardiológica identificó extrasístoles ventriculares polimorfas e intervalo QT prolongado (Figura 1). Se ordenó ecocardiograma y holter, y reevaluación con resultados. No se indicó ninguna terapia antiarrítmica. El ecocardiograma se realizó el mismo día siendo normal y el holter no se pudo realizar. Algunas horas más tarde, la paciente presentó PCS. Se identificó FV, y se realizó reanimación cardiopulmonar y descargas sucesivas de 100, 150, 200, y 300 Joules, se administró 3 dosis de epinefrina de 1mg cada una, sin lograse recuperar pulso.
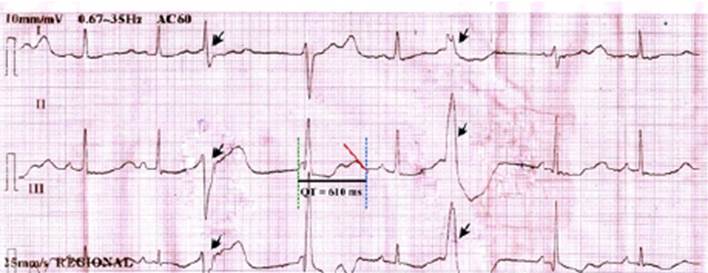
Figura 1 Segmento de ECG: Ritmo sinusal, eje normal, frecuencia cardiaca 70 l.p.m., extrasístoles ventriculares (puntas de flechas negras), intervalo QT 610 ms (línea negra sólida), intervalo QTc 659 ms (fórmula de Bazzet).
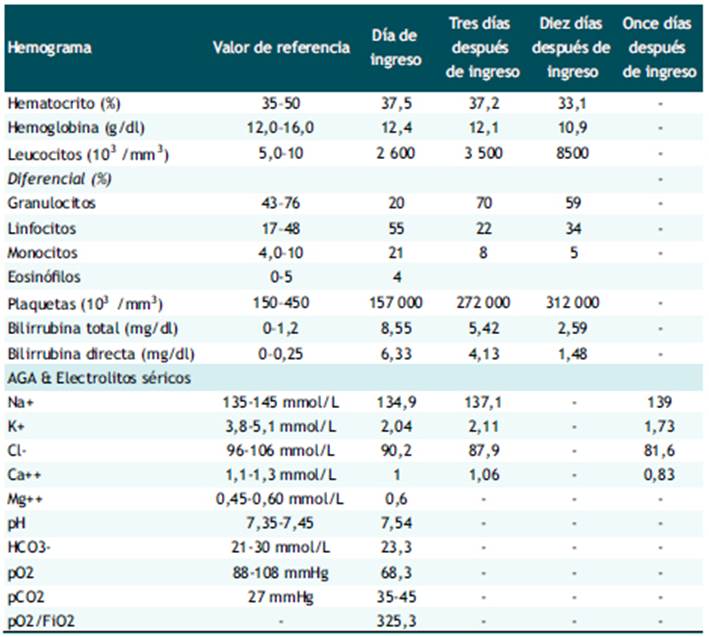
La analítica se resume en la Tabla 1, donde resaltan la hipokalemia severa persistente e hipocalcemia que pasaron inadvertidos tras su ingreso. Los últimos valores de electrolitos séricos fueron agregados a la historia clínica después del deceso de la paciente. La bioquímica sanguínea, con excepción de las bilirrubinas, fue normal. Los resultados de hormonas tiroideas fueron: TSH <0,005 mU/ml (rango de referencia 0,27 - 4,20), T4 libre 7,54 ng/dl (rango de referencia: 0,9 - 1,7), T3 libre 14,39 pg/ml (rango de referencia 2,02 - 4,43). No se midieron electrolitos, osmolalidad ni densidad urinaria. El urocultivo, coprocultivo, serología para VIH, hepatitis B y C fueron negativos. La ecografía abdominal fue normal y la radiografía de tórax mostró un pequeño infiltrado alveolar en hemitórax izquierdo.
Aspectos éticos
El familiar de la paciente otorgó su consentimiento informado para el reporte de caso. Se contó con la aprobación del Comité de Ética e Investigación del Hospital Regional Lambayeque.
Revisión sistemática
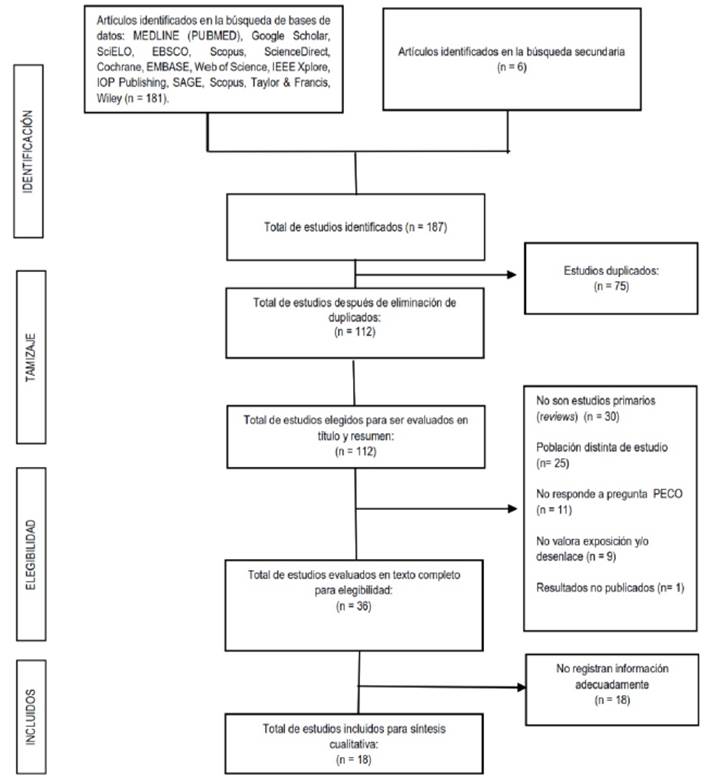
Para elaborar la presente revisión sistemática seguimos la guía Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA). Se realizó una búsqueda exhaustiva de artículos relevantes en Medline (PubMed), Google Scholar, Scielo, EBSCO, Scopus, Science Direct, Cochrane, EMBASE, Web of Science, IEEE Xplore, IOP Publishing, SAGE, Taylor & Francis y Wiley hasta el 30 de noviembre del 2021. Las búsquedas en las bases de datos electrónicas se realizaron usando tanto términos de vocabulario controlado (MeSH o Emtree) como términos libres siguiendo la estrategia PECO (Population: patients aged ≥15 to <65 years); Exposure: hypokalemia; Comparator: normokalemia OR hyperkalemia; Outcome: sudden cardiac arrest OR sudden cardiac death). La estrategia de búsqueda en cada base de datos se detalla en Material Suplementario. El protocolo excluyó los casos de MSC en <15 y ≥65 años, puesto que, las causas de MSC son diferentes en estos grupos etarios. En el primer grupo son más frecuentes la enfermedad cardiaca congénita, arritmias y miocarditis2,5, mientras que en los adultos mayores la principal causa de MSC es la cardiopatía isquémica1. El protocolo fue inscrito en PROSPERO (CRD42021288839). El proceso de selección de estudios se detalla en la Figura 2.
Tabla 2 Estudio incluidos en esta revisión sistemática.
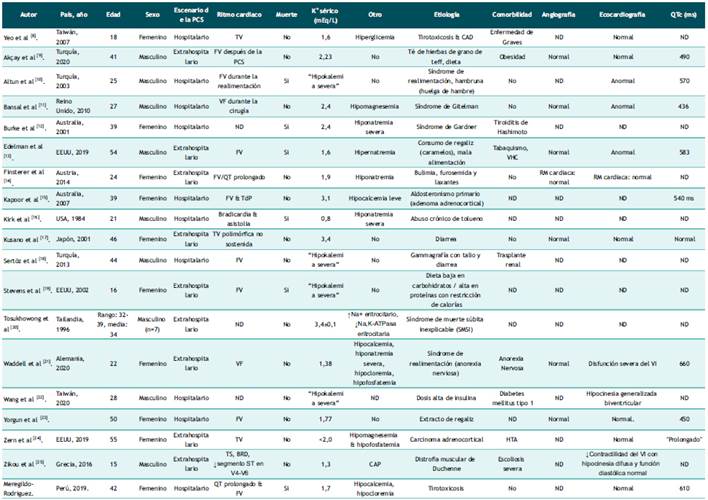
ND: No descrito o no determinado; FV: fibrilación ventricular; TV: taquicardia ventricular; TdP: Torsade de Pointes; TS: taquicardia sinusal; BRD: bloqueo de rama derecha; CAD: cetoacidosis diabética; VHC: infección por virus de la hepatitis C; HTA: hipertensión arterial; RM: resonancia magnética; VI: ventrículo izquierdo.
Incluimos artículos en texto completo o resumen. No hubo restricciones de idioma o año de publicación. Establecido el protocolo de revisión, se distribuyeron copias electrónicas a los autores. Para el proceso de revisión por pares se utilizó el software Rayyan™. Los artículos fueron evaluados por dos revisores ciegos (MGAR y GVT) y las discrepancias se resolvieron por un tercer revisor (EDMR). Todos los estudios incluidos fueron reportes de casos, series de casos y estudios observacionales. Las referencias de los artículos obtenidos y las revisiones pertinentes se analizaron en busca de artículos adicionales. También incluimos nuestro propio caso en la cohorte. Los datos se presentaron como media, desviación estándar (DE) y rango para las variables continuas y número de casos con porcentajes para las variables categóricas.
La información más relevante de cada estudio incluida fue: autor, país y año de publicación, edad y sexo del paciente, escenario de la PCS, ritmos cardíacos que precedieron o siguieron a la reanimación inicial de una PCS ("arritmias peri- paro cardíaco"), Se registró también el resultado (muerte), nivel de potasio sérico y otras alteraciones electrolíticas ácido-base, etiología final del PCS, comorbilidad, hallazgos angiográficos y ecocardiográficos y duración del intervalo QTc. Se ingresó los datos en Microsoft Excel™.
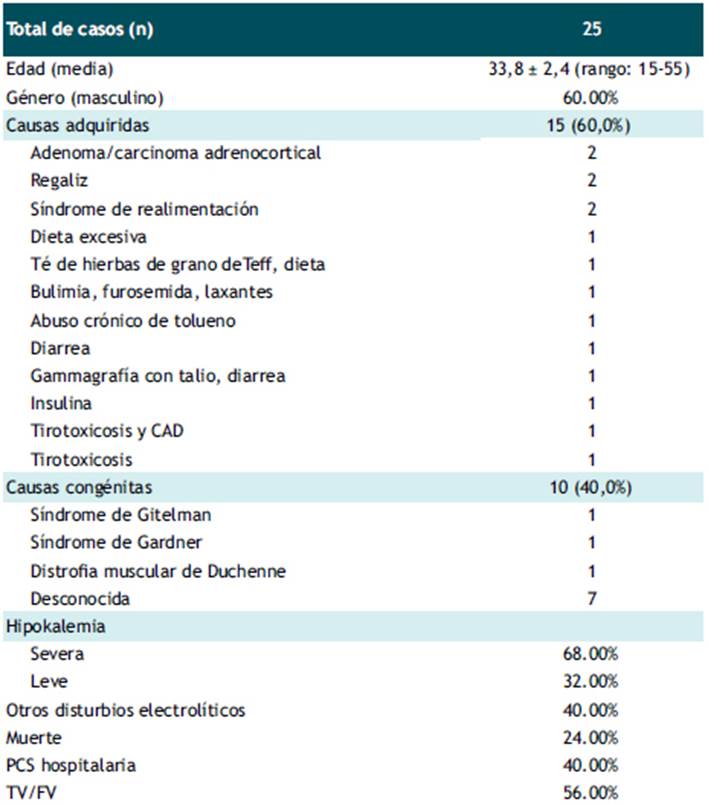
La búsqueda exhaustiva identificó 18 estudios que incluyeron 25 casos de PCS asociada a hipokalemia en pacientes adolescentes, jóvenes y adultos de mediana edad (rango: 15-55 años) sin enfermedad cardíaca estructural manifiesta. Los detalles de los estudios se enumeran en la Tabla 2 y las características de los casos se resumen en la Tabla 3. Los estudios excluidos y la razón de su excusión se detallan en Material Suplementario. La edad media de todos los casos fue de 33,8 ± 2,4 años (rango: 15-55 años), y 15 casos fueron varones. El 60% de casos correspondieron a etiologías adquiridas. En cuanto a los factores atribuibles a la PCS, al menos el 24,0% se relacionó con alguna anomalía dietética. La tirotoxicosis fue la etiología de PCS en el 8% de los casos de esta serie, uno de estos casos la tirotoxicosis se presentó de manera aislada y el otro asociado a cetoacidosis diabética. La hipopotasemia grave se presentó en casi el 70% de estos episodios de PCS. El 60% de casos no se asociaron con otras anomalías electrolíticas. La mayoría de PCS ocurrieron fuera del hospital y la arritmia peri-parada cardiaca más frecuente fue la TV/FV. Solo el 24% de los episodios de PCS resultaron en la muerte.
Discusión
Hasta donde sabemos, esta es la primera revisión sistemática que recopila reportes y series de casos de MSC asociados a hipopotasemia en personas adolescentes, jóvenes y de adultos de mediana edad (≥15 a <65 años) sin enfermedad cardíaca estructural. Así mismo, el caso descrito como viñeta clínica de MSC corresponde a una mujer de mediana edad sin enfermedad cardiaca previa, en quien la PCS se debió a hipokalemia severa e hipocalcemia asociada a tirotoxicosis. Nuestra paciente no tenía antecedentes familiares ni personales de cardiopatía y el ecocardiograma resultó normal, lo cual aleja -aunque no excluye- la posibilidad de cardiopatía estructural previa. De hecho, en los estudios incluidos en la presente revisión (Tabla 2) la definición de "ausencia de enfermedad cardiaca estructural" fue muy heterogénea, realizándose en algunos casos en base a la anamnesis, ecocardiograma, coronariografía, resonancia magnética nuclear cardiaca, o diferentes combinaciones de éstas8-25. Por el contrario, el análisis genético de mutaciones asociadas a síndrome de QT largo (KCNQ1, KCNH2, SCN5A, KCNE1 y KCNE2) suele realizarse con mucha menos frecuencia20,23.
Aunque comúnmente se cree que la asociación de tirotoxicosis e hipokalemia severa es característica de la parálisis periódica tirotóxica, los pacientes con hipertiroidismo pueden tener otras causas de hipokalemia como vómitos, diarrea, uso de diuréticos o laxantes, o tubulopatías renales congénitas (síndrome de Gitelman o Bartter) o adquiridas(26, 27). La hipokalemia en el hipertiroidismo se atribuye a la entrada del potasio al intracelular debido a actividad incrementada de la bomba Na+/K+-ATPasa26. El exceso de hormonas tiroideas incrementa el nivel de catecolaminas circulantes acrecentando la actividad de Na+/K+-ATPasa. De igual manera, los corticoides aumentan los niveles de insulina, lo que a su vez activa la Na+/K+-ATPasa27.
La tasa de excreción de potasio urinario, estado ácido-base sanguíneo, y la presión arterial son indicios útiles para definir la etiología de la hipokalemia. La presencia de alcalosis metabólica hipoclorémica y normotensión sugieren tubulopatía renal inducida por tirotoxicosis, diarrea, vómitos, o uso de diurético27. En nuestra paciente, no hubo evidencia de pérdidas extrarrenales de potasio. Sin bien inicialmente, la paciente cursó con vómitos, éstos ya no se presentaron después del ingreso, mientras que la hipokalemia persistió, incluso se tornó más severa. Por tanto, la causa más probable de la hipokalemia e hipocalcemia en este caso parece ser la tirotoxicosis misma o una tubulopatía inducida por la tirotoxicosis26,27. Es posible que la administración de corticoides también haya contribuido al desorden electrolítico. Sin embargo, en el presente caso no pudimos evaluar la presencia de alguna tubulopatía ya que no medimos la excreción urinaria de potasio.
El mecanismo exacto de MSC en un paciente individual frecuentemente es difícil de establecer, ya que la mayoría de pacientes no está siendo monitorizado al momento de la PCS. Por tanto, el mecanismo solo se puede inferir con base en la información obtenida después de producido el evento. No obstante, existen casos en los cuales el evento iniciante ha sido atestiguado o registrado como ocurrió en el caso de nuestra paciente. Tal como encontramos en el presente estudio, la TV/FV explican la mayoría de episodios de PCS. Las bradiarritmias y asistolia son causas menos comunes de MSC, presentándose en 10% de casos documentados con monitoreo ambulatorio2,4,6,18.
Más del 90% de las víctimas de MSC tienen alguna anormalidad cardiaca estructural previamente conocida o no, particularmente enfermedad coronaria. La MSC en pacientes con corazones aparentemente normales (en la autopsia) es responsable de entre el 10-40% de casos de MSC en pacientes con corazón normal3-6. Estos pacientes sin enfermedad subyacente son usualmente jóvenes (< 40 años). A pesar de una cada vez mejor comprensión fisiopatológica y desarrollo de métodos refinados de diagnóstico y tratamiento la MSC sigue siendo una preocupación mayor3.
Es probable que, la mayoría de pacientes con MSC sin enfermedad cardiaca estructural aparente no tengan en realidad corazones "normales", sino que nuestras herramientas diagnósticas actuales no permitan aún la identificación de algunas anormalidades estructurales o funcionales. En el pasado, la etiología de muchas de estas muertes fue consideradas "idiopáticas"; aunque, posteriores evaluaciones más exhaustivas han identificado la causa de la MSC como un desorden eléctrico primario (QT largo, Wolff- Parkinson-White, TV polimórfica catecolaminérgica, y síndrome de Brugada) en muchos de estos pacientes2,3,7.
Un hallazgo interesante del estudio de Choi DS et al. fue que la PCS hipokalémica se asoció con mejores resultados neurológicos (OR = 4,45; IC95% 1,67-11,91) y mayor supervivencia (OR = 2,25; IC95%: 1,05-4,82) comparada con la kiperkalemia o normokalemia28. De manera similar, Lin YR et al. reportaron que la función cardiaca post-resuscitación y la hemodinamia precoz se asociaron con el nivel de potasio sérico. Los pacientes con hiperkalemia tuvieron mayor probabilidad de bradicardia, arritmias, oliguria, acidosis, y menor supervivencia comparada con los pacientes con niveles de potasio bajos o normales29. Este resultado es concordante con nuestros hallazgos, ya que en esta revisión sistemática solo el 24% de los episodios de PCS hipokalémica resultaron en la muerte. Si bien, en el estudio de Choi DS et al. la supervivencia en aquellos que presentaron PCS hipokalémica fue menor que en nuestro estudio (32,6% versus 76,0%), ésta resultó significativamente más alta comparado con los grupos que presentaron PCS normokalémica (14,3%) e hiperkalémica (4,0%)13. Es importante notar que la mediana de la población en el estudio de Choi DS et al. fue 70 años, mientras que la mediana en nuestro estudio fue 33 años, lo cual explicaría esta diferencia en la supervivencia.
De acuerdo a nuestros resultados, el 60% de PCS ocurren fuera del hospital, lo cual concuerda también con otros estudios7,29,30. Así mismo, en aquellos pacientes que sufren PCS fuera del hospital la FV y TV son las causas más etiologías más comunes29,30. El estudio de Choi DS et al. incluyó exclusivamente pacientes que sufrieron PCS extra- hospitalaria, y se describe que en el 47.8% de 46 pacientes que presentaron PCS hipokalémica se identificó algún "ritmo desfibrilable pre-hospitalario", aunque no se especifica cuál28.
A nuestro entender, esta es la primera revisión sistemática acerca de las etiologías de la MSC asociada a hipokalemia. Empero, reportamos algunas limitaciones. Primero, de acuerdo a nuestro protocolo no consideramos estudios que incluyeron pacientes <15 años y ≥65 años de edad ya que en estos grupos etarios las causa de MSC son distintas2,3,7. La hipokalemia como etiología de MSC en estos grupos de edad rara vez ha sido descrita. Segundo, en la presente revisión sistemática excluimos un estudio realizado en Korea que incluía 46 pacientes que sufrieron MSC hipokalémica extrahospitalaria, debido a que no se especificaban algunas variables de interés para el presente estudio como la edad del paciente, padecimiento de alguna cardiopatía, la causa de la hipokalemia, entre otras28. Tercero, en la presente revisión sistemática es muy probable que exista sesgo de información debido al sesgo de publicación de estudios que reportan desenlaces favorables. Es decir, es posible que existan casos de PCS/MSC hipokalémica con resultado fatal que no se publicaron, lo cual podría explicar también la poca mortalidad que encontramos en este estudio.
Concluimos que, la tirotoxicosis es una causa infrecuente de MSC/PCS hipokalémica. La finalidad de esta revisión es resaltar la importancia del reconocimiento de la hipokalemia como causa inadvertida de QT prolongado, TV/FV y PCS. Además, es importante reconocer adecuadamente a la hipokalemia como causa de MSC/PCS por 2 razones: Primero, en nuestro estudio, la hipokalemia severa se presentó en casi el 70% de episodios de MSC y el intervalo QTc estuvo prolongado en 90% de casos en los que éste se pudo registrar.
Segundo, existe evidencia que indica que la PCS hipokalémica se asocia a mejor pronóstico neurológico y supervivencia, comparada con la PCS asociada a kiperkalemia o normokalemia.