Introducción
Síndrome corazón izquierdo hipoplásico (SCIH) se caracteriza por la presencia de un ventrículo izquierdo hipoplásico, con aorta ascendente hipoplásica, con estenosis severa o atresia de la válvula aórtica y mitral1. El origen de las causas es multifactorial y su relación con la pobreza podría impactar en países como América del sur2.
El SCIH representa el 8-12% de los defectos cardíacos congénitos en lactantes con enfermedad cardiaca crítica3. Siendo responsable del 25% de las muertes en la primera semana de vida4. La incidencia estimada de las cardiopatías congénitas en niños menores de 1 año en el Perú con SCIH es de 0,23 por mil nacidos vivos5.
El manejo anestésico es desafiante en pacientes con SCIH de alto riesgo e inestables, sometidos a procedimientos híbridos en etapa I que son estrategias emergentes6, que pospone los riesgos mayores de la reparación quirúrgica como es el procedimiento de Norwood7.
La técnica anestésica se basa en mantener el equilibrio de la circulación pulmonar y circulación sistémica conservando los mismos parámetros del preoperatorio8, optimizando estrategias de ventilación9. El uso de opioides proporciona estabilidad cardiovascular y atenúa potencialmente la respuesta inflamatoria, no hay estudios concluyentes sobre administración racional de opioides10. Los agentes volátiles proporcionan protección miocárdica mediante preacondicionamiento isquémico, sin embargo la evidencia no se traduce de lo experimental al entorno clínico11.
La supervivencia de los pacientes con SCIH después de banding pulmonar bilateral como estrategia de rescate, antes del procedimiento de Norwood, se reporta al mes de 88,2% y a los 5 meses estabilizándose en 70,6%12. La supervivencia en centros seleccionados informan son superiores al 90% en procedimientos de Norwood13.
En este caso clínico se describe el manejo anestésico del paciente con SCIH inestable sometido a procedimiento banding pulmonar bilateral antes del procedimiento de Norwood Sano.
Reporte de caso
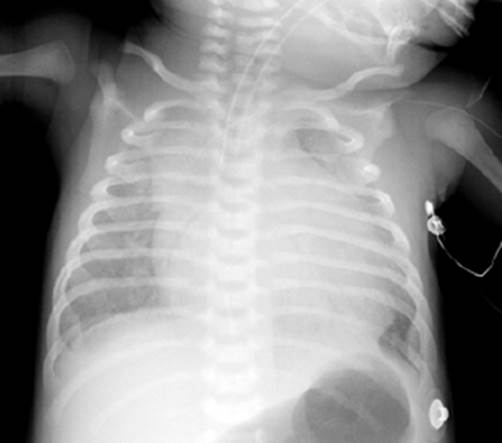
Neonato varón de 12 días con peso de 4,5 kg ingresó a la unidad de cuidados intensivos, ventilando espontáneamente con saturación de oxígeno de 87% (SaO2 %), con infusión de prostaglandina a dosis baja, con estudios de ecocardiografía, tomografía y radiografía compatible con SCIH (Figura 1, Figura 2). Antecedentes perinatales: parto por cesárea por sufrimiento fetal a las 37 semanas, test de APGAR 9/10 al minuto y 5 minutos, con 5 controles prenatales sin intercurrencias. Luego del nacimiento cianosis progresiva en extremidades, taquipnea persistente y desaturación.
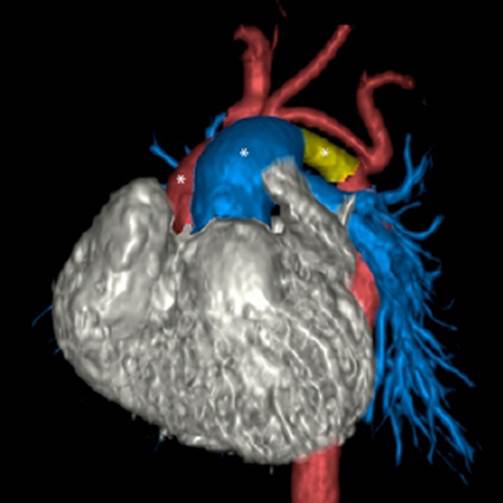
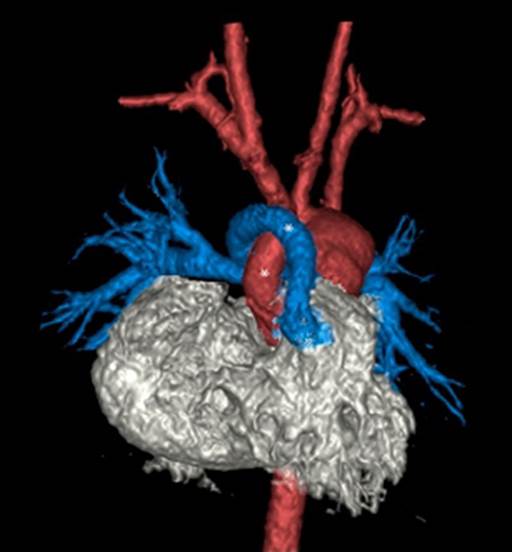
Figura 1 Tomografía cardiaca. Rojo: hipoplasia de aorta ascendente y arco distal. Azul: arteria pulmonar. Amarillo: ductus arterioso persistente.
Durante su evolución presenta paro cardiorespiratorio, con maniobras de reanimación avanzada recupera ritmo sinusal, por su inestabilidad hemodinámica se decide cirugía paliativa de rescate sin circulación extracorpórea (CEC).
Paciente ingresa a sala de operaciones intubado en ventilación mecánica controlada (CMV): volumen tidal (VT) 24 ml, frecuencia respiratoria (FR): 20 por minuto, presión al final de la espiración (PEEP): 9 mmHg, fracción inspirada de oxígeno (FiO2): 21%; drogas vasoactivas (dopamina, dobutamina), se continua con prostaglandina. Se realizó la inducción anestésica a predominio de opioide con fentanilo 5 microgramos/kilogramos (ug/kg), rocuronio 1.2 miligramos/kilogramos (mg/kg) y respecto al mantenimiento anestésico fentanilo 4 microgramos/kilogramo/hora (ug/kg/hr), rocuronio 5 mg por bolos, sevoflurano 0.8 % de concentración alveolar mínima (CAM %). Se procede a la monitorización estándar: electrocardiograma (ECG) de 5 derivadas, saturación de oxígeno pre-postductal, línea arterial femoral derecha: catéter N° 22, presión venosa central (PVC) en yugular interna derecha con catéter N° 4 french (Fr), temperatura nasofaríngea, espectroscopía cercana al infrarrojo (NIRS) unilateral derecho, capnografía, analizador de gases inhalatorio, analizador de gases arteriales, electrolitos séricos y diuresis. Procedimiento quirúrgico con apertura de tórax, se realiza banding pulmonar bilateral: colocación de banda a la rama pulmonar derecha de 3.2 mm y banda a la rama pulmonar izquierda de 3.3 mm, limitando mecánicamente el flujo pulmonar. El paciente tolera el procedimiento paliativo satisfactoriamente.
Al quinto día del postoperatorio continua hemodinámicamente compensado con signos de buena perfusión tisular, con infusión de drogas inotrópicas (dopamina) y vasodilatadores (nitroprusiato sódico). Una vez resuelta la emergencia se realiza junta médica para procedimiento electivo de Norwood Sano.
Ingresa a sala de operaciones para cirugía programada de Norwood Sano con CEC primera etapa del manejo SCIH; se continúa con las drogas vasoactivas, vasodilatadoras y prostaglandina. Respecto al manejo anestésico se empleó la técnica balanceada a predominio de opioide (fentanilo) con el objetivo de mantener el cociente entre flujo pulmonar y sistémico cercano a la unidad. Tabla 1 - Tabla 2.
Tabla 1 monitoreo y soporte hemodinámico en el perioperatorio del procedimiento de norwood sano.
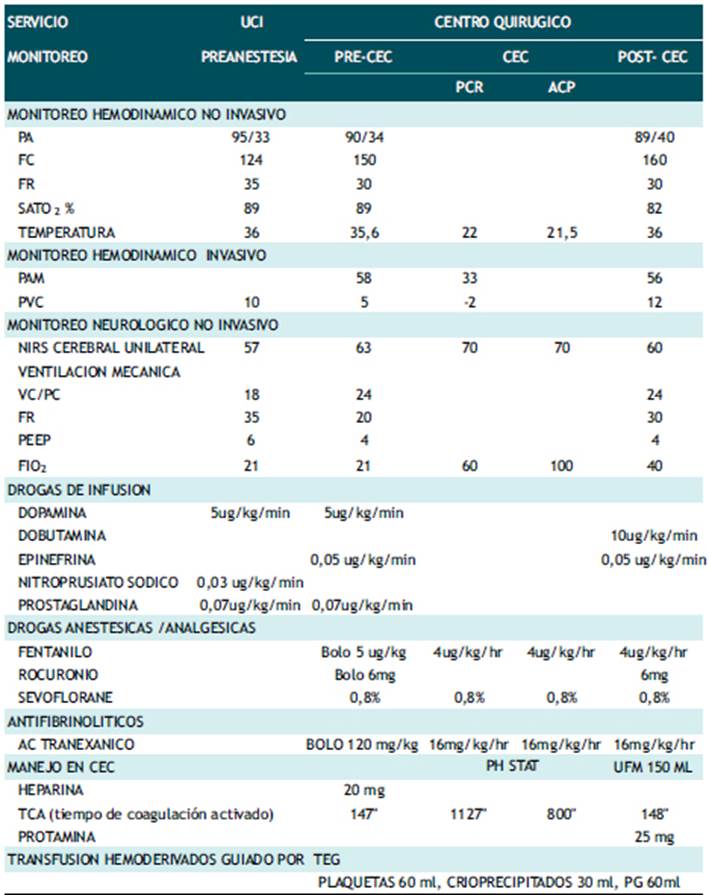
CEC: Circulación Extracorporea, PCR: Perfusión Cerebral Regional, ACP: Arresto Circulatorio Programado, TEG: Tromboelastrografía, UFM: Ultrafiltración Modificada; VC/PC: Volumen Control/Presión Control, PG: Paquete Globular, CAM: Concentración Alveolar Mínima
Tabla 2 Monitoreo gasométrico en procedimiento de norwood sano.
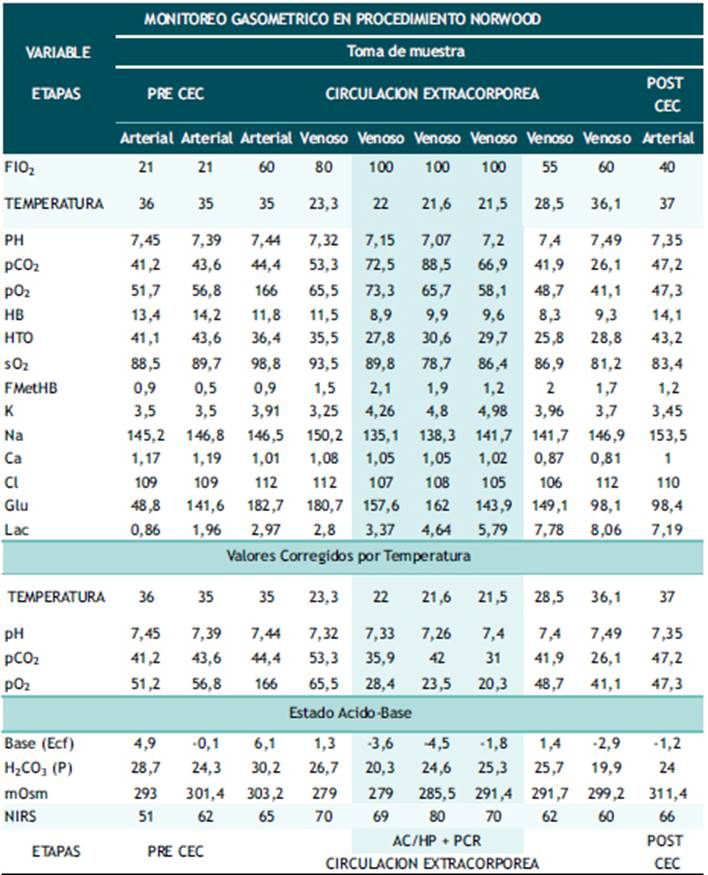
AC/HP + PCR: Arresto Circulatorio/Hipotermia Profunda + Perfusión Cerebral Regional
Luego de la apertura del tórax se procede a la anticoagulación completa con canulación de la arteria innominada a través de un tubo de injerto, canulación venosa bicaval y la técnica de perfusión cerebral regional anterógrada necesario durante el arresto circulatorio. El procedimiento de Norwood Sano se realizó con colocación de tubo de injerto de 6 mm de ventrículo derecho a arteria pulmonar más reconstrucción de la neoaorta con la técnica de chimenea y retiro del banding pulmonar bilateral (Figura 3). Se empleó un tiempo de CEC de 5 horas 6 minutos, tiempo de clampaje de aorta 3 horas 17 minutos, tiempo de arresto cardiaco 3 horas 9 minutos. Se utilizó custodiol para protección miocárdica, el manejo de gases se realizó con pH-stat e hiperoxia durante el arresto cardiaco e hipotermia profunda, el hematocrito dilucional mínimo fue de 27%. Al término de CEC se realizó ultrafiltración modificada por 10 minutos. A la salida de CEC se mantuvo estable con el soporte inotrópico (dobutamina, adrenalina), ventilación mecánica controlada por presión. La reversión de la anticoagulación se realizó con protamina; con cierre de tórax diferido. La revisión de hemostasia sin intercurrencias y la transfusión de hemoderivados fueron guiadas por tromboelastografía (TEG). El antifibrinolítico utilizado fue ácido tranexámico en bolo antes de la incisión quirúrgica y continuando con infusión hasta el final de la cirugía.
Evolución postoperatoria hemodinámicamente compensado, con drogas inotrópicas y vasodilatadores. El cierre de tórax fue a las 96 horas de la cirugía. Finalmente es extubado en el día 15 del postoperatorio. Actualmente paciente en seguimiento por el servicio de Cardiopediatría de la institución.
Discusión
En los pacientes con SCIH inestables con ductus arterioso adecuado y comunicación interauricular no restrictivo se debe considerar cirugía paliativa con banding pulmonar bilateral de emergencia, este debería realizarse en la primera semana de vida, estrategia que controla el flujo sanguíneo pulmonar12. En nuestro paciente con las características mencionadas se realizó el procedimiento paliativo donde el manejo anestésico tuvo el objetivo de equilibrar la relación del flujo pulmonar y sistémico cercano a la unidad para lograr un buen gasto cardiaco, con respecto a la anestesia general se limitó al uso de fentanilo, rocuronio y sevoflurano (medicamentos disponibles en nuestra institución) para lograr estos principios14.
Zajonz et al., prefieren anestésicos endovenosos a pequeñas dosis repetidas de midazolam (0,1-0,2 mg/kg), fentanilo (5-10 ug/kg), ketamina en pacientes inestables (0,5 a 1 mg/kg ) e inhalatorio isoflurano, sevoflurano (0,5-1% de CAM), relajante muscular (cisatracurio), analgésicos (paracetamol) y sedantes de acción corta (dexmedetomedina, clonidina) para reducir la dosificación de opioides y lograr una extubación temprana, lo cual es una medida segura después de la etapa híbrida paliativa6,7,15,16.
Respecto a la ventilación mecánica, las maniobras de hipoventilación con VT 8-12 ml/kg, PEEP 3-5 mmHg, FR 4-8 por minuto, manteniendo presión parcial de oxígeno (PaO2) entre 40-45 mmHg con SaO2 % de 75-80 %, hipercarbia con presión parcial de dióxido de carbono (PaCO2) entre 45-55 mmHg, aun así estas intervenciones ventilatorias son incapaces de reducir el cociente flujo pulmonar y sistémico (Qp/Qs) muy por debajo de 2:1 por lo que se requiere asegurar un aumento del gasto cardiaco para un adecuado suministro de oxígeno y presión de perfusión coronaria como lo recomienda Nars y Cols17.
Tabutt et al., concluyen en su estudio que en condiciones de ventilación controlada bajo anestesia general, el uso de una mezcla hipóxica (FiO2 17%) e hipercápnica con fracción inspirada de dióxido de carbono (FiCO2) al 2,7% llevan a un equilibrio de Qp:Qs cercano a la unidad 1:1 aumentado la resistencia vascular pulmonar. La mezcla hipercápnica da como resultado un mejor suministro de O2 sistémico, mayor presión arterial media y mayor saturación de O2 a nivel cerebral monitoreada con NIRS9.
Una vez estabilizado hemodinámicamente nuestro paciente y considerando la anatomía del SCIH se decidió por el procedimiento del Norwood Sano. La edad óptima se considera de 2 a 7 días, siendo la edad avanzada un factor de riesgo. No obstante, no hay evidencia que sugiera contraindicación del procedimiento de Norwood en niños mayores a 14 días, como en nuestro caso, que conlleven a una mayor mortalidad7. El plan anestésico para la reparación quirúrgica del Norwood en la I etapa del SCIH se realiza con CEC. Durante la inducción se utilizaron anestésicos endovenosos, de preferencia opioides como el fentanilo de 25-50 ug/kg que brinda analgesia, estabilidad hemodinámica y disminuye la respuesta al estrés, previa a la derivación de la cirugía cardiaca11. En cuanto al mantenimiento anestésico, protección cerebral y renal no encontramos evidencia clínica actual7. Los ensayos experimentales de los anestésicos volátiles tienen efecto beneficioso porque inducen protección miocárdica mediante el preacondicionamiento anestésico10.
La estrategia de neuroprotección utilizada durante la CEC fue la perfusión cerebral regional anterógrada que en combinación con el NIRS cerebral es útil para detectar problemas en la perfusión cerebral y se correlaciona con la saturación venosa de oxígeno cuyo objetivo es mantener entre 75-85% garantizando una adecuada entrega de oxígeno8.
En CEC no existe un consenso durante los procedimientos de Norwood existiendo amplias variaciones interinstitucionales7,18. Una limitante de este caso clínico fue la duración prolongada del arresto circulatorio programado, en comparación a instituciones internacionales con mayor afluencia de casos.
Después del procedimiento del Norwood Sano, a la salida de CEC, sigue siendo una etapa crítica por lo que requiere soporte inotrópico y/o vasodilatador, en nuestro caso se utilizó adrenalina con dosis bajas y dobutamina. Dosis altas de catecolaminas deben evitarse y agentes reductores de la postcarga como la milrinona es de preferencia. Un estudio evaluó el uso de milrinona después de la cirugía cardiaca pediátrica, comprobando que reduce los riesgos de síndrome de bajo gasto cardiaco19.
Finalmente se procedió a la revisión de hemostasia monitorizándose con el uso de TEG. Faraoni et al., encontraron asociación entre la transfusión de hemoderivados en neonatos y niños sometidos a cirugía cardiaca con una mayor incidencia de complicaciones trombóticas sin monitoreo de la coagulación intraoperatoria19.
Conclusiones
El SCIH requiere de procedimientos por intervencionismo y/o quirúrgico oportunos por su elevada morbimortalidad. El manejo anestésico puede realizarse mediante una técnica balanceada inhalatorio o endovenosa basada en opioides para lograr el objetivo de equilibrar la relación de flujo pulmonar y sistémico cercano a la unidad, junto a las maniobras de ventilación mecánica que nos permite manipular las resistencias vasculares y el flujo sanguíneo. En cuanto a la monitorización estándar es importante el neuromonitoreo durante el perioperatorio y su seguimiento.
Aún sigue siendo limitados los estudios respecto a la anestesia en esta primera etapa, a medida que la supervivencia siga mejorando se deben sumar esfuerzos multidisciplinarios para fortalecer los centros que manejan estas cardiopatías congénitas complejas.