INTRODUCCIÓN
El Lupus Eritematoso Sistémico (LES) de inicio tardío afecta a personas mayores de 50 años y ocurre en menos del 20% del total de casos de LES, como consecuencia del descenso de su incidencia con el envejecimiento 1. Los adultos mayores con LES tradicionalmente tienen un inicio de síntomas insidioso y menor incidencia de manifestaciones severas y orgánicas, con menor actividad de enfermedad, en comparación con los pacientes jóvenes 2. Sin embargo, en estos pacientes esta patología se asocia con una mayor prevalencia de comorbilidades, lesión orgánica y un peor pronóstico 3.
La presentación atípica del LES de inicio tardío lo hace de difícil diagnóstico, especialmente en los adultos mayores donde se presenta sintomatología divergente con respecto a su diagnóstico de fondo 4. El LES puede causar diferentes presentaciones neurológicas como: accidente cerebro vascular (ACV), demencia, convulsiones y entre las más raras: polineuropatía desmielinizante 5. No obstante, en el adulto mayor esta sintomatología puede atribuirse a otras patologías más frecuentes o a sus posibles comorbilidades asociadas, lo cual demoraría el diagnóstico final de LES y por ende el tratamiento oportuno 6.
Presentamos un reporte de caso de una paciente adulta mayor con polineuropatía periférica mixta causando debilidad generalizada, que se exacerbó rápidamente por un ACV hemorrágico, lo cual dificultó el diagnóstico de fondo de LES de inicio tardío por varios meses. Además, realizamos una búsqueda rápida sobre reporte de casos previos similares.
Hemos realizado una búsqueda sistemática rápida de la literatura en dos bases de dados: PubMed y Scopus en diciembre 2021. Se buscó por reporte de casos o series de casos de pacientes con LES de inicio tardío cuya manifestación inicial incluía alguna forma de polineuropatía periférica a los 60 años o más. Se excluyeron los casos que tenían antecedente de LES diagnosticado, y también se excluyeron otro tipo de estudios donde no se detallaban datos individuales de los pacientes. No se excluyó ninguno por fecha de publicación ni por lenguaje. Se siguieron las recomendaciones de Preferred Reporting Items for Systematic Reviews and Meta-Analyses 7. Se utilizaron palabras claves como: polineuropatía, poli radiculopatía, lupus y adulto mayor para la estrategia de búsqueda.
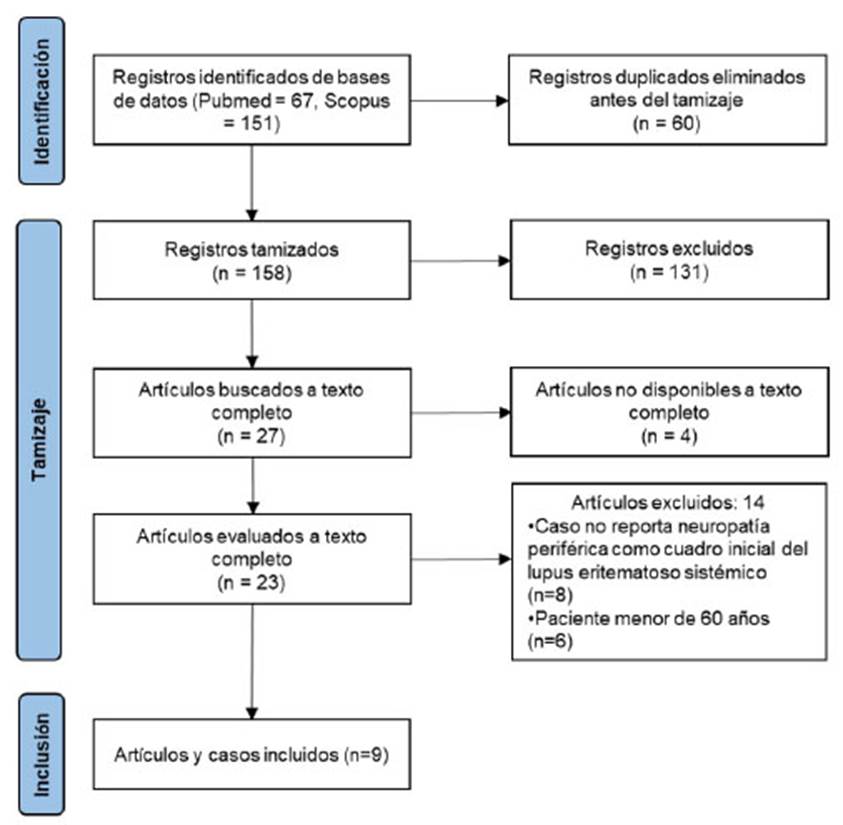
Se encontraron 218 registros, de los cuales se excluyeron 60 por estar duplicados, quedando 158 finalmente. Se buscó revisar 27 artículos a texto completo, pero no se tuvo acceso a cuatro de ellos, evaluando 23 artículos a texto completo. De estos, se eliminaron ocho artículos por no presentar neuropatía periférica como cuadro inicial del LES y seis por incluir pacientes menores de 60 años (Figura 1). Finalmente, se seleccionaron nueve artículos que reportaron algún tipo de neuropatía periférica como manifestación inicial del LES de inicio tardío 8,9,10,11,12,13,14,15,16 (Tabla 1).
Tabla 1 Casos reportados de neuropatía periférica como inicio del cuadro clínico del lupus eritematoso sistémico de inicio tardío
| Autor y año | Género y edad | Cuadro clínico | Tipo de neuropatía periférica | Tiempo de diagnóstico de LES desde inicio de neuropatía periférica | Tratamiento | Desenlace |
| Wada, 1992 8 | Varón de 63 años | Vejiga neurogénica | Mononeuropatía autonómica | Simultáneo | Prednisolona 40 mg y metilprednisolona 1gr por tres días | No mejoría de cuadro neurológico a los 18 meses |
| Bodi, 1998 9 | Varón de 72 años | Debilidad simétrica distal en miembros inferiores. Pérdida de reflejos y de sensibilidad | Polineuropatía mixta simétrica | ND | Pulsos de metilprednisolona y ciclofosfamida | Muerte después de 10 meses por vasculitis ulcerativa severa en piel |
| Matsuki, 1999 10 | Mujer de 61 años | Debilidad en pie izquierdo e hiperestesia en miembros inferiores | Polineuropatía mixta simétrica | ND | Metilprednisolona, mizoribina, e inmunoadsorción | Mejoría parcial a los 6 meses |
| Siatkowsli, 2001 11 | Mujer de 66 años | Pérdida de visión bilateral progresiva sin dolor por una semana. Parestesias en pierna izquierda por un año. | Mononeuropatía del quiasma óptico | Un año | 5 días de metilprednisolona y prednisona oral por 6 semanas | Mejora de visión a los 3 meses. Desarrolla mielitis transversa al año que responde a corticoides |
| Omdal, 2004 12 | Mujer de 74 años | Disfagia y disfonía por 6 meses. Luego, paro respiratorio | Mononeuropatía motora del nervio frénico | 6 meses | Ciclofosfamida IV 1000 mg y metilprednisolona cada 4 semanas. Prednisona 5 mg diario. | Recuperación parcial y extubación de ventilación mecánica a las 8 semanas |
| Harscher, 2007 13 | Mujer de 71 años | Parestesia simétrica en pies, dolor brazo izquierdo. Estatus epiléptico | Polineuropatía axonal mixta | 3 meses | Metilprednisolona, inmunoadsorción selectiva de Ac Ro. Ciclofosfamida y azatioprina | Recuperación parcial dos años y medio después |
| Durmus, 2010 14 | Mujer de 68 años | Parestesias y debilidad en miembros inferiores | Polineuropatía axonal mixta | 2 meses | Prednisona 40 mg/día y ciclofosfamida 1000 mg/mes | Mejora completa al año de seguimiento |
| Zhang, 2017 15 | Varón de 65 años | Adormecimiento y debilidad progresiva en cuatro extremidades | Polineuropatía mixta simétrica | 2 semanas | Pulsos de corticoesteroides | Recuperación parcial después de dos semanas |
| Nakamagoe, 2019 16 | Mujer de 61 años | Hipoestesia y debilidad simétrica en ambas piernas. Parálisis oculomotora de ojo derecho | Polineuropatía simétrica mixta desmielinizante Mononeuropatía del nervio oculomotor derecho | 6 meses | Tres pulsos con metilprednisolona (1000 mg/pulso) distribuido en tres semanas. Prednisona 30 mg/día | Mejoría completa de parálisis oculomotora a los nueve meses |
| Presente caso | Mujer de 71 años | Parestesia y debilidad simétrica en miembros inferiores | Polineuropatía simétrica mixta desmielinizante | 6 meses | Prednisona 20 mg. y cloroquina 250 mg. por día | Cinco años después resolución casi completa de síntomas neurológicos |
ND: No disponible
REPORTE DE CASO
Paciente mujer de 71 años, natural de Andahuaylas, procedente de Lima, acudió en abril del 2014 al servicio de Emergencia del Hospital Nacional Hipólito Unanue. Refería que desde hace cinco días presentaba dolor intenso tipo quemazón en planta de los pies, asociado a adormecimiento en ambos miembros inferiores y pérdida de la fuerza muscular a predominio del hemicuerpo derecho, que impedían la deambulación.
Al examen neurológico se encontraba despierta, lúcida, y orientada. Presentaba disminución de la fuerza muscular de miembros superior e inferior derecho, con signo de Babinzky negativo. Tenía presión arterial de 160/100 mmHg, frecuencia cardiaca de 115 lat./min. y saturación de oxígeno de 97% ambiental. El resto del examen físico no fue contributorio. Inicialmente fue diagnosticada como síndrome focal agudo neurológico por posible ACV. No se realizó tomografía axial computarizada (TAC) cerebral por no disponibilidad en hospital. Se obtuvieron como exámenes de laboratorio: albúmina en 2,7 g/dL y glucosa al azar 109 mg/dL. El hemograma y otras pruebas bioquímicas se encontraban en valores normales. La paciente recibió como tratamiento inicial: ranitidina 50 mg. cada 8 horas y dimenhidrinato 50 mg. cada 8 horas por vía endovenosa. La paciente presentó una evolución favorable, sin complicaciones, con funciones físicas normales, pero sin recuperar por completo la fuerza muscular, razón por la cual se le dio de alta al siguiente día, con indicación de realizarse una TAC cerebral, control por consultorio externo y terapia física.
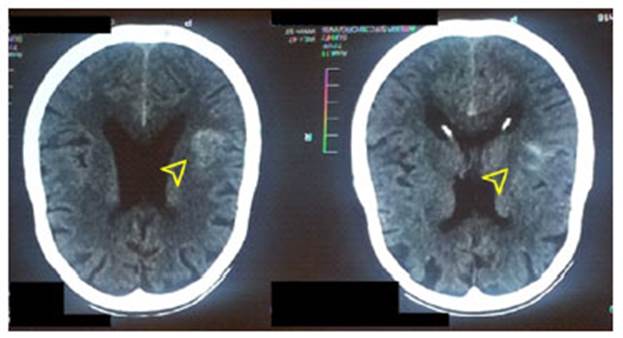
Una semana después, en consulta externa de neurología, se le diagnosticó hipertensión arterial no controlada (presión arterial 180/95 mmHg), déficit motor en miembros inferiores, paraplejia aguda y lumbalgia crónica con espondilo artrosis. La TAC cerebral evidenció una hemorragia subaguda intraparenquimatosa subcortical en el hemisferio izquierdo, la cual no se modificó durante el control al mes siguiente (Figura 2). Se le indicó: enalapril 10 mg. cada 8 horas, tramadol/paracetamol 37,5/325 mg. cada 12 horas, flunarizina 10 mg. cada 12 horas por vía oral y terapia física.
Se evidencia hemorragia intraparenquimatosa ubicada en el hemisferio izquierdo (Flecha amarilla). leve hidrocefalia y degeneración cortical.
Cinco meses después del cuadro clínico inicial, la paciente fue evaluada por el servicio de geriatría, donde se amplió la anamnesis. La paciente refería historia de edema declive, dolor generalizado a predominio de columna lumbar y disminución de fuerza muscular en miembros inferiores, astenia, caída de cabello, anorexia y baja de peso desde hacía aproximadamente seis meses (un mes antes del cuadro clínico inicial). La paciente se encontraba en silla de ruedas, realizaba pasos cortos con apoyo y presentaba disminución de movilidad en miembros inferiores. Además, se evidenció alopecia no cicatricial difusa en el cuero cabelludo, y limitación funcional por dolor y leve edema en articulaciones de miembros inferiores. Nuevos exámenes auxiliares evidenciaron: ácido fólico 5,4 ng/mL, vitamina B12 266 pg/mL, proteína C reactiva 0,83 mg/L, anticuerpos antinucleares (+) con patrón moteado grueso 1/320, y Elisa VIH, RPR para sífilis, serología HTLV-1 y 2 no reactivos.
Adicionalmente, la electromiografía evidenció una polirradiculoneuropatía crónica severa de tipo primariamente axonal, sensitivo-motora, desmielinizante de cuatro extremidades a predominio distal y de miembros inferiores. Principalmente se afectaron los nervios surales derecho e izquierdo con latencias prolongadas y amplitudes conservadas del potencial de acción, y los nervios peroneo profundo y tibial posterior bilateral con amplitud del potencial de acción disminuida. Además, mostró compromiso de los músculos peroneo lateral largo, gemelos, vastos internos bilateral con la acción muscular compuesta evocada con duración aumentada, amplitud aumentada, polifasia aumentada, y patrón de interferencia incompleta asociados a denervación tipo ondas positivas ++. Se le diagnosticó polineuropatía simétrica mixta desmielinizante sin déficit importante de vitamina B12 ni ácido fólico, hipertensión arterial controlada, desnutrición calórica proteica, secuela de hemorragia intraparenquimatosa y enfermedad de tejido conectivo: probable LES. Se indicó ácido fólico 400 mcg. por día, tiamina 100 mg. por día, piridoxina 50 mg. por día; complejo B12 en cápsulas 2 veces por día, losartan 50 mg. una vez al día, tramadol/paracetamol 37,5/325 mg. cada 12 horas, amitriptilina 25 mg. por día y como tratamiento inmunosupresor: prednisona 20 mg. y cloroquina 250 mg. por día, continuando con la terapia física.
El 05 de noviembre, dos semanas luego del inicio del tratamiento inmunosupresor, se evidenció una recuperación parcial de la fuerza muscular de las cuatro extremidades, disminución de dolor y edema articular en miembros inferiores, con posibilidad de deambulación asistida por corto tiempo y presión arterial estable. Se confirmó el diagnóstico de LES de inicio tardío con manifestaciones neurológicas y se mantuvieron los diagnósticos previos, continuando con el tratamiento instaurado.
En enero del siguiente año, la paciente refirió mejoría, capacidad de deambulación por sí misma con fuerza muscular conservada, disminución del dolor en articulaciones de miembros inferiores y de la astenia. Sin embargo, se evidenció facies cushingoide, por lo que se disminuyó la dosis de prednisona. Durante los siguientes meses, la paciente fue evaluada por neurología, que indicó gabapentina 300 mg. cada 8 horas, ácido alfa lipoico, 600 mg. cada 24 horas y terapia física. Durante el seguimiento de la paciente se le diagnosticó gastritis crónica, depresión leve, osteoporosis y síndrome de ojo seco, por lo cual recibe tratamiento por las especialidades correspondientes. En diciembre del 2015, un año después del inicio del tratamiento inmunosupresor, la paciente presentaba mejoría significativa de síntomas, a pesar de leves parestesias tipo quemazón en miembros inferiores. Continuaba con terapias físicas y las pruebas de laboratorio inmunológicas evidenciaban anticoagulante lúpico (-) y anticardiolipina IgM, IgA e IgG (-).
Durante los controles posteriores no se evidenció reactivación de LES y se controló la presión arterial, parestesias y lumbalgia. Hasta abril del 2020, la paciente tenía un seguimiento estricto cada tres meses y con el siguiente tratamiento: para el LES recibía deflazacort 6 mg. con hidroxicloroquina 400 mg. una vez al día; para la polineuropatía, gabapentina 300 mg. y amitriptilina 25 mg. una vez al día; para la osteoporosis, calcio carbonato 500 mg diario, alendronato 70 mg. semanal y vitamina D 400 UI, una vez al día; y para el control de la hipertensión arterial, 50 mg. de losartan una vez al día. Sin embargo, en mayo del 2020 la paciente falleció por neumonía por COVID-19, sin alguna referencia a la reactivación del LES.
DISCUSIÓN
Presentamos el caso de una paciente de 71 años que acudió a Emergencia, por debilidad generalizada y pérdida de fuerza muscular de un mes de evolución, la cual aumentó súbitamente luego de un ACV hemorrágico. La paciente presentó una evolución tórpida durante los siguientes meses, hasta la sospecha de probable neuro lupus de inicio tardío. Este diagnóstico fue confirmado cumpliendo criterios diagnósticos, con exámenes de laboratorio y con la respuesta terapéutica a inmunosupresores, los cuales produjeron una mejoría significativa al primer mes.
La frecuencia de LES de inicio tardío es alrededor del 19% del total de los pacientes con LES 17 dependiendo del punto de corte de edad, la cual varía entre 50-65 años 2. El LES de inicio tardío tiene una presentación clínica diferente, teniendo un inicio insidioso con manifestaciones clínicas inespecíficas, como artralgias, alteraciones hematológicas, y síndrome constitucional 2. Esto dificulta el diagnóstico, pues estos síntomas inespecíficos también pueden ser explicados por comorbilidades del adulto mayor 3. Los síntomas de debilidad generalizada y parestesias en el caso reportado fueron atribuidos al ACV hemorrágico, consecuencia de la hipertensión arterial no controlada. Esto hizo que el diagnóstico definitivo de lupus de inicio tardío demore aproximadamente seis meses desde el inicio de síntomas. Esta situación se repite en algunos reportes donde la búsqueda de tratamiento y diagnóstico definitivo duró entre seis meses 12,16 y un año 11 desde el inicio de síntomas. La presencia de neuropatía periférica al inicio de la enfermedad podría demorar el diagnóstico definitivo de LES 2, pues es una causa muy rara de neuropatía en adultos mayores 18, y en su lugar se priorizaría el diagnóstico relacionado con accidentes cerebrovasculares 15.
La anamnesis y examen físico del adulto mayor con sospecha de LES debe ser exhaustiva por medio de la valoración geriátrica integral, que incluya la descripción completa de síntomas, exploración osteoarticular, cardiovascular, dermatológica y neuro-psiquiátrica 19. El espectro de síndromes psiquiátricos o que afectan al sistema nervioso central o periférico, presentes en pacientes con lupus, cuando se han descartado otras causas, recibe la denominación de neurolupus 20. Su presentación clínica suele ser difusa; como disfunción cognitiva, trastornos del humor y psicosis; o presentarse como ACV o polineuropatías 5. La sospecha clínica de neurolupus responde a cumplir al menos un indicador del primer grupo de criterios (convulsiones, psicosis, ACV, lesión de nervios craneales, alteraciones motoras, alteraciones de la conciencia), y al menos dos indicadores del segundo grupo de criterios (disfunción cognitiva, dolor de cabeza, neuropatía periférica, cambios en neuroimágenes, cambios en exámenes auxiliares neurológicos) 21. El caso reportado cumple con tener alteraciones motoras, neuropatía periférica y una electromiografía alterada, haciendo sospechar de un neurolupus del tipo neuropatía periférica.
La polineuropatía periférica es bastante rara entre todos los pacientes con LES afectando a menos del 3% 22. En un estudio de pacientes con LES de inicio tardío de 50 años a más, se reportó que sólo 4 de los 92 tenían alguna afectación del sistema nervioso periférico 23. Se ha encontrado en la literatura científica 11 casos con LES de inicio tardía en mayores de 60 años que presentaron algún tipo de neuropatía periférica como inicio del cuadro de LES, incluyendo un caso de neuropatía periférica autonómica 8, mononeuropatías del quiasma óptico 11, nervio frénico 12 y del nervio oculomotor 16, y polineuropatías axonal mixtas simétricas 9,10,13,14,16. Sólo en un caso el desenlace fue fatal debido a posibles complicaciones del LES no neurológicas 9. La polineuropatía mixta desmielinizante simétrica explica la debilidad muscular que presentó la paciente un mes antes de acudir por Emergencia, la cual probablemente fue considerada esperable en el contexto clínico de una paciente geriátrica. Además, el evento agudo del ACV hemorrágico, desencadenado por la hipertensión arterial no controlada, opacó los síntomas motores principales. Es así como la debilidad muscular e incapacidad de movilidad fueron considerados inicialmente como secuelas del evento agudo de ACV, demorando el diagnóstico final de LES de inicio tardío con manifestaciones neurológicas.
Sólo luego de una evaluación geriátrica integral se pudo obtener más información sobre la clínica de la paciente, cumpliendo tres criterios clínicos: alopecia no descamativa, artralgias y neuropatía periférica; y un criterio inmunológico: anticuerpos antinucleares +, del Systemic Lupus International Collaborating Clinics 2012 vigente, para el diagnóstico definitivo de LES de inicio tardío 24. Luego de descartar otras causas de polineuropatía mixtas como diabetes mellitus (glucosa al azar normal), deficiencia de vitamina B12 y B9 (valores normales), vasculitis de vasos pequeños (sin síntomas asociados y marcadores inmunológicos negativos), y de confirmar la alteración de nervios periféricos con la electromiografía, se llegó a la conclusión que era una presentación de neuropatía periférica en una paciente con LES de inicio tardío, cumpliendo los criterios diagnósticos del European League Against Rheumatism para neurolupus 22. Finalmente, siguiendo recomendaciones para el manejo de neurolupus con corticoides e inmunosupresores, la paciente mejoró sus síntomas neurológicos sin tener recaídas durante 5 años, el cual es el mayor tiempo de seguimiento que se ha reportado de un paciente con LES de inicio tardío con neuropatía periférica.
Es necesario considerar el diagnóstico de LES de inicio tardío y polineuropatía en adultos mayores con debilidad muscular periférica, tomando en cuenta que tienen una presentación clínica atípica y que el uso de exámenes auxiliares es necesario, usualmente con adecuada respuesta a inmunosupresores