Introducción
El SARS-CoV-2 es un virus con una alta tasa de transmisión desde sus primeras variantes 1. Su transmisibilidad varía según múltiples factores como los lugares de contacto con el caso positivo (hogar, escuela, lugar de trabajo, etc.) o las actividades realizadas al interactuar con él (hablar, comer, etc) 2,3. De esta forma, se ha reportado que el entorno de contacto con mayor riesgo para el contagio de la SARS-CoV-2 es el hogar 4.
La tasa de ataque secundaria (TAS) domiciliaria se define como la probabilidad de que ocurra una infección entre los contactos del hogar de un caso primario 5. Se determina dividiendo la cantidad de contactos domiciliarios expuestos al caso primario que desarrollan la enfermedad, sobre la totalidad de contactos domiciliarios expuestos al caso primario 5,6. Con respecto a COVID-19, la determinación de este valor es útil para considerar el uso de medidas de prevención dentro del hogar como la utilización de mascarillas y aislamiento 7. De esta forma, revisiones sistemáticas previas evaluaron la TAS domiciliaria obteniendo valores variables entre 17.1% y 42.7% 8-12.
El presente estudio pretende complementar la información acerca de la TAS domiciliaria debido a que algunas revisiones sistemáticas previas presentaron criterios de inclusión flexibles, como contar con definiciones de caso infectado de SARS-CoV-2 no confirmado por una prueba de laboratorio, o haber evaluado a menos del 50% de los contactos. Asimismo, algunas revisiones no evaluaron ciertas variables, como el estado de la pandemia al momento de realización de los estudios incluidos. Por ello, el objetivo de este estudio fue determinar la TAS domiciliaria del SARS-CoV-2, además de realizar subanálisis con variables sociodemográficas, epidemiológicas y comorbilidades de interés.
Material y métodos
Diseño de estudio
Se desarrolló una revisión sistemática cuyo protocolo fue registrado en PROSPERO (CRD42021267573) y se encuentra disponible en: https://www.crd.york.ac.uk/prospero/display_record.php?ID=CRD42021267573.
Criterios de selección
Se incluyeron estudios observacionales en inglés o español. El primero debido a que la mayor parte de la literatura científica está redactada en este idioma 13, y el segundo debido a que el español es muy utilizado por los estudios de Latinoamérica y El Caribe 14. Otros idiomas no fueron considerados debido a dificultades para su traducción. Los estudios incluidos evaluaron a la población general, niños (< 18 años), y ancianos (≥ 65 años). Asimismo, estos debían indicar la TAS domiciliaria o brindar datos suficientes para su cálculo.
Se excluyeron estudios que contenían datos que formaban parte de otro estudio, manuscritos en los que no estaba claro la direccionalidad de la transmisión de la enfermedad, y artículos que solo evaluaron contactos sintomáticos por protocolo, por lo que no habrían evaluado a los contactos asintomáticos. Además, se excluyeron: cartas al editor, editoriales, reportes de casos, series de casos con menos de diez casos índice, estudios de modelamiento, revisiones narrativas y estudios que no fueron revisados por pares (pre-publicaciones y artículos publicados en revistas científicas sin revisión por pares).
Fuentes de información y estrategia de búsqueda
La búsqueda se realizó en las siguientes bases de datos: Medline, Scopus, LILACS y Google Scholar (de este último, solo los primeros 100 resultados), realizada entre diciembre de 2019 (fecha de inicio de la pandemia) y el primero de setiembre de 2021. Los términos de búsqueda utilizados se encuentran disponibles en la Tabla S1 del material suplementario (disponible en: https://doi.org/10.6084/m9.figshare.21315120).
Selección de estudios
La selección de estudios se llevó a cabo en la aplicación Rayyan QCRI 15. En ella, se eliminaron los artículos duplicados y se evaluaron los títulos, resúmenes, y posteriormente el texto completo según los criterios de selección. Además, se buscaron las referencias de los artículos seleccionados a texto completo. Ambas fases fueron realizadas por duplicado, al menos por dos autores y de manera independiente. Un tercer autor resolvió las discrepancias.
Extracción de la información
Se extrajeron los siguientes datos: número de casos índice, número de contactos domiciliarios, número de contactos infectados, tipo de estudio (retrospectivo, prospectivo), región (Asia Oriental y Pacífico, Europa y Asia Central, América Latina y El Caribe, Oriente Medio y África del Norte, Norte América, Asia Sur, África Sub-sahariana), nivel de ingresos del país donde se realizó el estudio según la clasificación del Banco Mundial (altos, medios altos, medios bajos, bajos) 16, tiempo de seguimiento, porcentaje de contactos evaluados, datos de la TAS general, así como la TAS según las características de los casos índice (sexo, edad, estado sintomático), y contactos domiciliarios (sexo, edad, estado sintomático, relación de pareja con el caso índice, y comorbilidades como diabetes mellitus e hipertensión arterial).
Además, también se recolectó información sobre el estado de la pandemia al inicio de cada estudio. Para ello, se extrajeron datos de la mortalidad e incidencia semanal en la fecha de inicio de inclusión de casos índice del país donde se realizó cada estudio. Estas cifras fueron recolectadas del repositorio de datos COVID-19 del Centro de Ciencia e Ingeniería de Sistemas de la Universidad Johns Hopkins 17. Luego, fueron categorizadas según los niveles de transmisión comunitaria (TC) de la COVID-19 de la Organización Panamericana de la Salud 18. Las categorías para la mortalidad semanal por 100 000 habitantes fueron: TC1 (< 1 muerte), TC2 (1 a < 2 muertes), TC3 (2 a < 5 muertes) y TC4 (≥ 5 muertes). Asimismo, las categorías para la incidencia semanal por 100 000 habitantes fueron: TC1 (< 10 casos), TC2 (20 a < 50 casos), TC3 (50 a < 150 casos) y TC4 (≥ 150 casos).
Asimismo, se extrajeron los siguientes datos del caso índice y contactos domiciliarios: la prueba utilizada para su diagnóstico (prueba molecular, serológica o antigénica), grupo etario (niño, adulto o adulto mayor), sexo, y estado sintomático (sintomático o asintomático). De igual forma, para el caso índice se extrajo información acerca del tipo de caso (población general, personal de salud o trabajador de empresa) y el lugar de diagnóstico (medio hospitalario o extrahospitalario). Por último, se extrajo datos de la relación de los contactos domiciliarios con el caso índice (pareja, hijo, otro familiar, no familiar).
La recolección de datos se realizó por duplicado, al menos por dos autores y de manera independiente. Un tercer autor resolvió las discrepancias.
Riesgo de sesgo
Se usó una versión modificada de la escala Newcastle-Ottawa que fue utilizada en estudios previos 11,19. Esta evalúa tres criterios: la selección de los participantes (4 puntos), la comparabilidad de los estudios (1 punto), y la determinación de la variable de interés (3 puntos). La calidad de los estudios fue clasificada según el puntaje obtenido con esta escala en: alta (7 a 9 puntos), moderada (4 a 6 puntos) y baja (≤ a 3 puntos). La evaluación del riesgo de sesgo fue desarrollada por duplicado, al menos por dos autores y de manera independiente. Un tercer autor resolvió las discrepancias.
Las modificaciones realizadas a esta escala se debieron a las diferencias entre nuestros criterios de inclusión y los de otros estudios, que incluyeron manuscritos con poca muestra o evaluaron solo contactos sintomáticos. Por tal motivo, se realizó una modificación respecto a la variable “Representatividad de la muestra del caso índice”, considerándose como “representativo de los casos COVID-19 de la región” a los estudios que evaluaron a toda la población o a un mínimo de tamaño muestral calculado para la región. Asimismo, consideramos como “algo representativo” cuando no se alcanzó el tamaño muestral calculado, este no se calculó y/o la selección de participantes fue por conveniencia. Por último, consideramos como “poco representativo” cuando solo se evaluaron a ciertos grupos de la población objetivo (pacientes hospitalizados, escolares, trabajadores de una empresa, entre otros). Para la variable “Contactos domésticos que fueron evaluados”, se consideró una mayor calidad si se incluyó a todos los contactos en el estudio, mientras que, una menor calidad si el estudio evaluó a menos del 50% de contactos domésticos. Finalmente, para la variable “Número de pruebas por contacto” se eliminó la categoría “no proporcionado” debido a que solo se incluyeron estudios que utilizaron pruebas para diagnosticar a los contactos.
Análisis estadístico
Para el análisis, la TAS se definió como la proporción de contactos domiciliarios de un caso índice que presentaron un resultado positivo en una prueba de laboratorio para SARS-CoV-2, dividido por la cantidad de contactos domiciliarios totales 6. Mientras que, un contacto domiciliario se refirió a toda persona (familiar o no) que habitaba en la misma vivienda que el paciente índice 19.
A partir de ello, se desarrolló un metaanálisis de proporciones haciendo uso del modelo de efectos aleatorios con el método de DerSimonian and Laird 20, previa estabilización de las varianzas con la doble transformación de Freeman-Tukey 21, y se evaluó la heterogeneidad con el estadístico I2 (22.
Para explorar la heterogeneidad, se realizaron análisis de subgrupos según: sexo, grupo etario, estado sintomático, y lugar de diagnóstico del caso índice; sexo, grupo etario, estado sintomático, relación de pareja con el caso índice, y presencia de comorbilidades (diabetes mellitus e hipertensión arterial) del contacto domiciliario. Asimismo, se desarrollaron metaregresiones usando un modelo de efectos aleatorios con el método de DerSimonian and Laird 23, junto al ajuste del error estándar con el método de Knapp-Hartung truncado 24 para estimaciones con al menos diez estudios. Cada estimado se acompañó de su intervalo de confianza al 95% (IC 95%) y su valor p. Además, se realizó un análisis de sensibilidad excluyendo a los estudios de baja calidad según la evaluación de riesgo de sesgo.
Por último, el sesgo de publicación fue evaluado con “funnel plots” para los análisis que tuvieron al menos 10 estudios incluidos 25. Todos los análisis fueron desarrollados en Stata v17.0 (StataCorp LP, College Station, TX, USA).
Resultados
Selección de estudios
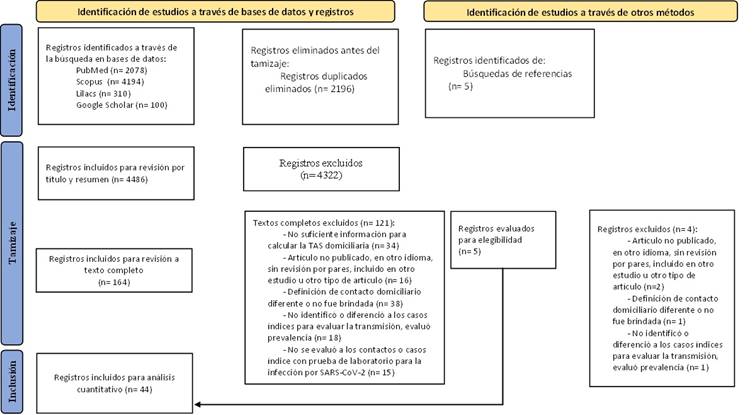
En la búsqueda inicial se obtuvieron 6682 registros en las bases de datos de Medline, Scopus, LILACS y Google Scholar. De ellos, 4486 fueron evaluados por título y resumen y solo 164 a texto completo. Se excluyeron 121 artículos que no cumplían los criterios de inclusión con lo que se seleccionaron 43 estudios. Adicionalmente, se evaluaron 5 artículos encontrados tras la búsqueda de referencias de los estudios seleccionados. Luego de su evaluación, se seleccionó uno adicional. Finalmente, se incluyeron 44 estudios para el análisis. (Figura 1)
Características de los estudios
De los estudios seleccionados, 22 (50%) fueron realizados en Asia Oriental y Pacífico, trece (29.6%) en Europa y Asia Central, cinco (11.4%) en Norte América y dos (4.6%) en Latino América y El Caribe. Solo hubo un estudio realizado en Asia Sur y África Sub Sahariana. Respecto al nivel de ingresos de los países donde se realizaron los estudios, 42 (95.5%) fueron realizados en países con ingresos económicos altos y medios-altos. El diseño de estudio en 43 (97.7%) de los artículos fue longitudinal, donde 27 (61.4%) fueron prospectivos. Por otro lado, 33 (75%) pertenecieron al nivel TC1 de transmisión comunitaria y seis (13.6%) al nivel TC3 según la mortalidad semanal reportada en los países de los estudios al inicio de su recolección de datos. Respecto a la incidencia semanal, 34 (77.3%) se encontraban en el nivel TC1 y ocho (18.2%) en el nivel TC2.
Para el diagnóstico de los casos índice, 34 (77.3%) estudios utilizaron solo pruebas moleculares, mientras que dos (4.6%) usaron solo pruebas serológicas. El diagnóstico del caso índice se realizó en un medio extrahospitalario en 34 estudios (77.3%). En relación al diagnóstico de los contactos domiciliarios, 26 (59.1%) estudios usaron solo pruebas moleculares, seguido de nueve (20.5%) que usaron solo pruebas serológicas. En cuanto a la duración del seguimiento de los contactos, 24 (63.2%) siguieron a los contactos por 14 días y doce (31.6%) lo hicieron por más de 14 días. Solo 22 (50%) estudios reportaron el porcentaje de contactos domiciliarios evaluados. Otras características de los estudios pueden observarse en la Tabla 1.
Tabla 1 Características de los estudios incluidos
| Articulo (ciudad/estado, país) | Año | Región* | TC de mortalidad† | TC de incidencia‡ | Definición de caso índice§ | Estado sintomático de caso índice | N° de casos índice | Prueba utilizada en el diagnóstico del caso índice | N° de contactos domésticos | Prueba utilizada en el diagnóstico del contacto | Tiempo de seguimiento de contactos | Lugar de diagnóstico | Ingresos económico del país | Calidad |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Chaw et al. (Brunéi)26 | 2020 | Asia oriental y Pacifico | 1 | 1 | Dato epidemiológico | Sintomáticos y asintomáticos | 19 | Prueba molecular | 264 | Prueba molecular | 14 días | No hospital | Alto | Baja |
| Kuwelker et al. (Bergen, Noruega)27 | 2021 | Europa y Asia Central | 1 | 1 | Fecha de síntomas y/o tamizaje | Sintomáticos y asintomáticos | 112 | Prueba molecular | 179 | IgG | > 14 días | No hospital | Alto | Alta |
| X Wang et al. (Beijing, China)28 | 2020 | Asia oriental y Pacifico | 1 | 1 | Fecha de síntomas y7o tamizaje | Sintomáticos y asintomáticos | 38 | Prueba molecular | 193 | Prueba molecular | 14 días | No hospital | Medio alto | Moderada |
| Li et al. (Hubei, China)29 | 2020 | Asia oriental y Pacifico | 1 | 1 | Dato epidemiológico | Sintomáticos | 105 | Prueba molecular | 392 | Prueba molecular | 14 días | Hospital | Medio alto | Moderada |
| Luo et al. (Guangzhou, China)30 | 2020 | Asia oriental y Pacifico | 1 | 1 | Dato epidemiológico | Sintomáticos y asintomáticos | 391 | Prueba molecular | 1015 | Prueba molecular | 14 días | No hospital | Medio alto | Moderada |
| Rosenberg et al. (New York, Estados Unidos)31 | 2020 | Norte América | 1 | 1 | Dato epidemiológico | Sintomáticos y asintomáticos | 229 | Prueba molecular | 343 | Prueba molecular | NI‖ | No hospital | Alto | Moderada |
| Rajmohan et al. (Kerala, India)32 | 2021 | Asia Sur | 1 | 1 | Dato epidemiológico | Sintomáticos y asintomáticos | 101 | Prueba molecular, prueba de antígenos | 387 | Prueba molecular, prueba de antígenos | 14 días | No hospital | Medio bajo | Moderada |
| Bo et al. (Wuhan, China)33 | 2021 | Asia oriental y Pacifico | 1 | 1 | Fecha de síntomas y/o tamizaje | Sintomático | 214 | Prueba molecular | 475 | Prueba molecular | 14 días | No hospital | Medio alto | Moderada |
| Bi et al. (Shenzhen, China)34 | 2020 | Asia oriental y Pacifico | 1 | 1 | Dato epidemiológico | Sintomáticos y asintomáticos | 391 | Prueba molecular | 686 | Prueba molecular | 14 días | No hospital | Medio alto | Moderada |
| Peng et al. (San Francisco, Estados Unidos)35 | 2021 | Norte América | 3 | 4 | Fecha de síntomas y/o tamizaje | NI‖ | 638 | Prueba molecular, prueba de antígenos | 867 | Prueba molecular, prueba de antígenos | NI | No hospital | Alto | Moderada |
| Thiel et al. (Principado de Liechtenstein)36 | 2020 | Europa y Asia Central | 3 | 4 | Dato epidemiológico | Sintomáticos y asintomáticos | 81 | Prueba molecular | 109 | IgG/IgM | > 14 días | No hospital | Medio bajo | Moderada |
| Cerami et al. (Carolina del Norte, Estados Unidos)37 | 2021 | Norte América | 3 | 3 | Fecha de síntomas y/o tamizaje | Sintomáticos | 100 | Prueba molecular, IgG/IgM | 176 | Prueba molecular, IgG/IgM | > 14 días | Hospital | Medio bajo | Alta |
| Reukers et al. (Utrecht, Países Bajos)38 | 2022 | Europa y Asia Central | 3 | 2 | Dato epidemiológico | Sintomáticos | 55 | Prueba molecular | 187 | Prueba molecular, IgG/IgM | > 14 días | Hospital | Medio alto | Moderada |
| Soriano Arandes et al. (Cataluña, España)39 | 2021 | Europa y Asia Central | 1 | 1 | Fecha de síntomas y/o tamizaje | Sintomáticos y asintomáticos | >80 | Prueba molecular, prueba de antígenos | 864 | Prueba molecular, prueba de antígenos | NI | Hospital | Alto | Moderada |
| Jing et al. (Guangzhou, China )40 | 2020 | Asia oriental y Pacífico | 1 | 1 | Fecha de síntomas y/o tamizaje | Sintomáticos y asintomáticos | 349 | Prueba molecular | 784 | Prueba molecular | 14 días | No hospital | Alto | Alta |
| Ratovoson et al. (Antananarivo, Madagascar)41 | 2021 | África sub sahariana | 1 | 1 | Fecha de síntomas y/o tamizaje | Sintomáticos y asintomáticos | 33 | Prueba molecular | 179 | Prueba molecular | > 14 días | No hospital | Alto | Alta |
| Doung-gern et al. (Tailandia)42 | 2020 | Asia oriental y Pacífico | 1 | 1 | Dato epidemiológico | Sintomáticos | 18 | Prueba molecular | 230 | Prueba molecular | > 14 días | No hospital | Alto | Baja |
| Cheng et al. (Taiwán)43 | 2020 | Asia oriental y Pacífico | 1 | 1 | Fecha de síntomas y/o tamizaje | Sintomáticos y asintomáticos | 100 | Prueba molecular | 151 | Prueba molecular | 14 días | No hospital | Alto | Moderada |
| Martinez et al. (Baltimore, Maryland, Estados Unidos)44 | 2021 | Norte America | 2 | 2 | Fecha de síntomas y/o tamizaje | NI | 277 | Prueba molecular | 638 | Prueba molecular | 14 días | No hospital | Alto | Moderada |
| Telle et al. (Noruega)45 | 2021 | Europa y Asia Central | 1 | 1 | Fecha de síntomas y/o tamizaje | NI | 7548 | Prueba molecular | 14053 | Prueba molecular | 14 días | No hospital | Alto | Moderada |
| Chirathaworn et al. (Tailandia)46 | 2020 | Asia oriental y Pacífico | 1 | 1 | Dato epidemiológico | Sintomáticos y asintomáticos | 217 | Prueba molecular | 118 | IgG | > 14 días | Hospital | Medio alto | Moderada |
| SY Park et al. (Corea del Sur)47 | 2020 | Asia oriental y Pacífico | 1 | 1 | Dato epidemiológico | Sintomáticos y asintomáticos | 97 | Prueba molecular | 225 | Prueba molecular | 14 días | No hospital | Bajo | Moderada |
| Xin et al. (Quindao, China)48 | 2021 | Asia oriental y Pacífico | 1 | 1 | Dato epidemiológico | sintomático | 31 | Prueba molecular | 106 | Prueba molecular | 14 días | No hospital | Medio alto | Moderada |
| Angulo et al. (Lima, Perú)49 | 2021 | Latino America y el Caribe | 4 | 2 | Dato epidemiológico | Sintomático y asintomático | 52 | Prueba molecular | 239 | IgG/IgM | < 14 días | No hospital | Alto | Baja |
| Lewis et al. (Estados Unidos)50 | 2021 | Norte América | 1 | 2 | Fecha de síntomas y/o tamizaje | Sintomático y asintomático | 58 | Prueba molecular | 188 | Prueba molecular IgG/IgM | 14 días | No hospital | Alto | Moderada |
| Wu et al. (Zhuhai, China)51 | 2020 | Asia oriental y Pacífico | 1 | 1 | Fecha de síntomas y/o tamizaje | Sintomático y asintomático | 35 | Prueba molecular | 148 | Prueba molecular | > 14 días | Ambos | Alto | Alta |
| Tanaka et al. (Osaka, Japón)52 | 2021 | Asia oriental y Pacífico | 1 | 1 | Dato epidemiológico | Sintomático y asintomático | 307 | Prueba molecular | 688 | Prueba molecular | 14 días | No hospital | Medio alto | Moderada |
| Xie et al. (Beijing, China)53 | 2021 | Asia oriental y Pacífico | 1 | 1 | Fecha de síntomas y/o tamizaje | Sintomático y asintomático | 20 | Prueba molecular | 79 | Prueba molecular | 14 días | Hospital | Alto | Moderada |
| Salihefendic et al. (Bosnia y Herzegovina)54 | 2021 | Europa y Asia central | 1 | 1 | Fecha de síntomas y/o tamizaje | NI | 25 | Prueba molecular | 123 | Prueba molecular IgG/IgM | > 14 días | Hospital | Medio alto | Moderada |
| Dupraz et al. (Cantón de Vaud, Suiza)55 | 2021 | Europa y Asia central | 1 | 1 | Dato epidemiológico | Sintomático y asintomático | 219 | Prueba molecular IgG/IgM | 302 | IgG/IgM | 14 días | No hospital | Medio alto | Moderada |
| Y Wang et al. (Beijing, China)7 | 2020 | Asia oriental y Pacífico | 1 | 1 | Fecha de síntomas y/o tamizaje | Sintomático | 124 | Prueba molecular | 335 | Prueba molecular | > 14 días | No hospital | Alto | Alta |
| Hu et al. (Guangzhou, China)56 | 2021 | Asia oriental y Pacífico | 1 | 1 | Fecha de síntomas y/o tamizaje | Sintomático | 100 | Prueba molecular | 267 | Prueba molecular | > 14 días | No hospital | Medio alto | Moderada |
| Kim et al. (Corea del Sur)57 | 2021 | Asia oriental y Pacífico | 1 | 1 | Dato epidemiológico | Sintomático | 107 | Prueba molecular | 208 | Prueba molecular | 14 días | No hospital | Alto | Baja |
| Ogata et al. (Tsuchiura, Japón)58 | 2021 | Asia oriental y Pacífico | 1 | 1 | Fecha de síntomas y/o tamizaje | Sintomático y asintomático | 236 | Prueba molecular | 496 | Prueba molecular | NI | No hospital | Alto | Alta |
| Brotons et al. (Barcelona, España)59 | 2021 | Europa y Asia central | 3 | 2 | Fecha de síntomas y/o tamizaje | Sintomático y asintomático | 381 | Prueba molecular IgG/IgM | 1084 | IgG/IgM | > 14 días | No hospital | Medio alto | Moderada |
| Koureas et al. (Larisa, Grecia)60 | 2021 | Europa y Asia central | 1 | 1 | Fecha de síntomas y/o tamizaje | Sintomático y asintomático | 30 | Prueba molecular | 223 | Prueba molecular | < 14 días | No hospital | Medio alto | Moderada |
| Miller et al. (Inglaterra)61 | 2021 | Europa y Asia central | 3 | 2 | Fecha de síntomas y/o tamizaje | Sintomático y asintomático | 126 | Prueba molecular IgG/IgM | 248 | Prueba molecular IgG/IgM | 14 días | No hospital | Alto | Alta |
| YJ Park et al. (Corea del Sur)62 | 2020 | Asia oriental y Pacífico | 1 | 1 | Fecha de síntomas y/o tamizaje | NI | 5706 | Prueba molecular | 10592 | Prueba molecular | 14 días | No hospital | Medio alto | Alta |
| Breyer et al. (Viena, Australia)63 | 2021 | Europa y Asia central | 2 | 1 | Fecha de síntomas y/o tamizaje | Sintomático y asintomático | 82 | IgG/IgM | 159 | IgG/IgM | < 14 días | No hospital | Medio alto | Moderada |
| Wu et al. (Hubei, Jiangsu, Zhejiang, Guangdong y Chongqing; China)64 | 2021 | Asia oriental y Pacífico | 1 | 1 | Fecha de síntomas y/o tamizaje | Sintomático y asintomático | 578 | Prueba molecular | 1516 | Prueba molecular | 14 días | No hospital | Alto | Alta |
| Charbonnier et al. (Paris, Francia)65 | 2021 | Europa y Asia central | 3 | 1 | Dato epidemiológico | Sintomático y asintomático | 34 | Prueba molecular IgG/IgM | 184 | Prueba molecular IgG/IgM | 14 días | Hospital | Alto | Baja |
| Son et al. (Busan, Corea)66 | 2020 | Asia oriental y Pacífico | 1 | 1 | NI | Sintomático y asintomático | 108 | Prueba molecular | 165 | Prueba molecular | 14 días | No hospital | Alto | Moderada |
| Silveira et al. (Río Grande del Sur, Brasil)67 | 2020 | Latino América y el Caribe | 1 | 1 | NI | Sintomático y asintomático | 16 | IgG/IgM | 37 | IgG/IgM | < 14 días | No hospital | Alto | Baja |
| Buonsenso et al. (Roma, Italia)68 | 2021 | Europa y Asia central | 4 | 2 | Fecha de síntomas y/o tamizaje | Sintomático y asintomático | 30 | Prueba molecular | 65 | IgG/IgM | > 14 días | Hospital | Alto | Moderada |
*Región donde se realizó el estudio según la clasificación del Banco Mundial
†Niveles de transmisión comunitaria de la COVID-19 de la Organización Panamericana de la Salud según la mortalidad reportada en el país donde se realizó el estudio: TC1 (< 1 muerte semanal por 100 000 habitantes), TC2 (1 a < 2 muertes semanales por 100 000 habitantes), TC3 (2 a < 5 muertes semanales por 100 000 habitantes) y TC4 (≥ 5 muertes semanales por 100 000 habitantes).
‡Niveles de transmisión comunitaria de la COVID-19 de la Organización Panamericana de la Salud según la incidencia reportada en el país donde se realizó el estudio: TC1 (< 10 casos semanales por 100 000 habitantes), TC2 (20 a < 50 casos semanales por 100 000 habitantes), TC3 (50 a < 150 casos semanales por 100 000 habitantes) y TC4 (≥ 150 casos semanales por 100 000 habitantes).
§Definición del caso índice según dato epidemiológico (cuando el caso índice se definió como el primer caso registrado en el domicilio) o fecha de síntomas y/o tamizaje (cuando el caso índice fue el primero en presentar síntomas o resultar positivo ante una prueba diagnóstica entre los habitantes de un hogar)
‖NI: no información
Las TAS reportadas por cada estudio pueden encontrarse en la Tabla S3 del material suplementario.
Resultados del metaanálisis
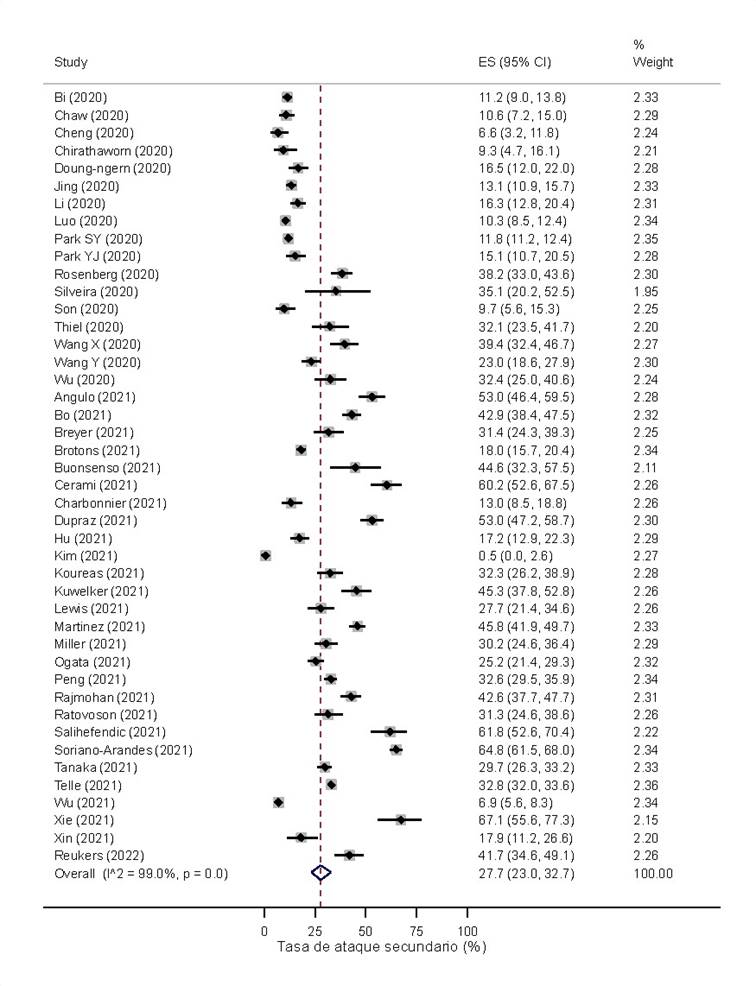
La TAS general fue de 27.7% (IC 95%: 23% 32.7%, I2 = 99.0%) (Figura 2). La región que obtuvo la mayor TAS fue América Latina y El Caribe con 50.5% (IC 95%: 44.5% 56.5%). No obstante, la mayoría de estudios pertenecieron a Asia Oriental y Pacífico, región donde la TAS fue de 17.7% (IC 95%: 13.8% 22%) (Figura S2 del material suplementario). Por otro lado, los países que tuvieron una menor TAS fueron aquellos con ingresos altos y medios-altos con 28.3% (IC 95%: 22.0% 35.1%) y 25.8% (IC 95%: 18.4% 34%), respectivamente (Figura S3 del material suplementario).
Los países con una tasa de mortalidad TC1 presentaron una TAS más baja con 25.2% (IC 95%: 19.8% 30.9%) (Figura S4 del material suplementario). De igual forma, los países con una incidencia de casos TC1 una TAS más baja con 24.9% (IC 95%: 19.6% 30.5%) (Figura S5 del material suplementario).
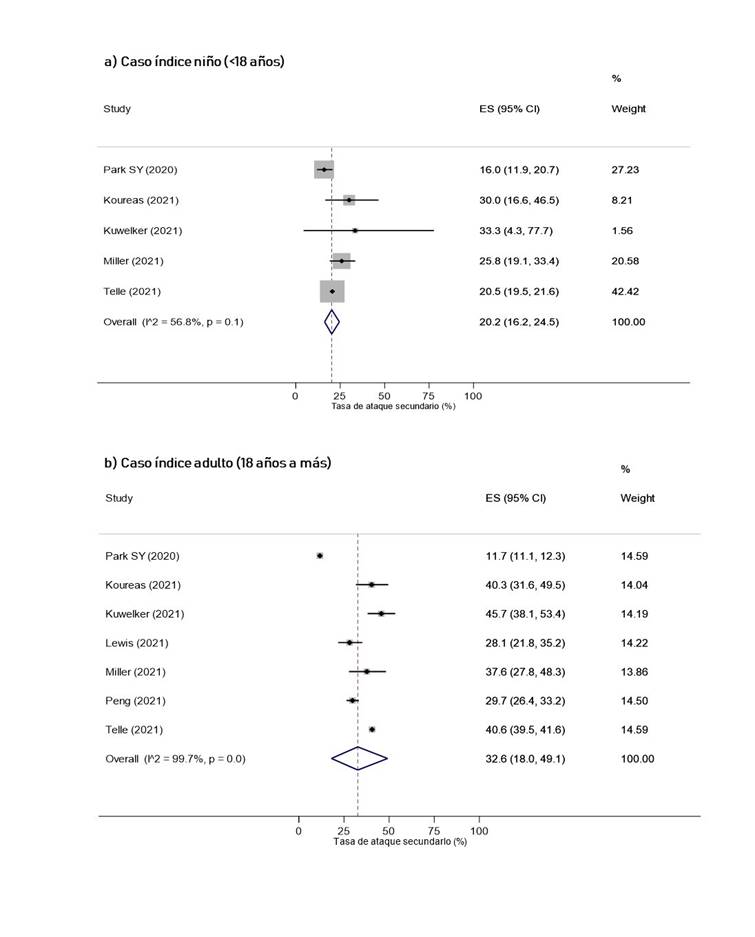
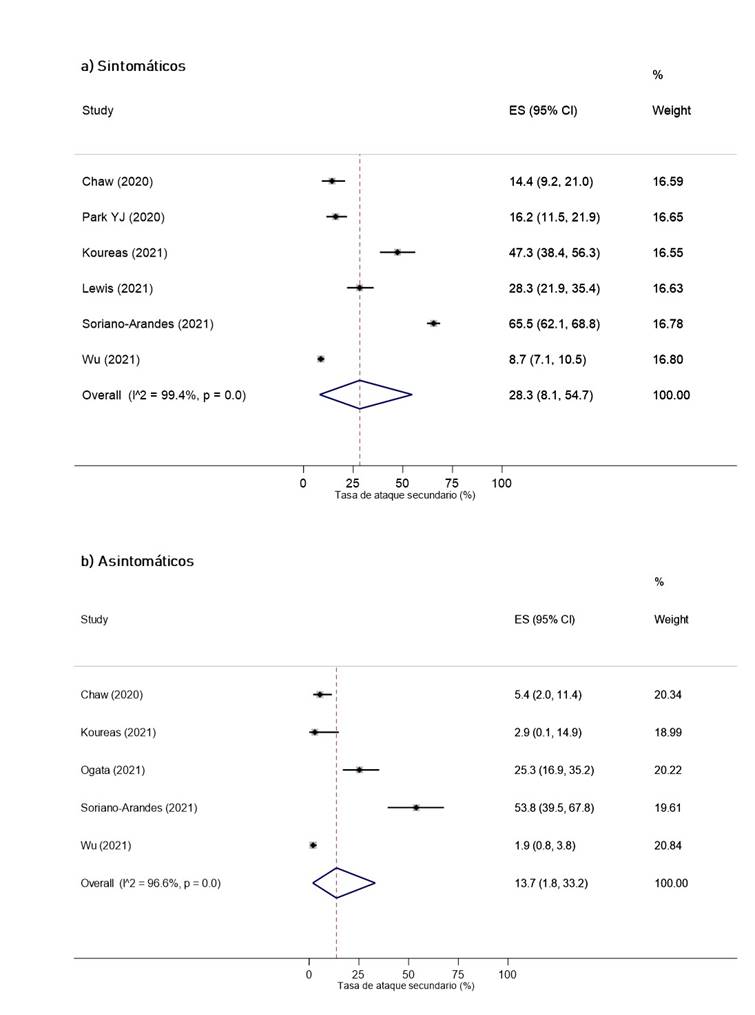
Según las características del caso índice, se obtuvo que la TAS cuando el caso índice era adulto (32.6%, IC 95%: 18% 49.1%) fue mayor que cuando era niño (20.2%, IC 95%: 16.2% 24.5%, I2 = 56.8%) (Figura 3). Además, la TAS fue mayor cuando el índice fue sintomático (28.3%, IC 95%: 8.1% 54.7%) que cuando fue asintomático (13.7%, IC 95%: 1.8% 33.2%) (Figura 4). Por otro lado, la TAS cuando el índice fue diagnosticado en un medio no hospitalario fue de 24.5% (IC 95%: 19.8% 29.5%), mientras que, cuando el índice fue diagnosticado en un medio hospitalario fue de 40.6% (IC 95%: 23.6% 58.7%) (Figura S9 del material suplementario).
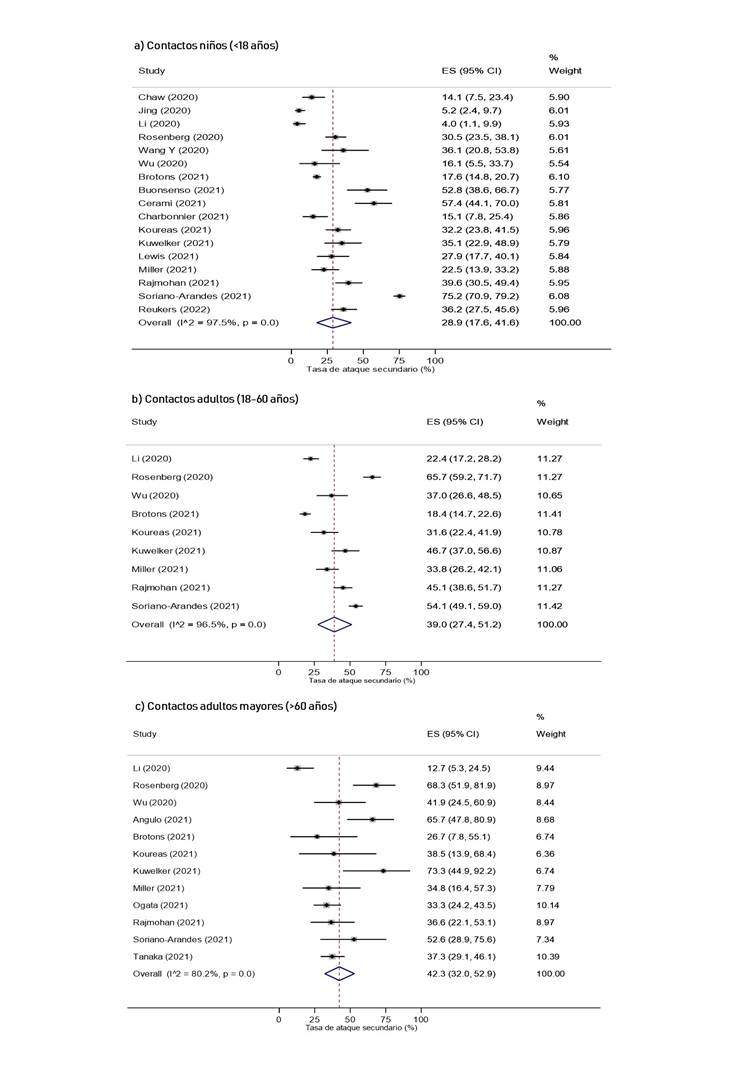
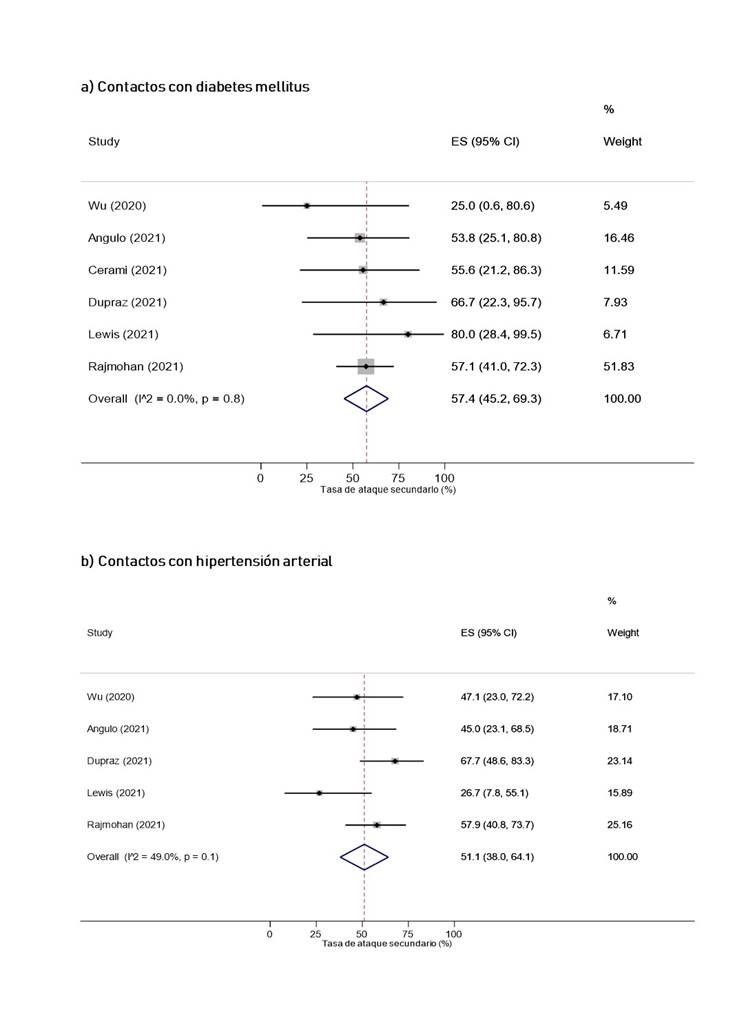
Según las características de los contactos domésticos, la TAS cuando los contactos eran adultos mayores (42.3%, IC 95%: 32% 52.9%) fue mayor que cuando los contactos fueron niños (28.9%, IC 95%: 17.6% 41.6%), y adultos (39%, IC 95%: 27.4% 51.2%) (Figura 5). Por otro lado, la TAS cuando el contacto era pareja del caso índice fue de 43.6% (IC 95%: 33.9% 53.4%) (Figura 14S del caso índice). Asimismo, la TAS cuando el contacto presentaba diabetes mellitus fue de 57.4% (IC 95%: 45.2% 69.3%, I2 = <0.01%), mientras que para hipertensión arterial se obtuvo 51.1% (IC 95%: 38% 64.1%, I2 = 49%) (Figura 6).
Todos los subanálisis tuvieron una heterogeneidad elevada, excepto el análisis de la TAS cuando el caso índice era niño y la TAS cuando el contacto presentaba diabetes mellitus o hipertensión arterial.
Resultados de la metaregresión y análisis de sensibilidad
Las metaregresiones mostraron que haber sido diagnosticado en un medio hospitalario influyó en la heterogeneidad de los resultados (p=0.02)
No se observó variaciones significativas en los estimados obtenidos al desarrollar el análisis de sensibilidad (disponible en https://doi.org/10.6084/m9.figshare.21202592.v1).
Resultados de la evaluación del riesgo de sesgo y sesgo de publicación
La calidad de 28 artículos (63.6%) fue moderada, diez tuvieron una calidad alta (22.7%) y solo seis tuvieron calidad baja (13.6%). Ningún artículo evaluó a menos del 50% de contactos domésticos del caso índice. Los resultados de la evaluación del riesgo de sesgo de cada artículo pueden observarse en la Tabla 1 y Tabla S2 del material suplementario. Por otra parte, se encontró sesgo de publicación según la evaluación gráfica mediante los gráficos de embudo (ver material suplementario).
Discusión
Resumen de los resultados
El 27.7% de los contactos domiciliarios de un caso diagnosticado con infección por SARS-CoV-2 se contagiaron por este virus. La TAS domiciliaria cuando el caso índice era sintomático fue el doble a cuando el caso índice fue asintomático. Además, la TAS fue mayor en los contactos domiciliarios adultos mayores. Por otro lado, más de la mitad de los contactos con diabetes mellitus e hipertensión arterial se contagiaron de SARS-CoV-2.
Comparación e interpretación de resultados
La TAS domiciliaria obtenida en este estudio fue de 27.7%. Esto es superior a lo reportado en revisiones sistemáticas previas donde la TAS domiciliaria osciló entre de 17.1% y 20% 8-11. La diferencia puede deberse a que nuestro estudio evaluó la TAS por un mayor periodo de tiempo de la pandemia, lo cual pudo ocasionar la inclusión de estudios más rigurosos que los publicados al inicio de la pandemia. Por otro lado, revisiones recientes reportaron una TAS domiciliaria de 42.7% y 25.1% para la variante Ómicron 12,69, característica que no fue evaluada por los estudios incluidos en esta revisión debido a su periodo de desarrollo.
La región de América Latina y El Caribe obtuvo la mayor TAS domiciliaria (50.5%) habiéndose incluido solo dos estudios. Esto puede ser explicado por una baja adherencia a las estrategias comunitarias de mitigación (distanciamiento físico, uso de mascarilla, y lavado de manos) dispuestas por los gobiernos de estos países 70. Por otro lado, Norte América, Europa y Asia Central, también presentaron TAS domiciliarias elevadas (40.6% y 37.9%, respectivamente). La mediana de edad poblacional elevada y alta prevalencia de comorbilidades pudieron haber influenciado en los resultados de estas regiones 71.
Asimismo, se obtuvo que la TAS domiciliaria fue menor en los países con altos y medios-altos ingresos económicos, lo cual pudo deberse a que estos países tuvieron mayor capacidad de afrontamiento de la pandemia. Esto debido a que cuentan con mejor acceso a salud, mejor detección y seguimiento de los casos infectados y/o aplicaron rápidamente medidas estrictas de control de transmisión 72.
Las TAS informadas para casos índices adultos fueron mayores que para los niños. Este hallazgo es distinto a lo reportado en una revisión sistemática donde no se encontró diferencias entre la TAS domiciliaria según la edad del caso índice 9. Sin embargo, nuestro resultado coincide con una revisión que mostró un aumento de la infectividad de los casos índice directamente proporcional a la edad 73. Además, se ha reportado una TAS domiciliaria para casos índices pediátricos de solo 8.4% 74, la cual es menor al 20.9% encontrado en nuestra revisión. Una posible explicación a este hallazgo es la menor cantidad de partículas de aerosol liberadas por los niños al hablar o respirar 75.
La TAS domiciliaria cuando el caso índice era sintomático fue el doble que cuando el caso índice era asintomático. De manera similar, una revisión encontró que la TAS domiciliaria para un caso índice sintomático fue de 20.2%, mientras que solo fue de 3% para uno asintomático 9. Otro estudio reportó que el riesgo de transmisión para casos índice sintomáticos fue de 3.23 veces más que los asintomáticos y presintomáticos 10. Si bien una reciente revisión sistemática refiere que tanto los casos sintomáticos y asintomáticos presentan la misma carga viral 76, una posible explicación a la menor transmisibilidad por parte de los asintomáticos puede ser que ellos eliminan el virus en menor tiempo 77. Por otro lado, la TAS fue mayor cuando el caso índice era diagnosticado en un medio hospitalario. Este hallazgo puede deberse a la mayor carga viral del SARS-CoV-2 en los casos hospitalizados 78,79.
Asimismo, la TAS fue mayor en los grupos etáreos de contactos longevos, similar a lo reportado en otros estudios 9-11. De esta forma, el aumento del contagio en contactos domésticos de mayor edad puede deberse a su menor eficacia en la respuesta inmunológica 80. Por otro lado, la TAS domiciliaria cuando el contacto era pareja del caso índice fue mayor que la TAS general. Este resultado es similar a otras revisiones que reportaron una mayor TAS cuando el contacto era el cónyuge 9,10, explicado por la mayor cercanía física en este tipo de relación.
Las TAS domiciliarias obtenidas cuando el contacto presentaba diabetes mellitus (57.4%) o hipertensión arterial (51.1%) fueron mayores que la TAS general. Este resultado es similar a lo obtenido en otra revisión donde la TAS domiciliaria para contactos con comorbilidades fue del 50% 9. Las razones de estos hallazgos pueden explicarse por el debilitamiento del sistema inmunológico provocado por la presencia de comorbilidades 81, resultando en una mayor predisposición a infecciones. De esta forma, se recomienda un seguimiento estricto a los contactos con comorbilidades para la identificación temprana de nuevos casos infectados.
Exploración de la heterogeneidad
Se ha descrito que las revisiones sistemáticas de estudios observacionales presentan alta heterogeneidad 82. Una revisión sistemática exploratoria recoge diferentes recomendaciones para afrontarla, tales como: restringir criterios de inclusión, evaluar su origen, realizar metaanálisis solo si no hay marcada heterogeneidad, o modificar el análisis estadístico de acuerdo al valor de la misma, realizando análisis de subgrupos y de sensibilidad de acuerdo al diseño de estudios o características clínicas 83. En nuestro estudio se siguieron estas recomendaciones, restringiendo criterios de inclusión considerados en revisiones previas, realizándose análisis de subgrupos, análisis de sensibilidad (según variables sociodemográficas, epidemiológicas y clínicas), y metaregresiones. No obstante, la heterogeneidad persistió excepto para ciertos subgrupos (grupo etáreo del caso índice y comorbilidades). Esto podría deberse a la variabilidad metodológica de los estudios incluidos, la naturaleza de su diseño observacional, frecuencia de tamizaje, medidas de control de cada país, hacinamiento, entre otros motivos. A pesar de ello, consideramos que nuestros resultados contribuyen a la evidencia existente debido a nuevas variables incluidas que permiten ampliar el estudio de la TAS domiciliaria.
Fortalezas y limitaciones
La principal fortaleza de este estudio fueron los criterios de selección utilizados, ya que fueron poco flexibles. De esta forma, únicamente se incluyeron estudios con diagnóstico de SARS-CoV-2 mediante alguna prueba de laboratorio. Además, se realizaron subanálisis según el estado de la pandemia al inicio de los estudios, la región donde se realizaron y el medio en el que se identificó al caso índice (hospitalario u no hospitalario), variables no consideradas en estudios previos.
No obstante, este estudio presentó ciertas limitaciones. Primero, la inclusión de artículos redactados en inglés o español limitó la inclusión de estudios en otros idiomas. Sin embargo, se usaron las principales bases de datos en los idiomas elegidos a fin de encontrar el mayor número de manuscritos. Segundo, la elevada heterogeneidad en los estimados dificulta la interpretación de los resultados. No obstante, se realizaron subanálisis y metaregresiones a fin de identificar las potenciales fuentes de heterogeneidad. Por último, el artículo no consideró el efecto de la vacunación y las nuevas variantes del virus (como el Ómicron y sus subvariantes) en la TAS domiciliaria, debido a que los estudios incluidos fueron realizados previos a su aparición 84.
Conclusión
En conclusión, la TAS domiciliaria de SARS-CoV-2 fue de 27.7%, siendo mayor al tener un caso índice sintomático, contacto adulto mayor y contacto con diabetes mellitus o hipertensión arterial. Por ello, se recomendaría sensibilizar a la población para cumplir las medidas preventivas dentro del hogar al presentarse alguno de estos escenarios.