Introducción
La infección aguda por SARS-CoV-2 en población pediátrica es principalmente asintomática o leve 1. Por otro lado, existen grupos pediátricos que podrían tener mayor vulnerabilidad, como las enfermedades oncohematológicas. Se ha publicado la experiencia en varios países sobre eso 2-5, incluso algunas revisiones sistemáticas 6-9. La mayoría reporta compromiso leve y supervivencia alta, pero con peores desenlaces clínicos en comparación con población pediátrica general. Además, reportan que en los países con menor ingreso económico o en aquellos pacientes de origen hispano se reporta mayor severidad de la COVID-19, con impacto importante sobre el acceso y la administración de la terapia contra el cáncer 3-5,8.
También se ha publicado estudios de Latinoamérica 10-15, pero en menor cantidad y con resultados heterogéneos. Debido a que el comportamiento clínico del SARS-CoV-2 puede variar principalmente según grupos étnicos, condiciones socioeconómicas, accesibilidad y calidad de los servicios de salud; resulta necesario documentar la experiencia de más centros hospitalarios, regiones o países de Latinoamérica. Por tanto, el objetivo de este estudio es describir las características clínicas y la supervivencia de pacientes pediátricos oncohematológicos con COVID-19 en un hospital de Lima, Perú.
Métodos
Diseño del estudio
Realizamos un estudio longitudinal retrospectivo con pacientes con infección por SARS-CoV-2 y enfermedad oncohematológica del Hospital Nacional Edgardo Rebagliati Martins (HNERM) en Lima, Perú.
Criterios de selección y muestra
Se incluyeron pacientes menores de 14 años hospitalizados desde abril del 2020 hasta agosto del 2021, con infección confirmada por SARS-CoV-2 (prueba antigénica o la Reacción en Cadena de la Polimerasa con Transcriptasa Inversa, RT-PCR), y con diagnóstico de enfermedad oncohematológica (debut o como antecedente) realizado por oncólogo o hematólogo.
Procedimientos
Los datos se recolectaron a partir de la historia clínica (física y electrónica). Realizamos el seguimiento a través de la historia clínica desde el ingreso hospitalario hasta seis meses después del alta del último paciente, o hasta cuando el paciente había fallecido o no acudía a sus controles.
Variables de estudio
Describimos las variables según a) edad, género, contacto domiciliario o intrahospitalario, sintomatología, b) el tipo (sólida y hematológica) y fase de la neoplasia (debut o antecedente), c) los desenlaces desfavorables durante la hospitalización como saturación de oxígeno (SatO2) ≤ 92% e intubación en emergencia, defunción, ingreso a unidad de cuidados intensivos (UCI), requerimiento de ventilación mecánica invasiva (VMI) y cánula de alto flujo (CAF), presencia de shock, diagnóstico de síndrome inflamatorio multisistémico pediátrico asociado a COVID-19 (SIM-C), y del síndrome de activación macrofágica (SAM).
Análisis estadístico
Los datos obtenidos ingresaron a una base en el programa Excel Microsoft ® (versión para Windows 2016), que posteriormente se revisó, depuró y analizó. Para el análisis de datos se utilizó el programa STATA v.16 (StataCorp LP, College Station, Texas, Estados Unidos). Se realizó un análisis descriptivo de las variables categóricas mediante frecuencias absolutas y relativas. Las variables cuantitativas se reportaron mediante la media y desviación estándar o mediana y el rango intercuartílico (RIQ), en base a las pruebas de normalidad. En el análisis bivariado, para las variables categóricas se utilizó chi cuadrado o prueba exacta de Fisher (según valores esperados), mientras que para las variables cuantitativas se utilizó T de Student o la prueba U de Mann-Whitney (según pruebas de normalidad). Para el análisis de supervivencia, el evento de interés fue la muerte, las observaciones censuradas fueron por pérdida durante el seguimiento, y finalización del estudio antes de la ocurrencia del evento. La supervivencia global fue estudiada mediante las curvas de Kaplan-Meier y se estratificó según uso de quimioterapia post COVID-19, complicaciones intrahospitalarias, condición paliativa, tipo de neoplasia, comorbilidad y sexo, estableciéndose comparaciones de supervivencia utilizando la prueba de Log-rank. Para todas las pruebas estadísticas se utilizó un nivel de significancia estadística de 0,05.
Aspectos éticos
El proyecto fue aprobado por el comité de ética del HNERM, número de registro 832-2021-305. Se respetó la confidencialidad de los datos. Algunas características de estos pacientes fueron publicadas como parte de un estudio multicéntrico, este concluyó de forma global, sin análisis de subgrupos por país ni hospital, y se enfocó en la asociación con la mortalidad intrahospitalaria 15.
Resultados
Incluimos 30 pacientes, la mediana de edad fue 6,5 años (RIQ 4-10) y 17 (56,7%) fueron varones. Veinticinco (83,3%) fueron sintomáticos, siendo la mediana del tiempo de enfermedad de 3 días (RIQ 1-5). Seis (20%) fueron referidos de otros centros hospitalarios. Seis (20%) tuvieron contacto intradomiciliario, 11 (36,7%) hospitalario, y en 13 (43,3%) el contacto fue extrahospitalario pero sin contacto intradomiciliario. Las manifestaciones clínicas más frecuentes fueron fiebre (60%), síntomas respiratorios altos (tos, odinofagia y/o coriza) (46,7%), trastorno gastrointestinal (vómitos, náuseas, dolor abdominal, y/o diarrea) (23,3%) y dificultad respiratoria (polipnea, tirajes, y/o quejido) (20%) (Tabla 1). La prueba antigénica fue positiva en 19/23 (82,6%) pacientes y la RT-PCR, en 14/18 (77,8%) pacientes.
Tabla 1 Características clínico-epidemiológicas de pacientes con infección por SARS-CoV-2 y enfermedad oncohematológica.
| Características generales | Total n= 30 | Sólida n=8 | Hematológica n=22 | Valor p | Vivo n=26 | Fallecido durante hospitalización n=4 | Valor p |
|---|---|---|---|---|---|---|---|
| Edad (años)a | 6,5 (4-10) | 9 (6-11) | 6 (3-10) | 0,334e | 8,5 (4-10) | 3,5 (3-5) | 0,746e |
| Varones | 17 (56,7) | 5 (62,5) | 12 (54,6) | 1,00f | 15 (57,7) | 2 (50,0) | 1,00f |
| Sintomático | 25 (83,3) | 5 (62,5) | 20 (90,9) | - | 21 (80,8) | 4 (100,0) | - |
| Tiempo de enfermedad a | 3 (1-5) | 2 (1-2) | 4 (1-5) | 0,445e | 3 (1-4) | 5,5 (3,5-6,5) | 0,538e |
| Contacto domiciliario | 6 (20,0) | 3 (37,5) | 3 (13,6) | 0,300f | 5 (19,2) | 1 (25,0) | 1,00f |
| Contacto hospitalario | 11 (36,7) | 0 (0,0) | 11 (50,0) | - | 9 (34,6) | 2 (50,0) | 0,611c |
| Manifestaciones clínicas | |||||||
| Fiebre | 18 (60,0) | 4 (40,0) | 14 (63,6) | 0,417f | 14 (53,8) | 4 (100,0) | 0,268f |
| Días de fiebre a | 2 (1-3) | 2 (1,5-5) | 2,5 (1-3) | 0,825e | 2 (1-3) | 2,5 (1,5-4) | 0,699e |
| Síntomas respiratorios altos b | 14 (46,7) | 4 (50,0) | 10 (45,5) | 1,000f | 11 (42,3) | 3 (75,0) | 0,315f |
| Trastorno gastrointestinal c | 7 (23,3) | 0 (0,0) | 7 (31,8) | - | 7 (26,9) | 0 (0,0) | - |
| Dificultad respiratoria d | 6 (20,0) | 2 (25,0) | 4 (18,2) | 0,645f | 3 (11,5) | 3 (75,0) | 0,018f |
a. Mediana + rango intercuartílico. b. Tos, odinofagia, y/o coriza. c. Vómitos, náuseas, dolor abdominal, y/o diarrea. d. Polipnea, tirajes, y/o quejido. e. Prueba U de Mann-Whitney. f. Prueba exacta de Fisher.
En relación con el tipo de neoplasia, 22 (73,3%) de las neoplasias fueron del tipo hematológicas, de estas 18 (81,8%) pacientes tenían leucemia linfoblástica aguda (LLA) de células B, un (4,6%) paciente LLA de células T, dos (9%) con leucemia mielocítica aguda (LMA) y uno (4,55%) Linfoma No Hodgkin. Ocho (26,7%) pacientes tuvieron el diagnóstico de neoplasia sólida, cuatro (50%) tuvieron tumores cerebrales, tres (37,5%) tumores óseos, y uno (12,5%) tuvo tumor ocular. De los 18 pacientes con LLA de células B, la mediana de edad fue de 6 años (RIQ 3-10), 17 era sintomáticos y se caracterizaron por fiebre en 12 pacientes, síntomas respiratorios altos y trastorno gastrointestinal en siete pacientes. De los cuatro pacientes con tumor cerebral, la mediana de edad fue de 9,5 años (RIQ 6,5-11), todos fueron varones y tres eran sintomáticos; siendo los síntomas más frecuentes los respiratorios altos en tres pacientes, y fiebre y dificultad respiratoria en dos pacientes.
Sobre la fase de la neoplasia, cinco pacientes fueron diagnosticados al ingreso por emergencia (debut), de los cuales dos pacientes tenían LLA de células B, y los otros tres pacientes tuvieron LMA, tumor cerebral y tumor ocular. Los 25 pacientes restantes tenían el antecedente de cáncer y estaban en alguna fase de su tratamiento, de ellos ocho pacientes tenían metástasis, cinco en condición paliativa, dos con recaída de la neoplasia, dos en seguimiento inmediato del tratamiento de tumor cerebral, y en ocho pacientes no se pudo identificar la fase de tratamiento.
En relación con desenlaces clínicos desfavorables, en la emergencia seis (20%) pacientes presentaron SatO2≤92%, cuatro (13,3%) fueron intubados y ninguno falleció. Durante la hospitalización, cuatro (13,3%) pacientes requirieron UCI, y nueve (30%) VMI (en intermedios/UCI). Además, cuatro (13,3%) pacientes requirieron CAF, siete (23,3%) desarrollaron shock, un (3,3%) paciente fue diagnosticado con SIM-C y otro (3,3%) con SAM. Cuatro (13,3%) pacientes fallecieron en hospitalización debido a COVID-19, con una mediana de edad de 3,5 años (RIQ 3-5) y con sintomatología caracterizada por fiebre y dificultad respiratoria, dos con LLA de células B (uno en paliativo y otro en recaída), uno con LMA (debut), y uno con tumor cerebral (en seguimiento inmediato al tratamiento). La SatO2≤92% en emergencia (p=0,018), requerimiento de CAF (p=0,004), y el desarrollo de shock (p=0,001) se asociaron con el fallecimiento durante hospitalización (Tabla 2).
Tabla 2 Desenlaces desfavorables de pacientes con infección por SARS-CoV-2 y enfermedad oncohematológica.
| Características | Total n=30 | Sólida n=8 | Hematológica n=22 | Valor p | Vivo n=26 | Fallecido durante hospitalización n=4 | Valor p |
|---|---|---|---|---|---|---|---|
| Saturación de oxígeno ≤ 92%en emergencia | 6 (20,0) | 2 (25,0) | 4 (18,2) | 0,645c | 3 (11,5) | 3 (75,0) | 0,018c |
| Intubado en emergencia | 4 (13,3) | 2 (25,0) | 2 (9,1) | 0,284c | 2 (7,7) | 2 (50,0) | 0,075c |
| Transferido a UCI | 4 (13,3) | 0 (0,0) | 4 (18,2) | - | 2 (7,7) | 2 (50,0) | 0,075c |
| Días UCI a | 4 (3-5) | - | 4 (3-5,5) | - | 4,5 (3-6) | 4 (3-5) | 0,683b |
| Ventilación mecánica (intermedios/UCI) | 9 (30,0) | 4 (50,0) | 5 (22,7) | 0,195c | 6 (23,1) | 3 (75,0) | 0,069c |
| Días de ventilación mecánica a | 4 (3-4) | 4 (2,5-9,5) | 3 (3-4) | 0,616b | 3,5 (2-4) | 4 (3-5) | 0,509b |
| Cánula de alto flujo | 4 (13,3) | 2 (25,0) | 2 (9,1) | 0,284c | 1 (3,9) | 3 (75,0) | 0,004c |
| Shock | 7 (23,3) | 2 (25,0) | 5 (22,7) | 1,000c | 3 (11,5) | 4 (100,0) | 0,001c |
| Muerte hospitalaria | 4 (13,3) | 1 (12,5) | 3 (13,6) | 1,000c | - | - | - |
| Reinicio de tratamiento oncológico post COVID-19 (ambulatorio/hospitalario) (n=26) | 22 (84,6) | 5 (19,2) | 17 (65,4) | 0,643c | 22 (84,6) | - | -- |
| Muerte en el seguimiento (n=26) | 11 (42,3) | 3 (11,5) | 8 (30,8) | 1,000c | - | - | - |
a. Mediana + rango intercuartílico. b.U de Mann-Whitney. c.Exacta de Fisher.
UCI: Unidad de cuidados intensivos.
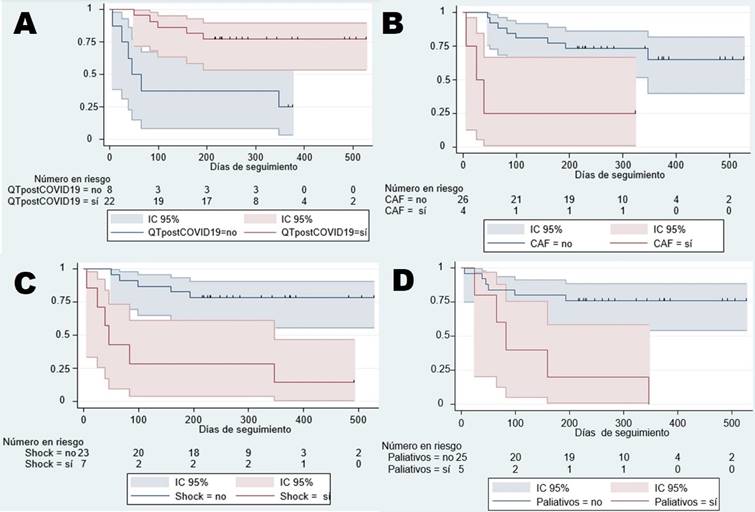
Sobre la supervivencia, 22 de los 26 (84,6%) pacientes que no fallecieron durante hospitalización reiniciaron quimioterapia post COVID-19 (15 con LLA de células B), y 11 de los 26 (42,3%) fallecieron durante el seguimiento (siete con LLA de células B y dos con tumor cerebral) (Tabla 2). La mediana del seguimiento fue de 238 días con RIQ de 99 a 365 días (rango: 6 a 526 días). La supervivencia a los 526 días de seguimiento fue de 59,26% (36,53 a 76,20%; IC95%) (figura 1). Aumentando a 77,27% (53,74 a 89,85%; IC95%) a los 526 días en aquellos que recibieron quimioterapia post COVID-19 en comparación con los que no, disminuyendo la supervivencia a 25% (3,71% a 55,81%; IC95%) a los 375 días (p=0,0023). En aquellos que requirieron CAF disminuyó a 25% (8,9% a 66,53%; IC95%) a los 322 días en comparación con los que no usaron, en ese grupo aumentó la supervivencia a 64,96% (39,72% a 81,74%; IC95%) a los 526 días (p=0,0013). También, la supervivencia disminuyó a 14,29% (7,1% a 46,49%; IC95%) a los 491 días en aquellos que desarrollaron shock en comparación con los que no, en el grupo no shock aumentó la supervivencia a 78,26% (55,42% a 90,32%; IC95%) a los 526 días (p=0,0002). Sobre los pacientes de condición paliativa, todos habían fallecido a los 347 días. La supervivencia a los 159 días fue del 2% (0,84% a 58,19%; IC95%) en comparación con los que no tenían esta condición, aumentando a 76% (54,2% a 88,43%; IC95%) a los 526 días (p=0,0011) (figura 2). No se encontró diferencias significativas en la supervivencia según tipo de neoplasia (hematológica versus sólida), comorbilidad, sexo, dificultad respiratoria severa al diagnóstico, intubación en la emergencia, requerimiento de UCI y de VMI.
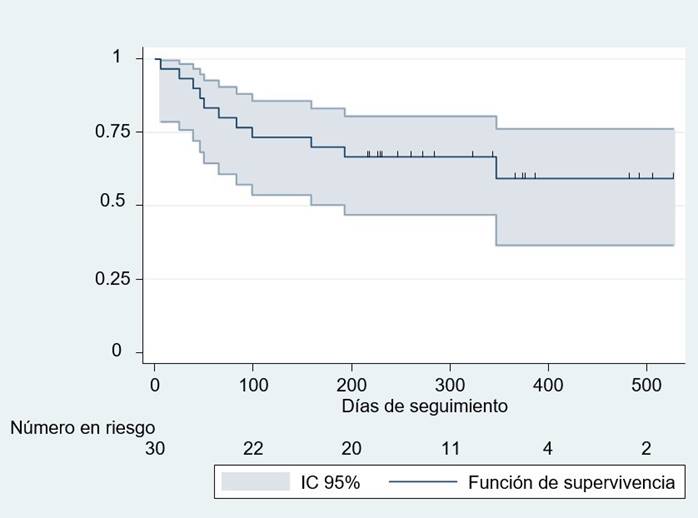
Figura 1 Estimación de la supervivencia de Kaplan-Meier de pacientes pediátricos oncológicos con COVID-19.
Discusión
Tras la llegada de la pandemia del SARS-CoV-2 surgieron grandes preocupaciones por los pacientes oncológicos pediátricos, por el probable riesgo de desarrollar manifestaciones graves y muerte 9,16. En nuestro estudio, la mayoría desarrollaron enfermedad leve-moderada, pero también requirieron UCI, soporte respiratorio, hemodinámico, y acontecieron fallecidos, mayor a otros estudios 2-9,14. También evidenciamos una supervivencia de 59,26% a los 526 días de seguimiento. Los casos graves pueden darse en niños inmunosuprimidos sobre todo al cursar con neutropenias y/o linfopenias profundas y prolongadas asociados a quimioterapias intensas, en enfermedades refractarias o en recaídas, y con la presencia de comorbilidades que condiciona una inmunidad adaptativa muy comprometida 16. Además, se ha reportado mayor severidad en países con ingreso mediano-bajo 3,8, e incluso en aquellos pacientes de origen hispano 4, probablemente por el poco acceso y la baja calidad de los servicios de salud. El Perú es un país con ingreso mediano alto según el banco mundial 17, pero con marcada desigualdad social y económica, y con serios déficits en el sistema de salud que fueron mucho más notorios durante la pandemia 18. Todo ello ha contribuido a tener un gran exceso de muerte asociado a COVID-19 en comparación con otros países 19, y esto también se reflejó en la mayor severidad encontrada en nuestros pacientes, considerando también que la mayoría tuvieron enfermedad oncológica avanzada.
En nuestro estudio, los escolares, y el género masculino predominaron, bastante similar a lo reportado en otros estudios 4,5,7,9,14. El contacto intradomiciliario se reportó en un 20% de pacientes, incluso se reportó contacto intrahospitalario en un 36,7%. Otros estudios reportan menor contacto intradomiciliario (12,1%) 13, e intrahospitalario durante la pandemia (20,3%) 9. Diferencias en el contacto pueden explicarse por la gran cantidad de contagios que sucedieron en Lima durante el periodo de estudio 20. La mayoría presentaron enfermedad avanzada, otros reportan menor frecuencia de la condición paliativa (5,7,9). Además, predominaron las neoplasias hematológicas (73,3%), principalmente la LLA de células B, similar a la mayoría de los estudios 2-5,14,15. Por otro lado, los síntomas predominantes (fiebre, síntomas respiratorios altos, síntomas gastrointestinales y dificultad respiratoria severa) fueron similares a las revisiones sistemáticas encontradas, principalmente en la frecuencia reportada de fiebre y de síntomas respiratorios 6-9.
En nuestro hospital la mayoría de los pacientes desarrollaron enfermedad leve-moderada, similar a lo reportado en otros estudios 2,5,7,9,14,15. Sin embargo, a diferencia de la mayoría de los estudios 2,4-9,14, en el nuestro hemos encontrado una mayor frecuencia de compromiso severo durante la hospitalización y en el seguimiento. Un 13,3% ingresó a UCI, algunos estudios reportan menor requerimiento (aproximadamente 9%) 4,7, pero un estudio primario, de Brasil con un n=179 pacientes, reportó hasta 19% 14. Otros reportan necesidad de VMI de 2,7 a 6% 4,14,15, mucho menor a lo reportado por nuestro estudio (30%). Además, un 23,3% de nuestros pacientes desarrollaron shock, mayor a lo reportado en Latinoamérica (22,6%) 15, y en Estados Unidos (1,7%) 4. En relación con los fallecidos, un 13,3% de pacientes murieron durante la hospitalización debido a COVID-19. Otros estudios reportan una menor tasa de mortalidad de 0,6 a 8% en revisiones sistemáticas 6-9, y de 1,2 a 12,3% en estudios primarios 2,4,5,14.
Así mismo, a todos se les suspendió el tratamiento oncológico con el diagnóstico de COVID-19, reiniciando quimioterapia a la mayoría durante el seguimiento, con una supervivencia de 59,26% (36,53 a 76,20%; IC95%) a los 526 días. Al inicio de la pandemia no existía consenso sobre el tratamiento oncológico, actualmente existen protocolos a seguir y recomendaciones más específicas 21-23. El reinicio de la quimioterapia se dio en la mayoría, pero de forma paulatina, evidenciándose baja supervivencia en nuestro estudio (59,26%; con IC95%: 6,53 a 76,20%) en comparación con otros 2,3,14. En Polonia, reportaron una supervivencia de 97,3% (92.9-99% IC95%) durante 100 días de seguimiento 2. En otros estudios la supervivencia disminuye en países con ingreso económico promedio-bajo 3, con pacientes con índice de masa corporal alterado y con enfermedad severa al diagnóstico 14. En nuestro estudio, la supervivencia aumentó en aquellos que recibieron quimioterapia post COVID-19, y disminuyó en pacientes de condición paliativa, con requerimiento de CAF y desarrollo de alteración hemodinámica, todo ello en base a un análisis exploratorio crudo de la supervivencia resultando las conclusiones preliminares. Por último, de forma preliminar encontramos que los pacientes con SatO2<92%, requerimiento de CAF, y desarrollo de shock se asociaron con el fallecimiento durante hospitalización, similar a los descrito en población general. Son asociaciones preliminares que son necesarias confirmarlas en estudios con mayor muestra y potencia estadística.
La principal fortaleza de este estudio es que hemos incluido casos confirmados de COVID-19, y que realizamos una revisión exhaustiva de la historia clínica (física y electrónica), por lo que contribuye a describir la infección aguda de forma confiable. Además, realizamos un seguimiento con el fin de determinar la supervivencia de estos pacientes. Por otro lado, este estudio podría tener limitaciones relacionadas con la fuente secundaria usada y la recolección retrospectiva. Además, no hemos recolectado datos sobre los marcadores inflamatorios, ni del tratamiento de COVID-19, tampoco profundizamos en el tratamiento oncológico. Tampoco evaluamos confusores en el análisis de supervivencia, sólo se realizó un estudio exploratorio en base a un análisis bivariado debido al pequeño tamaño muestral. Por último, este estudio representa las características de una muestra pequeña de un único hospital. Por todo ello, las conclusiones son preliminares y deberían ser extrapoladas con cautela en otras poblaciones.
Sobre las implicancias en la práctica clínica, es necesario mantenernos vigilantes con pacientes oncohematológicos pediátricos infectados por SARS-CoV-2 debido a que pueden desarrollar enfermedad severa, incluso fallecer. Además, es importante evitar el retraso del tratamiento oncológico de fondo con el fin mejorar la supervivencia de los pacientes.
En conclusión, en nuestro estudio la mayoría de los pacientes pediátricos oncohematológicos con COVID-19 desarrollaron enfermedad leve-moderada. Sin embargo, el SARS-CoV-2 también causó afectación severa, muerte y baja supervivencia. Es necesario el desarrollo de estudios prospectivos en Latinoamérica que representen la casuística local o regional, con el fin de esclarecer el perfil clínico y supervivencia de estos pacientes, para mejorar su manejo y pronóstico.