Introducción
La neuropatía periférica afecta a casi el 50 % de los adultos con diabetes a lo largo de su vida (1.La estrategia de precisión y precocidad adecuada en el diagnóstico de la neuropatía periférica diabética es combinar pruebas neurológicas periféricas que puedan evaluar las fibras nerviosas finas y gruesas2.Las imágenes termográficas son una alternativa biomédica viable y emergente en el diagnóstico de neuropatía periférica diabética3.
La NPD se expresa clínicamente por la presencia de síntomas y/o signos de disfunción nerviosa periférica de los miembros inferiores de manera simétrica en los pacientes con diabetes, con afectación autonómica sensorial y motora en la etapa inicial y avanzada respectivamente (4.
Los principales factores asociados a esta patología son la edad del paciente, el tiempo de duración de la diabetes, la hiperglucemia, la hipertensión, la obesidad, el tabaquismo y otros que pueden influir en su presentación clínica, aparición y gravedad5.Un metaanálisis ha concluido que la duración de la diabetes , la edad , la hemoglobina glicosilada , la retinopatía diabética están asociados significativamente al incremento de la NPD ,pero sin asociación con el índice de masa corporal, el tabaquismo ,los triglicéridos y el colesterol total6.
El diagnóstico de la NPD de fibras gruesas se realiza por la prueba clínica de sensibilidad táctil y vibratoria cuya expresión clínica se caracteriza por ser tardía y asintomática (7. Por otro lado, el diagnóstico de NPD de fibras pequeñas se realiza por pruebas funcionales vasomotoras como la prueba termorregulación cuya expresión clínica se caracteriza por ser precoz y dolorosa (8.
Las NPD de pequeñas fibras delgadas son diagnosticadas por pruebas vasomotoras cuyo fundamento es la alteración de la termorregulación de la piel al estimulo pasivo o activo por frio o calor produciendo una ausencia o disminución de la respuesta de vasoconstricción (9. Los antecedentes de prevalencia de NPD de fibras pequeñas varían de 1.6% a 13.5% en Dinamarca10 y 24.7% en China11 usando pruebas clínicas y biomédicas combinadas en ambos estudios.
Las imágenes termográficas medicas son representaciones graficas que evalúa la termorregulación, por medio de la captación de las emisiones de calor de la piel explorada que luego es procesada y analizada para identificar una alteración (12. Las imágenes termográficas son aplicadas en el apoyo diagnóstico y seguimiento de la neuropatía periférica diabética, enfermedad arterial periférica, deformidad del pie y úlceras diabéticas (13.
Los antecedentes sobre diagnóstico de NPD de fibras pequeñas usando imágenes termográficas, han mostrado resultados válidos y exitosos en la India (14, Rumania (15, Brasil (16, Singapur (17 y China (18.
La neuropatía diabética como principal complicación crónica de la diabetes, su alta prevalencia mundial, sus factores asociados , su prevención para evitar úlceras y la capacidad de evaluar el componente neurológico autonómico por las imágenes termográficas justifican el objetivo de calcular la prevalencia e identificar los factores asociados al diagnóstico de la neuropatía periférica de fibras pequeñas usando imágenes termográficas en una unidad especializada que atiende a diabéticos tipo 2 en la ciudad de Trujillo-Perú .
Material y métodos
El diseño de la investigación fue observacional y transversal a través de la presencia de un diagnóstico de neuropatía periférica diabética de fibras pequeñas por imagen termográfic y su asociación con diferentes variables. Los pacientes con diabetes tipo 2 participantes fueron reclutados de un programa público de diabetes en Trujillo (ubicado en la costa norte del Perú a 34 metros sobre el nivel del mar), derivados de centros de atención primaria de salud durante el año 2018 y evaluados por una unidad especializada privada de la misma ciudad. La población de estudio fue recolectada durante 12 meses y su selección se realizó por muestreo aleatorio simple. Los criterios de selección fueron: diagnóstico de diabetes según la guía clínica del Ministerio de Salud del Perú, ausencia de lesiones ulcerosas en el pie , ausencia de enfermedad mental o discapacidad motora que impida la movilización u otras patologías neurológicas secundarias, y la aprobación del consentimiento informado por escrito. La unidad de análisis fue cada paciente con diabetes con o sin diagnóstico de neuropatía periférica de fibras pequeñas.
El tamaño de la muestra se calculó mediante la metodología del poder estadístico utilizando el programa OpenEpi de código abierto , para la cual se consideró un nivel de confianza de 95% , una potencia de 80%, la razón de expuestos a no expuestos para estudios transversales igual a 2 , se consideró el porcentaje de no expuestos positivos 20% y el OR 2.3 (valor promedio de los factores significativos ) que fue extraído de un metaanálisis(6).El resultado final fue 83 y 165 para los expuestos y no expuestos a NPD respectivamente.
Las variables consideradas según el diseño fueron presencia de neuropatía periférica de fibras pequeñas , demográficas como el grupo etario según OMS y género ,antecedentes de la diabetes como el tiempo de enfermedad y control regular de atención, comorbilidades como la presencia de hipertensión arterial , nefropatía y retinopatía, estilo de vida como la presencia de actividad física y dieta baja en carbohidratos, síntomas neurológicos como la presencia de dolor o adormecimiento e IMC según OMS(alto o normal ) .La presencia de actividad física fue considerada cuando el paciente con diabetes practicaba una caminata vigorosa , trotar o correr 3 veces a la semana durante 30 minutos y la presencia de dieta baja en carbohidratos fue considerada de acuerdo al programa nutricional supervisado de su centro de atención de salud de referencia
Los pacientes fueron evaluados mediante exploración clínica para el diagnóstico de la NPD de fibras gruesas y para el diagnóstico de NPD de fibras delgadas prueba de termorregulación (prueba biomédica) usando imágenes termográficas. Ambos componentes fueron validados en un estudio local (19.
El interrogatorio para el diagnóstico de NPD para fibras gruesas y pequeñas consistió en preguntar sobre las características demográficas, antecedentes de diabetes, comorbilidades, estilo de vida y presencia de síntomas neurológicos.
El examen físico para el diagnóstico de la NPD para fibras gruesas fueron la prueba de sensibilidad táctil con el monofilamento de 10 gr en tres zonas plantares de cada pie , y la prueba vibratoria con el diapasón de 128 Hz sobre el hallux de cada pie según las recomendaciones de la IWGDF7.
El examen físico para el diagnóstico de la NPD para fibras pequeñas fue la prueba de termorregulación que consistió en los siguientes pasos:
La región de interés para la adquisición de las imágenes fueron la zona plantar de ambos pies del paciente en decúbito dorsal y usando un aislante periférico de fondo muy similar al estudio de Van Netten20.
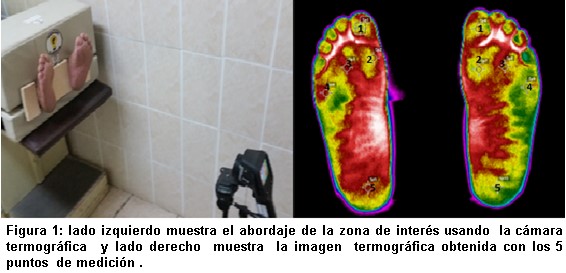
La captura de las imágenes termográficas fueron realizadas usando una cámara FLIR E60 (sensor de infrarrojos de 360 x 240 píxeles, sensibilidad térmica de 0,05 °C, rango espectral de 7 5 a 14 µm) siguiendo las recomendaciones internacionales21 en un entorno acondicionado previo del paciente de 15 minutos antes del examen con una temperatura de 20 a 25 °C y una humedad del 60-80%, equipo y accesorios calibrados y realizados por un técnico médico capacitado, ver Figura 1.
La imagen termográfica fue registrado digitalmente en JPG por la cámara y luego enviado a una computadora para ser analizada por el software FLIR Tool .
Este estudio consideró como estímulo el ambiente de la sala de exploración entre 20 a 25 grados °C (5 minutos en promedio), esto corresponde a evaluación termográfica pasiva. No consideramos estímulos de frio o calor en este estudio.
El análisis de las imágenes termográficas consideró la segmentación y mediciones absolutas puntuales de cinco zonas plantares de ambos pies18 localizadas en el centro del hallux, la prominencia del primer metatarsiano, la prominencia del tercer metatarsiano, prominencia del quinto metatarsiano y el talón.
Se compararon las temperaturas absolutas de las 5 lugares de cada planta usando el valor absoluto del diferencial de la temperatura absoluta puntual de cada punto en las 5 zonas segmentadas de la planta.
El resultado final se consideró como termorregulación anormal cuando el valor diferencial de medición de temperatura puntual fue mayor a 2 °C en cualquiera de los 5 puntos de medición22.
El diagnóstico definitivo de NPD de fibras pequeñas fue considerado cuando la prueba de termorregulación con imágenes termográficas fue anormal . Este proceso fue gestionado y analizado por una plataforma online de gestión de datos. El médico de familia capacitado analizó la información de los datos e imágenes que luego fueron validados por el investigador principal por telemedicina. El paciente recibió un informe sobre su diagnóstico final y fue referido a su lugar de centro de atención primaria de salud.
La estadística descriptiva fue el cálculo de frecuencias relativas y absolutas en las variables observacionales. La estadística inferencial consistió en analizar la relación de la presencia de NPD de fibras pequeñas con factores demográficas , antecedentes de diabetes, comorbilidades , estilo de vida . síntomas y presencia de IMC elevado. Se utilizó análisis usando la prueba de chi-cuadrado utilizando el software SPSS versión 24.No usamos análisis multivariado por regresión logístico debido a que el tamaño de muestra no alcanzaba el mínimo recomendado. Los componentes éticos y deontológicos fueron el consentimiento informado por escrito, confidencialidad y aprobación del comité de ética externo acreditado por el Instituto Nacional de Salud. (Figura 1)
Resultados
Los diabéticos tipo 2 considerados en la evaluación fueron 304 de un total de 310 por que seis de ellos fueron excluidos por presentar una imagen termográfica de mala calidad . Las características de los sujetos evaluados fueron : edad promedio en 65.07±11.39, género masculino en 57.6% ,10 a más años de diabetes en 67.4%,hipertensión 50.3% y presencia de actividad física en el 82,9%. Ausencia de síntomas neurológicos en 61.2% , IMC alto en 76.6%; sensibilidad táctil conservada en el 93,1%, sensibilidad vibratoria conservada en el 88,2% y prueba de termorregulación conservada en 72.7%.El diagnóstico de NP de grandes fibras ,fibras pequeñas y global fueron 14.8%, 27.3% y 34.9% respectivamente .El análisis de la variable diagnóstico de NPD de pequeñas fibras respecto a los factores concurrentes, mediante la prueba de "Chi" cuadrado, encontró solo asociación con la presencia de retinopatía(α=0,02) con una asociación directa con fuerza débil por el coeficiente de contingencia (C= 0.18); detalles en la Tabla 2. (Tabla 1)
Tabla 1 Características generales de 304 pacientes con diabetes tipo2 evaluados para diagnóstico de neuropatía periférica en un centro especializado de pie diabético
| Características | Parámetro | F | % |
|---|---|---|---|
| Demográfica | Genero Hombre Mujer | 175 129 | 57.6 42.4 |
| Antecedentes de diabetes | Tiempo de enfermedad Menos de 10 años 10 a mas Tipo de tratamiento Oral Insulina | 99 205 279 25 | 32.6 67.4 91.8 8.2 |
| Comorbilidades | Hipertensión arterial Si No Retinopatía Si No Nefropatía Si no | 153 151 84 220 32 272 | 50.3 49.7 30.3 69.7 10.5 89.5 |
| Estilo de vida | Dieta baja en carbohidratos Si No Actividad física Si No | 153 151 252 52 | 50.3 49.7 82.9 17.1 |
| Síntoma neurológico | Dolor o adormecimiento Si No | 72 232 | 23.7 76.3 |
| Exploración clínica | IMC Normal sobrepeso obesidad Sensibilidad táctil Presente Ausente Sensibilidad vibratoria Presente Ausente Termorregulación por IT Presente Ausente | 101 133 70 283 21 268 36 221 83 | 33.2 43.8 23.0 93.1 6.9 88.2 11.8 72.7 27.3 |
| Diagnóstico de neuropatía periférica | Grandes fibras Si No Pequeñas fibras Si No Grandes o pequeñas fibras (global ) Si No | 45 259 83 221 106 198 | 14.8 85.2 27.3 72.7 34.9 65.1 |
Tabla 2 Análisis de asociación entre pacientes con diabetes tipo 2 con y sin diagnóstico de neuropatía periférica de pequeñas fibras en un centro especializado de pie diabético
| Características | Parámetro | NPD-pf presente (83) | NPD-pf Ausente (221) | p< 0.05 |
|---|---|---|---|---|
| Demográfica | Genero Hombre Mujer Edad Menor de 70 años 70 a mas años | 49 34 52 31 | 126 95 141 80 | 0.75 0.19 |
| Antecedentes de diabetes mellitus tipo 2 | Tiempo de enfermedad Menos 10 años 10 a mas años Tipo de tratamiento Oral Insulina | 24 59 79 5 | 75 146 200 21 | 0.41 0.19 |
| Comorbilidades | Hipertensión arterial Si No Retinopatía Si No Nefropatía Si no | 38 45 19 64 9 74 | 115 106 73 148 23 198 | 0.33 0.02* 0.91 |
| Estilo de vida | Dieta baja en carbohidratos Si No Actividad física Si No | 36 47 68 15 | 117 104 184 37 | 0.13 0.78 |
| Síntoma neurológico | Dolor o adormecimiento Si no | 67 16 | 165 56 | 0.27 |
| Exploración clínica | IMC según OMS Normal(18.5 a 24.9) Elevado (25 a mas ) | 30 53 | 71 150 | 0.73 |
NPD-pf: neuropatía periférica diabética de fibras pequeñas, IMC: índice de masa corporal, *: C(coeficiente de contingencia ) igual a 0.18.
Discusión
Este estudio encontró 27.3% como frecuencia de diagnóstico de neuropatía periférica diabética de pequeñas fibras usando la imagen térmica y solo estuvo asociada a la presencia de retinopatía diabética.
El diagnóstico de la NPD se realiza de manera tardía porque solo se considera la afectación de fibras gruesas (somatosensoriales ) que detectan la alteración neurológica en etapa avanzada23. La NPD que afecta las pequeñas fibras ocurre tempranamente y está asociadas con dolor neuropático , úlcera dérmica y pie de Charcot24.
El diagnóstico de NPD de fibras gruesas, se realiza por las pruebas de sensibilidad táctil y vibratoria que corresponden a las fibras mielínicas Aδ de 1-5 μm y Aβ de 6-12 μm respectivamente25. Por otro lado, el diagnóstico de la NPD de fibras pequeñas denominadas autonómicas, se realiza usando pruebas funcionales o estructurales que corresponden a las fibras amielínicas C de 0.2-1.5 μm8,26.Este estudio focalizo el diagnóstico a la NPD de fibras pequeñas pero incluyó la evaluación de la NPD de fibras gruesas de tal manera que se trató de abarcar el compromiso anatómico de todas las fibras nerviosas en la descripción de la características de la población objetivo .
El diagnóstico de la NPD de fibras pequeñas es realizado usando pruebas funcionales tales como la imagen Doppler laser, cuantificación de sensorio por umbral de dolor o calor ,evaluación del sudor motora, potenciales evocados y micro neurografía27. También con el uso de pruebas estructurales como microscopia confocal corneal, biopsia de piel y biopsia del nervio8. Este estudio utilizó para el diagnóstico de NPD de fibras pequeñas una prueba funcional del mecanismo de termorregulación que es similar a la imagen Doppler laser .
Este estudio encontró una prevalencia de NPD global de casi 35%, es decir fibras delgadas y gruesas , dentro de los rangos reportados por una revisión sistemática28. Por otro lado , la prevalencia de NPD de pequeñas fibras encontrada en este estudio fue superior a un estudio danés10) y similar a un estudio chino11. La diferencia respecto estudio danés se explica porque su población fueron diabéticos recién diagnosticados ; la similitud con el estudio Chino se explica porque su población presento una tiempo de diabetes de más de 10 años , pero una diferencia resaltante es que ellos usaron una prueba estructural como la microscopia confocal corneal.
La utilización de la imagen termográfica como expresión fisiológica de la termorregulación pasiva realizada en ésta investigación fue similar a los estudios de la India14,Rumania15, Singapur17 y China18) y respecto al diseño de estudio fue similar solo al estudio de la India ya mencionado. Este estudio solo fue similar en diagnóstico de NPD de fibras pequeñas al realizado en Brasil16. Por otro lado, ninguno de los estudios mencionados utilizó la telemedicina o se realizaron en un entorno de atención primaria. La termorregulación alterada que se expresa en la imagen infrarroja, se debe al aumento de la captación de la onda infrarroja de la piel inervada por un nervio periférico alterado que no regula el reflejo vasomotor del plexo capilar produciendo una vasodilatación sostenida que aumenta la temperatura en la zona29.
Este estudio encontró como único factor asociado a la NPD de fibras pequeñas la presencia de retinopatía diabética. Esta asociación se explica porque la neuropatía periférica diabética presenta similar proceso fisiopatológico que la retinopatía sobre todo cuando están afectadas las fibras pequeñas30.Los factores como antecedentes de diabetes , estilos de vida, síntomas neurológicos no estuvieron asociados a la NPD de fibras pequeñas por la subjetividad de su recolección.
Las limitaciones encontradas en este estudio fueron la utilización de un software de análisis de imágenes termográficas no personalizado y la no monitorización de la HbA1c. Las fortalezas fueron el uso de una plataforma de telemedicina. La implicancia clínica es que el uso de la imagen termografía permite complementar de forma temprana e integral la detección de la neuropatía periférica diabética.
La conclusión de este estudio utilizando una prueba biomédica de termorregulación pasiva expresada en la imagen termográfica, encontró un 23.7% de prevalencia de NPD de pequeñas fibras en los pacientes con diabetes tipo 2 estudiados. Esta alta prevalencia está asociada directamente y fuerza leve a la presencia de retinopatía diabética. El aporte científico de este estudio fue poder calcular la prevalencia de la NPD de fibras delgadas usando una novedosa prueba biomédica térmica no invasiva siendo válida en el contexto del diagnóstico del pie en riesgo a úlcera en diabéticos tipo 2 sobre todo en aquellos con presencia de retinopatía diabética.