Introducción
Se investigó una variable: el control interno de calidad de RT-PCR en tiempo real para la detección cualitativa de SARS-CoV-2. Esta variable a su vez es un proceso y se buscó optimizar este proceso, porque la RT-PCR en tiempo real, más conocida como “prueba molecular”, es la prueba “gold standard” para diagnosticar contagio con SARS-CoV-2, en los primeros días de síntomas o de haber estado en contacto con casos positivos 1; así pues, esta técnica molecular tiene importancia clínica, epidemiológica y social en el actual contexto de pandemia por COVID-19 2.
Sin embargo, la RT-PCR en tiempo real para la detección cualitativa de SARS-CoV-2, implica, como cualquier proceso complejo, una serie de actividades que van desde la toma de muestra, pasan por la fase de alicuotado, extracción de ARN viral, preparación de master mix, amplificación de material genético, lectura e interpretación de resultados y todo esto se realiza para finalmente, entregar al paciente un resultado dicotómico: positivo o negativo 3.
En cada fase y procedimiento, es muy probable que se incremente la variabilidad (error) del proceso 4, y esta variabilidad se refleja en los valores Cq o Ct (Cycle threshold) de los controles. La no identificación de errores y la falta de medición de la magnitud de los mismos, podrían alterar el proceso al punto de invalidar análisis, repetirlos, generar más gastos, aumentar el tiempo de entrega de resultados e incluso, entregar más resultados falsos negativos y falsos positivos con el consecuente efecto nocivo en la salud de los pacientes 5.
La actual monitorización de este proceso, consiste sólo en verificar que los controles negativos (que identifican contaminación) y positivos (que identifican inhibición), amplifiquen según un punto de corte (Cq o Ct estandarizado) y de esta forma se validen cada día, los resultados de las muestras de pacientes que fueron acompañados por estos controles 6. Esta es la forma básica de hacer control interno de calidad para esta técnica, respecto a los productos de la amplificación, en los laboratorios de biología molecular, actualmente 7.
Ejecutar el control interno de la calidad, no puede consistir sólo en pasar controles para cumplir el día a día, debe consistir en analizar la variabilidad que los resultados de los controles (Cq) van generando a lo largo del tiempo, pero, existe el problema de que los valores Cq son muy variables y podrían no comportarse según una distribución normal, así que no sería factible aplicar herramientas estadísticas, como sí es posible para la mayoría de analitos en el laboratorio clínico 8, o es práctica común en RT-PCR en tiempo real de tipo cuantitativo, como cuando se reporta carga viral, por ejemplo 9. Por lo tanto, es necesario que el control interno de calidad de la RT-PCR en tiempo real para la detección cualitativa de SARS-CoV-2, deba ser ejecutada de forma más óptima 10.
Se debe monitorizar y mantener bajo control, la variabilidad de los valores Cq, ya que estos reflejan la historia del proceso completo de RT-PCR en tiempo real. Sin embargo, los valores Cq son de naturaleza semicuantitativa (resultan de asociar unidades de fluorescencia con ciclos de amplificación) 11 y quizá esto explique que se consideren, a priori, como datos a partir de los cuáles no se pueden obtener estadígrafos de tendencia central o de dispersión 12 y que por lo tanto, no sea factible aplicar el típico control interno de la calidad, como es práctica común en diversas áreas del laboratorio clínico 13. Esta situación podría explicar que no se haya encontrado publicaciones que traten directamente este tema.
La demostración de la distribución normal o una tendencia hacia esta, de los valores Cq de los controles negativos y positivos, sería el requisito básico para poder, aplicar herramientas estadísticas a estos valores, implementar y monitorizar el control interno de la calidad para RT-PCR en tiempo real para detección cualitativa de SARS-CoV-2, de forma análoga a la técnica molecular cuantitativa.
Como se sostuvo anteriormente, toda la RT-PCR en tiempo real para detección cualitativa de SARS-CoV-2 es un proceso y, la optimización de este proceso se sustenta en la calidad de los valores Cq de controles utilizados, es decir, en la aceptación de los lotes de estos valores 14. Asimismo, la optimización del control interno de calidad quedaría evidenciado con la obtención de índices Cpk superiores a 1.33, que están relacionados con la reducción (no eliminación) de la necesidad de inspección 15, porque el proceso ha logrado relativa estabilidad y la variabilidad se ha reducido de forma significativa, debido quizá a la ejecución de buenas prácticas de laboratorio y estandarización de los procedimientos, con el consecuente beneficio en el diagnóstico molecular y la salud del paciente.
Material y método
Diseño del estudio: este fue un estudio prospectivo y longitudinal, llevado a cabo desde agosto del 2020 hasta marzo del 2021, en un laboratorio de Biología Molecular, acreditado por el Instituto Nacional de Salud (INS) y ubicado a 3259 msnm en la ciudad de Huancayo, Perú.
Muestra: se tuvo como control interno (CI) al virus de la arteritis equina (EAV). De la mezcla de este control interno con agua de grado molecular, se obtenían los controles negativos cargados en los procesos de alicuotado y extracción de ARN. Los controles negativos se usaban para detectar inhibición de la PCR y se leían con el filtro Cy5. Por otro lado, como control positivo se utilizó una molécula de ADN bicatenario circular, patentado por el fabricante, empleado para detectar rendimiento de primers y sondas y se leía con el filtro FAM 16.
El control negativo de alicuotado
Criterios de inclusión: Sólo se consideraron valores Cq de controles que permitieron validar resultados de muestras de pacientes, es decir, Cq ≤ 33 cuyas curvas tuvieron forma sigmoidea.
Criterios de exclusión: Si un valor de Cq de alguno de los tres tipos de controles, en una misma fecha, se leyó como No Cq (inválido), entonces los valores Cq de los otros dos controles se descartaron, aunque estos fueran válidos (Cq ≤ 33).
Al final se obtuvieron 143 valores Cq de tres tipos de control: control negativo de alicuotado, control negativo de extracción y control positivo. El número de valores Cq quedó distribuido de la siguiente manera: agosto 2020 4, septiembre 2020 19, octubre 2020 (28) , noviembre 20 17, diciembre 20 19, enero 2021 (25) , febrero 2021 (21) , marzo 2021 10.
Reactivos e instrumentos
Para obtener los valores Cq, se utilizó el kit de amplificación FTD-SARS-CoV-2 (Siemens) y el termociclador AriaMx (Agilent Technologies). El kit de amplificación tenía especificidad para los genes N y ORF1ab.
Procesamiento de datos
El procesamiento de datos se hizo con Minitab versión 19. De esta forma, se calcularon los límites de control, a partir de 51 valores de Cq obtenidos de agosto a octubre del 2020. En base a estos límites de control, se monitorizaron y controlaron 92 valores Cq obtenidos desde noviembre del 2020 hasta marzo del 2021.
Se construyó una hoja de trabajo con 51 valores de Cq de cada uno de los controles, correspondientes a los meses agosto, septiembre y octubre del 2020. A partir de estos datos, se obtuvo lo siguiente: coeficiente de Anderson-Darling (AD) para determinar distribución normal de los datos, gráficas de probabilidad para inspeccionar patrón de normalidad de datos, estadísticos básicos como media y desvío estándar para calcular límites de variabilidad o dispersión de proceso, gráfico de corridas para calificar la formación de conglomerados, mezcla, tendencia y oscilación de datos que a partir de ahora servirían como referencia para el control de variabilidad mensual de la RT-PCR en tiempo real para detección cualitativa de SARS-CoV-2, a partir de noviembre del 2020.
Se obtuvieron gráficas de monitorización y control para los tres tipos de control; así pues, se calcularon media y desvío estándar mensuales para analizar la variabilidad de estos parámetros, de forma mensual, dentro de los límites de variabilidad ya definidos. De esta manera, se pudo detectar aquellas fechas en las que hubo mayor variabilidad y la formación de desplazamientos o tendencias de los valores Cq.
Se determinó la aceptación del lote de valores Cq y se calculó el índice Cpk para cada uno de los tres tipos de control a partir de 92 datos de cada uno de estos, de noviembre del 2020 a marzo del 2021.
Resultados
Prueba de normalidad de valores Cq
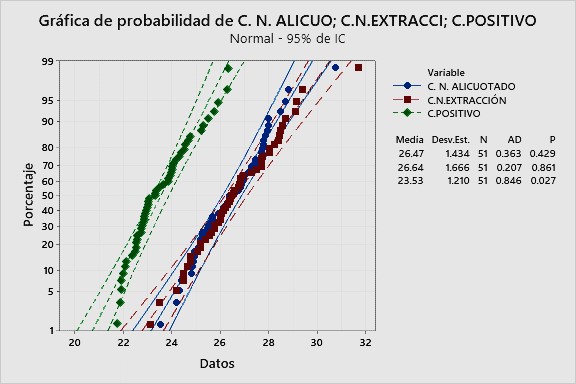
En base a 51 valores de Cq para cada uno de los tres controles, correspondientes a los meses de agosto, septiembre y octubre, se calculó el coeficiente de Anderson-Darling (AD). En la Figura 1, puede observarse que los valores de Cq del control negativo de alicuotado y del control negativo de extracción, tienen coeficientes AD bajos y que los valores p son mayores al nivel de significancia de 0.05, lo que indica que estos valores Cq sí tienen distribución normal. Para el control positivo se puede observar un valor p de 0.027 que es menor al nivel de significancia 0.05. Sin embargo, al ser el coeficiente AD relativamente bajo y al notar que la gran mayoría de sus valores Cq están dentro de las gráficas de probabilidad, se puede asumir que también tiene distribución normal.
Cálculo de media y desvío estándar como límites de variabilidad
La monitorización de los Cq de los controles analizados desde noviembre del 2020 hasta marzo del 2021, requirió de establecer límites de variabilidad tales como la media y el desvío estándar, los cuales se calcularon en base los valores Cq de agosto, setiembre y octubre del 2020, que en conjunto fueron 51 datos, superior a los 20 datos como mínimo que se recomienda usar, haciéndose esto para poder obtener valores estadísticamente más robustos, tal y como se observa en la Tabla 1.
Gráficas de corridas y prueba de aleatoriedad
Para proceder con la monitorización y control de valores Cq de los tres controles es una condición necesaria poder demostrar que estos datos tienen distribución aleatoria, es decir, que los datos no tienen una cierta tendencia a agruparse o alinearse hacia un lado de la media o que están sesgados. Para confirmar esta aleatoriedad, el p-valor fue menor al nivel de significancia (0.05) para los siguientes parámetros: conglomerados, mezclas, tendencia y oscilación. Los únicos parámetros que no cumplieron esta condición fueron el control negativo de alicuotado y control positivo para el parámetro formación de conglomerados Esto puede observarse en la Tabla 2.
Tabla 2 Valores p de parámetros de aleatoriedad para controles obtenidos en los meses de agosto, septiembre y octubre del 2020
| Parámetro | Control negativo de alicuotado | Control negativo de extracción | Control positivo |
|---|---|---|---|
| Nivel de significancia (p) | 0.050 | 0.050 | 0.050 |
| Valor p para conglomerado | 0.008 | 0.102 | 0.008 |
| Valor p para mezcla | 0.992 | 0.898 | 0.992 |
| Valor p para tendencia | 0.545 | 0.184 | 0.993 |
| Valor p para oscilación | 0.455 | 0.816 | 0.007 |
Aceptación de lote de valores Cq
A partir del lote de 92 valores Cq obtenidos de noviembre del 2020 a marzo del 2021, para cada uno de los tres tipos de controles: control negativo de alicuotado, del control negativo de extracción y del control positivo, el algoritmo de Minitab, seleccionó de forma aleatoria, 11 valores Cq. En la Tabla 2, puede observarse que los desvíos estándar calculados a partir de estos 11 valores Cq, son menores al desvío estándar máximo (DEM) que es 8.30 y que, por lo tanto, todos los lotes de valores Cq monitorizados, fueron aceptados, tal y como se observa en la Tabla 3.
Tabla 3 Estadísticos de dispersión de controles obtenidos a partir de datos de agosto, septiembre y octubre del 2020
| Parámetro | Control negativo de alicuotado | Control negativo de extracción | Control positivo |
|---|---|---|---|
| Tamaño de muestra | 11 | 11 | 11 |
| Media | 25.96 | 27.64 | 23.79 |
| Desviación estándar | 1.37 | 1.98 | 0.94 |
| Límite de especificación inferior (LEI) | 1 | 1 | 1 |
| Límite de especificación superior (LES) | 31 | 31 | 31 |
| Distancia crítica (valor k) | 1.56 | 1.56 | 1.56 |
| Desviación estándar máxima (DEM) | 8.30 | 8.30 | 8.30 |
| Decisión | Aceptar lote | Aceptar lote | Aceptar lote |
Índice de capacidad real de proceso Cpk
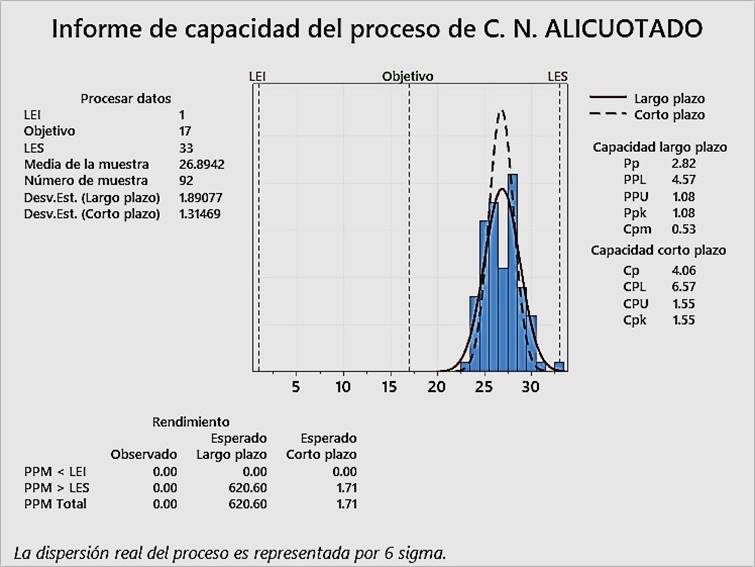
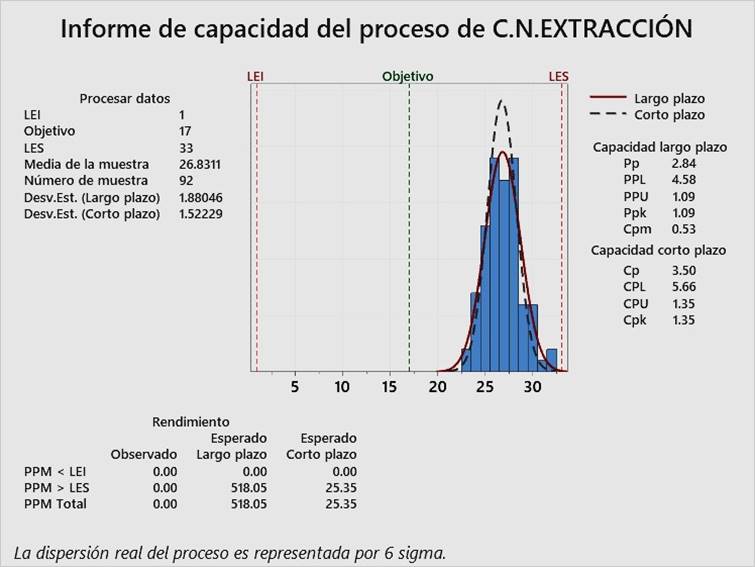
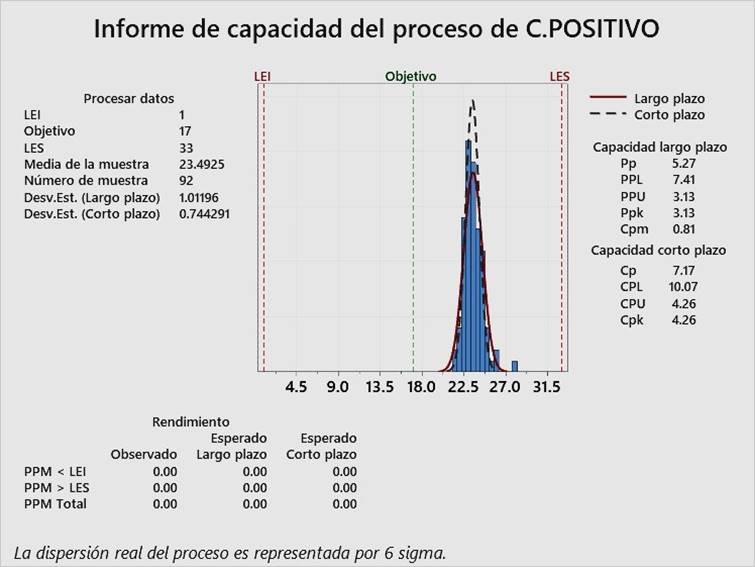
En las Figura 2, Figura 3 y Figura 4, pueden observarse los índices Cpk para el control negativo de alicuotado, control negativo de extracción y control positivo, respectivamente. Todos los índices Cpk son superiores a 1.33, lo cual evidencia que el control interno de calidad de RT-PCR en tiempo real para detección cualitativa de SARS-CoV-2, ha sido aceptable, que se puede reducir la inspección del proceso y que, por lo tanto, ha sido optimizado para los tres tipos de control, desde noviembre del 2020 hasta marzo del 2021.
Discusión
Quizá no se haya encontrado trabajos publicados sobre el control de calidad de RT-PCR en tiempo real para la detección cualitativa de SARS-CoV-2, por el hecho de que no se dispone de datos cuantitativos como sí ocurre cuando se analizan parámetros de controles, tales como carga viral o número de copias por mililitro, que se supone tienen distribución normal 9. En cambio, los valores Cq de los controles empleados en este tipo de RT-PCR son semicuantitativos 11, son muy variables, son muy sensibles, podrían estar muy dispersos, podrían no tener distribución normal, en concreto, podría ser muy riesgoso su control a lo largo del tiempo, después de todo la técnica de PCR es una técnica de biología molecular.
No obstante, existe una tendencia en el mundo científico de relacionar valores de Cq muy pequeños a mayores cargas virales y valores grandes de Cq a menores cargas virales, como deseando encontrar alguna relación matemática 6)(17. A propósito de esto, existen también estudios en los que al analizar cómo varía el Cq de muestras en pools en RT-PCR en tiempo real de tipo cualitativo, los Ct se relacionan aritmética y geométricamente 18)(19)(20.
Lo que se hizo aquí, simplemente fue aplicar las ya conocidas herramientas estadísticas del control interno de calidad a la RT-PCR en tiempo real para detección cualitativa, teniendo como insumo a los valores Cq de los controles. Encontrar que los valores Cq tienen distribución normal fue la base para proseguir con la investigación. Asimismo, ayudó mucho el hecho de que el lote del kit de amplificación y, por tanto, de producción industrial de los controles, fue el mismo durante toda la investigación.
Se implementó un sistema de gestión de calidad en el laboratorio de biología molecular para estandarizar procesos desde la toma de muestra, hasta la emisión de resultados; se monitorizó y controló la temperatura de cada conservadora y de los ambientes de trabajo, se mejoraron las técnicas de esterilización de espacios para evitar contaminación; se mejoraron también los registros de las actividades realizadas diariamente. Así pues, todo esto ayudó a disminuir la magnitud del error en los procedimientos.
El proceso de control interno de calidad de RT-PCR en tiempo real para detección cualitativa de SARS-CoV-2, fue el proceso investigado y la aceptación de todo el lote de valores Cq analizado, así como la obtención de un índice de capacidad real de proceso (Cpk) mayor a 1.33, demostraron que este proceso se había optimizado a lo largo del tiempo.
Sin embargo, cabe puntualizar algunos aspectos:
Se suele recomendar que los límites de control para monitorizar los controles, se obtengan a partir de un mínimo de 20 datos, pero, aquí se utilizaron 52 valores de Cq correspondientes a los meses de agosto, setiembre y octubre del 2020. Esto le dio más poder estadístico la media y desvío estándar que se usaron en adelante cómo límites de control.
La aceptación del lote de valores Cq para los tres controles indica que la dispersión de estos, es decir, su fluctuación diaria, fue menor que la máxima que podría permitirse. La misma lógica se podría aplicar para el índice de capacidad real del proceso (Cpk); sin embargo, tanto la aceptación del lote de valores Cq y los Cpk aceptables obtenidos, podrían deberse más a la amplitud de los límites teóricos para Cq, los cuales estaban en el rango de 1 a 33, siendo 33 el punto de corte para decidir si el Cq de un control era válido o no, según el fabricante. Si estos límites se redujeran, podrían obtenerse menores valores para Cpk; no obstante, al no disponerse de un límite teórico más exacto, el rango de amplitud de 1 a 33, no deja de ser adecuado para un primer análisis de capacidad real de proceso.
Por último, los resultados obtenidos indican que, si se establece la estandarización de procedimientos y buenas prácticas en el laboratorio de biología molecular, se puede desarrollar un programa de control interno de calidad de RT-PCR en tiempo real para la detección cualitativa de SARS-CoV-2 y que es posible que este enfoque se pueda extrapolar hacia la detección cualitativa de material genético de cualquier virus y microorganismo en general.