Introducción
La fascitis necrotizante es una infección que afecta los planos faciales, provocando necrosis de los tejidos subcutáneos. Este se caracteriza por su rápida progresión y toxicidad sistémica, pudiendo incluso conducir a la muerte1. El tratamiento convencional de las superficies sanguinolentas, provocadas como secuela de la fascitis necrosante, incluye la aplicación de injertos de piel. El tratamiento estándar para la fascitis necrosante implica cirugía, terapia con antibióticos y monitoreo del paciente. Sin embargo, el manejo de las heridas posquirúrgicas representa un reto para el especialista en cirugía oral y maxilofacial debido a su lento y largo proceso de resolución con resultados estéticos desfavorables1,2,3. Varios estudios han considerado que la membrana amniótica humana tiene un potencial regenerativo debido a sus propiedades biológicas (propiedades inmunomoduladores, adhesivas o antiadherentes y antimicrobianas). Cuando se utiliza la membrana amniótica humana como sustituto de los injertos de piel, se ha informado de una ausencia de infecciones de la herida, una reducción del dolor y una mayor tasa de reepitelización de la superficie de la piel traumatizada4.
La membrana amniótica humana regula el transporte de líquidos y electrolitos, reduce el crecimiento bacteriano, tiene baja inmunogenicidad, facilita la reepitelización, alivia el dolor, reduce la inflamación e inhibe la apoptosis de las células epiteliales. En su capa estromal se encuentran factores liberadores, proliferativos y angiogénicos, que reducen la inflamación y modulan la cicatrización5. La membrana amniótica humana también expresa factor de crecimiento epidérmico, factor de crecimiento de hepatocitos y factor de crecimiento de queratinocitos5,6. Su capa epitelial (epitelio cúbico simple) se asienta sobre una gruesa membrana basal rica en colágeno tipo III, IV y laminina, que favorece la adhesión y migración celular, estimulando la reepitelización. Otra propiedad es la ausencia de una reacción inmune a este tejido, evitando así una reacción inflamatoria7. El objetivo es presentare el caso de una paciente en el que se usó la membrana amniótica como material de apósito para reconstruir la superficie hemorrágica dejada por la fascitis necrotizante.
Reporte del caso
Mujer de 35 años con antecedente de anemia sin tratamiento desde hace 3 años, a quien se le extrajeron las piezas dentarias 3.6 y 3.8 y luego se le prescribió clindamicina 300 mg cada 8 horas, ketorolaco 10 mg cada 8 horas y dexametasona 4 mg cada 12 horas, todos administrados por vía oral durante 5 días. Al quinto día de las exodoncias, recibió un golpe en la cara izquierda, que le produjo una tumefacción progresiva de la zona con síntomas de disfagia, odinofagia y trismo.
Al sexto día de las exodoncias, acudió al servicio de odontología en donde se le prescribió Megacilina Forte® 4.000.000 UI más dexametasona 4 mg, ambas por vía intramuscular cada 24 horas durante 3 días. Al décimo día de las exodoncias, por la evolución desfavorable, acudió al Hospital Nacional Hipólito Unanue, donde ingresó a medicina interna; y posteriormente fue derivada al servicio de Cirugía Oral y Maxilofacial. En la evaluación extraoral, se observó una tumefacción extraoral indurada de las regiones geniana, palpebral, labial, masetero, submandibular y submentoniana izquierda, con fístula activa a nivel submandibular y lesión costrosa de aproximadamente 5 x 2 cm. (Figura 1)
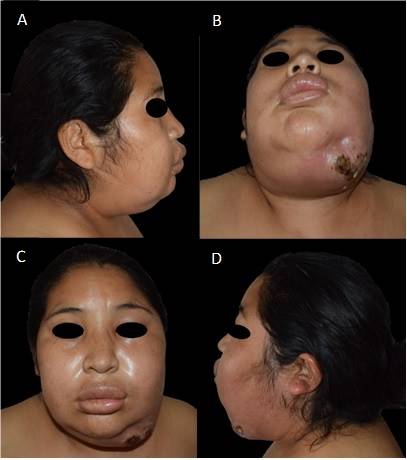
Figura 1 Fotografías extraorales de la paciente en el preoperatorio. (A) Vista lateral derecha del preoperatorio de la paciente. (B) Vista preoperatoria submentoniana de la paciente. (C) Vista preoperatoria frontal de la paciente. (D) Vista preoperatoria lateral izquierda de la paciente.
En la evaluación intraoral, se observa disminución de la apertura bucal, ligera pérdida del fondo del surco posteroinferior por tumefacción blanda difusa con extensión a mucosa yugal y piso de boca del lado izquierdo. Además, se evidenció secreción purulenta con olor fétido en el lecho alveolar de la pieza 3.8. La bioquímica sanguínea mostró leucocitos 24200/μL, linfocitos 4800/μL, segmentados 17200/μL, hematocrito 24,7% y hemoglobina 7,1 g/dL. Posteriormente, la paciente fue diagnosticado con un absceso cervicofacial odontogénico y fascitis necrotizante. Se hospitalizó a la paciente y se prescribió antibioterapia con vancomicina 1g Intravenosa (IV) cada 12 horas con meropenem 2g IV cada 8 horas y metamizol 1g IV condicionado a fiebre. En el segundo día de la hospitalización, se le transfundió un paquete globular y se decide intervenir quirúrgicamente y se realiza drenaje intraoral y extraoral más escarectomía.
La evolución postoperatoria de la paciente fue favorable (Figura 2). A partir del cuarto día postoperatorio, se normalizaron los valores de leucocitos, linfocitos y segmentados. Después de 7 días de terapia antibiótica inicial, se continuó con vancomicina 1g IV cada 12 horas + meropenem 1g IV cada 8 horas durante 7 días adicionales. En el día once del postoperatorio, tras limpiar la herida extraoral en la región submandibular y comprobar la ausencia de secreciones, se decide colocar una membrana amniótica de 9 x 5 cm (con un margen mínimo de 1 cm sobre tejido sano) y posteriormente controles diarios (Figura 3).
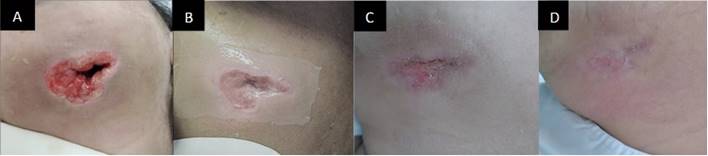
Figura 3 Fotos postoperatorias. (A) Vista postoperatoria el día 1. (B) Vista postoperatoria el día 11 (colocación de la membrana amniótica humana). (C) Vista postoperatoria el día 14. (D) Vista postoperatoria el día 16.
La membrana amniótica utilizada se seleccionó de una donante de entre 20 y 30 años que tenía el mismo grupo sanguíneo que la receptora y que tenía todas las pruebas preparto negativas (incluidas las pruebas de VIH y hepatitis B). La membrana amniótica se obtuvo de una cesárea electiva que no se presentó sin complicaciones. Tres días después de la colocación de la membrana amniótica, se evidenció reepitelización de la herida y la paciente fue dado de alta. Finalmente, se realizaron controles ambulatorios, demostrándose recuperación completa de la herida a los cinco días del alta.
Discusión
En nuestro reporte de caso, encontramos que el uso de la membrana amniótica tuvo efectos favorables en la regeneración de los tejidos en el postoperatorio de una paciente con fascitis necrotizante infectada.
La membrana amniótica humana es un tejido avascular que se compone de cinco capas, la primera monocapa de células epiteliales, la segunda capa que es una membrana basal acelular, una tercera capa compacta compuesta por proteínas de matriz extracelular, la cuarta capa de células mesenquimales y una quinta capa esponjosa que separa el amnios y el corion. Actualmente, la membrana amniótica humana está siendo utilizada en diferentes campos de la medicina, debido a sus propiedades antiinflamatorias e inmunomoduladoras. Las células amnióticas humanas se consideran candidatas válidas para la terapia celular en diversos trastornos degenerativos. Se han utilizado en el tratamiento de quemaduras, defectos de la piel y lesiones de la córnea, especialmente en pacientes quemados para lograr la reepitelización8,9. Malhotra et al.10 mencionan que, a diferencia del aloinjerto de piel, en el cual el paciente debe estar inmunosuprimido, la colocación de la membrana amniótica en la piel o defecto corneal se ha realizado sin signos de rechazo. La membrana amniótica humana tiene un efecto angiogénico y se ha descrito que tiene una fracción antibiótica derivada del principio activo formado por el epitelio amniótico11,12. Los tejidos fetales extraembrionarios, como el amnios, contienen glicoproteínas que se ha demostrado in vitro que bloquean la reacción de rechazo inmunitario que puede ocurrir13-15. Algunos investigadores consideran que el amnios tiene una acción antibacteriana única, debido a la presencia de alantoína, un subproducto del metabolismo de las purinas, el cual tiene propiedades bactericidas10,12-14. Además, contiene inmunoglobulinas, lisozimas y una proteína bacteriolítica16,17.
Se reconoce que la fascitis necrosante genera lesiones cutáneas extensas, por lo que el paciente tendría que ser tratado posteriormente para la recuperación del tejido mediante injertos8. Kesting et al.18 revisaron el uso de una membrana amniótica humana en el campo de la cirugía oral y maxilofacial y mencionaron que podría ser un material seguro para la cicatrización debido a sus propiedades inmunomoduladores, adhesivas o antiadherentes, analgésicas y antimicrobianas. Además, Sharma et al.19 informaron que la membrana amniótica redujo el tiempo quirúrgico y facilitó la realización del procedimiento de cobertura radicular en tres pacientes con recesiones gingivales clase I y II de Miller en comparación con el uso de tejido de injerto autógeno. Sin embargo, se requieren estudios experimentales y controlados para evaluar los beneficios potenciales de esta intervención en el campo de la cirugía bucal y maxilofacial.
Johri S. et al. (20 realizaron un ensayo clínico para evaluar el potencial de cicatrización de la membrana amniótica en comparación con la fibrina rica en plaquetas luego de cirugías endodónticas. Ellos encontraron que la membrana amniótica tuvo una mejor respuesta angiogénica al promoverla en comparación con la fibrina rica en plaquetas a los 6 meses. El potencial osteogénico fue similar en ambos grupos. Sin embargo, la membrana amniótica tiene mayor disponibilidad y es más rentable por lo que resultaría en una alternativa terapéutica prometedora.
Fénelon M. et al. 21) realizaron una revisión sistemática sobre los beneficios de usar la membrana amniótica en cirugía oral y maxilofacial. Incluyeron 17 estudios en donde se encontró que la membrana amniótica había tenido respuestas favorables de cicatrización en cirugías periodontales, cirugía periimplantaria, prostodoncia, paladar hendido y reconstrucción tumoral. Sin embargo, no se realizó un análisis cuantitativo debido a la amplia heterogeneidad por la variabilidad en cuanto al diseño e intervención con la membrana amniótica.
Por lo tanto, según las características reportadas del amnios humano se incluyen la rápida adhesión a la superficie expuesta, disminución de la infección, neovascularización y la falta de rechazo inmunológico. Estas representan grandes ventajas en comparación con el tratamiento convencional con injertos homólogos y heterólogos.
Conclusiones
En nuestro caso, considerando el tiempo de resolución y las secuelas que se presentan después de una fascitis necrotizante, los resultados obtenidos al aplicar la membrana amniótica demostraron un efecto positivo en la regeneración de los tejidos al promover la reepitelización de la lesión provocada como secuela de la fascitis necrotizante.