Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. v.57 n.3 Lima 2011
TRILOGÍA PESO AL NACER EN LAS ALTURAS DEL PERÚ
Valores normales de peso al nacer a 3 400 m de altura
Normal birth weight at 3 400 m above sea level
Wilfredo Villamonte-Calanche1,2,3; María Estela Jerí-Palomino1,2.
1 Departamento Materno-Infantil, Hospital Nacional Adolfo Guevara Velazco, EsSalud, Cusco, Perú
2 CENIMFA: Centro de Investigación de Medicina Fetal del Altura, Cusco, Perú
3 Facultad de Medicina, Universidad Nacional San Antonio Abad, Cusco, Perú
Tema Libre presentado al XVIII Congreso Peruano de Obstetricia y Ginecología, Lima, octubre 2010.
Resumen
Objetivo: Conocer los percentiles 5, 10, 50, 90 y 95 del peso al nacer en neonatos que provienen de madres con gestación única, sin patología, a 3 400 m de altura. Diseño: Estudio descriptivo retrospectivo. Institución: Hospital Nacional Adolfo Guevara Velazco de EsSalud, Cusco, Perú. Participantes: Neonatos. Intervenciones: Entre los años 1999 y 2006, se evaluó en el Sistema de Vigilancia Perinatal el peso al nacer de 8 500 neonatos provenientes de gestaciones únicas normales. Principales medidas de resultados: Peso al nacer. Resultados: Solamente los neonatos entre la semana 36 y 42 mostraron un número adecuado para la evaluación estadística y se obtuvo los percentiles 5,10, 50, 90 y 95 del peso al nacer. Conclusiones: El peso de los recién nacidos varones es mayor al de las mujeres y aumenta conforme se incrementa la edad gestacional.
Palabras clave: Neonatos, peso al nacer, sistema de vigilancia perinatal, Cusco, Perú altura.
Abstract
Objectives: To determine the 5th, 10th,50th, 90th and 95th birth weight percentiles of newborns from normal singleton pregnant women without pathology at 3 400 m above sea level (Cusco). Design: Descriptive and retrospective study. Setting: Adolfo Guevara Velazco National Hospital, EsSalud, Cusco, Peru. Participants: Newborns. Interventions: Birth weight analysis of 8 500 normal neonates recorded between 1998 and 2006 in the Perinatal Information System database. Results: Only the 36 through 42 weeks neonates showed appropriate number of cases to be analyzed. We obtained the 5th, 10th, 50th, 90th, and 95th percentiles of newborns birth weights. Conclusions: Male newborns birth weights were higher than female neonates and increased through gestation.
Key words: Neonates, birth weight, perinatal surveillance system, Cusco, Peru, high altitude.
INTRODUCCIÓN
Un importante marcador de morbilidad es el peso al nacer (1) y existe una relación inversa entre la altura y el crecimiento fetal. La hipoxia hipobárica produce un menor crecimiento fetal, así como algunas condiciones patológicas, como por ejemplo la insuficiencia placentaria.
Aproximadamente 9 millones de personas en el Perú son residentes permanentes por encima de los 2 000 m (2,3), lo cual representa aproximadamente el 30% de la población peruana, lo que hace a la hipoxia hipobárica en el embarazo de altura como la causa más común de hipoxia materno-fetal. Giussani y col (4) demostraron la acción directa de dicha hipoxia en el crecimiento de embriones de pollo incubados a gran altura, donde el peso final fue menor comparado con aquellos que fueron incubados a nivel del mar. Se corrigió este evento, cuando a gran altura se incubó los embriones en un ambiente con suplemento de oxígeno semejante al del nivel del mar. En humanos, Gwenn y col (5) encontraron que por cada 1 000 m que se asciende en altura, el peso al nacer disminuye 102 gramos, aunque nosotros demostramos que en nuestro medio la disminución solo era de 44 gramos por cada 1 000 m (6). Esto es válido hasta los 4 000 m, por encima del cual la propuesta de Gwenn y col se cumple.
Por esta razón, es importante conocer los valores normales del peso al nacer de gestaciones únicas normales, ya que permitirán definir en forma adecuada las patologías relacionadas con el nacimiento a 3 400 metros sobre el nivel del mar.
MÉTODOS
Se realizó un estudio descriptivo retrospectivo, con el objeto de conocer los percentiles 5, 10, 50, 90 y 95 del peso al nacer en neonatos que provenían de madres de gestación única sin patología alguna, a 3 400 m.
Se evaluó el peso al nacer de 8 500 neonatos del Sistema de Vigilancia Perinatal del Hospital Nacional Adolfo Guevara Velazco, de EsSalud del Cusco, Perú, en un periodo comprendido entre 1999 y 2006.
Se consideró los 6 546 recién nacidos normales que cumplían con las condiciones de inclusión, de los cuales 42 correspondían a gestaciones menores de 36 semanas, los que fueron excluidos, ya que no se pudo realizar su evaluación estadística. Finalmente, solamente 6 504 neonatos de gestaciones de 36 a 42 semanas fueron evaluados. La edad gestacional que se consideró fue en base al primer día de la última menstruación.
El análisis estadístico se realizó utilizando el paquete estadístico SSPS versión 17 y se halló los percentiles 5, 10, 50, 90 y 95.
RESULTADOS
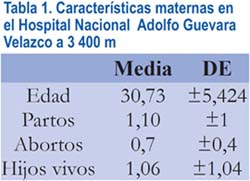
Las características de las madres son mostradas en la tabla 1, donde se evidencia que el promedio de la edad materna fue 30 años y que la mayoría de madres solamente había tenido un hijo y ningún aborto.
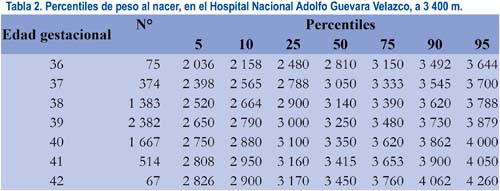
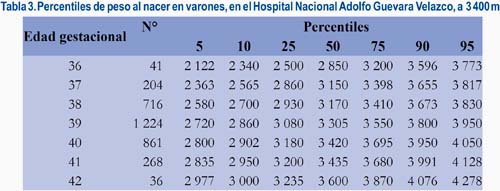
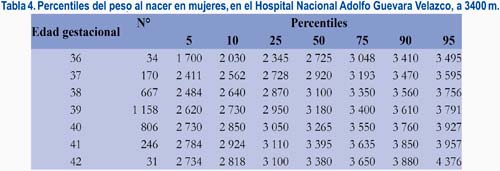
En la tabla 2 se observa los valores correspondientes a los pesos al nacer desde la semana 36 a la 42. En la tabla 3 se muestra los valores de los recién nacidos normales de sexo masculino y, en la tabla 4, los que corresponden a los neonatos de sexo femenino.
DISCUSIÓN
Existe mucha información que menciona que el crecimiento fetal en altura es menor que a nivel del mar. Mortola y col (7) describieron que el umbral para el efecto de la hipoxia hipobárica en el peso al nacer se inicia alrededor de los 2 000 m, el cual corresponde a una presión atmosférica de alrededor de 590 mmHg o una presión inspiratoria de oxígeno de aproximadamente 114 mmHg. Nosotros demostramos que a 3 400 m la media del peso al nacer en neonatos a término disminuye en 121 g en relación a nivel del mar (6) y no 340 g, como lo proponen Gwenn y col en Estados Unidos de América (5).
El crecimiento normal de los fetos es uno de los mejores indicadores de buena salud y nutrición, mientras que el crecimiento anormal (macrosomía o restricción del crecimiento intrauterino) se asocia con un elevado riesgo de complicaciones perinatales (8-10). Por esta razón, los valores obtenidos de peso al nacer en neonatos normales que provienen de madres sin patología alguna y de buenas condiciones socioeconómicas deberían ser un parámetro acorde para la evaluación de todo feto que nace a 3 400 m.
El nacimiento de un bebé pretérmino es anormal, ya que generalmente representa una patología de fondo, ya sea materna o fetal, como preeclampsia, rotura prematura de membranas, infección urinaria, entre otros. Consecuentemente, si consideramos solamente a los neonatos normales provenientes de madres de la misma condición, lógicamente no tendremos una población de bebés pretérmino adecuada para el estudio. Una excepción en nuestro estudio fueron los neonatos con 36 semanas.
En estos días, estamos estudiando socioeconómicamente las gestantes que acuden al Hospital Nacional Adolfo Guevara Velazco y nuestros resultados preliminares muestran que son diferentes a la mayoría de la población que vive en el Perú y acude a los hospitales públicos. Una muestra de ello es que 100% de familias tiene un empleo y recibe un salario (más de 60% gana más de 1 000 soles mensualmente), cerca de 70% tiene educación superior, todas cuentan con seguro de salud, la mayoría vive en zonas urbanas y tiene un adecuado control prenatal (cerca a 85% visitan a un personal de salud, más de 5 veces durante toda la gestación). Hartinger y col (11), quienes estudiaron a la población que acude a los hospitales públicos, describieron a 3 400 m una media del peso a término de 3 090 ± 506 g, mientras que nosotros hallamos una media de 3 262 ± 393 g.
El crecimiento fetal en la altura empieza a ser menor entre las 25 y 29 semanas (12). Krampl y col (13) describieron que no hay redistribución en las mediciones Doppler de la circulación fetal a este nivel, como ocurre en la restricción del crecimiento intrauterino, donde hay redistribución del flujo sanguíneo debido a una insuficiencia placentaria. Esta reducción del crecimiento fetal en la altura es mediada posiblemente por la regulación relacionada con la hipoxia de las proteínas ligadoras de los factores de crecimiento semejantes a la insulina (IGFBPs) (14) y por la limitación de nutrientes maternos, como la glucosa, los cuales son importantes para el crecimiento fetal (15,16). Krampl y col (17) describieron que no hay diferencia en IGFBP-1 en las gestantes de nivel del mar y altura antes de las 25 semanas de gestación. Después de esta época, las concentraciones séricas de IGFBP-1 se incrementan en altura. Esta proteína se une a las IGF-I y II con gran afinidad y evita los efectos mitogénicos de las IGFs (18).
Moore y col (19) describieron que el déficit en el transporte de oxígeno es el mecanismo causal para la disminución del crecimiento fetal en la altura, y es posible que este sea un mecanismo de adaptación frente a la hipoxia hipobárica de este lugar (20,21); además, existe correlación directa con la hipoxia (22) y la respuesta ventilatoria materna, la cual se relaciona con el peso al nacer (23).
Aunque hay información que concluye que el flujo materno a la unidad uteroplacentaria puede estar reducido hasta en 50% sin disminución del crecimiento fetal (24), Zamudio y col (25,26) probaron que los nativos de altura responden a la hipoxia del mismo modo que las personas que recién migraron a la altura. Ellos creen que las diferencias ancestrales en la disminución del peso fetal se deben a otros factores que las modificaciones en el aporte de oxígeno a gran y baja altura y que este tendría un origen placentario. Existe asociación entre la disminución del crecimiento fetal con una reducción del consumo de glucosa (27), debido a un incremento en el consumo de este por la placenta, como causa de una disminución del transporte al feto (16). En la placenta de altura, es posible que el mecanismo conocido como reprogramación metabólica responda a esta interrogante. En este, la hipoxia impulsa la inhibición activa del metabolismo oxidativo y es combinado con un incremento del uso anaeróbico de la glucosa (1,28).
Por otro lado, la hipoxia induce una mayor producción de los niveles de hemoglobina en la gestante, lo que incrementa los niveles en la sangre arterial de mujeres que viven en altura comparadas con aquellas de nivel del mar. Elevadas concentraciones de hemoglobina incrementan la capacidad de transporte del oxígeno, pero aumentan también la viscosidad. Esta situación disminuye la perfusión a nivel de los capilares. En embarazos a nivel del mar, un incremento de la hemoglobina y la viscosidad se asocian con complicaciones como la restricción del crecimiento intrauterino y la preeclampsia, lo cual se halla de acuerdo con la hipótesis que la elevada viscosidad es un factor de riesgo para una deficiente perfusión de la placenta (21). Gonzales y col demostraron que la hemoglobina de las gestantes menores a 11 g/dL y mayores a 13 g/dL incrementan el riesgo para la restricción del crecimiento intrauterino en la altura (4), debido a un incremento de la viscosidad (29) y una disminución del flujo en la arteria uterina, resultando en un menor peso fetal (30).
En conclusión, los pesos al nacer de niños que nacen a 3 400 m de altura son algo diferentes a los de nivel del mar, por lo cual es importante definir los rangos normales que aquí presentamos para una evaluación adecuada de estos.
REFERENCIAS BIBLIOGRÁFICAS
1. Brahimi-Horn C, Pouyssegur J. The role of the hypoxia-inducible factor in tumor metabolism growth and invasion. Bull Canc. 2006;93:E73-80.
2. Giussani DA, Salinas CA, Villena M, Blanco CE. The role of oxygen in prenatal growth: studies in the chick embryo. J Physiol. 2007;585(Pt 3):911-7.
3. Valero Ramos WR, Hanco Sirena I, Coronel Béjar M, Dueñas Castillo J. Características del periodo de adaptación del recién nacido en la altura. Acta Med Per. 2009;26(3):151-5.
4. Gonzales FG, Steenland K, Tapia V. Maternal hemoglobin level and fetal outcome at low and high altitudes. Am J Physiol Regul Integr Comp Physiol. 2009;297:R1477- R1485.
5. Gwenn M, Jensen MA, Moore L. The effect of high altitude and other risk factors on birthweight: independent or interactive effects? Am J Public Health.1997;87:1003-7.
6. Villamonte W, Jerí M, Lajo L, Monteagudo J, Diez G, Laurent A. Peso al nacer en diferentes niveles de altura en el Perú. Rev Per Ginecol Obstet. 2011;57(3). En publicación.
7. Mortola JP, Frappell PB, Aguero L, Armstrong K. Birth weight and altitude: A study in Peruvian communities. J Pediatr. 2000;136:324-9.
8. O´Relly-Green CP, Divon MY. Receiver operating characteristic curves of ultrasonographics estimates of fetal weight for prediction of fetal growth restriction in prolonged pregnancies. Am J Obstet Gynecol. 1999;181:1133-8.
9. Sokol RJ, Chik L, Dombrowski MP, Zador IE. Correctly identifying the macrosomic fetus: improving ultrasonography- based prediction. Am J Obstet Gynecol. 2000;182:1489-95.
10. Salomon LJ. Early fetal growth: concepts and pitfalls. Ultrasound Obstet Gynecol. 2010;35:385-7.
11. Hartinger S, Tapia V, Carrillo C, Bejarano L, Gonzales GF. Birth weight at high altitudes in Peru. Int J Gynecol Obstet. 2006;93:275-81.
12. Krampl E, Lees C, Bland M, Espinoza DJ, Moscoso G, Campbell S. Fetal biometry at 4340 m compared to sea level in Peru. Ultrasound Obstet Gynecol. 2000;16:9-18.
13. Krampl E, Espinoza Dorado J, Lees C, Moscoso G, Bland JM, Campbell S. Fetal Doppler velocimetry at high altitude. Ultrasound Obstet Gynecol. 2001;18:329-34.
14. Tucci M, Nygard K, Tanswell BV, Farber HW, Hill DJ, Han V. Modulation of insulin-like growth factor (IGF) and IGF binding protein biosynthesis by hypoxia in cultured vascular endothelial cells. J Endocrinol. 1998;157:13-24.
15. Hecher K, Snijder R, Campbell S, Nicolaides K. Fetal venous, intracardiac, and arterial blood flow measurements in intrauterine growth retardation: relationship with fetal blood gases. Am J Obstet Gynecol.1995;173:10-5.
16. Zamudio S, Torrico S, Ewa F, Oyala M, Echalar L, et al. Hypoglycemia and the origin of hypoxia-induced reduction in human fetal growth. PLos One. 2010;5(1):e8551.
17. Krampl E, Kametas NA, McAuliffe F, Cacho Zegarra AM, Nicolaides K. Maternal serum insulin-like growth factor binding protein-1 in pregnancy at high altitude. Obstet Gynecol. 2002;99:594-8.
18. Lee PD, Conover Ca, Powell DR. Regulation and function of insulin-like growth factor-binding-protein-1. Proc Soc Exp Biol Med. 1993;204:4-29.
19. Moore LG, Shriver M, Bemis L, Hickler B, Wilson M, et al. Maternal adaptation to high-altitude pregnancy: an experiment of nature a review. Placenta. 2004;25(Suppl A):S60-71.
20. Hochachka PW, Stanley C, Matheson GO, Mc Kenzie DC, Allen PS, Parkhouse WS. Metabolic and work efficiencies during exercise in Andean natives. J Appl Physiol. 1991;70(4):1720-30.
21. Krampl E. Pregnancy at high altitude. Ultrasound Obstet Gynecol Gynecol. 2002;19:535-9.
22. Moore LG, Rounds SS, Jahningen D, Grover RF, Reeves JT. Infant birth weight is related to maternal arterial oxygenation at high altitude. J Appl Physiol. 1982;52:695-9.
23. Moore LG, Brodeur P, Chumbe O, D´Brot J, Hofmesiter S, Monge C. Maternal hypoxic ventilator response, ventilation, and infant birth weight at 4300 m. J Appl Physiol. 1986;60:1401-6.
24. Carter AM. Factor affecting gas transfer across the placenta and the oxygen supply to the fetus. J Dev Physiol. 1989;12:305-22.
25. Postigo L, Heredia G, Islley NP, Torricos T, Dolan C, et al. Where the O2 goes to: preservation of human fetal oxygen delivery and consumption at high altitude. J Physiol. 2009;587:693- 708.
26. Zamudio S, Postigo L, Illsley NP, Rodriguez C, Heredia G, et al. Maternal oxygen delivery is not related to altitude- and ancestry-associated differences in human fetal growth. J Physiol. 2007;582.2:883-95.
27. Kalkhoff RK. Impact of maternal fuels and nutritional state on fetal growth. Diabetes. 1991;40:61-5.
28. Semenza GI. Oxygen-dependent regulation of mitochondrial respiration by hypoxia-inducible factor 1. Biochem J. 2007;405:1-9.
29. Kametas NA, Krampl E, McAuliffe F, Rampling MW, Nicolaides KH. Pregnancy at high altitude: a hyperviscocity state. Acta Obstet Gynecol Scand. 2004;83:627-33.
30. Julian CG, Wilson MJ, Lopez M, Yamashiro H, Tellez W, Rodriguez A, Biham AW, Shriver MD, Rodriguez C, Vargas E, Moore LG. Augmented uterine artery blood flow and oxygen delivery protect Andeans from altitude-associated reductions in fetal growth. Am J Physiol Regul Integr Comp Physiol. 2009;296:R1564-R1575.
Correspondencia:
Dr. Wilfredo Villamonte Calanche
Villamonte100@hotmail.com













