Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. v.57 n.4 Lima 2011
SIMPOSIO SÍNDROME METABÓLICO
Resistencia a la insulina y acción insulínica
Insulin resistance and insulin action
Isaac Crespo Retes1,2; J Patricia Crespo-Pereda3; María Teresa Crespo-Pereda3
1 Profesor Principal, Escuela de Medicina Hipólito Unanue
2 Director, Instituto de Endocrinología y Metabolismo
3 Instituto de Endocrinología y Metabolismo
Resumen
Es importante reconocer el síndrome de resistencia a la insulina, lo que a menudo se está denominando enfermedad de la civilización occidental. El predominio de estas enfermedades se encuentra incrementado con la asociación de la epidemia de obesidad en países desarrollados. Se hace una revisión sobre obesidad, resistencia a la insulina, hipertensión arterial y síndrome de ovario poliquístico.
Palabras clave: Metabolismo de la glucosa, resistencia a la insulina, hipertensión arterial, síndrome de ovario poliquístico.
Abstract
It is important to recognize insulin resistance syndrome, frequently called the occidental civilization disease. Predominance of these diseases is increasing in association with epidemics of obesity in developed countries. A review on obesity, insulin resistance, arterial hypertension and polycystic ovary syndrome is done.
Key words: Glucose metabolism, insulin resistance, arterial hypertension, polycystic ovary syndrome.
UTILIDAD CLÍNICA DE RECONOCER LA RESISTENCIA A LA INSULINA
Es importante reconocer el síndrome de resistencia a la insulina, lo que a menudo se está denominando enfermedad de la civilización occidental. El predominio de estas enfermedades se encuentra incrementado con la asociación de la epidemia de obesidad en países desarrollados.
OBESIDAD
Alrededor de 30 a 50% de las mujeres con síndrome de ovario poliquístico son obesas (1,2). La obesidad estaba presente en casi todas las pacientes originalmente descritas por Stein y Leventhal, en 1935 (3). Las mujeres con síndrome de ovario poliquístico suelen tener un patrón androide de obesidad, que indica un aumento relativo de la adiposidad visceral. El hallazgo de un aumento de la proporción cintura a cadera u otras medidas más sofisticadas con imágenes de la distribución de la grasa corporal pueden servir como medida sustituta del aumento de los depósitos viscerales de grasa. Este patrón de distribución de la grasa corporal ha sido asociado a niveles elevados de andrógenos, así como con anormalidades en la tolerancia a la glucosa, la secreción de insulina y los perfiles de las lipoproteínas (4,5).
Si bien la obesidad contribuye a la resistencia a la insulina en el síndrome de ovario poliquístico, la magnitud de la resistencia a la insulina excede a aquella que sería posible predecir en base a la masa corporal total o incluso en la libre de grasa (6). Una posible explicación para esto es que la hiperinsulinemia ejerce un efecto lipogénico. Otra posibilidad es que la falta de progesterona por la anovulación predispone a la obesidad abdominal y a un cambio en el tipo de fibra muscular, los cuales tienen consecuencias metabólicas nocivas (7). Se ha informado que, con respecto a los controles pareados por peso y por distribución de la grasa corporal, la termogénesis posprandial está reducida en las mujeres con síndrome de ovario poliquístico y se asocia con un aumento de la resistencia a la insulina (8). No obstante, la magnitud de la reducción de la termogénesis posprandial parece no ser suficiente para explicar el grado de obesidad de la mayoría de las pacientes con síndrome de ovario poliquístico. La resistencia a la insulina también ha sido implicada en la dificultad para bajar de peso en respuesta a una dieta hipocalórica. No obstante, un informe reciente ha demostrado que las diferencias en la resistencia a la insulina no predicen la pérdida de peso en respuesta a dietas hipocalóricas en mujeres obesas sanas (9). Todavía queda por discernir si este hallazgo es aplicable a las mujeres con síndrome de ovario poliquístico. Sin embargo, se ha demostrado claramente que la atenuación de la resistencia a la insulina, ya sea debida a pérdida de peso o por medios farmacológicos con diazóxido, metformina o tiazolidinedionas (TZD), mejora muchas de las alteraciones metabólicas presentes en las mujeres con síndrome de ovario poliquístico (10).
ANGIOTENSINÓGENO Y ANGIOTENSINA II
A pesar que la insulina inhibe la producción de angiotensinógeno en los adipocitos, la expansión del tejido adiposo en la obesidad asocia niveles circulantes elevados de angiotensinógeno y angiotensina II, lo que podría explicar la génesis de la hipertensión en los obesos.
INHIBIDOR 1 DEL ACTIVADOR DEL PLASMINÓGENO (PA I-1)
El PAI-1 es secretado en exceso por los adipocitos en los obesos. La cantidad de grasa visceral predice los niveles circulantes de PAI-1 (11). El PAI-1 inhibe la activación del plasminógeno, lo que implica una acción procoagulante, en tanto inhibe la disolución de la fibrina por la plasmina. Tanto la insulina como el TNFα y el TGFβ estimulan su síntesis.
RESISTINA
La disminución de la resistencia insulínica por las tiazolidinedionas podría deberse a la modificación inducida por estas drogas en la síntesis y secreción de un factor adipocitario. Los investigadores averiguaron que los genes inducidos durante la diferenciación adipocitaria eran inhibidos al exponer los adipocitos maduros a estas drogas. Esto les llevó al descubrimiento de una proteína, a la que llamaron resistina (12). Esta proteína circula en el suero y se eleva notablemente en la obesidad. Su inmuno neutralización reduce la glicemia y mejora la acción insulínica en ratones con diabetes tipo 2. Por el contrario, la administración de la proteína recombinante deteriora la tolerancia a la glucosa y la sensibilidad insulínica en ratones normales. La resistencia se codifica en el cromosoma 19 en nuestra especie y sus niveles se elevan con la realimentación después del ayuno. Se supone que la resistina tiene acciones autocrinas sobre los adipocitos y se especula acciones paracrinas y endocrinas en el músculo, hígado y cerebro, pero aún no se conoce sus receptores o mecanismos de acción.
ADIPONECTINA
Recientemente, en 1995, el grupo de Lodish, del Massachusetts Institute of Technology (MIT), describió una nueva proteína exclusivamente sintetizada por los adipocitos y llamada de distintas maneras por los distintos grupos que la describieron: Acrp30 (adipocyte complement related protein of 30 kDa, Scherer (13)), apM1 (adipose most abundant gene transcript-1, Maeda (14)), AdipoQ (Hu, 1996) y adiponectina (15). Se trata de una adipocitoquina al igual que la leptina, el TNFα, la IL-6, el PAI-1 y la adipsina (complemento D), de 247 aminoácidos en nuestra especie, con una alta homología estructural con los colágenos VIII y X, el complemento C1q y el TNFα. La proteína circula en cantidades importantes en el suero (5-10 mg/L) y, en agudo contraste con las otras adipocitoquinas, estos niveles caen en los obesos y en diabéticos tipo 2. El gen que codifica la proteína se encuentra en el locus 27 del brazo largo del cromosoma 3 (3q27). La adiponectina tendría efectos antiinflamatorios, ya que inhibe la proliferación de precursores mielomonocíticos y la actividad fagocitaria de los macrófagos, así como su producción de TNFα (16). Aparte de inhibir la síntesis de TNFα, esta proteína se une al colágeno de la íntima en el endotelio lesionado de la aorta humana, donde inhibe en forma dosis-dependiente la adhesión celular inducida por esta última citoquina (14), posiblemente inhibiendo la expresión de las múltiples moléculas de adhesión vía NF-kB (17). Todo lo anterior hace emerger un cuadro compatible con un importante papel anti-aterosclerótico para la adiponectina.
PORCIÓN GLOBULAR DE LA ADIPONECTINA: gAcrp30
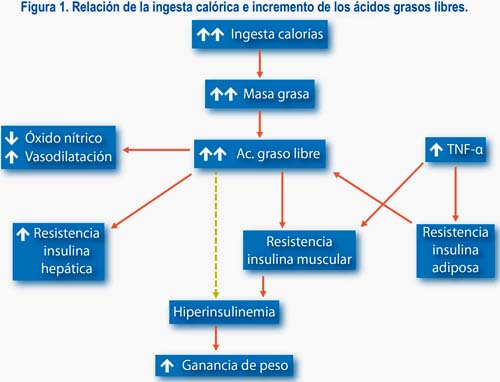
Como derivado proteolítico de la adiponectina, el grupo de Lodish, en el MIT, desarrolló un fragmento (aminoácidos 104- 247) que contiene el dominio globular del extremo carboxiloterminal de la proteína, postulando que la proteína completa sería un precursor inactivo, al igual que otras proteínas de la cascada de activación del complemento. El fragmento obtenido por digestión proteolítica de la adiponectina, llamado gAcrp30, fue usado para estudiar su efecto sobre los niveles elevados de AGC después de una comida rica en grasa o después de inyectar Intralipid en ratones. En estas condiciones, el gAcrp30 redujo en forma significativa los niveles circulantes elevados de AGC, lo que fue causado en parte por un aumento agudo de la oxidación de AGC en las mitocondrias del músculo.
ACANTOSIS NIGRICANS
En el año 1976, Kahn y col. (18) comunicaron un estudio de pacientes con resistencia a la insulina y acantosis nigricans, quienes mostraron dos anormalidades: la del receptor, tipo A, y anticuerpos antirreceptor de insulina, denominados tipo B. Un estudio posterior mostró una tercera variedad tipo C, que se caracterizaba por hiperandrogenismo, resistencia a la insulina y acantosis nigricans (HAIRAN).
El reconocimiento de la importante asociación del hiperandrogenismo con la hiperinsulinemia condujo a la hipótesis que la insulina podría mediar la síntesis de andrógenos ováricos. Smith (19) demostró la elevación de androstenediona, testosterona y dehidrotestosterona (DHT) en mujeres con resistencia a la insulina. Además, la elevación de los andrógenos tenía una correlación positiva a la insulina en la carga de glucosa.
Las mujeres con resistencia insulínica severa, asociada a la acantosis nigricans en los síndromes de tipo A y B, frecuentemente presentan signos de hiperandrogenismo. Estas pacientes son sumamente raras. Pero, la resistencia insulínica, hiperinsulinemia y obesidad son comunes en mujeres con ovarios poliquísticos. La variedad -mucho más frecuente- de resistencia insulínica menos severa ha sido llamada tipo C o síndrome de HAIRAN (hiperandrogenismo, insulinorresistencia, acantosis nigricans) (20).
La disminución de la resistencia insulínica y la hiperinsulinemia con metformina en mujeres con ovarios poliquísticos disminuye el hiperandrogenismo y tiende a normalizar la ovulación y la menstruación, aumentando la fertilidad.
Las pacientes con ovarios poliquísticos tienen resistencia insulínica en la misma magnitud que la que se ve en la diabetes mellitus no dependiente de insulina (DMNID). La hiperinsulinemia resultante parecería aumentar la secreción de andrógenos en estos ovarios poliquísticos, tal vez por estimulación de receptores IGF-1 (21,22). La resistencia insulínica de mujeres con ovarios poliquísticos es empeorada por la obesidad (asociada en un 50%) y por la lipodistribución androide, que frecuentemente presentan. Las pacientes con ovarios poliquísticos y con peso normal presentan diferencias significativas en niveles de LH, globulina ligadora de hormona sexual (SHBG), testosterona libre e insulinemia, existiendo una correlación positiva entre el peso y la testosterona libre y una correlación negativa con la SHBG (23,24).
No todas las mujeres con hiperinsulinemia desarrollan síndrome de ovario poliquístico, por la misma razón que no todas las personas con resistencia insulínica e hiperinsulinismo terminan con DMNID o hipertensión arterial. Se necesita por lo menos dos factores patogénicos: la hiperinsulinemia y una predisposición especial de los ovarios para responder a la hiperinsulinemia con un aumento de la secreción de andrógenos y los cambios quísticos del ovario. Esta predisposición al ovario poliquístico varía mucho de persona a persona (25). Hay mujeres que sin hiperinsulinemia podrían llegar al ovario poliquístico; otras requieren una hiperinsulinemia moderada, como las mujeres con el síndrome de resistencia insulínica tipo C; y, finalmente, cuando se dan niveles extremos de hiperinsulinemia (como en los síndromes de resistencia insulínica, asociados con acantosis nigricans tipo A y B), la gran mayoría de mujeres presenta hiperandrogenismo.
Varios estudios sugieren que una gran mayoría de mujeres delgadas con HAIRAN son normosensitivas a la insulina y tienen niveles de insulina y lipoproteínas normales (23,24,26). Finalmente, exceptuando el fenotipo HAIRAN, tienen una sensibilidad a la insulina y alteraciones de lípidos, con síndrome de poliquistosis ovárica, y esto podría estar relacionado a una determinada distribución abdominal grasa (23-25, 27).
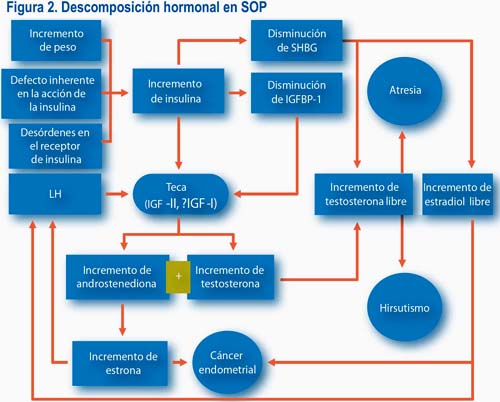
No todas las mujeres con síndrome de ovario poliquístico reaccionan igualmente a agentes que controlan el ovario. Así, en las mujeres con ovario poliquístico y sobrepeso, en respuesta a tratamientos con anticonceptivos orales presentan alteraciones a la tolerancia de los carbohidratos (figura 2).
Referencias bibliográficas
1. Conway GS, Honour JW, Jacobs HS. Heterogeneity of the polycystic ovary syndrome: clinical, endocrine and ultrasound features in 556 patients. Clin Endocrinol. 1989;30:459-70.
2. Franks S. Polycystic ovary syndrome: a changing persective. Clin Endocrinol. 1989;31:87- 120.
3. Stein IF, Leventhal ML. Amenorrhea associated with bilateral polycystic ovaries. Am J Obstet Gynecol. 1935;29:181-91.
4. Sonnenberg GE, Hoffman RG, Mueller RA, Kissebah AH. Splachnic insulin dynamics and secretion pulsatilities in abdominal obesity. Diabetes. 1994;43:468- 77.
5. Kissebah AH. Upper body obesity: abnormalities in the metabolic profile and the androgenic/ estrogenic balance. En: Dunaif A y col. (Ed). Current Issues in Endocrinology amd Metabolism: Polycystic Ovary Syndrome. Cambridge MA: Blackwell Scientific. 1992:359-74.
6. Dunaif A, Segal KR, Futterweit W, Dobrjansky A. Profound peripheral insulin resistance, independent of obesity, in polycystic ovary syndrome. Diabetes. 1989;38:1165-74.
7. Björntorp P. Classification of obese patients and complications related to the distribution of surplus fat. Nutrition. 1990;6:131-7.
8. Robinson S, Chan S-P, Spacey S, et al. Postprandial thermogenesis is reduced in polycystic ovary syndrome and is associated with increased insulin resistance. Clin Endocrinol Metab. 1999;36:537- 43.
9. McLaughlin T, Abbasi F, Carantoni M, et al. Differences in insulin resistance do not predict weight loss in response to hypocaloric diets in healthy obese women. J Clin Endocrinol Metab. 1999;84:578-81.
10. Ehrmann DA. Insulin-lowering therapeutic modalities for polycystic ovary syndrome. Endocrinol Metab Clin North Am. 1999;28:423-38.
11. Janand-Delenne B, Chagnaud C, Raccah D, et al. Visceral fat as a main determinant of plasminogen activator inhibitor 1 level in women. Int J Obesity. 1998;22:312.
12. Steppan CM, Bailey ST, Bhat S, et al. The hormone resistin links obesity to diabetes. Nature. 2001;409:307.
13. Scherer PE, Williams S, Fogliano M, et al. A novel serum protein similar to C1q, produced exclusively in adipocytes. J Biol Chem. 1995;270:26746.
14. Ouchi N, Kihara S, Arita Y, et al. Novel modulator of endothelial adhesion molecules: adipocytederived plasma protein adiponectin. Circulation. 1999;100:2473.
15. Takahashi M, Arita Y, Yamagata K, et al. Genomic structure and mutations in adipose-specific gene, adiponectin. Int J Obes. 2000;24:861.
16. Yokota T, Oritani K, Takahashi I, et al. Adiponectin, a new member of the family of soluble defense collagens, negatively regulates the growth of myelomonocytic progenitors and the function of macrophages. Blood. 2000;96:1723.
17. Ouchi N, Kihara S, Arita Y, et al. Adiponectin, an adipocytederived plasma protein, inhibits NF-kB signaling through a c-AMPdependent pathway. Circulation. 2000;102:1296.
18. Kahn Cr, Flier JS, Bar RS, Archer JA, Gorden P, Martin MM, Roth J. The syndromes of insulin resistance and acanthosis nigricans. N Engl J Med. 1976;294:739-45
19. Smith S, Ravnikar VA, Barbieri RL. Androgen and insulin response to an oral glucose challenge in hyperandrogenic women. Fertil Steril. 1987;48(1):72-7.
20. Moller DE, Flier JS. Insulin resistance. Mechanisms, syndromes and implications. N Engl J Med. 1991;325:938.
21. Barbieri RL. Smith S, Ryan KJ. The role of hiperinsulinemia in the athogenesis of ovarian hyperandrogenism Fertil Steril. 1988;50:197.
22. Dunaif A. Insulin resistance and ovarian dysfunction. En: Moller DE (Editor). Insulin Resistance. England: Wiley & Sons Ltd. 1993:301-25.
23. Bringer J, Lefebvre P, Boulet F, Grigorescu P, Renard E, Hedon B, Orsetti A. Body composition and regional fat patterning in polycystic ovarian síndrome: relationship to hormonal and metabolic profiles. Ann NY Acad Sci. 1993;687:115-23.
24. Holte J, Bergh T, Giennarelli G, Wide L. The independent effects of polycystic ovary syndrome and obesity on serum concentrations of gonadotrophins and sex steroids in premenopausal women. Clin Endocrinol. 1994;41:473-81.
25. Ovesen P, Moller J, Ingerslev HJ, Jorgensen JO, Mengel A. Normal basal and insulin stimulated fuel metabolism in lean women with the polycystic ovary syndrome. J Clin Endocrinol Metab. 1993;77:1636-40.
26. Rajkhowa M, Bicknell J, Jones M, Clayton RN. Insulin sensitivity in women with polycystic ovary syndrome: relationship to hyperandrogenemia. Fertil Steril. 1994;61(4):605-12.
27. Weber RFA, Pache TD, Jacobs ML, Docter R, Lynn Loriaux D, Fauser BCJM, Birkenhager JC. The relation between clinical manifestations of polcycystic ovary syndrome and B-cell function. Clin Endocrinol (Oxf). 1993;38(3):295-300.













