Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. v.58 n.1 Lima 2012
SIMPOSIO FERTILIDAD ASISTIDA EN MAYORES DE 38 AÑOS
Estimulación ovárica en usuarias mayores de 38 años
Ovarian stimulation in women over 38 years of age
Francisco J. Ruiz Flores1,2; Juan A. García Velasco1,2
1 IVI Madrid, España
2 Universidad Rey Juan Carlos, Madrid, España
Resumen
La edad en la que las mujeres comienzan a buscar su primer embarazo se ha venido retrasando en las sociedades desarrolladas. Este retraso tiene como consecuencia una disminución de la fecundabilidad materna, pues a partir de los 35 años comienza a disminuir y lo hace en una forma muy significativa a partir de los 40 años. En esta revisión se hace un recuento de la estimulación ovárica en usuarias mayores de 38 años.
Palabras clave: Infertilidad, mujer de edad mayor de 38 años, estimulación ovárica, tasa de embarazo.
Abstract
Age when women start looking to have their first pregnancy is being postponed in developed societies. This delay results in reduction in maternal fecundability that starts at age 35 and is significant at age 40 and over. In this review we recount ovarian stimulation in women over 38 years.
Key words: Infertility, woman over 38 years, ovarian stimulation, pregnancy rate.
En los últimos años, la edad a la que las mujeres comienzan a buscar su primer embarazo se ha venido retrasando en las sociedades desarrolladas. Este retraso en la edad se encuentra relacionado a ciertos factores, como la necesidad de tener una condición financiera y profesional que ofrezcan seguridad, un deseo para esperar a iniciar una relación sentimental estable, segundos matrimonios y un mejor acceso a diferentes métodos de anticoncepción.
El retraso en la edad para la primera gestación tiene como consecuencia una disminución de la fecundabilidad materna, pues a partir de los 35 años comienza a disminuir y lo hace en una forma muy significativa a partir de los 40 años (1). Se cree que esta disminución es a causa de una baja calidad ovocitaria, relacionada al envejecimiento ovárico. También es importante agregar que la reserva ovárica comienza a descender, lo que lleva a un menor número de ovocitos recuperados tras la punción ovárica, por lo que las mujeres que retrasan su primer embarazo tienen que enfrentarse a una situación adversa de cantidad y calidad ovocitaria.
Las consecuencias de este retraso se ven reflejadas directamente en la población y sobre todo en los centros de reproducción asistida. Tan solo en los Estados Unidos de Norteamérica se duplicó el número de nacimientos de pacientes con edad entre 40 y 44 años, en un periodo de 12 años (1990 a 2002) (1).
Es importante mencionar que, en las mujeres atendidas en centros de reproducción se observa un descenso en las tasas de embarazo en los tratamientos de técnicas de reproducción asistida (TRA), encontrándose relacionado directamente a la edad materna. Por este motivo, es fundamental ofrecer un asesoramiento óptimo a las pacientes que acuden a los centros, sobre todo a las de edad materna avanzada (EMA; y entendida esta por encima de los 38 años en el presente escrito), acerca de las tasas de gestación y de recién nacidos por cada ciclo y ciclos acumulados.
Cabe mencionar también que existe una desinformación en la población general respecto a las posibilidades que ofrecen las TRA. Muchas pacientes de edad avanzada creen que, al acudir a los centros de reproducción se logrará revertir el efecto del envejecimiento ovárico. Las TRA no compensan en su totalidad esos años perdidos (2).
La EMA se encuentra relacionada a una baja respuesta posterior a las estimulaciones ováricas. A mayor edad, disminuye la respuesta ovárica. Se conoce que el número de folículos primordiales desciende a medida que avanza la edad materna; la respuesta ovárica a la FSH disminuye igualmente (3).
FACTORES PREDICTIVOS PARA UNA BAJA RESPUESTA ANTES DE UNA ESTIMULACIÓN OVÁRICA
La prevalencia de una baja respuesta (BR) aumenta con la edad y después de los 40 años se encuentra por encima de 50% de las pacientes (4). Es por esto que el factor de riesgo de más peso para una baja respuesta es la edad materna avanzada. Siempre se debe confirmar esta posible baja respuesta con pruebas de reserva ovárica (PRO), puesto que algunas mujeres pueden aún producir folículos y ovocitos. De igual forma, la edad joven de la mujer tampoco protege del todo de una baja respuesta, puesto que también es posible encontrarla en pacientes jóvenes aunque con menor prevalencia.
Hay otros factores genéticos y condiciones adquiridas descritas que predisponen a una baja respuesta, como sería el caso de las infecciones pélvicas (5). La aparición de ciclos menstruales más cortos se encuentra igualmente relacionada a una baja respuesta (6). La quimioterapia para tratamiento de cáncer también es otro factor de riesgo para baja respuesta (7). La endometriosis es otro padecimiento que podría llevar a una baja respuesta (8).
Pruebas de reserva ovárica
Las PRO son aquellas que idealmente deberían medir el número restante de folículos primordiales y la calidad de los ovocitos. Actualmente, las PRO ofrecen una medida indirecta de la cohorte de folículos antrales reclutables presentes al inicio del ciclo menstrual. Existen diferentes PRO, como la FSH basal, la inhibina B, el recuento de folículos antrales (RFA), la hormona antimülleriana (AMH), el volumen ovárico y las pruebas dinámicas.
Las PRO, hasta el momento, podrían ser consideradas como aceptables o buenas para valorar el aspecto cuantitativo de los folículos y como pobres para valorar el aspecto cualitativo de los ovocitos.
De todas las PRO, las más que ofrecen una mejor sensibilidad y especificidad son el RFA y la AMH (9). Hasta el momento no se ha evidenciado mejoría alguna en la predictividad de las PRO al unir o combinar las pruebas, comparado con pruebas únicas (10). En otras palabras, el RFA y la AMH predicen la baja respuesta en las pacientes en una forma aceptable, pero no óptima. En la literatura existen diferentes puntos de corte para definir un RFA o AMH anormal: para el RFA el punto de corte varía entre 5 a 7 folículos antrales y para la AMH el punto de corte puede variar entre niveles de 0,5 a 1,1 ng/mL.
Algunos autores han establecido que los niveles de AMH se relacionan con el número de folículos, pero no con la calidad ovocitaria o la constitución cromosómica (11).
En un trabajo retrospectivo se evaluó los ciclos realizados a pacientes con AMH extremadamente baja, ≤0,4 ng/mL (12). Dentro de las 128 pacientes, 58 de ellas tenían más de 42 años y se logró conseguir cuatro embarazos (6,9%), que resultaron en dos nacimientos (3,4%). Con estos datos se podría cuestionar el rechazo para hacer un tratamiento en estas pacientes basándose únicamente en los niveles de AMH.
ESTIMULACIÓN OVÁRICA EN USUARIAS MAYORES A 38 AÑOS
Protocolos de estimulación suave
La estimulación ovárica es un pilar dentro de la reproducción asistida para obtener un mayor número de ovocitos y compensar de esta forma la ineficiencia de la FIV, donde se necesita un número suficiente de embriones. Los protocolos de estimulación actuales son utilizados para suprimir la función hipofisaria combinado con dosis altas de gonadotropinas (FSH). El más utilizado es el protocolo de agonistas de la GnRH, seguido del protocolo de antagonistas de la misma GnRH. Estos protocolos actuales son complejos, muy costosos y precisan de una inyección diaria durante varios días, por lo que es necesaria una revisión frecuente de los ovarios.
Edwards y colaboradores en 1996 sugirieron la utilización de ciertos protocolos de estimulación ovárica más suave, o en su defecto menos agresiva (13). La meta de estos protocolos de estimulación suave es la de ofrecer mayor seguridad y que sean fáciles de utilizar por las pacientes, intentando minimizar los riesgos.
Cuando se utiliza estos protocolos suaves, existe la preocupación de que se obtendrá una respuesta ovárica reducida, con una hipotética disminución en las tasas de embarazo. En mujeres de edad avanzada podría pensarse que esta situación es contraproducente, pues de entrada se obtiene menos ovocitos tras la estimulación ovárica. La actual evidencia sugiere que una estimulación y respuesta ovárica limitada podría tener efectos beneficiosos en el potencial implantatorio, mejorando la calidad ovocitaria. En otras palabras, menor número de ovocitos obtenidos, pero de mayor calidad, que resultan en embriones con mejores tasas de implantación. Es importante apuntar también que existe una tendencia para reducir el número de embriones a ser transferidos, por lo que se requiere menos embriones para trabajar en el laboratorio.
Con la introducción de los antagonistas de la GnRH en la práctica clínica, ha sido posible utilizar protocolos de estimulación ovárica más suaves. A diferencia de los agonistas, los antagonistas no producirán una descarga inicial de gonadotropinas endógenas, por lo que ayudan a tener una supresión hipofisaria inmediata y rápida, aunque reversible.
Implicaciones de los protocolos de estimulación suave
Se ha visto que la estimulación ovárica puede afectar la calidad de los embriones (de acuerdo a su morfología y constitución cromosómica) (14). Los niveles de estradiol elevados durante la estimulación tienen un impacto negativo en el desarrollo y potencial implantatorio de los embriones. Aunque se obtiene menos ovocitos durante las estimulaciones suaves, en forma general representan una cohorte más homogénea de ovocitos de buena calidad. Se ha visto que el número total de embriones de óptima calidad resultantes de las estimulaciones suaves es muy similar al número obtenido en protocolos convencionales de estimulación, debiendo esto resultar en una tasa igual de embarazo (14).
Debido al uso reducido de medicación y de riesgos de hiperestimulación, las estimulaciones suaves tienen ciertos beneficios económicos. El coste es sustancialmente menor en estos protocolos comparado a los convencionales. También, los protocolos suaves ofrecen un tratamiento más corto y con menos complicaciones a las pacientes, por lo que podrían disminuir el estrés psicológico relacionado a las TRA. Las pacientes generalmente reportan menos efectos secundarios y menos cancelaciones del ciclo; es incluso menos probable que las pacientes abandonen el ciclo.
ANDROGENIZACIÓN FOLICULAR
Pacientes con baja respuesta: papel de la LH
La suplementación con LH en la población general de pacientes en ciclos de reproducción asistida no muestra ventaja alguna, aún cuando se sabe que esta hormona es crucial para el desarrollo del folículo y que los mismos tratamientos causen una disminución en sus niveles séricos (15). A diferencia del resto de pacientes de una población general, existe cierta evidencia que apoya el uso de la LH en protocolos de estimulación con antagonistas de la GnRH para aquellas con baja respuesta. En una revisión sistemática se concluyó que, aunque no existe una diferencia significativa que argumente el uso de la LH en los protocolos convencionales, se observó un efecto benéfico con la suplementación de LH, particularmente en pacientes con baja respuesta (16).
Inhibidores de la aromatasa
Los inhibidores de la aromatasa bloquean la conversión de los andrógenos a estrógenos, promoviendo un ambiente intrafolicular abundante en andrógenos. Bloquean la acción de la enzima aromatasa, que cataliza el último paso para la producción de estrógenos, es decir, la conversión de androstenediona a estrona y de testosterona a estradiol.
Existe evidencia que sugiere un papel potencialmente benéfico a favor del uso de inhibidores de la aromatasa para tratar mujeres con intentos fallidos para inducir la ovulación (17). Es necesario aún determinar la duración del tratamiento, así como la dosis exacta en este tipo de medicamentos.
El anastrazol y el letrozol son inhibidores de la aromatasa no competitivos que suprimen la producción de estrógenos en 97 a 99%. Cuando son administrados en la parte inicial del ciclo menstrual, incrementan la secreción de gonadotropinas y estimulan el desarrollo folicular. En los últimos años, un gran acúmulo de evidencia demuestra el éxito del tratamiento al utilizar estos medicamentos para inducir la ovulación en mujeres infértiles (18). Tienen además propiedades periféricas que presentan ciertas ventajas para su uso en pacientes con baja respuesta, pues al bloquear la conversión de sustrato androgénico a estrógeno, se presenta una acumulación intraovárica de andrógenos. Esta elevación de la concentración de andrógenos ováricos pudiera llegar teóricamente a mejorar el reclutamiento y desarrollo folicular.
Inhibidores de la aromatasa en bajas respondedoras
A pesar de que no existe una evidencia sólida para justificar el uso de letrozol en pacientes con baja respuesta, ciertos estudios sugieren un efecto que puede ser benéfico en estas pacientes. Nuestro grupo presentó un estudio (19), en el año de 2005, de pacientes con baja respuesta, en el cual se valoraba el tratamiento del letrozol. Se incluyó 147 pacientes con baja respuesta. Del total, 71 pacientes fueron incluidas en el grupo de estudio, siendo estimuladas con un régimen de dosis alta más letrozol. Al grupo control de 76 pacientes le fue indicado únicamente un régimen de dosis alta sin letrozol. En cuanto a los resultados, se obtuvo significativamente un mayor número de ovocitos en el grupo de estudio, así como una mayor tasa de implantación. La tasa de embarazo fue igualmente mayor en el grupo de estudio, aunque la diferencia no fue significativa. Por otro lado, no se encontró diferencias significativas en la tasa de fecundación, los días totales de estimulación, las dosis totales administradas de medicamento, las concentraciones séricas de estradiol el día de la administración de HCG y la longitud endometrial.
Otros trabajos han sido publicados en los que no se encuentra este efecto benéfico con el uso del letrozol (20,21). Existe además otra cuestión importante con el uso de inhibidores de la aromatasa. Se requiere de más información para conocer con exactitud la seguridad en relación a la teratogenicidad de estos medicamentos. En un trabajo fue reportado el posible efecto teratogénico del letrozol (22), aunque en investigaciones posteriores se ha concluido que el potencial teratogénico es poco probable (23), ya que el medicamento es eliminado del cuerpo casi completamente antes de que se produzca la implantación.
Testosterona y dehidroepiandrosterona (DHEA)
El ovario secreta tres principales andrógenos: testosterona, dehidroepiandrosterona y androstenediona. La DHEA es mayormente secretada por las glándulas suprarrenales. La hormona luteinizante (LH) actúa como punto clave para controlar la producción de andrógenos por el ovario. Por otro lado, se cree que las células de la granulosa al secretar factores paracrinos participan igualmente en la regulación de la producción ovárica de andrógenos (24).
Hasta el momento no se cuenta con información suficiente acerca del papel que tienen los andrógenos y los agentes moduladores de andrógenos en el tratamiento de mujeres con baja respuesta. Los diferentes estudios muestran variaciones en los tipos de pacientes seleccionadas, además de los distintos tipos de andrógenos utilizados, por lo que no se puede obtener conclusiones específicas.
Ciertos estudios han proporcionado evidencia de que un tratamiento previo con andrógenos induce un aumento significativo del número de folículos antrales (25). Este tipo de estudios ha llevado a suponer que el tratamiento de mujeres con baja respuesta pueden beneficiarse con un manejo previo de andrógenos o de agentes moduladores de andrógenos. Por otro lado, los andrógenos parecen tener un papel importante en la fisiología folicular, pues la expresión del gen del receptor de andrógenos se correlaciona con la proliferación de células de la granulosa y el crecimiento folicular (26).
De estos estudios en animales podemos concluir que los andrógenos podrían ayudar a aumentar el reclutamiento de folículos y también tener efectos positivos y negativos sobre la maduración folicular. Este punto es sumamente importante, ya que se cree generalmente que únicamente los efectos negativos son los que aparecen (27).
Podemos concluir lo siguiente en cuanto a la información que se tiene al momento que favorece al uso de los andrógenos:
La testosterona transdérmica podría incrementar el número de folículos antrales y el número de ovocitos obtenidos posterior a la punción, así como a tasas de embarazo más altas. Un estudio en particular no demostró efecto benéfico alguno en la respuesta ovárica (28,29).
En relación a estudios con DHEA, luego de un tratamiento con este andrógeno se observó una respuesta más significativa a la hormona folículo estimulante (FSH), con concentraciones séricas de estradiol más elevadas y con un mayor número de folículos maduros al final de la estimulación (30).
Al igual que en los inhibidores de la aromatasa, se requiere aún mucha información para obtener conclusiones de peso que favorezcan su uso, así como para definir la dosis exacta y la duración de los tratamientos.
FECUNDACIÓN IN VITRO
La tasa de gestación se ve limitada en la fecundación in vitro (FIV) por la edad materna. Los datos que nos aporta el registro de la ESHRE, del año 2006 (31), son muy claros al respecto. Las tasas de gestación fueron 28,2, 22,2 y 9,6% en pacientes de menos de 34, 35 a 39 y ≥40 años, respectivamente. Se observa disminución de ambas tasas según va aumentando la edad de las pacientes. En un reciente trabajo se analiza en forma retrospectiva los resultados de más de 2 000 ciclos de FIV en pacientes de 40 años o más (32). La tasa de gestación (beta-hCG positiva) por transferencia fue 23,9%, la tasa de gestación por ciclo iniciado 13,4%, con una tasa de aborto de 44,8%. Finalmente, la tasa de recién nacido por ciclo iniciado fue 6,7%. El análisis de los diferentes grupos por edades resultó en una diferencia significativa en recién nacido vivo por ciclo iniciado en pacientes menores de 43 años y en las de 43 años o más.
VITRIFICACIÓN DE OVOCITOS
Las pacientes de edad avanzada, como hemos descrito anteriormente, comúnmente presentan una baja respuesta. En la práctica clínica, una de las mejores opciones terapéuticas disponibles actualmente es la acumulación y vitrificación de los ovocitos, pudiendo requerir una cantidad variada de ciclos de estimulación para lograr obtener un número adecuado de ovocitos y realizar una microinyección (ICSI). La vitrificación es un método para preservar ovocitos, con una excelente tasa de supervivencia posterior a la descongelación (33). Se puede obtener grandes ventajas con la vitrificación de ovocitos para acumulación, pues el resultado es un mayor número de embriones transferidos con tasa de embarazo más elevada en pacientes con BR.
DIAGNÓSTICO GENÉTICO PREIMPLANTACIONAL
Un tratamiento que se encuentra relacionado a la estimulación ovárica, sobre todo en pacientes de edad avanzada, es el diagnóstico genético preimplantacional (DGP). Este tratamiento fue inicialmente desarrollado para ayudar a parejas con padecimientos genéticos. Posteriormente, se creó la hipótesis de que al seleccionar embriones euploides (para ciertos pares cromosómicos comunes) se podría incrementar el éxito reproductivo. El DGP se encuentra ahora incluido como método de tamizaje (screening) preimplantacional (PGS) en ciertas situaciones, como la EMA, pues se presentarán aneuploidías en una gran cantidad de embriones en este tipo de pacientes.
Como se conoce ya, con una EMA se tiende a recuperar un menor número de ovocitos, resultando esto en un menor número de embriones disponibles para transferir. En ciclos de PGS incluso resultan menos embriones. Es aquí donde la vitrificación de ovocitos y de embriones es de gran ayuda. En un estudio (34) de nuestro grupo descubrimos que en ciertas pacientes con EMA el PGS ayuda a mejorar los resultados reproductivos con ovocitos propios. Las pacientes mayores de 40 años fueron las más beneficiadas.
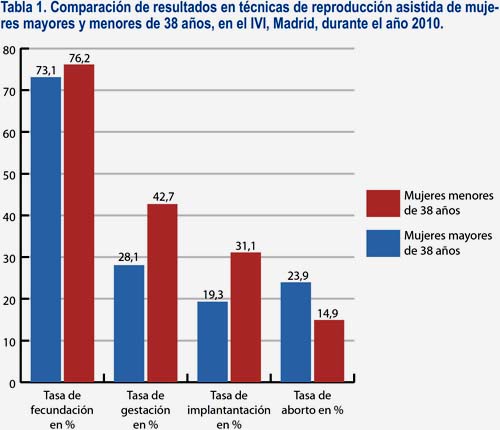
Con los datos existentes actualmente, la utilización del PGS permite ofrecer la opción terapéutica más exitosa y segura con ovocitos propios en las mujeres con EMA (tabla 1).
Referencias bibliográficas
1. U.S. National Center for Health Statistics. Health and Injury Chartbook. En: US National Center for Health Statistics, National Vital Statistics Report. Vol. 50, No. 7. Hyattsville, MD: Centers for Disease Control and Prevention. Disponible en: http://www.cdc.gov/nchs/data/NVSR/nvsr50/nvsr50_07.pdf
2. Leridon H. Can assisted reproduction technology compensate for the natural decline in fertility with age? A model assessment. Hum Reprod. 2004;19(7):1548-53.
3. Goverde AJ, McDonnell J, Schats R, Vermeiden JP, Homburg R, Lambalk CB. Ovarian response to standard gonadotrophin stimulation for IVF is decreased not only in older but also in younger women in couples with idiopathic and male subfertility. Hum Reprod. 2005;20:1573–7.
4. El-Toukhy T, Khalaf Y, Hart R, Taylor A, Braude P. Young age does not protect against the adverse effects of reduced ovarian reserve an eight year study. Hum Reprod. 2002;17:1519–24.
5. Keay SD, Barlow R, Eley A, Masson GM, Anthony FW, Jenkins JM. The relation between immunoglobulin G antibodies to Chlamydia trachomatis and poor ovarian response to gonadotropin stimulation before in vitro fertilization. Fertil Steril. 1998;70:214–8.
6. Brodin T, Bergh T, Berglund L, Hadziosmanovic N, Holte J. Menstrual cycle length is an age-independent marker of female fertility: results from 6271 treatment cycles of in vitro fertilization. Fertil Steril. 2008;90:1656–61.
7. De Vos M, Devroey P, Fauser BC. Primary ovarian insufficiency. Lancet. 2010;11:911–21.
8. Garcia-Velasco JA, Somigliana E. Management of endometriomas in women requiring IVF: to touch or not to touch. Hum Reprod. 2009;24:496–501.
9. La Marca A, Sighinolfi G, Radi D, Argento C, Baraldi E, Artenisio AC, Stabile G, Volpe A. Anti-Mullerian hormone (AMH) as a predictive marker in assisted reproductive technology (ART). Hum Reprod Update. 2010;16:113–30.
10. Verhagen TE, Hendriks DJ, Bancsi LF, Mol BW, Broekmans FJ. The accuracy of multivariate models predicting ovarian reserve and pregnancy after in vitro fertilization: a meta-analysis. Hum Reprod Update. 2008;14:95–100.
11. Guerif F, Lemseffer M, Couet ML, Gervereau O, Ract V, Royere D. Serum antimullerian hormone is not predictive of oocyte quality in vitro fertilization. Ann Endocrinol (Paris). 2009;70(4):230–4.
12. Weghofer A, Dietrich W, Barad DH, Gleicher N. Live birth chances in women with extremely lowserum anti-Mullerian hormone levels. Hum Reprod. 2011 Abr 30. [Publicación electrónica antes de impresión]
13. Edwards, RG, Lobo, R, Bouchard, P. Time to revolutionize ovarian stimulation. Hum Reprod. 1996;11:917–9.
14. Verberg MF, Macklon NS, Nargund G, Frydman R, Devroey P, Broekmans FJ, Fauser BC. Mild ovarian stimulation for IVF. Hum Reprod Update. 2009;15:13-29.
15. Van Wely M, Westergaard LG, Bossuyt PM, Van der Veen F. Human menopausal gonadotropin versus recombinant follicle stimulation hormone for ovarian stimulation in assisted reproductive cycles. Cochrane Database Syst Rev. 2003;(1):CD003973.
16. Mochtar MH, Van der Veen, Ziech M, van Wely M. Recombinant luteinizing hormone (rLH) for controlled ovarian hyperstimulation in assisted reproductive cycles. Cochrane Database Syst Rev. 2007;(2):CD005070.
17. Mitwally MF, Casper RF. Use of an aromatase inhibitor for induction of ovulation in patients with an inadequate response to clomiphene citrate. Fertil Steril. 2001;75(2):305-9.
18. Mitwally MF, Casper RF, Diamond MP. The role of aromatase inhibitors in ameliorating deleterious effects of ovarian stimulation on outcome of infertility treatment. Reprod Biol Endocrinol. 2005;3:54.
19. Garcia-Velasco JA, Moreno L, Pacheco A, Guillén A, Duque L, Requena A, Pellicer A. The aromatase inhibitor letrozole increases the concentration of intraovarian androgens and improves in vitro fertilization outcome in low responder patients: a pilot study. Fertil Steril. 2005;84(1):82-7.
20. Schoolcraft WB, Surrey ES, Minjarez DA, Stevens JM, Gardner DK. Management of poor responders: can outcomes be improved with a novel gonadotropin- releasing hormone antagonist/ letrozole protocol? Fertil Steril. 2008;89(1):151-6.
21. Yarali H, Esinler I, Polat M, Bozdag G, Tiras B. Antagonist/letrozole protocol in poor ovarian responders for intracytoplasmic sperm injection: a comparative study with the microdose flare-up protocol. Fertil Steril. 2009;92(1):231-5.
22. Biljan MM, Hemmings R, Brassard N. The outcome of 150 babies following treatment with letrozole or letrozole and gonadotropins. Fertil Steril. 2005;88:665-9.
23. Tulandi T, Martin J, Al-Fadhli R, Kabli N, Forman R, Hitkari J, Librach C, Greenblatt E, Casper RF. Congenital malformations among 911 newborns conceived after infertility treatment with letrozole or clomiphene citrate. Fertil Steril. 2006;85(6):1761-5.
24. Tanbo T, Dale PO, Abyholm T. Recombinant follicle-stimulating hormone stimulates ovarian androgen synthesis in down-regulated ovulatory women. Gynecol Endocrinol. 2001;15(6):407-12.
25. Vendola KA, Zhou J, Adesanya OO, Weil SJ, Bondy CA. Androgens stimulate early stages of follicular growth in the primate ovary. J Clin Invest. 1998;101(12):2622-9.
26. Weil SJ, Vendola K, Zhou J, Adesanya OO, Wang J, Okafor J, Bondy CA. Androgen receptor gene expression in the primate ovary: cellular localization, regulation, and functional correlations. J Clin Endocrinol Metab. 1998;83(7):2479-85.
27. Gleicher N, Weghofer A, Barad DH. The role of androgens in follicle maturation and ovulation induction: friend or foe of infertility treatment? Reprod Biol Endocrinol. 2011;9:116.
28. Balasch J, Fábregues F, Peñarrubia J, Carmona F, Casamitjana R, Creus M, Manau D, Casals G, Vanrell JA. Pretreatment with transdermal testosterone may improve ovarian response to gonadotrophins in poor-responder IVF patients with normal basal concentrations of FSH. Hum Reprod. 2006;21:1884-93.
29. Massin N, Cedrin-Durnerin I, Coussieu C, Galey-Fontaine J, Wolf JP, Hugues JN. Effects of transdermal testosterone application on the ovarian response to FSH in poor responders undergoing assisted reproduction technique--a prospective, randomized, double-blind study. Hum Reprod. 2006;21:1204-11.
30. Casson PR, Lindsay MS, Pisarska MD, Carson SA, Buster JE. Dehydroepiandrosterone supplementation augments ovarian stimulation in poor responders: a case series. Hum Reprod. 2000;15(10):2129-32.
31. De Mouzon J, Goossens V, Bhattacharya S, Castilla JA, Ferraretti AP, Korsak V, Kupka M, Nygren KG, Nyboe Andersen A; European IVF-monitoring (EIM) Consortium, for the European Society of Human Reproduction and Embryology (ESHRE). Assisted reproductive technology in Europe, 2006: results generated from European registers by ESHRE. Hum Reprod. 2010;25(8):1851-62.
32. Serour G, Mansour R, Serour A, Aboulghar M, Amin Y, Kamal O, Al-Inany H, Aboulghar M. Analysis of 2,386 consecutive cycles of in vitro fertilization or intracytoplasmic sperm injection using autologous oocytes in women aged 40 years and above. Fertil Steril. 2010;94(5):1707-12.
33. Cobo A, Meseguer M, Remohí J, Pellicer A. Use of cryo-banked oocytes in an ovum donation programme: a prospective, randomized, controlled, clinical trial. Hum Reprod. 2010;25(9):2239-46.
34. Milán M, Cobo AC, Rodrigo L, Mateu E, Mercader A, Buendía P, Peinado V, Delgado A, Mir P, Simón C, Remohí J, Pellicer A, Rubio C. Redefining advanced maternal age as an indication for preimplantation genetic screening. Reprod Biomed Online. 2010;21(5):649-57.













