Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Ginecología y Obstetricia
On-line version ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.58 no.1 Lima 2012
ARTÍCULO ORIGINAL
Ganglio centinela para estadios tempranos en cáncer de cuello uterino
Sentinel lymph node detection in early uterine cervical cancer
Henry Valdivia1; Rossana Morales2; Luis Taxa3; Manuel Álvarez1; Carlos Santos1; Albert Zevallos1; Carlos Velarde1; Marco Sánchez1; Aldo López1; Absalón Montoya1
1 Departamento de Cirugía Ginecológica, Instituto Nacional de Enfermedades Neoplásicas, Lima-Perú
2 Departamento de Medicina Nuclear,, Instituto Nacional de Enfermedades Neoplásicas, Lima-Perú
3 Departamento de Patología, Instituto Nacional de Enfermedades Neoplásicas, Lima-Perú
RESUMEN
Objetivo: Determinar la factibilidad y seguridad del ganglio centinela (GC) con el uso combinado del mapeo linfático con Tc 99 y la inyección de colorante azul (patent blue) en pacientes con cáncer de cérvix temprano sometidas a histerectomía radical con linfadenectomía pélvica bilateral. Diseño: Estudio prospectivo. Institución: Instituto Nacional de Enfermedades Neoplásicas, Lima, Perú. Participantes: Pacientes con cáncer temprano de cuello uterino. Intervenciones: Entre diciembre de 2003 y diciembre de 2006, 66 pacientes con cáncer temprano de cuello estadios IA2 (n=2), IB1 (n=63) y IIA (n=1) fueron sometidas a detección del ganglio linfático centinela con linfoscintigrafía el día previo a la operación y mapeo linfático intraoperatorio con colorante azul y sonda detectora de radiación gama. El tratamiento quirúrgico se completó con la realización de la histerectomía radical y linfadenectomía pélvica bilateral, por laparotomía. Principales medidas de resultados: Detección de ganglios centinelas. Resultados: En las 66 pacientes estudiadas se detectó 136 ganglios centinelas, con un promedio de 2,06 por paciente. Se utilizó el método combinado (Tc 99 y patent blue). La localización más frecuente fue la región obturatriz con un 69,9% (n=95). Se halló metástasis en los ganglios pélvicos en 11 pacientes, que fueron correctamente localizadas en el ganglio centinela con una sensibilidad de 100%. Cuando el ganglio centinela fue negativo, no se encontró metástasis en los ganglios no centinela (VPN 100%). Conclusiones: La identificación del ganglio centinela con tecnecio-99 combinado con la inyección de colorante azul es factible y mostró un valor predictivo negativo de 100%.
Palabras clave: Ganglio centinela, histerectomía radical, cáncer de cérvix, linfadenectomía, dextrán 99mTc, linfoscintigrafia.
Abstract
Objective: To determine sentinel node (SN) detection feasibility and safety by using lymphatic mapping with 99m Tc Dextrán and injection of blue dye (patent blue) in patients with early cervical cancer undergoing radical hysterectomy with bilateral pelvic lymphadenectomy. Design: Prospective study. Setting: Instituto Nacional de Enfermedades Neoplasicas, Lima, Peru. Participants: Patients with early cervical cancer. Interventions: Between December 2003 and December 2006, 66 patients with early cervical cancer stages IA2 (n = 2), IB1 (n = 63) and IIA (n = 1) underwent sentinel lymph node detection with lymphoscintigraphy the day before operation and intraoperative lymphatic mapping with blue dye and gamma radiation detection probe. Surgical treatment was completed with radical hysterectomy and bilateral pelvic lymphadenectomy by laparotomy. Main outcome measures: Sentinel node detection. Results: One hundred and thirty-six sentinel nodes were detected in all 66 patients, average 2.06 per patient, by using the combined method 99m Tc dextrán and patent blue. Most common location was the obturator region in 69.9% of cases (n = 95). Pelvic lymph node metastases were found by the sentinel node in 11 patients (sensitivity of 100%). In negative sentinel node cases (55 patients) no metastases were encountered (negative predictive value, NPV = 100%). Conclusions: Sentinel node identification using 99m technetium Dextrán and blue dye injection is feasible and had a negative predictive value of 100%.
Key words: Sentinel node, radical hysterectomy, cervical cancer, lymphadenectomy, dextrán 99mTc, lymphoscintigraphy.
INTRODUCCIÓN
El cáncer de cérvix es una neoplasia que afecta principalmente a los países en vías de desarrollo. En el año 2008 se presentaron 529 000 nuevos casos en el mundo, de los cuales el 85% fue visto en los países menos desarrollados (1).
En el Perú tenemos tres registros poblacionales de las ciudades más importantes del país, que muestran tasas de incidencia para Lima de 23,5/100000 mujeres (2), Arequipa 35,2/100000 (2003)(3) y Trujillo 43,2/100000 (2002)(4). El cáncer de cuello uterino se estadifica de acuerdo a la clasificación de la Federación Internacional de Ginecología y Obstetricia (FIGO)(5). Los estadios iniciales (I y IIA) puede ser manejados quirúrgicamente y los estadios avanzados reciben tratamiento combinado con quimioterapia-radioterapia (QT-RT). El tratamiento quirúrgico implica la disección de los ganglios linfáticos pélvicos que, aunque no están considerados en el estadiaje de la FIGO, representan un factor pronóstico importante para la sobrevida (5- 8).
En pacientes con cáncer de cuello uterino estadios I y IIA, según la clasificación FIGO, el porcentaje de metástasis linfáticas pélvicas varía entre 0-16% y 24-31%, respectivamente (9,10). En el Instituto Nacional de Enfermedades Neoplásicas (INEN), las pacientes con carcinoma de cuello uterino estadio Ia1 tienen un porcentaje de compromiso ganglionar cercano a cero, y en los estadios IA2 y IB1 dicho porcentaje va de 5 a 15% (11).
La linfadenectomía pélvica, descrita como parte del tratamiento quirúrgico para estadios iniciales de cáncer de cérvix, no está exenta de complicaciones. El linfoquiste se presenta en más del 20% y el linfedema en 10 a 15% de pacientes (9,12), aunque muchos investigadores creen que el porcentaje podría aumentar, ya que los métodos utilizados para medir estas complicaciones son imprecisos y no existen estudios adecuados que hayan evaluado este problema. Otras complicaciones descritas son las lesiones nerviosas, vasculares y ureterales. Es por esto, que se busca alternativas que reduzcan la incidencia de complicaciones y una gran oportunidad se presenta con la identificación del ganglio centinela (9,12).
El ganglio centinela (GC) es el primer ganglio linfático que drena el tumor primario (13). La utilización del una sonda de detección gamma en sala de operaciones se inició con los trabajos de Krag y colaboradores (14). El cirujano, en sala de operaciones utiliza una sonda de detección portátil, que localiza la radiactividad en el ganglio caliente que ha sido previamente visto en las imágenes de linfoscintigrafía. Se retira el o los ganglios centinelas hasta que la radiactividad en el lecho operatorio cae por debajo de 10% de la radiactividad del GC. Adicionalmente el ganglio centinela está teñido de azul, lo que facilita su detección (14,15).
En los años ochenta, Morton y col. desarrollaron el concepto de ganglio centinela utilizando linfoscintigrafía como un adicional a su trabajo para reconocer los patrones de drenaje del melanoma cutáneo (16). Su estudio describe la técnica de inyectar por vía intradérmica un colorante vital azul en el lugar del melanoma e identificar el ganglio teñido de azul en la cadena ganglionar regional correspondiente al drenaje del tumor primario. En 237 disecciones ganglionares estándar realizadas en este primer estudio, les fue posible identificar el GC en 82% de los casos. La linfoscintigrafía realizada con dextrán Tc 99m les sirvió para detectar el drenaje anómalo y disminuir el tiempo de búsqueda del ganglio centinela durante la cirugía. La biopsia del ganglio centinela predijo el estado de la cadena ganglionar en 99% (16).
Por lo tanto, la identificación, extirpación y estudio histológico del ganglio centinela pronostica el estado de los otros ganglios que dependen de él. El ganglio centinela puede ser localizado utilizando colorantes vitales como el patent blue V, que se inyecta alrededor del tumor al inicio de la cirugía o mediante radioisótopos, en forma simultánea (16-18). Ambas técnicas tienen ventajas y desventajas y la utilización de ambas aumenta el porcentaje de detección (14,19,20).
La detección del ganglio centinela en sala de operaciones brinda la posibilidad de mejorar el tratamiento de las pacientes con cáncer ginecológico, gracias a la identificación de las metástasis ganglionares que nos permitirán tomar decisiones para reducir la morbilidad de los procedimientos quirúrgicos (21).
El concepto de ganglio centinela en pacientes con cáncer de cuello uterino está siendo evaluando desde 1999 (22), e implica que la propagación linfática del tumor primario a nivel de los ganglios regionales se produce en una forma ordenada. La ausencia o presencia de un tumor en el ganglio centinela es considerada como representativo en toda la región de los ganglios linfáticos, por lo que si este ganglio se encuentra libre de metástasis, se ha propuesto que podría obviarse la disección ganglionar correspondiente (23).
En la actualidad, el 90% de los ganglios linfáticos resecados en los pacientes con el cáncer cervical son histológicamente negativos, por lo que la aplicación del concepto de centinela parece factible (24).
El objetivo principal de este estudio fue evaluar la factibilidad, eficacia y seguridad del ganglio centinela en cáncer de cérvix inicial. Un análisis paralelo permitirá evaluar los estudios de impronta y biopsia congelación de los ganglios centinelas de manera intraoperatoria.
MÉTODOS
Entre diciembre de 2003 y diciembre de 2006 se realizó un estudio prospectivo, incluyendo a los pacientes con carcinoma invasor de cuello uterino que tuvieron estadios IA2, IB1 y IIA, de menos de 4 cm de diámetro, tratamiento quirúrgico con histerectomía radical y linfadenectomía pélvica bilateral por laparotomía y tipo histológico de carcinoma epidermoide o adenocarcinoma. Fueron criterios de exclusión la enfermedad metastásica detectada en la evaluación preoperatoria, radioterapia o linfadenectomia pélvica previas y alergia al radiocoloide o azul patente.
Con relación al procedimiento para la detección del ganglio centinela, se inyectó 5 mCi (175 MBq) de tecnecio 99m dextrán en los cuatro cuadrantes del cérvix o en el área peritumoral, 24 horas antes de la cirugía. Las imágenes fueron adquiridas con una cámara gamma planar General Electric, con un detector con colimador de energía baja multipropósito. La paciente fue colocada en decúbito supino, con el detector sobre la zona pélvica y un blindaje de plomo en la zona de inyección. En algunos casos, para facilitar la detección del ganglio centinela, se colocó a la paciente en posición ginecológica. El software utilizado fue el PIP (portable imaging processing), siendo las imágenes luego transformadas a formato JPG, para su interpretación.
Se evaluó el flujo linfático por apreciación visual y se consideró como ganglio centinela al primer ganglio que mostrase hipercaptación del radiofármaco. Antes del inicio de la cirugía se confirmó que la zona retuviese la hipercaptación, siendo necesaria en algunos casos una nueva inyección de 1 mCi de dextrán Tc 99m en el cuello uterino.
Al inicio de la cirugía se inyectó patent blue en las mismas áreas del cuello uterino donde se inyectó el material radioactivo. Se exploró las regiones ganglionares pélvicas, presacras y paraórticas en forma visual y utilizando el detector de radiación Navigator. Durante la cirugía se midió la radioactividad del GC antes de resecarlo y luego en el lecho operatorio una vez resecado el ganglio, para descartar la presencia de otros ganglios hipercaptadores del material radioactivo.
Luego de la resección del ganglio centinela, las pacientes fueron sometidas a histerectomía radical y linfadenectomía pélvica bilateral, extirpándose los ganglios de las regiones iliaca externa, obturatriz e interiliaca en forma completa.
El estudio histopatológico del ganglio centinela fue realizado por parafina, cortando cada ganglio en forma perpendicular a su eje mayor, con intervalos de 2 a 3 mm. Si el o los ganglios eran pequeños, entre 2 y 3 mm, eran estudiados sin seccionarlos. Cada corte era agrupado en 5 fragmentos como máximo, en un casette. Luego, se hizo cortes de H&E entre 3 a 4 micras de espesor, a intervalos de 150 micras. El resto de ganglios no centinela fueron cortados en su eje mayor y estudiados con H&E.
La base de datos fue tabulada en el software Excel para Windows XP, siendo luego procesada en el software para análisis estadísticos SPSS 17. Para el análisis estadístico de las variables, se usó tablas de distribución de frecuencia y medidas de resumen. Se calculó la sensibilidad, especificidad y valores predictivos positivos y negativos del uso del ganglio centinela como predictor de compromiso ganglionar metastástico en los ganglios no centinela.
RESULTADOS
Sesentaiséis pacientes fueron enroladas en el presente estudio, con una edad media de 40,7 años. La gran mayoría, 63 pacientes (95,5%), pertenecía al estadio clínico IB1. En cuanto al tipo histológico, 43 pacientes (65,2%) tuvieron histología de carcinoma epidermoide y 23 (34,8%) adenocarcinoma. Así mismo, a 63 pacientes (95,5%) se les realizó histerectomía radical y linfadenectomía pélvica bilateral, mientras que a las 3 restantes (4,5%) solamente linfadenectomía pélvica bilateral, ya que al tener el hallazgo de ganglio pélvico metastásico, se decidió tratamiento con radioterapia (tabla1)

La localización del tumor en el cérvix uterino fue: en el labio anterior 40 pacientes (60,6%), labio posterior 36 (54,5%), en ambos labios 25 (37,9%) y solo en el canal endocervical 10 pacientes (15,2%).
Para la identificación del ganglio centinela, en todas las pacientes se utilizó radiocoloide, detectándose el ganglio centinela en 98,5% de los casos (65/66) mediante linfoscintigrafía, el día previo al acto quirúrgico, y en sala de operaciones en todos los casos, al utilizar la sonda detectora de radiación gamma. El azul patente logró detectar el GC en 76,7% (46/60) de las pacientes.
Se detectó 136 ganglios centinelas, con un promedio de 2,06 por paciente. Los sitios más frecuentes fueron las regiones obturatriz e interiliaca, como se muestra en la tabla 2. Llamó la atención una paciente en la que se detectó el ganglio centinela en la región perineal. En 29 pacientes (43,9%) se tuvo ganglio centinela de forma bilateral.
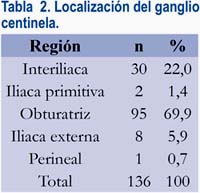
Se halló metástasis en los ganglios pélvicos en 11 pacientes, que fueron correctamente localizadas en el ganglio centinela también con radiocoloide, con una sensibilidad de 100%. Cuando el ganglio centinela fue negativo, no se encontró metástasis en los ganglios no centinela (VPN 100%).
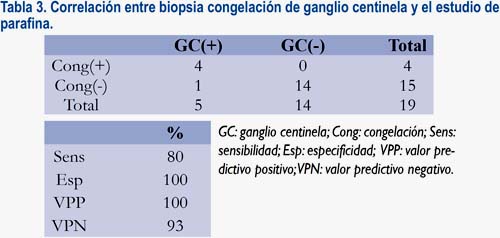
Se utilizó biopsia por congelación del ganglio centinela en 19 pacientes. En este grupo, de los 5 ganglios centinela con metástasis halladas en el estudio definitivo por parafina, 4 fueron detectados intraoperatoriamente mediante la biopsia congelación, lo que representó una sensibilidad de 80% y VPP del 100% (tabla 3).
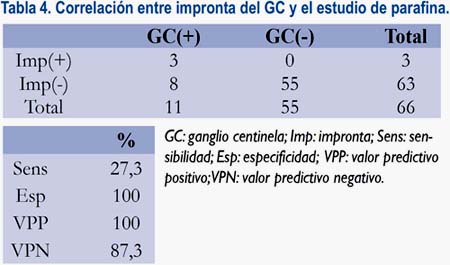
En todos los casos se utilizó el estudio mediante impronta intraoperatoria. De los 11 ganglios centinela con metástasis encontradas en el estudio por parafina, solamente tres fueron detectadas intraoperatoriamente mediante el estudio con impronta, con una sensibilidad de 27,3% (tabla 4).
DISCUSIÓN
En la última década, el procedimiento del ganglio linfático centinela (GC) ha sido ampliamente utilizado en pacientes con cáncer de mama, vulva y melanoma. Los beneficios clínicos de la biopsia del GC incluyen la reducción de riesgo relativo de linfedema y la pérdida de la sensibilidad. Los beneficios específicos en el manejo del cáncer de cuello uterino incluyen: una disminución de las lesiones nerviosas de los grandes vasos y ureterales, menor pérdida de sangre, disminución del tiempo quirúrgico y mejor identificación de los ganglios linfáticos metastásicos a través ultraestadiaje (25).
Los trabajos preliminares con tinta azul muestran tasas de detección de 60 a 100%. En la mayoría de los trabajos se utilizó 4 mL de tinta inyectados en los cuatro cuadrantes del cérvix uterino, encontrándose discrepancia acerca de si existe relación entre la cantidad de tinta, número de sitios de inyección y la variación de la tasa de detección (26-28). Hay tres tipos de tinta que han sido utilizadas (azul patente, azul de metileno y linfazorium); sin embargo, son muy pocos los trabajos para poder determinar cuál de ellas es más efectiva (29-31). En nuestro estudio, utilizando 2 mL de azul patente e inyectando 0,5 mL en cada cuadrante, la tasa de detección fue 76,7%, lo cual concuerda con los estudios señalados.
Estudios previos, al aplicar solo el radiocoloide (Tc 99), muestran una mayor tasa de detección, que oscila entre 70% y 100% (32-34). La cantidad utilizada de radiocoloide fue 40 a 220 MBq. En el presente estudio, la tasa de detección fue bastante alta, 98,5%, con la linfoscintigrafía el día previo al acto quirúrgico, y de 100% con sonda detectora de radiación gamma en el acto operatorio, utilizando 175 MBq de tecnecio 99m dextrán en los cuatro cuadrantes del cérvix o en el área peritumoral, 24 horas antes de la cirugía.
La ventaja de Tc 99 es la oportunidad de detectar localizaciones aberrantes de los ganglios linfáticos centinelas (25), como se pudo evidenciar en el presente estudio, en el que se encontró uno en la región perineal. Asimismo, el uso de ambas técnicas, 99mTc y tinta azul, denominado método combinado, aumenta la tasa de detección significativamente, oscilando entre 80% y 100% (26). En nuestro estudio, el método combinado detectó el GC en el 100% de los casos.
La tasa de detección de ganglio centinela bilateral varía entre 19% y 90% (17,18,24,26,28-30). En nuestro estudio, la detección bilateral fue 43,9%. Los defensores de la detección bilateral argumentan que el cuello del útero es un órgano localizado en la línea media y, por lo tanto, el drenaje linfático se dirige hacia ambos lados de la pelvis.
Los datos muestran que los vasos linfáticos podrían estar obstruidos cuando hay metástasis, antecedentes de enfermedad inflamatoria o cirugía, alterando el drenaje bilateral, mostrándose como unilateral (32-34). Por lo tanto, si la técnica del GC se adopta en la práctica habitual, será imperativo que al menos un GC sea detectado en cada hemipelvis y, si no es posible su identificación, entonces se debe completar el procedimiento con una linfadenectomía completa y reglada de la hemipelvis, donde no se evidenció (35).
La sensibilidad global del ganglio centinela, identificado como un indicador de metástasis ganglionar pélvica en los ganglios no centinela, varía en estudios previos entre el 80 y el 100% (23,28,29,36,37). En el presente estudio, la sensibilidad encontrada fue del 100%, tanto para la aplicación del radiocoloide como con la tinta azul. El VPN también fue de 100%. En estudios previos, se encontró valores de VPN desde 88 hasta 100% (28,34-36).
En resumen, la identificación del GC en mujeres con cáncer de cérvix temprano es factible y seguro. El uso del método combinado con Tc 99 y colorante azul (patent blue) permitió una detección del 100%, con un valor predictivo negativo (VPN) también del 100%. Sin embargo, son necesarios estudios que demuestren cuál es la metodología más adecuada para la evaluación histopatológica del ganglio centinela.
Referencias Bibliográficas
1. Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. GLOBOCAN 2008, Cancer Incidence and Mortality Worldwide: IARC Cancer Base No. 10 [Internet]. Lyon, France: International Agency for Research on Cancer; 2010. Disponible en: http://globocan.iarc.fr
2. Centro de Investigación Maes Heller, Instituto de Enfermedades Neoplásicas. Registro de Cáncer en Lima Metropolitana 1994 -1997. Lima: Instituto de Enfermedades Neoplásicas; 2004.
3. Registro de cáncer hospitalarioregión de salud Arequipa. Arequipa: 2002:1-74.
4. Albújar PF. El cáncer en Trujillo, 1996 - 2002: incidencia y mortalidad. Registro de Cáncer de Base Poblacional de Trujillo, Perú. Informe N° 4 Trujillo, Noviembre 2006.
5. Committee on Practice Bulletins – Gynecology. ACOG Practice Bulletin. Diagnosis and treatment of cervical carcinomas, num 35, May 2002. Obstet Gynecol. 2002;99(5 Pt 1):855–67.
6. Stehman FB, Bundy BN, DiSaia PJ, Keys HM, Larson JE, Fowler WC. Carcinoma of the cervix treated with radiation therapy: I. A multi-variate analysis of prognostic variables in the Gynecologic Oncology Group. Cancer. 1991;67(11):2776–85.
7. Ho CM, Chien TY, Huang SH, Wu CJ, Shih BY, Chang SC. Multivariate analysis of the prognostic factors and outcomes in early cervical cancer patients undergoing radical hysterectomy. Gynecol Oncol. 2004;93 (2):458–64.
8. Takeda N, Sakuragi N, Takeda M, Okamoto K, Kuwabara M, Negishi H, et al. Multivariate analysis of histopathologic prognostic factors for invasive cervical cancer treated with radical hysterectomy and systematic retroperitoneal lymphadenectomy. Acta Obstet Gynecol Scand. 2002;81(12):1144–51.
9. Benedetti P, Basile S, Angioli R. Pelvic and aortic lymphadenectomy in cervical cancer: The standardization of surgical procedure and its clinical impact. Gynecol Oncol. 2009;113(2):284–90.
10. Sakuragi N. Up-to-date management of lymph node metastasis and the role of tailored lymphadenectomy in cervical cancer. Int J Clin Oncol. 2007;12:165–75.
11. Valdivia FH, Santos OC, Álvarez LM, Velarde NC, Mariátegui SJ, Galdos KO. Evaluación de factores pronósticos en pacientes tratadas con histerectomía radical tipos II y III para cáncer de cérvix en el Instituto Especializado de Enfermedades Neoplásicas de Perú. Boletín del Inen, Lima Perú. 2005;27(1):18-29.
12. Matsuura Y, Kawagoe T, Toki N, Tanaka M, Kashimura M. Longstanding complications after treatment for cancer of the uterine cervix - clinical significance of medical examinations at 5 years after treatment. Int J Gynecol Cancer. 2006;16(1):294-7.
13. Nieweg OE, Tanis PJ, Kroon BBR. The definition of a sentinel node. An Surg Oncol. 2001;8(6):538-41.
14. Krag D, Weaver D, Ashikaga T, Moffat F, Klimberg VS, et al. The sentinel node in breast cancer: a multicenter validation study. N Engl J Med. 1998;339:941–6.
15. Veronesi U, Paganelli G, Galimberti V, Viale G, Zurrida S, et al. Sentinel- node biopsy to avoid axillary dissection in breast cancer with clinically negative lymph-nodes. Lancet. 1997;349:1864-7.
16. Morton DL, Wen DR, Wong JH, Economou JS, Cagle LA, Storm FK, Foshag LJ, Cochran AJ. Technical details of intraoperative lymphatic mapping for early stage melanoma. Arch Surg. 1992;127(4):392-9.
17. Morton DL. Sentinel node mapping and an International Sentinel Node Society: Current issues and future directions. Ann Surg Oncol. 2004(11):137-43.
18. Levenback C, Burke TW, Morris M, Malpica A, Lucas KR, Gershenson DM. Potential applications of intraoperative lymphatic mapping in vulvar cancer. Gynecol Oncol. 1995;59:216-20.
19. Mariani G, Moresco L, Viale G, Villa G, Bagnasco M, Canavese G, Buscombe J, Strauss W, Paganelli G. Radioguided sentinel node biopsy in breast cancer surgery. J Nuclear Med. 2001;42:1198-215.
20. Terada KY, Coel MN, Ko P, Wong JH. Combined use of intraoperative lymphatic mapping and lymphoscintigraphy in the management of squamous cell cancer of the vulva. Gynecol Oncol. 1998;70:65–9.
21. Cady B. Sentinel lymph node procedure in squamous cell carcinoma of the vulva. J Clin Oncol. 2000;18:2795–7.
22. Levenback C. Intraoperative lymphatic mapping and sentinel node identification: gynecologic applications. En: Schlag PM, Veronesi U, eds. Lymphatic Metastasis and Sentinel Lymphonodectomy. Berlin, Germany: Springer Verlag; 2000:150–60.
23. Maaike HM, Hedwig P, van de Nieuwenhof JA. The role of sentinel node biopsy in gynecological cancer: a review. Curr Op Oncol. 2009;21:425–32.
24. Schneider A. The sentinel concept in patients with cervical cancer. J Surg Oncol. 2007;96:337–41
25. Gortzak-Uzan L, Jimenez W, Nofech-Mozes S, Ismiil N, Khalifa MA, et al. Sentinel lymph node biopsy vs. pelvic lymphadenectomy in early stage cervical cancer: is it time to change the gold standard? Gynecol Oncol. 2010;116:28-32.
26. Dargent D, Martin X, Mathevet P. Laparoscopic assessment of the sentinel lymph node in early stage cervical cancer. Gynecol Oncol. 2000;79:411-5.
27. Yuan S, Liang L, Liu J, Zhang HZ, Xiong Y, Yan XJ, Wei M, Zhang CQ. Sentinel lymph node identification with methylene blue in cervical cancer. Ai Zheng. 2004;23:1089- 92.
28. Altgassen C, Hertel H, Brandstadt A, Kohler C, Durst M, Schneider A. Multicenter validation study of the sentinel lymph node concept in cervical cancer: AGO Study Group. J Clin Oncol. 2008;26:2943-51.
29. El-Ghobashy AE, Saidi SA. Sentinel lymph node sampling in gynaecological cancers: techniques and clinical applications. Eur J Surg Oncol. 2009;35:675–85.
30. Levenback C. Update on sentinel lymph node biopsy in gynecologic cancers. Gynecol Oncol. 2008;111:S42–S43.
31. Simmons R, Thevarajah S, Brennan MB , Christos P, Osborne M. Methylene blue dye as an alternative to isosulfan blue dye for sentinel lymph node localization. Ann Surg Oncol. 2003;10(3):242–7.
32. Martínez-Palones JM, Gil-Moreno A, Pérez-Benavente M, Roca I, Xercavins J. Intraoperative sentinel node identification in early stage cervical cancer using a combination of radiolabeled albumin injection and isosulfan blue dye injection. Gynecol Oncol. 2004;92:845–50.
33. Kara PP, Ayhan A, Caner B, Gültekin M, Ugur O, Bozkurt MF, Usubutun A. Sentinel lymph node detection in early stage cervical cancer: a prospective study comparing preoperative lymphoscintigraphy, intraoperative gammaprobe, and blue dye. Ann Nucl Med. 2008;22(6):487–94.
34. van de Lande J, Torrenga B, Raijmakers PG, Hoekstra OS, van Baal MW, et al. Sentinel lymph node detection in early stage uterine cervix carcinoma: a systematic review. Gynecol Oncol. 2007;106(3):604– 13.
35. OBoyle JD, Coleman RL, Bernstein SG, Lifshitz S, Muller CY, Miller DS. Intraoperative lymphatic mapping in cervix cancer patients undergoing radical hysterectomy: a pilot study. Gynecol Oncol. 2000;79:238-43
36. Popa I, Plante M, Renaud MC, Roy M, Têtu B. Negative sentinel lymph node accurately predicts negative status of pelvic lymph nodes in uterine cervix carcinoma. Gynecol Oncol. 2006;103(2):649–53.
37. Oawa S, Kobayashi H, Amada S, Yahata S. Sonoda K, Kaku T, Wake N. Sentinel node detection with 99mTc phytate alone is satisfactory for cervical cancer patients undergoing radical hysterectomy and pelvic lymphadenectomy. Int J Clin Oncol. 2010;15(1):52–58
Correspondencia:
Dr. Henry Valdivia
Departamento de Cirugía Ginecológica,
Instituto Nacional de Enfermedades Neoplásicas
Av. Angamos Este 2520, Lima-33, Perú.
Teléfono (511) 2016500 anexo 2224.
Correo electrónico: henryvaldiviaf@hotmail.com
Artículo recibido el 23 de enero de 2012
Aceptado para publicación el 3 de febrero de 2012.













