Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. v.58 n.1 Lima 2012
ARTÍCULO ORIGINAL
Curvas de crecimiento personalizadas para optimizar el diagnóstico de restricción de crecimiento intrauterino
Costumized growth curves for intrauterine growth restriction diagnosis optimization
Oswaldo Tipiani-Rodríguez1,2
1 Hospital Nacional Edgardo Rebagliati Martins, EsSalud, Lima, Perú
2 Clínica Médica Cayetano Heredia, Lima, Perú
Resumen
Introducción: Los fetos con restricción de crecimiento intrauterino (RCIU) tienen riesgo alto de morbimortalidad perinatal y existe mucha dificultad para diferenciarlos de los pequeños para la edad gestacional (PEG), debido a que incluso la ecografía Doppler tiene limitaciones al respecto. Se ha planteado que las curvas de crecimiento personalizadas podrían esclarecer esta disyuntiva. Objetivos: Diseñar un software con curvas de crecimiento personalizadas para optimizar el diagnóstico de RCIU en EsSalud. Diseño: estudio comparativo, observacional y descriptivo. Institución: Hospital Edgardo Rebagliati Martins (HNERM), EsSalud, Lima, Perú. Participantes: Gestantes y sus fetos y recién nacidos. Metodología: Se construyó una curva de crecimiento con mediciones ultrasónicas de fetos de gestantes del HNERM cuyo peso se conoció al nacimiento y, en base a esta, se diseñó un software con curvas personalizadas. Se usó t de student, ANOVA y pruebas no paramétricas para el estudio estadístico y se consideró p<0,05 para la significancia. Principales medidas de resultados: Curva de crecimiento fetal personalizada. Resultados: Se seleccionó 29 239 recién nacidos, atendidos entre 2003 y 2010. El peso neonatal estuvo influido por la talla materna, el peso pregestacional, la edad materna (ANOVA: F=3,8; F= 214,7 y F=11,2, respectivamente; p<0,05), el sexo fetal masculino y la multiparidad (t de student; p<0,001). Se diseñó un software, basado en estos parámetros, para la predicción del peso fetal para cada semana gestacional. Conclusiones: Se diseñó un software con curvas de crecimiento intrauterino personalizadas para optimizar el diagnóstico de fetos con RCIU, en EsSalud.
Palabras clave: Curva de crecimiento intrauterino personalizada, restricción de crecimiento intrauterino, EsSalud, software.
Abstract
Background: Fetuses with intrauterine growth restriction (IUGR) are at high risk of perinatal morbidity and mortality and there is much difficulty to differentiate fetuses with IUGR from those small for gestational age (SGA), because even Doppler ultrasound has limitations in this regard. It has been suggested that customized growth curves could shed light on this dilemma. Objectives: To design a customized growth curves software to optimize IUGR diagnosis at EsSalud. Design: Comparative, observational and descriptive study. Setting: Hospital Edgardo Rebagliati Martins (HNERM), EsSalud, Lima, Peru. Participants: Pregnant women and their fetuses and newborns. Methods: An intrauterine growth curve was constructed with ultrasound fetal measurements born and newborn weight recorded at HNERM and, based on this a customized growth curves software was designed. Students t, ANOVA and non-parametric tests were used. Differences were considered significant when p <0.05. Main outcome measures: Customized fetal growth curve. Results: We selected 29 239 newborns between 2003 and 2010. Neonatal weight was found to be influenced by maternal height, pre-gestational weight, maternal age (ANOVA: F= 3.8; F= 214.7; and F=11.2 respectively; p<0,05), male fetal sex and multiparity (student t test, p<0,001). Software was designed based on these parameters for predicting fetal weight for each gestational week. Conclusions: Customized fetal growth curves software was designed in order to optimize IUGR fetuses diagnosis at EsSalud.
Key words: Customized growth curves, intrauterine growth restriction, EsSalud, software.
INTRODUCCIÓN
La restricción de crecimiento intrauterino (RCIU) es definida como el fracaso del feto para alcanzar su potencial de crecimiento(1). Es el factor más comúnmente identificado en los bebés nacidos muertos(2). Se asocia con mayor riesgo de nacimiento prematuro, con incremento de su morbilidad, incluyendo enterocolitis necrotizante, lesión cerebral hipóxica y sus secuelas a largo plazo, con la necesidad de asistencia respiratoria, enfermedad pulmonar crónica y retinopatía del prematuro(3). En la vida futura, los niños con restricción de crecimiento tienen mayor riesgo de obesidad, diabetes, insuficiencia renal y enfermedad isquémica del corazón(4-6).
Debido a que aún no es posible determinar cuáles fetos no expresan su potencial de crecimiento, la definición clínica aceptada en consenso considera que un neonato con un ponderado ubicado por debajo del percentil 10 para su edad gestacional tiene el crecimiento restringido, debido a que esta población concentra mayor riesgo de muerte y de enfermedad (7,8).
Sin embargo, de acuerdo con esto, la mayoría de los casos de restricción del crecimiento también es pequeño para la edad gestacional (PEG), lo cual induce a error, puesto que no todos los bebés pequeños tienen RCIU y no todos los fetos con restricción del crecimiento son PEG (9). Por lo tanto, la diferenciación entre el RCIU y PEG representa un gran desafío en la obstetricia moderna, puesto que su vigilancia y manejo es diferente.
La ecografía Doppler es usada como herramienta de distinción entre estos casos, ya que la mayoría de fetos con restricción del crecimiento real responden a insuficiencia placentaria (10). Por tanto, el estudio Doppler de la arteria umbilical es el estándar clínico para distinguir entre fetos que muestran anormalidades de flujo (entonces catalogados como fetos con RCIU) y aquellos con flujometría normal, siendo considerados estos últimos como parte del espectro normal de peso reducido (PEG) (11-13). Sin embargo, la evidencia creciente sugiere que una proporción considerable de fetos con diagnóstico de PEG tiene restricción de crecimiento real, a pesar de mostrar flujometría Doppler normal de la arteria umbilical (13-15). Esto se reafirma con el hecho de que la mayoría de fetos con resultados adversos atribuibles a la restricción del crecimiento se produce en bebés con Doppler umbilical normal (16). Asimismo, la mayoría de fetos en quienes se decide un parto en el tercer trimestre temprano por flujometría Doppler anormal (incluyendo anormalidades del ductus venoso) no presenta acidemia (29).
Por otro lado, aunque es fácilmente deducible, se aplica poco el concepto de que cada feto tiene un potencial de crecimiento de acuerdo con sus características maternas, paternas y fetales. Por ejemplo, el peso de un feto de 38 semanas, producto de madre con 20 años de edad, 50 kg de peso, talla 1,50 m, nulípara y de sexo femenino será muy diferente de uno de 38 semanas de otra madre con 35 años de edad, 90 kg, talla 1,80 m, multípara y de sexo masculino.
Si no consideramos las características maternas ni fetales que influyen en el crecimiento fetal tendremos mucha discrepancia en el manejo de fetos con RCIU. Por ejemplo (como lo señalamos en un estudio nuestro previo)(17), si tenemos el caso de un feto de 38 semanas con un ponderado de 2 800 g, al enfrentarlo con una curva de crecimiento estándar puede tener el diagnostico de adecuado para la edad gestacional (según curva de Lubchenco y curva del MINSA) y RCIU (según curva del HNERM). Entonces, si planteamos un manejo a esta gestante considerando solo las primeras curvas, se descuidaría la vigilancia de un feto con RCIU si la madre pertenece a la población del HNERM.
Sin embargo, al tener en cuenta las características maternas y fetales, ese ponderado puede ser normal en una gestante de 20 años, con 50 kg de peso, talla 1,50 m, nulípara y de sexo femenino, pertenecientes a la población del HNERM.
Por todas estas razones, se ha propuesto que las curvas personalizadas, ajustadas según las características materno-fetales, pueden mejorar la distinción entre pequeños para la edad gestacional y RCIU (27,28). Por ello, nuestro objetivo fue diseñar un software con curvas de crecimiento personalizadas, para optimizar el diagnóstico de RCIU en EsSalud.
MÉTODOS
Se realizó un estudio comparativo, observacional y descriptivo. Se revisó la información materna y de los neonatos cuyo parto fue atendido en el HNERM entre el 1 de enero de 2003 y el 30 de junio de 2010. Se incluyó gestantes con feto único, que tenían entre 24 a 43 semanas de gestación, calculadas por fecha de última regla (FUR) confiable y/o ecografía del primer trimestre. Nuestra fuente fue la base de datos del Servicio de Vigilancia Fetal del mismo hospital. Se excluyó a los neonatos con datos incompletos, a los gemelares, aquellos con malformaciones congénitas mayores y aquellos cuya edad gestacional calculada por evaluación pediátrica difería en dos a más semanas con la calculada con FUR o ecografía del primer trimestre; asimismo, a madres con cualquier patología médica u obstétrica señalada al ingreso o hallada durante su hospitalización (anemia crónica, desnutrición, asma, TBC u otra enfermedad infecciosa, cardiopatías, nefropatías, aquellas con tumores, adicción al tabaco, alcohol o drogas mayores, trastornos de inserción placentaria o desórdenes hipertensivos gestacionales).
Se clasificó los pesos al nacer de acuerdo con sus percentiles. Se construyó una curva de crecimiento intrauterino propia del HNERM con tendencia polinómica de tercer orden.
Para observar la influencia de la talla, peso y edad materna sobre el peso al nacer usamos ANOVA. Dividimos a las gestantes en tres grupos de acuerdo con la talla media ± 2DS: grupo 1 con talla ≤ 1,45 m; grupo 2, entre 1,46 a 1,69 m; y grupo 3, con talla ≥1,70 m. Los pesos maternos pregestacionales fueron agrupados en cuartiles, y la edad fue dividida en tres grupos: menores de 20 años, de 20 a 35 y mayores de 35 años.
Para todos los cálculos, se consideró p<0,05 para la significancia estadística. Los datos fueron procesados en SPSS versión 17 y Microsoft Excel.
RESULTADOS
De 54 187 partos atendidos en el HNERM en el periodo considerado para nuestro estudio seleccionamos 29 259 recién nacidos, quienes cumplían los criterios de inclusión y de exclusión. Hubo un número reducido de muestra (menos de 5 para cada grupo) en gestaciones menores de 30 semanas, por lo cual se analizó los datos a partir de ese punto de corte (n=29 239). Se clasificó los pesos al nacer de acuerdo con sus percentiles y según la edad gestacional, observando una relación directa entre ambos (tabla 1). Se obtuvo los percentiles 2,5; 5; 10; 50 y 90 desde las 34 a 42 semanas de gestación. Asimismo, se construyó una curva de crecimiento intrauterino (figura 1).
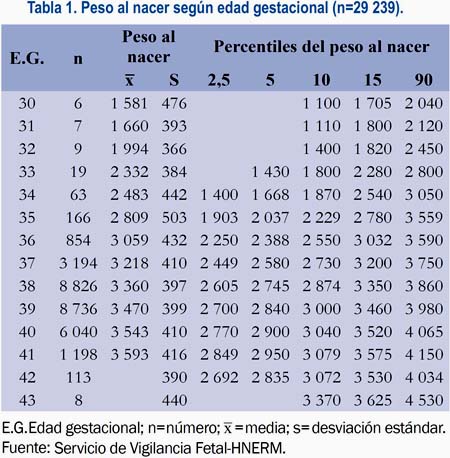
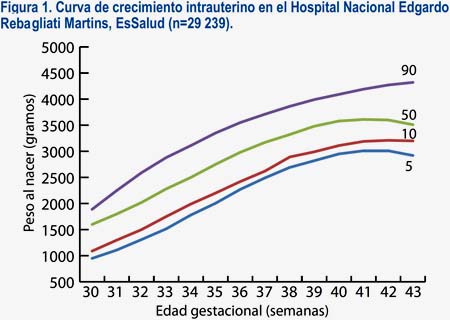
Se observó que a mayor talla (ANOVA: F= 3,82; p= 0,02), peso (ANOVA: F=214,7; p< 0, 001) y edad materna (ANOVA: F= 11,2; P< 0,001) se obtiene mayores pesos al nacer (p<0,05 por Tukey entre todos los grupos).
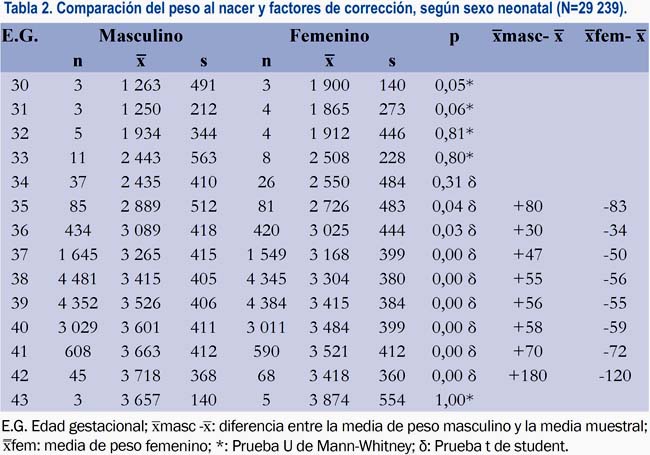
Asimismo, los neonatos masculinos tenían significativamente más peso que los femeninos (tabla 2), así como las multíparas más que las nulíparas (tabla 3).
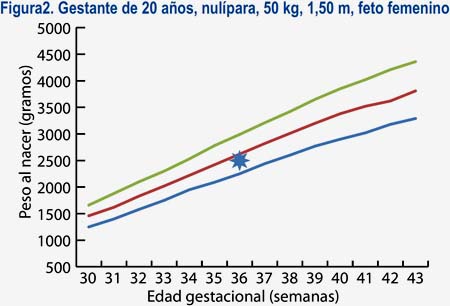
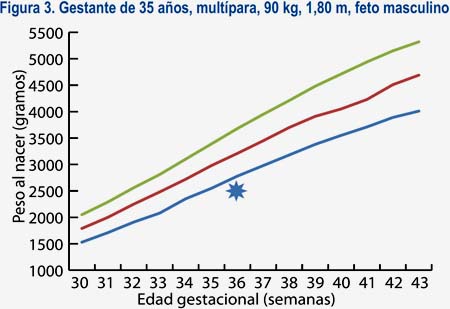
En base a estas características, se diseñó un software al cual llamaremos software con curva de crecimiento personalizada (SOCUPE), en el cual, al introducir las características materno-fetales -como la edad, peso, talla y paridad maternas, además del sexo fetal- puede obtenerse una curva de crecimiento para una persona en particular (curva personalizada) (figura 3), de tal modo que puede predecirse el peso esperado ideal para cada semana gestacional y, de este modo, optimizar el diagnóstico de problemas de crecimiento fetal.
Se puede observar, por ejemplo, en la figura 2 que, si estamos frente a un feto de 36 semanas con un ponderado de 2 500 g podríamos tener una conducta conservadora o expectante en el caso de una nulípara joven delgada, puesto que sería un feto adecuado para su edad gestacional (diagnóstico que coincide con las curvas estándares de Lubchenco, del MINSA y del HNERM)(17). Sin embargo, en el caso de una multípara con mayor talla, peso y edad, estaríamos frente a un feto con RCIU (figura 3) y habría que concentrar más recursos para su pronta atención.
DISCUSIÓN
Nuestro estudio demuestra que las curvas de crecimiento intrauterino varían según características materno-fetales como la edad, talla, peso y paridad maternas, además del sexo fetal, y con ella, el diagnóstico de restricción de crecimiento intrauterino, por lo cual el uso de curvas personalizadas podría optimizar el diagnóstico de RCIU.
En muchos de nuestros hospitales se usa patrones clínicos como la altura uterina y/o el percentil del ponderado ecográfico o de la circunferencia abdominal (basados en curvas poblacionales), para decidir una hospitalización por sospecha de RCIU. Sin embargo, en un grupo importante de estas pacientes los estudios fetales resultan normales y estas salen de alta sin complicaciones; y, llegado el momento del parto, sus productos nacen sin problemas mórbidos derivados de su crecimiento. Por tanto, dichas hospitalizaciones pueden producir un incremento de costos hospitalarios, uso de recursos innecesarios y estancia hospitalaria incrementada, sin beneficio perinatal. Viceversa, hay casos en los cuales, de acuerdo con la altura uterina y/o el ponderado ecográfico, el peso fetal es considerado normal según curvas poblacionales estándares, siendo, sin embargo, fetos con RCIU para una madre en particular, y se sufre las consecuencias de morbimortalidad feto-neonatales por disminución de la vigilancia maternofetal.
Por tanto, mediante el ajuste de variaciones individuales materno-fetales, las curvas de crecimiento personalizadas pueden reducir diagnósticos falsos positivos de RCIU (18) y es probable que puedan reducir sobreintervenciones. Por ejemplo, en el Reino Unido, 109 mujeres fueron inducidas por sospecha de RCIU diagnosticado sobre la base de curvas de crecimiento convencionales; sin embargo, la aplicación retroactiva de curvas personalizadas encontró que la mayoría de las inducciones (58%) se hizo en embarazos cuyo peso fetal estaba dentro el rango normal (19).
La principal limitación en nuestro estudio fue el número reducido de neonatos prematuros. Esta limitación es, sin embargo, difícil de salvar, porque es poco probable tener muchos neonatos prematuros sin alguna patología que la haya causado. Es más, el peso, en estos casos, es influido por la causa de la prematuridad(20-23) No obstante, la importancia de contar con curvas como la nuestra radica en que casi el 80% de los neonatos con RCIU nace a término (24).
Finalmente, si bien el uso de curvas hospitalarias propias es muy importante para detectar perinatos en riesgo para una población específica(17), es mucho mejor que el ponderado de cada feto sea calculado con curvas personalizadas para cada caso individual (18,25,26).
En conclusión, se ha diseñado un software con curvas de crecimiento intrauterino personalizadas para optimizar el diagnóstico de fetos con RCIU en EsSalud.
Agradecimientos
Al Ing. Miguel Ángel Cornelio Sánchez y la Ing. Karla Melissa Ramírez Marimón por su importante contribución al presente estudio.
Referencias Bibliográficas
1. Gardosi J, Chang A, Kalyan B , Sahota D, Symonds EM. Customised antenatal growth charts. Lancet. 1992;339(8788):283–7.
2. Gardosi J. Fetal growth: towards an international standard. Ultrasound Obstet Gynecol. 2005;26:112–4.
3. Garite TJ, Clark R, Thorp JA. Intrauterine growth restriction increases morbidity and mortality among premature neonates. Am J Obstet Gynecol. 2004;191:481–7.
4. De Boo HA, Harding JE. The developmental origins of adult disease (Barker) hypothesis. Aust N Z J Obstet Gynaecol. 2006;46:4–14.
5. Barker DJ. Adult consequences of fetal growth restriction. Clin Obstet Gynecol. 2006;49:270–83.
6. Eriksson JG. Epidemiology, genes and the environment: lessons learned from the Helsinki Birth Cohort Study. J Intern Med. 2007;261:418–25.
7. Resnik R. Intrauterine growth restriction. ACOG. Obstet Gynecol. 2002;99:490–6.
8. Frøen JF, Gardosi JO, Thurmann A , Francis A, Stray-Pedersen B. Restricted fetal growth in sudden intrauterine unexplained death. Acta Obstet Gynecol Scand. 2004;83(9):801–7.
9. Lee PA, Chernausek SD, Hokken- Koelega AC, Czernichow P; International Small for Gestational Age Advisory Board. International Small for Gestational Age Advisory Board consensus development conference statement: management of short children born small for gestational age, April 24–October 1, 2001. Pediatrics. 2003;111(6 Pt 1):1253–61.
10. Lackman F, Capewell V, Gagnon R, Richardson B. Fetal umbilical cord oxygen values and birth to placental weight ratio in relation to size at birth. Am J Obstet Gynecol. 2001;185(3):674–82.
11. Royal College of Obstetrics and Gynaecology Green-Top Guidelines: The Investigation and Management of the Small-for-Gestational- Age Fetus. London, RCOG, 2002.
12. SOGC Clinical Practice Guidelines. The use of fetal Doppler in obstetrics. J Obstet Gynecol Can. 2003;25:601–7.
13. Figueras F, Eixarch E, Gratacos E, Gardosi J: Predictiveness of antenatal umbilical artery Doppler for adverse pregnancy outcome in small-for-gestational-age babies according to customised birthweight centiles: population-based study. BJOG. 2008;115(5):590–4.
14. McCowan LM, Harding JE, Stewart AW. Umbilical artery Doppler studies in small for gestational age babies reflect disease severity. BJOG. 2000;107:916–25.
15. Hershkovitz R, Kingdom JC, Geary M, Rodeck CH. Fetal cerebral blood flow redistribution in late gestation: identification of compromise in small fetuses with normal umbilical artery Doppler. Ultrasound Obstet Gynecol. 2000;15(3):209– 12.
16. Chang TC, Robson SC, Spencer JA, Gallivan S. Prediction of perinatal morbidity at term in small fetuses: comparison of fetal growth and Doppler ultrasound. Br J Obstet Gynaecol. 1994;101(5):422–7.
17. Tipiani O, Malaverry H, Páucar M, Romero E, Broncano J, Aquino R, Gamarra R. Curva de crecimiento intrauterino en el Hospital Edgardo Rebagliati Martins y su aplicación en el diagnóstico de restricción de crecimiento intrauterino. Rev Per Ginecol Obstet. 2011;57(2):69-76.
18. Mongelli M, Gardosi J. Reduction of falsepositive diagnosis of fetal growth restriction by application of customized fetal growth standards. Obstet Gynecol. 1996;88:844–8.
19. Dua A, Schram C. An investigation into the applicability of customised charts for the assessment of fetal growth in antenatal population at Blackburn, Lancashire, UK. J Obstet Gynaecol. 2006;26:411–3.
20. Bukowski R, Gahn D, Denning J, Saade G. Impairment of growth in fetuses destined to deliver preterm. Am J Obstet Gynecol. 2001;185:463-7.
21. Gardosi JO. Prematurity and fetal growth restriction. Early Hum Dev. 2005;81:43-9.
22. Morken NH, Kallen K, Jacobsson B. Fetal growth and onset of delivery: a nationwide population-based study of preterm infants. Am J Obstet Gynecol. 2006;195:154-61.
23. Hutcheon JA, Zhang X, Cnattingius S, Kramer MS, Platt RW. Customized birthweight percentiles: does adjusting for maternal characteristics matter? BJOG. 2008;115:1397-404.
24. Boers K. Disproportionate Intrauterine Growth Intervention Trial At Term: DIGITAT. BMC Pregnancy and Childbirth. 2007;7:12-4.
25. Deter RL. Individualized growth assessment: evaluation of growth using each fetus as its own control. Semin Perinatol. 2004;28:23-32.
26. Gardosi J, Chang A, Kalyan B, Sahota D, Symonds EM: Customised antenatal growth charts. Lancet. 1992;339:283-7.
27. Gardosi J, Figueras F, Clausson B, Francis A. The customised growth potential: an international research tool to study the epidemiology of fetal growth. Paediatr Perinat Epidemiol. 2010;25(1): 2–10.
28. Dua A, Schram C. An investigation into the applicability of customised charts for the assessment of fetal growth in antenatal population at Blackburn, Lancashire, UK. J Obstet Gynaecol. 2006;26(5):411–3.
29. Mari G, Hanif F, Treadwell M, Kruger M. Gestational age at delivery and Doppler waveforms in very preterm IUGR fetuses as predictors of perinatal mortality. J Ultrasound Med. 2007;26(5):555-9.
Correspondencia:
Dr. Oswaldo Tipiani Rodríguez
Servicio de Ginecología y Obstetricia
Clínica Médica Cayetano Heredia
Av. Honorio Delgado 370, Urb. Ingeniería, SMP, Lima, Perú
Celular: 997454058
Correo electrónico: oswaldo5tipi@hotmail.com.
Trabajo recibido el 7 de diciembre de 2011
Aceptado para publicación el 20 de enero de 2012.
Trabajo autofinanciado. No existen conflictos de interés.














