Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. v.58 n.3 Lima 2012
SIMPOSIO: INFERTILIDAD
Estimulación ovárica en reproducción asistida
Ovarian estimulation in assisted reproduction
Luis Ernesto Escudero Velando1
1
Director Medico Grupo PRANOR de Reproducción Asistida
Resumen
Existen en la actualidad muchos protocolos que tienen por objeto estimular hormonalmente al ovario en ciclos de fecundación in vitro (FIV), con el objeto de conseguir que este produzca una mayor cantidad de óvulos en un mismo ciclo. El problema está en que inicialmente se producía Correspondencia: una ovulación espontanea y por ello el éxito de los tratamientos era bajo. Hoy en día el uso de análogos de GnRH (agonistas y antagonistas) ha abierto un amplio número de posibilidades y ha mejorado de forma importante el éxito en los tratamientos de reproducción asistida. Este capítulo intenta introducir algunos protocolos de estimulación ovárica actuales y ofrecer una visión en conjunto de las diferentes formas como se puede trabajar este aspecto.
Palabras clave: Fertilización in vitro, estimulación ovárica, hiperestimulación ovárica controlada, antagonistas de GnRH, agonistas de GnRH.
Abstract
In recent times, there have been many protocols developed for ovulation induction in IVF, with the main objective of getting more oocytes in the same cycle without premature luteinization. Nowadays there is a wide variety of medications used for this purpose that have made IVF easier and more successful. In this chapter we try to introduce some of these ovulation induction protocols as well as some alternatives.
Key words: In vitro fertilization, ovarian estimulation, controlled ovarían hyperestimulation, GnRH antagonists, GnRH agonists.
INTRODUCCIÓN
Desde que Edwards y Steptoe reportaran el primer embarazo conseguido luego de una fecundación in vitro, en el año 1978, muchas cosas han cambiado en el campo de la medicina reproductiva. Cuando se consiguió esta hazaña, el tratamiento consistió en inseminarun ovocito conseguido a través de la aspiración del folículo que se produjo en un ciclo natural.
Con el pasar del tiempo, se ha desarrollado diferentes protocolos de estimulación ovárica(1),con la intención de tener un mayor número de ovocitos disponibles en un solo ciclo ovárico y poder trabajar con estos, obteniendo mejores resultados en el laboratorio de fecundación in vitro (FIV). Existe hoy en día una gran variedad de medicamentos disponibles para la estimulación hormonal; con estos se consigue una super ovulación y luego de un proceso que se realiza en el laboratorio son utilizados para los diferentes tratamientos de FIV; ello aporta algunas ventajas importantes; sin embargo, también algunas desventajas.
En este capítulo trataremos de esquematizar el proceso natural del funcionamiento ovárico, repasaremos cuáles son los puntos positivos de la hiper estimulación ovárica y cuáles los negativos, así como también, explicaremos los diferentes protocolos utilizados para conseguir este fin.
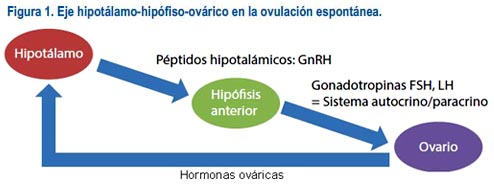
El estimulo ovárico se inicia con acción de la hormona liberadora de gonadotropinas (GnRH), que es un decapéptido de secreción pulsátil y con una vida media muy corta, tanto que no es detectable en la circulación periférica, solo a nivel del sistema portal. Esta hormona actúa sobre la hipófisis anterior y fomenta la liberación, tanto de la hormona folículo estimulante (FSH) como de la hormona luteinizante(LH), ambas de suma importancia en el ciclo ovárico. Por acción de la FSH el ovario consigue reclutar un folículo del grupo de folículos antrales y llevarlo hasta la maduración del mismo; luego, por efecto de la LH este se romperá, con la consecuente ovulación (figura 1).
Existen varios tipos de estimulación ovárica empleados en los diferentes tratamientos de reproducción asistida, tratamientos agrupados como aquellos de baja complejidad y los de alta complejidad. En los tratamientos de baja complejidad se requiere protocolos de estimulación suave o mínima, que lleven a la obtención de no más de cuatro ovocitos, mientras que en los de alta complejidad se requiere de más óvulos, por lo que los tratamientos suelen ser algo más agresivos.
Empezaremos describiendo las opciones de estimulación ovárica considerada como suave o para protocolos de baja complejidad.
CICLO NATURAL
En este manejo no existe tratamiento, ya que consiste en realizar un control ecográfico a lo largo del ciclo ovárico fisiológico de la paciente, viendo el crecimiento folicular único y acompañarlo hasta su desarrollo final. Una vez el folículo alcance los 21 a 23 mm de diámetro medio es conveniente sincronizar la ovulación para poder ajustar el tratamiento indicado a este evento. Para ello se realiza la inducción farmacológica de la ovulación mediante el uso de hormona gonadotropina coriónica (hCG) entre 2 500 y 5 000 unidades.
Para poder realizar este tipo de procedimiento es mandatorio que la paciente tenga ciclos ováricos regulares, ya que de lo contrario no se conseguiría el objetivo deseado con ciclos anovulatorios. La ventaja más importante en este caso consiste en que la respuesta es de un solo folículo (monofolicular), con los que las posibilidades de embarazo múltiple están bastante reducidas; este punto debe ser una prioridad para el médico tratante, ya que los embarazos múltiples deben ser considerados una falla del tratamiento.
PÉRDIDA DE PESO
A través de los años se ha visto que las pacientes con sobrepeso tienen peor pronóstico en lo que respecta a tasas de éxito en tratamientos de reproducción asistida, así como una mayor tasa de abortos en los ciclos de reproducción asistida(2). Las pacientes con sobrepeso y obesidad suelen tener ciclos ováricos irregulares, ya que son en su mayoría ciclos sin ovulación, lo que complica la posibilidad de quedar embarazada de forma natural.
En el caso de las pacientes obesas, es decir, aquellas mujeres con un índice de masa corporal mayor de 30 (IMC >30), según la organización Mundial de la Salud (OMS), la pérdida de 5 a 10% del peso corporal es suficiente para que la paciente recupere su funcionamiento ovárico normal, reiniciando con ciclos menstruales regulares. Además, aquellas que requieran de tratamientos de reproducción asistida (TRA) tendrán mejores resultados a largo y mediano plazo.
Es importante notar que el uso de medicamentos necesarios para la hiperestimulación ovárica, que es fundamental en los TRA, varía de acuerdo al peso de las pacientes; a mayor peso mayor necesidad de medicamentos. Por ello, está claro que las pacientes obesas requieren de mayor dosis. Dado que estas pacientes tienen una importante alteración a nivel hormonal, el uso de dosis altas eleva la posibilidad de desarrollar un síndrome de hiperestimulación ovárica y todas las consecuencias negativas que este problema tiene en las pacientes(3).
El grupo de mujeres obesas con síndrome de ovario poliquístico (SOP) representa el más difícil para tratar. En estas pacientes no solo el riesgo de hiperestimulación es muy elevado, sino que las tasas de éxito dentro de las TRA está disminuida por el impacto negativo a nivel del endometrio(3). Es mandatorio por tanto que las pacientes obesas que van a ingresar a un programa de reproducción asistida se sometan primero al asesoramiento de un grupo de médicos para poder bajar de peso de forma adecuada.
CITRATO DE CLOMIFENO
El citrato de clomifeno (CC) ha sido utilizado para la inducción de ovulación por muchos años. Esta droga funciona como una sustancia antiestrogénica, impidiendo la comunicación normal entre los ovarios y el eje del hipotálamo y la hipófisis. Ya que el receptor de estrógeno se encuentra bloqueado por el medicamento, la hipófisis interpreta un menor nivel sanguíneo de estrógeno y secreta aún más FSH (hormona estimuladora de folículos) para estimular los ovarios. En los casos de pacientes con oligomenorrea (anovulatorios), este mecanismo consigue el crecimiento y desarrollo de un folículo dominante en 70% de las pacientes, con la consecuente ovulación; de este grupo de pacientes, 25a 40% logrará embarazarse(4,5). En las pacientes que van a TRA más complejas, este tratamiento resulta en el reclutamiento y el desarrollo de un mayor número de folículos y eventualmente de una superovulación.
El efecto antiestrogénico del clomifeno también puede afectar la acción del estrógeno que prepara el revestimiento del endometrio y la secreción cervical de moco, así como la disminución adecuada del crecimiento endometrial; sin embargo, el efecto final en estos órganos parece luego del tratamiento haber quedado equilibrado, dado que el efecto negativo del clomifeno es contrarrestado por el aumento en la producción de estrógeno debido a la estimulación ovárica. Es importante por ello una monitorización delendometrio durante el seguimiento de la estimulación ovárica.
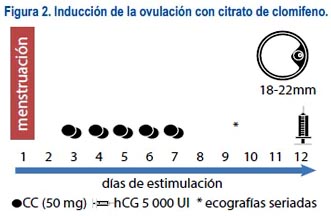
Los protocolos con CC son iniciados en el segundo o tercer día de regla. Lo usual es empezar con dosis bajas (50 mg) por cinco días y reevaluar a la paciente mediante monitoreo ecográfico continuo. Si en el primer ciclo no hay respuesta, la dosis puede aumentarse mes a mes hasta conseguir el objetivo final. Usualmente, las dosis máximas a utilizar llegan a los 150 mgx día de CC, siempre en un máximo de 5 días (figura 2).
A pesar que el uso de citrato de clomifeno es ampliamente conocido, existe un grupo de pacientes en el que este medicamento no produce respuesta. En general, las mujeres con obesidad y con aumento de la resistencia a la insulina, hiperandrogenismo o con nivel basal de LH aumentado, deben recurrir a otro tipo de medicamento para conseguir la ovulación(6,7).
INHIBIDORES DE LA AROMATASA
Los agentes inhibidores de la aromatasa (IA) son medicamentos utilizados como primera línea en el tratamiento del cáncer de mama. Los no esteroideos son activos por vía oral. Actualmente, los más conocidos son el anastrozol, vorozol y letrozol (Femara®). El letrozol es el que se utiliza con mayor frecuencia; actúa por supresión en la producción de estrógenos a nivel central, que se consigue bloqueando la conversión de andrógenos a estrógenos mediante una inhibición en la acción de la aromatasa, que es la hormona encargada de este proceso. Los IA dan el mensaje de falta de estrógenos, con lo que aumentan los andrógenos intrafoliculares y, a su vez, la expresión de los receptores para FSH; esta retroalimentación favorece la producción de gonadotropinas, pero sin tener los efectos adversos antiestrogénicos del CC(8).
Estudios recientes han demostrado gran eficacia en inducir la ovulación y lograr embarazo en mujeres con SOP e inadecuada respuesta alCC, así como, mejorar la respuesta a la FSH en pacientes malas respondedoras(9). La relación de equivalencia de clomifeno a letrozol es de 50mg (CC) a 2,5 mg (letrozol). Los esquemas utilizados con el letrozol son los mismos usados para el clomifeno, comenzando el tercer o quinto día del ciclo menstrual.
En algunos estudios, se ha mostrado la efectividad del letrozol en aquellas pacientes que no responden al CC, así como también, que estos medicamentos al usarse de forma concomitante con las gonadotropinas, mejoran la respuesta ovárica en las pacientes baja respondedoras que en ciclos previos no lograron una adecuada estimulación ovárica(8).
GONADOTROPINAS
Existen diferentes tipos de medicamentos dentro de esta familia, dependiendo básicamente de cómo están constituidos o de su procedencia. Lo que parece claro es que todos ejercen su efecto mediante una acción similar. Los más conocidos son las gonadotropinas menopáusicas humanas (hMG) y las gonadotropinas recombinantes (r-FSH y r-LH), de tecnología más actual. Sin embargo, aún no ha podido demostrarse fehacientemente que medicamentos obtenidos con mayor tecnología desarrollen una mejor respuesta(10,11). Lo único claro es que en casos de gonadotropinas recombinantes, los lotes del producto siempre serán idénticos, mientras que en los casos de gonadotropinas menopáusicas purificadas estos pueden variar ligeramente.
Las gonadotropinas son utilizadas con mayor frecuencia en TRA de alta complejidad, dado que la respuesta ovárica permite un desarrollo folicular múltiple y en casos de fecundación invitro es mejor contar con un mayor número deovocitos disponibles para el tratamiento. Es importante resaltar que estas hormonas empleadas en exceso o sin control pueden desencadenar una respuesta exagerada, llegando a producirse en síndrome de hiperestimulación ovárica(SHO) con todas las complicaciones que de este se derivan(12).
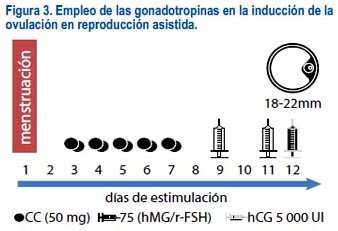
Otro uso de estas drogas es en aquellas pacientes que no responden al CC o al letrozol; en este grupo pueden ser utilizadas como protocolos de estimulación alternativos o como protocolos de rescate (figura 3).
Gonadotrofina menopáusica humana (hMG)
Es una hormona que deriva de la orina de mujeres menopáusicas y que mediante un proceso de purificación permite obtener las hormonas que ahí se encuentran (FSH 75 unidades y LH75 unidades). La industria farmacéutica ha conseguido que estos productos sean cada vez más limpios de impurezas y por tanto más efectivos, controlados y con lotes de producto estandarizados. Actualmente, existen en el mercado dos tipos de hMG, las purificadas y las altamente purificadas (HP), siendo estas las que ofrecen una mejor opción para el tratamiento(13).
En el caso de la hMG, el compuesto tiene tanto FSH como LH y, en teoría, en partes iguales. La idea es que ambas hormonas actúen de forma simultánea. La FSH se encarga de reclutar un mayor número de folículos del grupo de folículos basales y a la vez estimula su crecimiento, mientras que la LH se encarga de la maduración final de los mismos, sin llegar a producir la ovulación. Esto se consigue dado que la LH estaría siendo administrada de forma constante y no permitiendo la aparición del pico de LH necesario para desencadenar la ovulación.
La hMG permite el desarrollo folicular múltiple y su uso debe estar siempre supervisado mediante un control ecográfico estricto, para prevenir el síndrome de hiperestimulación ovárica(SHO) en casos de TRA, así como la posibilidad de un embarazo múltiple en el caso de que se emplee técnicas menos complejas, como la inseminación intrauterina (IIU) o el coito programado (CP). En algunos casos, es conveniente y oportuno pasar a una paciente que inicialmente estaba programada para IIU a técnicas de FIV si presenta una respuesta exagerada al tratamiento(14).
Hormona folículo estimulante (FSH)
En la fisiología del ovario, esta hormona es la responsable del proceso de reclutamiento folicular y del desarrollo del folículo dominante a través del ciclo menstrual. Hay disponibles actualmente en el mercado diferentes tipos de FSH, todas orientadas para su uso en hiperestimulación ovárica controlada. Hay productos de origen urinario (FSH-u, FSH-hp) y otros producidos con tecnología recombinante, es decir, obtenidos en laboratorio mediante el procesamiento de una proteína (r-FSH). La FSH se utiliza de forma habitual en la gran mayoría de protocolos de estimulación ovárica disponibles, tanto la fracción de folitropina α como la folitropina β, ambas con efecto similar(15,16).
Se postula que las pacientes con niveles basales altos de LH no necesitan en principio de esta hormona durante la hiperestimulación ovárica, por lo que estas drogas libres de LH serían las de primer uso. Un ejemplo práctico son las pacientes con síndrome de ovario poliquístico(SOP), donde los niveles de LH basales están por encima de los de FSH.
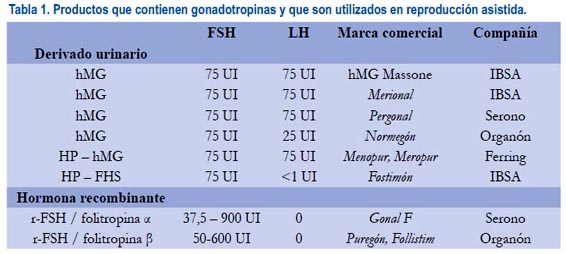
Todos los protocolos empleados en hiperestimulación ovárica emplean algún tipo de hormona de las antes descritas, en algunos casos solos, en otros casos asociadas a un análogo de la GnRH, que puede ser agonista o antagonista(17). Los análogos de la GnRH son medicamentos utilizados para prevenir el pico espontáneo de LH y la ovulación, que afectan la receptividad endometrial por asincronía en los casos donde se realiza protocolos de estimulación ovárica para TRA. Existe en el mercado muchos productos que contienen gonadotropinas y que son utilizados para TRA (tabla 1).
ANÁLOGOS DE LA GNRH
Como explicáramos al inicio de este capítulo, la hormona liberadora de gonadotropinas (GnRH) es un decapéptido de secreción pulsátil con una vida media muy corta, detectable solo a nivel de la circulación portal. Esta hormona actúa sobre la hipófisis anterior e induce la liberación de las gonadotropinas (FSH y LH). Los análogos de GnRH, de acuerdo a su forma de acción, pueden ser agonistas o antagonistas.
En un inicio, los protocolos de estimulación ovárica no empleaban análogos de la GnRH, por lo que se producían alteraciones a nivel de la sincronía del ciclo (luteinización prematura) y las fallas en las TRA eran frecuentes. Existía un 20% de cancelaciones de ciclo y una tasa de embarazo promedio que no superaba el 15%. Hoy en día, estos productos son empleados en la gran mayoría de ciclos de estimulación ovárica en TRA; sin embargo, a pesar de su uso rutinario, la luteinización prematura es un evento aún presente que afecta el éxito de los tratamientos iniciados. Según diversos estudios, se ha visto que se produce en 5 a 35% de los ciclos con agonistas(18,19) y en 5 a 20% de los ciclos con antagonistas(20). Con relación a luteinización prematura parcial (elevación de progesterona sin LH), se describe tasas de 38% para los casos de antagonistas(21).
Agonistas de GnRh
Los agonistas de GnRH son hormonas con una constitución similar a la GnRH endógena y que actúan mediante un sistema de desensibilización. La desensibilización es un conjunto de fenómenos que determinan la pérdida por parte de la célula gonadotropa hipofisiaria de su capacidad secretora de gonadotropinas, al ser estimulada por la GnRH de forma continua.
Ejercen su acción se mediante la unión a los receptores de GnRH presentes en la superficie de la hipófisis anterior; es decir, el análogo de GnRH administrado activa mediante la unión con su receptor la liberación de gonadotropinas(efecto flare-up), pero al ser estos administrados de forma continua, terminan por copar los receptores disponibles, saturándolos y dejándolos ocupados (figura 4A). Al liberarse la hormona GnRH endógena en forma de pulsos, encuentra todos los receptores tomados y no tiene cómo ejercer su acción; de esta forma queda inhibida la liberación de las gonadotropinas (LH y FSH) de la hipófisis anterior (figura 4B).
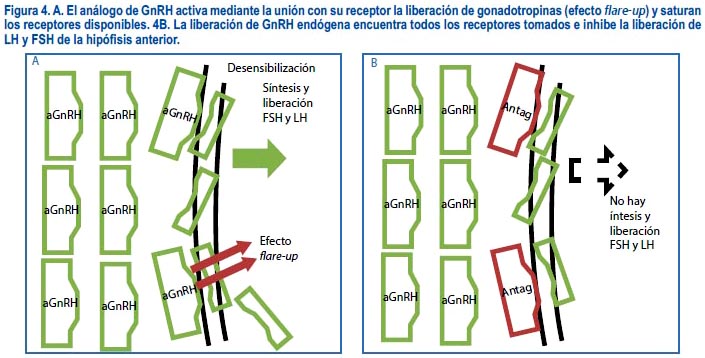
Se emplea los agonistas en TRA desde hace muchos años con resultados bastante buenos; tienen como una ventaja importante su fácil uso y control durante el ciclo de estimulación ovárica en casi todo tipo de pacientes. Es importante destacar el efecto flare-up que producen los agonistas de GnRH; esto quiere decir que al iniciarse su administración se produce una liberación hormonal de gonadotropinas endógenas y estas ejercen su acción en la folículo-génesis inicial; por ello, en la mayoría de ciclos, el agonista se inicia una a dos semanas antes de que termine el ciclo menstrual (antes de la regla) y comience el nuevo periodo menstrual, y con este la estimulación ovárica. El éxito de este tratamiento radica en evitar la elevación de la progesterona previamente a la colocación de la hCG para maduración ovocitaria final, aunque en algunos casos a pesar de que esto suceda igual puede conseguirse el embarazo(22).
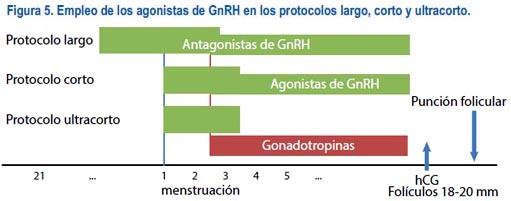
Los agonistas tienen algunos efectos negativos. El más importante es la necesidad de inyectarse el producto por un número prolongado de días, con toda la incomodidad que esto genera en las pacientes, ya que al ser una droga que actúa por desensibilización requiere de una a dos semanas para ejercer su efecto de forma adecuada. Como consecuencia de este efecto, si deseamos que el ovario recobre su función normal, debemos descontinuar el producto y esperar en algunos casos hasta seis semanas. Dentro de las opciones de tratamiento están los protocolos largos, cortos y los ultracortos. En todos se utiliza el fármaco diariamente; la diferencia radica en el momento en que se inicia el agonista y en algunos casos en la dosis que se emplea. Cuando se realiza protocolos largos, se inicia el agonista de GnRH el día 21 del ciclo previo al tratamiento; se emplea de forma diaria hasta el final de la estimulación.
Es importante notar que la dosis inicial se reduce a la mitad una vez se inicia el estimulo con las gonadotropinas. En el caso de protocolos cortos y ultracortos, el agonista se inicia el primer o segundo día del ciclo menstrual y las gonadotropinas al día siguiente; si el esquema es corto, luego de tres días se baja la dosis a la mitad y se continúa hasta el final de la estimulación; si es ultracorto, solo se le emplea por tres días (figura 5).
Existen en el mercado, muchos tipos de agonistas de GnRH. En el Perú, son dos los de mayor uso, los que contienen acetato de leuprorelina (Luprón, Lorelina) y los de triptorelina (Decapeptyl). Ambos son empleados en los ciclos de estimulación ovárica de forma similar.
Antagonistas de GnRH
Los antagonistas de GnRH son hormonas que actúan mediante un sistema de bloqueo competitivo de los receptores para GnRH presentes en la superficie de la hipófisis anterior (figura 4B); de esta forma se bloquea la producción de gonadotropinas (FSH y LH) de forma directa. A diferencia de los agonistas, no requieren de un periodo de desensibilización; su acción es inmediata y su vida media muy corta. Al actuar bajo inhibición competitiva de los receptores de GnRH, no existe una activación de los mismos y por lo tanto no se produce el efecto flare-up que se ha descrito con el uso de los agonistas(23).
Los antagonistas fueron descubiertos hace muchos años, pero su uso se asociaba con efectos adversos severos (alergias), por lo que su uso quedó en el olvido. Es recién a partir de la década de los 90s(24), con la introducción de los antagonistas de tercera generación, que son empleados con mayor frecuencia en ciclos de hiperestimulación ovárica. La principal ventaja de estos compuestos es la forma rápida de acción y el mecanismo de acción directa, que evita el pico prematuro de LH; además de otros beneficios, como el empleo de menos días de medicamento, que lo convierte en un protocolo más amigable y mejor aceptado(25).
Existen dos protocolos para el uso de los antagonistas, dependiendo de la dosis que se emplee. Pueden ser de uso por depósito (una sola inyección), en dosis de 3 mg, o en dosis diaria de 0,25 mg(26). Actualmente, este último es el más empleado. En ambos casos, la estimulación con gonadotropinas se inicia el segundo día del ciclo y la hCG empleada para inducción de ovulación se coloca con folículos de 17 a 18 mm de diámetro. En el caso de usar antagonistas de forma diaria, se les coloca el mismo día de la hCG, a la misma hora, aunque algunos grupos prefieren colocarlo 12 horas antes (figura 6).

En el 2003 presentamos en el congreso de la ESHRE en Viena (presentación oral), y luego se publicó en Fertility and Sterility, un estudio sobre el uso de antagonistas en forma diaria(27). En este estudio, se comparaba dos alternativas de uso del medicamento, variando en el día de inicio. El antagonista (0,25 mg) podía ser iniciado cuando el folículo mayor medía 14 mm de diámetro medio o iniciarse de forma fija, siempre en el mismo día (día 6 del ciclo de estimulación), independientemente de la medida folicular. Como conclusión de este trabajo y otros similares que iban en la misma línea, actualmente la mayoría de protocolos emplea el antagonista diario (0,25 mg) de forma individualizada, es decir, inician su uso cuando el folículo mayor tiene entre 13 y 14 mm de diámetro medio.
INDUCTORES DE LA OVULACIÓN
Para que los ciclos de estimulación ovárica resulten satisfactorios, es necesario que los ovocitos obtenidos se encuentren maduros (metafase II);en este sentido, el estímulo que produce la liberación de LH, conocido como pico preovulatorio, es indispensable para que los eventos se den deforma adecuada. Antiguamente se buscaba identificar el pico endógeno de LH, pero esto resultaba muy complicado y poco efectivo. Actualmente se intenta reproducir este evento, mediante la administración de hormona gonadotropina coriónica (hCG), ya que esta tiene una constitución muy similar a la LH y alcanza a actuar sobre los receptores de esta, produciendo el mismo efecto.
El momento de aplicación de la hCG varía de acuerdo al tipo de ciclo de estimulación ovárica que se esté llevando a cabo. Los parámetros clásicos están determinados para los ciclos en los que se emplea agonistas de GnRH y son:
-
Por ecografía: folículo mayor entre 18 y 20mm de diámetro medio.
-
Por análisis de sangre: estradiol en suero >200 pg/mL (x cada fol. > de 17 mm).
En los casos de uso de antagonistas de GnRH, el valor del estradiol no puede ser empleado como referencia debido a una gran variación en el mismo con el uso de este tipo de medicamento(27), por lo que se emplea como valor referencial el diámetro medio del folículo mayor, debiendo estar este entre 17 y 18mm. En los casos en los que no se emplea ningún tipo de análogo de GnRh, el uso de la hCG debe ser antes que en los casos anteriores.
La hCG actúa en promedio a las 37 o 39 horas luego de haber sido colocada, por lo que la aspiración folicular debe realizarse entre 35 y36 horas luego de su aplicación. En el mercado existen hormonas con dosis de 2 500 a 10 000 UI de hCG urinaria. Actualmente, también se dispone de hCG recombinante que produce el mismo efecto, pero que tiene una forma de aplicación bastante más sencilla.
CONCLUSIONES
Cuando se habla de protocolos de estimulación ovárica, lo más importante resulta identificar adecuadamente el tipo de tratamiento que se va a realizar y el tipo de paciente a la que se va a tratar. Existen muchas opciones, pero es menester del médico tratante identificar la más adecuada. No debemos olvidar que cada paciente tiene condiciones distintas y muchas veces lo que funciona para una paciente puede no funcionar para otra.
Se debe hacer una buena historia clínica y es necesario recabar toda la información posible sobre los problemas que la paciente y su pareja traigan como motivo de consulta. Solo así se podrá decidir el mejor tratamiento, debiendo tener en cuenta que este siempre será individualizado.
REFERENCIAS BIBLIOGRÁFICAS
1. Jones HW, Jones GS, Andrews MC, Acosta A, Bundren C, et al. The program for in vitro fertilization at Norfolk. Fertil Steril. 1982;38(1):14-21.
2. Bellver J, Busso C, Pellicer A, Remohí J, Simón C. Obesity and assisted reproductive technology outcomes. Reprod Biomed Online. 2006;12(5):562-8.
3. Bellver J, Martínez-Conejero JA, Labarta E, Alamá P, Melo MA, Remohí J, Pellicer A, Horcajadas JA. Endometrial gene expression in the window of implantation is altered in obese women especially in association with polycystic ovary syndrome. Fertil Steril. 2011;95(7):2335-41.
4. Gysler M, March CM, Mishell DR Jr, Bailey EJ. A decade's experience with an individualized clomiphene treatment regimen including its effect on the postcoital test. Fertil Steril. 1982;37(2):161-7.
5. Imani B, Eijkemans MJ, te Velde ER, Habbema JD, Fauser BC. A nomogram to predict the probability of live birth after clomiphene citrate induction of ovulation in normogonadotropic oligoamenorrheic infertility. Fertil Steril. 2002;77(1):91-7.
6. Imani B, Eijkemans MJ, te Velde ER, Habbema JD, Fauser BC. Predictors of patients remaining anovulatory during clomiphene citrate induction of ovulation in normogonadotropic oligoamenorrheic infertility. J Clin Endocrinol Metab. 1998;83(7):2361-5.
7. Homburg R, Armar NA, Eshel A, Adams J, Jacobs HS. Influence of serum luteinising hormone concentrations on ovulation, conception, and early pregnancy loss in polycystic ovary syndrome. BMJ. 1988;297(6655):1024-6.
8. Mitwally MF, Casper RF. Use of an aromatase inhibitor for induction of ovulation in patients with inadequate response to clomiphene citrate. Fertil Steril 2011;75:305-9.
9. Holzer H, Casper R, Tulandi T. A new era in ovulation induction. Fertil Steril. 2006;85:277-84.
10. Bagratee JS, Lockwood G, Lópz-Bernal A, Barlow DH, Ledger WL. Comparison of highly purified FSH (metrodinhigh purity) with pergonal for IVF superovulation. J Assist Reprod Genet. 1998;15(2):65-9.
11. Filicori M, Cognigni GE, Pocognoli P, Tabarelli C, Fertini F, Perri T, Parmegiani L. Comparison of controlled ovarian stimulation with human menopausal gonadotropin or recombinant follicle-stimulating hormone. Fertil Steril. 2003;80(2):390-7.
12. Bellver J, Escudero E, Pellicer A. Ovarian mutilating surgery is not an option in the management of severe ovarian hyperstimulation syndrome (OHSS). Hum Reprod. 2003;18(7):1363-7. DEBATE–continued. Sobre el artículo: Amarin ZO. Bilateral partial oophorectomy in the management of severe ovarian hyperstimulation syndrome (OHSS). An aggressive, but perhaps life-saving procedure. Hum Reprod. 2203;18:1-6.
13. Westergaard LG, Erb K, Laursen S, Rasmussen PE, Rex S. The effect of human menopausal gonadotrophin and highly purified urine-derived follicle stimulating hormone on the outcome of in-vitro fertilization in down regulated women. Human Reprod. 1996;11(6):1209-13.
14. Many A, Azem F, Lessing JB; Yovel I, Yavetz H, Amit A. Pregnancy rate in IVF rescue in high responders to human menopausal gonadotropin. J Assist Reprod Genet. 1999;16(10): 520-2.
15. Brinsden P, Akagbosu F, Gibbons LM, Lancaster S, Gourdon D, Engrand P, Loumaye E. A comparison of the efficacy and tolerability of two recombinant human follicle-stimulating hormone preparations in patients undergoing in vitro fertilization-embryo transfer. Fertil Steril. 2000;73(1):114-6
16. Harlin J, Csemiczky G, Wramsby H, Fried G. Recombinant follicle stimulating hormone in in vitro fertilization treatment-clinical experience with follitropin alpha and follitropin beta. Hum Reprod. 2000;15(2): 239-44.
17. Jennings JC, Moreland K, Peterson CM. In vitro fertilization: A review of drug therapy and clinical management. Drugs. 1996;52(3):313-43.
18. Edelstein MC, Seltman HJ, Cox BJ, Robinson SM, Shaw RA, Muasher SJ. Progesterone levels on day of human chorionic gonadotropin administration in cycles with gonadotropin-releasing hormone agonist suppression are not predictive of pregnancy outcome. Fertil Steril. 1990;54(5):853-7.
19. Silverberg KM, Burns WN, Olive DL, Riehl RM, Schenken RS. Serum progesterone levels predict success of in vitro fertilization/embryo transfer in patients stimulated with leuprolide acetate and human menopausal gonadotropins. J Clin Endocrinol Metab. 1991;73(4):797-803.
20. Ubaldi F, Albano C, Peukert M, Riethmuller-Winzen H, Smitz J, Van Steirteghem A, Devroey P. Subtle progesterone rise after the administration of the gonadotrophin-releasing hormone antagonist cetrorelix in intracytoplasmic sperm injection cycles. Hum Reprod. 1996;11(7):1405-7.
21. Bosch E, Valencia I, Escudero E, Crespo J, Simón C, Remohí J, Pellicer A. Premature luteinization during gonadotropin-releasing hormone antagonist cycles and its relationship with in vitro fertilization outcome. Fertil Steril. 2003;80(6):1444-9.
22. Ubaldi F, Smitz J, Bourgain C, Van Steirteghem A, Devroey P. Pregnancy and birth after high serum progesterone concentrations during follicular phase in an in-vitro fertilization cycle with gonadotrophin-releasing hormone agonist suppression. Hum Reprod. 1995;10(1):211-3.
23. Olivennes F, Freedman R. Friendly IVF: the way of the future? Hum Reprod 1998;13:1121-4.
24. Frydman R, Cornel C, de Ziegler D, Taieb J, Spitz IM, Bouchard P. Prevention of premature luteinizing hormone and progesterone rise with a gonadotropin-releasing hormone antagonist, Nal-Glu, in controlled ovarian hyperstimulation. Fertil Steril. 1991; 56: 923-7.
25. Olivennes F, Cunha-Filho JS, Fanchin R, Bouchard P, Frydman R. The use of GnRH antagonists in ovarian stimulation. Hum Reprod Update 2002;8:279-90.
26. Ganirelix dose-finding study group. A double-blind, randomized, dose-finding study to assess the efficacy of the GnRH antagonist ganirelix to prevent premature LH surges in women undergoing controlled ovarian stimulation with recombinant FSH. Human Reprod 1998;13:3023-31.
27. Escudero E, Bosch E, Crespo J, Simón C, Remohí J, Pellicer A. Comparison of two different multiple dose gonadotropin-releasing hormone antagonist protocols in a selected group of in vitro fertilization-embryo transfer patients. Fertil Steril. 2004;81(3):562-6.
Correspondencia
Dr. Luis Ernesto Escudero V.
Correo electrónico: ernestoescudero@fertilidadperu.com













