Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. v.58 n.4 Lima 2012
SIMPOSIO: ANEMIA
Fisiopatología e impacto de la deficiencia de hierro y la anemia en las mujeres gestantes y en los recién nacidos/infantes
Physiopathology and impact of iron deficiency and anemia in the pregnant women and newborn/infant
Nils Milman1
1 Senior Consultant, Department of Obstetrics, Næstved Hospital, University of Copenhagen, Næstved, Denmark
Resumen
La deficiencia de hierro es el trastorno de deficiencia más prevalente; y la anemia por deficiencia de hierro es la forma de anemia más frecuente en las mujeres gestantes. Son causas menores de la anemia la deficiencia de folato y de la vitamina B12; así como las hemoglobinopatías y la anemia hemolítica. Se define a la anemia como niveles de hemoglobina <110 g/L en el primer y en el tercer trimestre y <105 g/L en el segundo trimestre de la gestación. El diagnóstico se basa en la medición de los valores de la hemoglobina, así como en un perfil hematológico completo y la determinación de los niveles plasmáticos de ferritina, los cuales pueden sustentarse en la saturación de la transferrina en el plasma y el receptor soluble de transferrina en el suero (sTfR, soluble transferrin receptor). En las mujeres no gestantes en edad reproductiva, un 40% tiene valores de ferritina por debajo de 30 μg/L, lo cual indica que las reservas de hierro o son pequeñas o están ausentes; y, en consecuencia, tienen un pobre nivel del hierro con respecto a un embarazo futuro. Los requerimientos para la absorción del hierro aumentan durante la gestación, de 0,8 mg/día en el primer trimestre a 7,5 mg/día en el tercer trimestre, siendo el promedio 4,4 mg/día. En cuanto a la edad reproductiva, un 40% de las mujeres en Escandinavia y posiblemente hasta un 80% de las mujeres peruanas (dependiendo de su condición social y su lugar de residencia) tienen niveles bajos de hierro con respecto a un embarazo futuro. En el Perú, la prevalencia de la anemia en las mujeres no gestantes de edad reproductiva es 22%, y en las mujeres gestantes es de 27%. La prevalencia de la anemia en el tercer trimestre puede variar desde 14 hasta 52% en las mujeres que no toman suplementos de hierro (dependiendo del país y de la condición social); y de 0 a 25% en las mujeres que toman suplementos de hierro (dependiendo de las dosis del citado elemento). La deficiencia de hierro y la anemia poseen consecuencias severas en las mujeres gestantes, estando asociadas con una menor capacidad para trabajar, fatiga, debilidad y disturbios psíquicos, condiciones que en su totalidad afectan la calidad de vida tanto a nivel físico como psíquico. En el feto/en el recién nacido la deficiencia de hierro puede tener consecuencias serias para el desarrollo de las funciones cerebrales. Incrementa la prevalencia de nacimientos prematuros y la frecuencia de peso bajo al nacer, así como la mortalidad perinatal. Los niños nacidos de madres con deficiencia de hierro tienen un menor desarrollo cognitivo, motor, socio-emocional y neurofisiológico, así como menores valores del cociente de inteligencia en comparación con los infantes y niños nacidos de madres con niveles normales de hierro. La anemia por deficiencia de hierro posee consecuencias serias en las mujeres y en los fetos/neonatos; y requiere una intervención eficiente con una profilaxis y/o tratamiento con hierro. En el futuro, los sistemas de cuidado de la salud prenatal deberán dedicar más esfuerzos para erradicar este problema tan significativo.
Palabras clave: Anemia; deficiencia de hierro; embarazo.
Abstract
Iron deficiency is the most prevalent deficiency disorder and iron deficiency anemia the most frequent form of anemia in pregnant women. Minor causes of anemia are folate and vitamin B12 deficiency, hemoglobinopathy and hemolytic anemia. Anemia is defined as hemoglobin <110 g/L in 1st and 3rd trimester and <105 g/L in 2nd trimester. The diagnosis relies on analysis of hemoglobin, a full blood count and plasma ferritin, which can be supported by plasma transferrin saturation and serum soluble transferrin receptor (sTfR). Among non-pregnant women of reproductive age, 40% have ferritin below 30 μg/L, which indicates small or absent iron reserves and therefore a poor iron status with respect to future pregnancy. Requirements for absorbed iron increase during pregnancy from 0.8 mg/day in 1st trimester to 7.5 mg/day in 3rd trimester, on the average 4.4 mg/day. Among women of reproductive age, 40% of Scandinavian and possibly up to 80% of Peruvian women (depending of social status and residence) have a poor iron status with respect to future pregnancy. In Peru, the prevalence of anemia in non-pregnant women of reproductive age is 22%, and in pregnant women 27%. The prevalence of anemia in the 3rd trimester may vary from 14 to 52% in women not taking iron supplements (depending on country and social status) and from 0 to 25% in women taking iron supplements (depending on the dose of iron). Iron deficiency and anemia has severe implications for pregnant women, being associated with decreased work capacity, fatigue, weakness and psychic dysfunctions, which all impair the quality of life both on the physical and psychical level. In the fetus/newborn infant iron deficiency may have serious consequences for development of brain functions. It increases the prevalence of premature birth and the frequency of low birth weight as well as the perinatal mortality. Children born to iron deficient mothers have poorer cognitive, motor, socialemotional and neurophysiologic development and lower intelligence quotient than infants and children born to iron-replete mothers. Iron deficiency anemia has serious consequences for both women and fetus/newborn infants and requires efficient intervention with iron prophylaxis and/or treatment. In the future, more efforts should be dedicated by the antenatal care health system to eradicate this significant problem.
Key words: anemia; iron deficiency; pregnancy
INTRODUCCIÓN
El hierro es un metal esencial para los seres humanos. Es necesario para la síntesis de la hemoglobina en los glóbulos rojos y en la síntesis de la mioglobina en las células musculares, así como para el funcionamiento de una serie de metaloenzimas vitales que contienen hierro. Es importante tener un balance corporal adecuado de hierro para nuestro bienestar y calidad de vida(1-3). En las mujeres que salen embarazadas, es necesario tener buenos niveles del hierro para una buena evolución del embarazo, para el bienestar de la madre y para un desarrollo normal del feto y la madurez del infante recién nacido. La deficiencia de hierro, aun en la ausencia de anemia por deficiencia de hierro, puede tener un impacto negativo en las mujeres de edad reproductiva, causando deterioro de la capacidad cognitiva y un menor desempeño físico(1,2). En las mujeres que han dado a luz (las puérperas), la anemia por deficiencia de hierro está asociada con inestabilidad emocional, depresión, tensión (estrés) y con un rendimiento bajo en las pruebas para evaluar la función cognitiva(3). Adicionalmente, la anemia por deficiencia de hierro durante el embarazo (anemia preparto) por lo general está asociada con un menor desarrollo cerebral, parto prematuro y bajo peso al nacer, así como en un peso bajo al nacer considerando la edad gestacional del neonato(4-8). Adicionalmente, la anemia por deficiencia de hierro en el preparto predispone al desarrollo de anemia después del parto (anemia posparto)(9,10).
Globalmente, la deficiencia de hierro y la anemia por deficiencia de hierro son los trastornos de deficiencia nutricional más prevalentes en las mujeres de edad reproductiva(11). Sin embargo, existen diferencias mayores en la nutrición con hierro entre las mujeres de los países subdesarrollados y desarrollados. En las regiones de menor desarrollo en el mundo, la anemia por deficiencia de hierro en el preparto es más la regla antes que la excepción, con una prevalencia promedio de aproximadamente 52%, en tanto que en las pudientes sociedades occidentales, la prevalencia es menor debido a una mejor nutrición, aproximadamente un 25% en las mujeres que no toman suplementos de hierro durante el embarazo(11,12) y menos del 5% en las mujeres que toman suplementos de hierro adecuados durante la gestación(12,13). La presente revisión se centrará en la fisiopatología y en las consecuencias de la deficiencia de hierro y la anemia del preparto en las mujeres gestantes y en sus recién nacidos.
¿CÓMO PODEMOS EVALUAR EL ESTADO DEL HIERRO EN LAS MUJERES?
Puede determinarse el estado del hierro en las mujeres antes de la gestación con el uso de los biomarcadores estándar para el hierro, la ferritina plasmática, el hierro en el plasma (en ayunas), los niveles plasmáticos de transferrina y el cálculo de la saturación de transferrina en el plasma, el receptor soluble para transferrina en el suero (sTfR, soluble transferrin receptor) y la hemoglobina en sangre, incluyendo un perfil hematológico completo y los índices de los glóbulos rojos. En las personas saludables, la concentración de ferritina en sangre es un biomarcador para las reservas movilizables de hierro; esto es, el estado del hierro(14,15). En las mujeres no gestantes, una concentración de ferritina en 1 mg/L corresponde a 7 a 8 mg de hierro movilizable( 14). Los niveles de ferritina por debajo de 30 mg/L son consistentes con una pobre condición del hierro; esto es, reservas de hierro pequeñas o ausentes, tal como se verifica con la ausencia de hemosiderina en la médula ósea(15,16). Los valores de ferritina por debajo de 15 mg/L son consistentes con una depleción del hierro; y los niveles por debajo de 12 mg/L están asociados con anemia por deficiencia de hierro(16,17). En las mujeres con trastornos inflamatorios o infecciosos, los niveles plasmáticos de ferritina pueden estar falsamente elevados, fuera de proporción con las reservas corporales de hierro. Si se sospecha la presencia de tales condiciones, también deberán medirse los niveles plasmáticos de la proteína C reactiva, con el fin de evaluar el grado de inflamación.
Se calcula la saturación de la transferrina en el plasma a partir del análisis del hierro en el plasma y de la transferrina plasmática. Una saturación por debajo de 15% indica un suministro inadecuado de hierro a los precursores de los glóbulos rojos y en los tejidos corporales(17).
La superficie de los precursores de los glóbulos rojos (incluyendo a los reticulocitos) está cargada de receptores para transferrina, los cuales aumentan en número durante la deficiencia de hierro(18). Puede medirse la densidad de los receptores libres en el suero como receptores solubles (sTfR). En la presencia de deficiencia de hierro, se observa una elevación en los sTfR del suero. Las mujeres no gestantes y las gestantes con reservas de hierro completas poseen niveles séricos similares de los sTfR(19). Puede emplearse a los sTfR del suero para identificar a las mujeres con niveles bajos de ferritina en el plasma, las cuales adicionalmente tienen una deficiencia pronunciada de hierro(19,20). Aún se utiliza ampliamente la concentración de hemoglobina como único marcador de la deficiencia de hierro. Sin embargo, los niveles de hemoglobina no son apropiados para determinar el estado del hierro - especialmente durante la gestación, en donde las mujeres presentan diversos grados de hemodilución, lo cual posee una influencia marcada en los niveles de la hemoglobina.
En resumen, la ferritina plasmática proporciona información acerca de la capacidad de las reservas corporales de hierro, de los sTfR en el suero y en cierta magnitud, de la saturación de la transferrina en el plasma, genera información acerca de la deficiencia de hierro a nivel celular, en tanto que la hemoglobina proporciona información acerca de la deficiencia de hierro a nivel funcional. Para fines prácticos, los valores de la hemoglobina, determinados en el sistema HemoCueâ o en alguna máquina automática para efectuar dicha medición; por ejemplo, el dispositivo Advia 120â y la ferritina en el plasma son adecuados para evaluar el estado del hierro y diagnosticar la anemia por deficiencia de hierro en la mayoría de las mujeres.
Requerimientos para el aumento en los niveles del hierro durante el embarazo
Durante el embarazo normal, existe un aumento fisiológico drástico en los requerimientos de hierro. Ninguna otra situación fisiológica durante la vida genera tantas demandas en el suministro de hierro. La demanda por el hierro absorbido aumenta, de la demanda obligatoria inicial en 0,85 mg/día durante el primer trimestre a aproximadamente 7,5 mg/día en el tercer trimestre. El requerimiento promedio durante toda la gestación es aproximadamente 4,4 mg/ día(9,21); ver la figura 1.
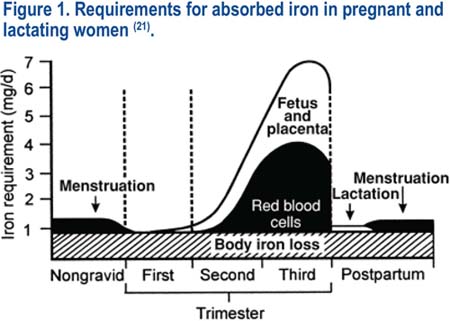
Se ha estimado que el requerimiento total promedio de hierro durante el embarazo normal es aproximadamente 1 240 mg(9,21), ver la tabla 1. Después del parto, la masa de glóbulos rojos de la madre declina hacia los valores previos al embarazo; y se recicla el hierro de la hemoglobina de los glóbulos rojos eliminados para reponer las reservas corporales de hierro. En consecuencia, la pérdida neta de hierro, asociada con el embarazo per se, es menor, aproximadamente 630 mg(9,21). Estos resultados se derivan de estudios realizados en mujeres que viven a nivel del mar o en altitudes bajas (menos de 1 500 mg sobre el nivel del mar). Aproximadamente 70% del área total del Perú se encuentra a nivel del mar o en altitudes bajas. Un 63,5% de la población (alrededor de 30 millones de habitantes) vive en altitud menor de 1 500 m.s.n.m. Alrededor de 35% de la población vive permanentemente en las grandes alturas, las cuales fluctúan entre 1 500 y 4 500 metros sobre el nivel del mar. Existe información limitada acerca del impacto real de las grandes altitudes en el embarazo; y hasta donde sepamos, no existe información que indique si los requerimientos de hierro son diferentes en las mujeres que viven a grandes alturas en comparación con las mujeres que viven en bajas alturas.

Muchas mujeres pueden tener una pobre condición del hierro antes del embarazo
Las mujeres en edad reproductiva con menstruaciones regulares entre aproximadamente los 14 a los 50 años de edad tienen pérdidas considerables de sangre y de hierro durante el periodo fértil de su vida. En las mujeres escandinavas, la mediana de la pérdidas de hierro en la menstruación son 0,45 a 0,56 mg/día; un 25% de las mujeres tiene pérdidas de hierro que exceden 0,85 mg/día, lo cual, conjuntamente con las pérdidas de hierro obligatorias de 0,85 mg, hacen una demanda total de hierro absorbido que supera 1,70 mg/día. Estas demandas altas de hierro pueden ser satisfechas solamente en las mujeres con un buen estado nutricional que consumen una dieta saludable que contenga hierro con una biodisponibilidad alta, presente en las carnes, pollo y pescado. En las mujeres que tienen una dieta que contenga predominantemente cereales y vegetales y ausencia de carne, no pueden satisfacer las demandas dietarias de hierro; y muchas de estas mujeres tienen una pobre condición de dicho elemento y frecuencias elevadas de deficiencia de hierro y de anemia por deficiencia de hierro. El estado nutricional depende de la condición social; y en el Perú, aproximadamente 30% de la población vive en condición de pobreza y 10% en extrema pobreza; e indudablemente, tienen niveles del hierro más deficientes en comparación con el sector más pudiente de la población.
En Escandinavia, la mayoría de las mujeres saludables en edad reproductiva tiene una reserva baja de hierro, con una mediana de la ferritina plasmática en 40 mg/L; 10% de las que no son donantes de sangre y 21% de las donantes voluntarias de sangre tienen valores de ferritina por debajo de 15 mg/L, lo cual es consistente con depleción de hierro; y 4% tiene anemia por deficiencia de hierro no reconocida. En total, un 42% tiene valores de ferritina por debajo de 30 mg/L; esto es, reservas de hierro pequeñas o ausentes(22,23). Ello significa que aún en los países desarrollados, un 40% de las mujeres tiene niveles bajos del hierro antes de salir gestando. Solamente 14 a 20% tienen valores de ferritina por encima de 70 mg/L, esto es, reservas de hierro mayores de 500 mg, lo cual casi equilibra la pérdida neta de hierro durante el embarazo(9,21); estas mujeres tienen reservas de hierro adecuadas y pueden pasar la gestación sin desarrollar deficiencia, aún cuando no tomen suplementos de hierro(24).
De acuerdo con la base de datos de la Organización Mundial de la Salud (OMS) referentes a la anemia, se estima que la prevalencia de dicha condición (niveles de hemoglobina por debajo de 120 g/L) en las mujeres peruanas en edad reproductiva (15 a 49 años de edad) es elevada, por encima de 40%(25). Esta información ha sido recolectada por la OMS durante el periodo entre los años 1993 a 2005. Sin embargo, de acuerdo con la Encuesta Demográfica y de Salud realizada en el Perú en el año 2009(26), se ha observado una marcada declinación en la prevalencia de la anemia (niveles de hemoglobina por debajo de 110 g/L), de 40% a 22% en las mujeres en edad reproductiva (figura 2). La ciudad capital, Lima Metropolitana, tiene una prevalencia de anemia de 23%; y, por lo general, la prevalencia de la anemia es menor en las áreas urbanas en comparación con las áreas rurales.
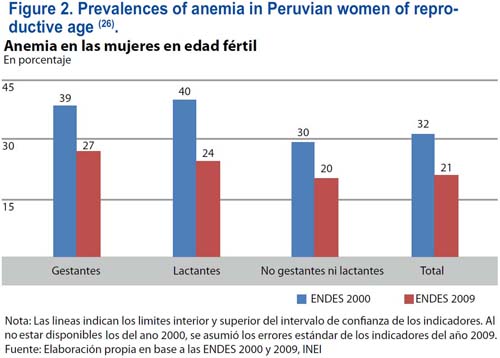
En las mujeres gestantes peruanas, la OMS comunicó una elevada prevalencia de la anemia, por encima de 40%(25); y ello fue confirmado en la Encuesta Demográfica y de Salud Familiar (ENDES), realizada en el año 2000, y en el Monitoreo Nacional de Indicadores Nutricionales (MONIN), el cual encontró una prevalencia de 4% en el año 2004. Sin embargo, de acuerdo con la Encuesta Demográfica y de Salud realizada en el Perú en el año 2009(26), se ha registrado una declinación marcada en la prevalencia de la anemia en las mujeres gestantes, de 40% a 27% (figura 2). La mayoría de las mujeres con anemia, alrededor de un 75%, sufre de anemia por deficiencia de hierro. Como la prevalencia de la deficiencia de hierro es mucho mayor con respecto a la prevalencia de la anemia por deficiencia de hierro(11), podemos concluir que los valores de la prevalencia de las reservas corporales de hierro depletadas y de la deficiencia de hierro deben ser muy elevadas, probablemente por encima de 70 a 80% en la mayoría de las mujeres peruanas.
Ciertos subgrupos de mujeres se encuentran en un mayor riesgo para tener deficiencia de hierro. Estas incluyen a las multíparas, aquellas con múltiples embarazos, las donantes de sangre, las vegetarianas y las mujeres de una condición socioeconómica baja.
CAUSAS DE LA ANEMIA
La mayoría, un 75 a un 80% de las mujeres gestantes con anemia, tiene anemia por deficiencia de hierro. En una fracción más pequeña de las mujeres, se encuentra otras causas de anemia, principalmente por deficiencia de folato y/o de la vitamina B12, así como por la presencia de enfermedades inflamatorias o infecciosas(27). Sin embargo, estudios recientes han demostrado que tanto los niveles plasmáticos de folato como los de cobalamina disminuyen marcadamente durante el embarazo(28,29), lo cual sugiere que la deficiencia de las vitaminas citadas puede tener un papel significativo. Las mujeres en las regiones del Mediterráneo, Medio Oriente, Lejano Oriente y África pueden tener hemoglobinopatías, lo cual causa anemia en el preparto. En la población de raza negra de origen africano que vive en el Perú, aproximadamente un 10% tiene una hemoglobinopatía (hemoglobina S)(30). Adicionalmente, estas mujeres son más propensas para presentar deficiencias de vitaminas. En consecuencia, en muchos países, la búsqueda de hemoglobinopatías es parte del programa de control prenatal en las poblaciones en riesgo.
La anemia por deficiencia de hierro es por definición una anemia que responde al tratamiento con hierro, administrado por las vías oral o intravenosa. El hierro es obligatorio para la producción de hemoglobina en los precursores de los glóbulos rojos (los eritroblastos); y si el suministro de hierro en la médula ósea es inadecuado, la producción de hemoglobina cae y declina el número de glóbulos rojos en la circulación. Ello subsecuentemente lleva al desarrollo de anemia por deficiencia de hierro, con una concentración baja de hemoglobina. Típicamente, la anemia es microcítica, con un volumen promedio bajo de los glóbulos rojos (MCV, mean red cell volume) e hipocrómica, con un contenido bajo de hemoglobina en los glóbulos rojos; esto es, un valor promedio bajo de la hemoglobina en los glóbulos rojos (MCH, mean red cell hemoglobin) y una concentración promedio baja de hemoglobina en los glóbulos rojos (MCHC, mean red cell hemoglobin concentration). En la mayoría de las mujeres, la deficiencia de hierro surge debido a una ingestión dietaria de hierro insuficiente. Las encuestas dietarias han demostrado que aún en los países desarrollados y pudientes, la ingestión dietaria de hierro es muy baja en algunos subgrupos poblacionales(31). Por ejemplo, las mujeres danesas en edad reproductiva tienen una ingestión dietaria de hierro en 9 mg/día(32), lo cual significa que más de 90% de las mujeres tiene una ingestión por debajo de la cantidad recomendada diaria de hierro, fijada en por lo menos 18 mg/día.
El hierro dietario consiste en hierro heme y hierro no heme. El hierro heme posee una buena biodisponibilidad, llevando a una absorción gastrointestinal favorable del hierro, mientras que el hierro no heme tiene una biodisponibilidad pobre, lo cual indica una absorción baja del hierro. El hierro heme está presente en los productos alimentarios de origen animal (carne, pollo, pescado), en tanto que el hierro no heme se encuentra predominantemente en los productos alimentarios de origen vegetal (verduras, cereales, granos, legumbres). Adicionalmente, la carne contiene un denominado factor de la carne, el cual facilita la absorción del hierro no heme. En consecuencia, los individuos que consumen con regularidad alimentos de origen animal se encuentran en un menor riesgo para desarrollar deficiencia de hierro en comparación con los individuos que consumen exclusivamente alimentos de origen vegetal.
Las pérdidas continuas de sangre, que son predominantemente en el tracto gastrointestinal debido a infecciones, parasitosis intestinales, o por enfermedad inflamatoria intestinal, también pueden contribuir con la deficiencia de hierro y con la anemia. Es más, las mujeres con una pérdida marcada de sangre en sus periodos menstruales o aquellas con sangrado uterino recurrente debido a alguna enfermedad ginecológica tienen un riesgo muy aumentado para desarrollar deficiencia de hierro y anemia.
Los estudios sobre la absorción gastrointestinal de hierro en las mujeres gestantes demuestran que la absorción aumenta con una duración creciente del embarazo. El aumento es más pronunciado después de las 20 semanas de gestación(9). Sin embargo, el aumento en la absorción del hierro parece ser causado por una depleción progresiva de dicho elemento. Las mujeres gestantes con reservas amplias de hierro no presentan el mismo incremento en la absorción de hierro en comparación con las mujeres con reservas de hierro pequeñas o depletadas. Un estudio llevado a cabo en Inglaterra( 33) encontró una correlación inversa entre los niveles plasmáticos de ferritina y la absorción de hierro. Adicionalmente, un estudio realizado en el Perú(34) examinó la absorción del hierro en el tercer trimestre utilizando isótopos de dicho elemento. Las mujeres que habían tomado diariamente 60 mg de hierro ferroso durante el embarazo tuvieron una absorción promedio de hierro en 12%, lo cual es similar a lo registrado en las mujeres no gestantes. Hubo una correlación inversa entre los niveles plasmáticos de ferritina y la absorción de hierro. Las mujeres con valores plasmáticos de ferritina por debajo de 30 mg/L tuvieron una absorción promedio de 12,2%, aquellas con valores de ferritina por encima de 30 mg/L tuvieron una absorción promedio de 6,8%; y las mujeres con los niveles máximos de ferritina, en 61 mg/L tuvieron una absorción en 1,5%. Estos resultados sugieren que el incremento en la absorción del hierro durante la gestación es inducido principalmente por los niveles bajos de dicho elemento.
RECONOCIENDO LA ANEMIA
Las mujeres gestantes que toman suplementos de hierro poseen concentraciones de hemoglobina marcadamente mayores en comparación con lo registrado en las mujeres que no toman tal suplementación(12,35); ver la figura 3. Es difícil aceptar que esta sea la intención de la naturaleza, que las mujeres tengan deficiencia de hierro mientras estén gestando; y, por tanto, hemos definido a las concentraciones de hemoglobina halladas en las mujeres sin deficiencia de hierro como los valores normales óptimos. La hemodilución induce fluctuaciones fisiológicas en los niveles de la hemoglobina durante la gestación(12,36,37). En las mujeres que reciben suplementos de hierro, las concentraciones de la hemoglobina muestran una caída constante desde fines del primer trimestre, debido a la hemodilución, alcanzando un nivel mínimo a aproximadamente 25 semanas de gestación (figura 3). Posteriormente, los niveles de hemoglobina se elevan durante el tiempo restante del embarazo hasta alcanzar los valores máximos poco antes del parto(12,38–43). La elevación previa al parto se debe a la combinación de un aumento en la masa de hemoglobina y por una disminución de la hemodilución. En las mujeres que no toman suplementos de hierro, los niveles de la hemoglobina continúan cayendo hasta las 32 semanas de gestación, probablemente debido a una eritropoyesis con deficiencia de hierro; y en adelante se mantienen bastante estables, aparte de un leve aumento poco antes del parto, causado por la reducción de la hemodilución. Como el grado de hemodilución muestra una variación considerable entre las mujeres, las concentraciones normales de la hemoglobina muestran una variación similar; y ello torna algo complicado establecer puntos de corte confiables para definir la anemia.
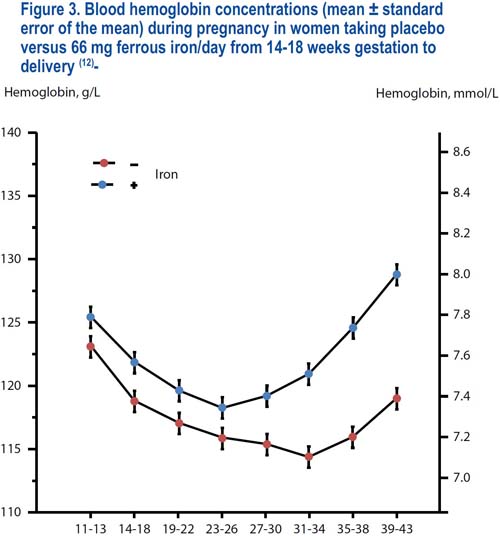
Estudios realizados en Escandinavia en mujeres caucásicas gestantes saludables(12,36,37) sin deficiencia de hierro, y viviendo a nivel del mar, han demostrado que el quinto percentil para la hemoglobina en sangre fue 111 g/L en el primer trimestre y 109 g/L en el primer mes, 106 g/L en el segundo mes y 103 g/L en el tercer mes del segundo trimestre; 105 g/L en los primeros dos meses; y 110 g/L en el último mes del tercer trimestre. Ninguna de las mujeres con niveles adecuados de hierro tuvo valores por debajo de 100 g/L.
Con el fin de hacer que estos valores sean aplicables en una situación clínica práctica, hemos simplificado los puntos de corte para definir la anemia a lo siguiente: hemoglobina por debajo de 110 g/L en el primer y tercer trimestre y por debajo de 105 g/L en el segundo trimestre. Esta definición de la anemia preparto está cerca al punto de corte fijado en 110 g/L, tal como lo propuso la Organización Mundial de la Salud (OMS)(11) y las Encuestas Demográficas y de Salud (DHS, Demographic and Health Surveys)(44), durante toda la etapa gestacional.
No existen valores de referencia normales para los niveles de hemoglobina en las mujeres gestantes que viven a grandes altitudes, los cuales puedan ser empleados a fin de ajustar los puntos de corte para definir la anemia en las diferentes altitudes. Antes que modificar los puntos de corte para definir la anemia de acuerdo con la altitud, pueden ajustarse los niveles de la hemoglobina con respecto a la altitud, utilizando fórmulas específicas(44). De esta manera, se reduce el valor efectivo de la hemoglobina conforme aumenta la altitud, debido a que hay una menor disponibilidad de oxígeno; y de esta manera se traduce la concentración media de hemoglobina a la concentración correspondiente al nivel del mar.
¿Qué tan frecuente es la anemia en las mujeres gestantes?
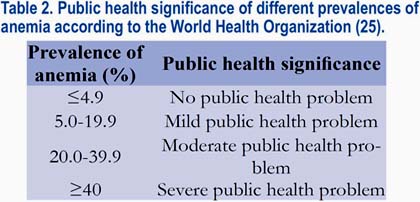
La prevalencia de la anemia durante la gestación muestra una variación marcada de región a región. Se encuentra una prevalencia mínima, en aproximadamente un 25% en Europa y en las Américas, incluyendo al Perú, mientras que el Sudeste de Asia y África presentan prevalencias elevadas en 48% y 57%, respectivamente(25). En Dinamarca, las mujeres gestantes que no toman suplementos de hierro tienen una prevalencia de la anemia en alrededor de 25%(12). En contraste, la prevalencia de la anemia en las mujeres que toman 40 mg de hierro ferroso por día durante la gestación está por debajo de 5%(13). En general, más de 56 millones de mujeres gestantes en todo el mundo están afectadas de anemia; de estas mujeres, aproximadamente 7 millones viven en Europa y en las Américas, y los 49 millones restantes viven en países subdesarrollados. La OMS ha evaluado las consecuencias en la salud pública de la anemia en las mujeres en edad reproductiva (tabla 2). Parece ser que la prevalencia de la anemia en el Perú, en un valor de 27%, está clasificada como un problema moderado de salud pública.
Es obvio que la frecuencia de la anemia por deficiencia de hierro en el preparto depende de los niveles de dicho elemento en las mujeres antes de salir embarazadas. Durante la gestación, una ingestión dietaria baja y una suplementación pobre con hierro, una biodisponibilidad baja del hierro, una menor absorción del hierro debido a enfermedades gastrointestinales y las pérdidas de sangre no fisiológicas -por ejemplo, una hemorragia uterina-, en su totalidad pueden contribuir con la deficiencia de hierro y con la anemia.
Las guías referentes a la profilaxis con hierro y al tratamiento de la anemia por deficiencia de hierro durante el embarazo varían de país a país; y, en consecuencia, se esperaría que la frecuencia de la anemia preparto muestre variaciones similares. A pesar de las recomendaciones generales de la OMS acerca de la profilaxis con hierro, la anemia preparto aún es un problema prenatal mayor.
Los estudios aleatorios y controlados con placebo referentes a la suplementación con hierro pueden dar una impresión acerca de qué tan frecuentemente ocurren la anemia y la anemia por deficiencia de hierro en las mujeres gestantes que no toman suplementos de hierro(35). Todos los estudios han encontrado valores promedio de la hemoglobina durante el embarazo, los cuales son consistentemente menores en las mujeres que recibieron placebo en comparación con las mujeres que recibieron suplementos de hierro(12,38–47).
En un estudio controlado con placebo realizado en mujeres gestantes en Dinamarca (107 recibieron placebo, 100 fueron tratadas con 66 mg de hierro ferroso elemental por día, desde las 14 semanas de gestación), a quienes se midió los niveles de hemoglobina a intervalos regulares hasta el parto, un 5% de las que recibieron placebo contra un 7% de las mujeres tratadas con hierro, tuvieron anemia a fines del segundo trimestre, en tanto que un 22% en comparación con un 2% tuvieron anemia a fines del tercer trimestre(12).
Se presenta en la tabla 3 una revisión de los estudios controlados con placebo referentes a la profilaxis con hierro en mujeres gestantes, los cuales han informado la ocurrencia de anemia(12,39,41–47). Todos los estudios muestran consistentemente que las mujeres que reciben placebo tienen una frecuencia marcadamente mayor de la anemia en el segundo y el tercer trimestre en comparación con las mujeres que tomaban suplementos de hierro. En las mujeres que recibieron placebo, la frecuencia de la anemia en el tercer trimestre fluctúa entre 14 a 52%; y en las mujeres que tomaban suplementos de hierro se encuentra entre 0 a 25%, dependiendo de las dosis de dicho elemento. En estudios que incorporaron las mediciones de ferritina en el plasma, la frecuencia de la anemia por deficiencia de hierro en las mujeres que recibieron placebo fluctuó entre 12 y 17%; y en las mujeres tratadas con suplementos de hierro fue de 0 a 3%(12,13,43,47).
En mujeres danesas gestantes saludables, la frecuencia de los niveles bajos de hemoglobina es significativamente mayor en las mujeres que recibieron placebo en comparación con aquellas que recibieron suplementos de hierro (tabla 4). A partir de todos los estudios citados podemos concluir que aún en las sociedades occidentales, la anemia en el preparto es un problema significativo en el control prenatal. Y la situación es mucho más crítica en los países subdesarrollados y en los grupos de ingresos bajos en la población.
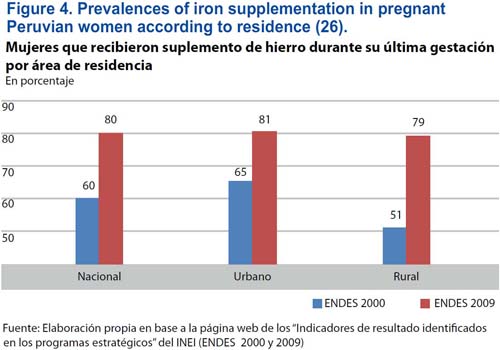
En el Perú, han ocurrido mejoras mayores en la frecuencia de la suplementación con hierro a las mujeres gestantes durante la última década. En el año 2009, los suplementos de hierro fueron utilizados por 80% de las mujeres gestantes viviendo en áreas rurales y urbanas (figura 4). En comparación, el cumplimiento con la suplementación con hierro en las mujeres gestantes danesas es 77%.
EVALUACIÓN DE LA ANEMIA PREPARTO
Cuando una mujer gestante llega a la consulta de control prenatal con anemia, es esencial obtener un diagnóstico correcto con el fin de iniciar un tratamiento específico. Los primeros pasos para diagnosticar la anemia incluyen una historia clínica detallada y un examen clínico minucioso. En la mayoría de las mujeres, a menudo en más de 90%, la anemia es causada por deficiencia de hierro, lo cual puede confirmarse mediante el examen de los biomarcadores del estado del hierro (niveles plasmáticos de ferritina, saturación de transferrina en el plasma y posiblemente con los niveles séricos del receptor soluble de transferrina (sTfR). Si estas pruebas indican deficiencia de hierro, deberá considerarse esta condición aún si el grado de anemia fuera consistente con la anemia por deficiencia de hierro que ocurre durante la gestación, que se presenta en las mujeres que no toman suplementos de hierro y/o que tienen una ingestión dietaria de hierro baja, con una biodisponibilidad baja. Si ocurriera anemia por deficiencia de hierro en las mujeres que toman suplementos de hierro, deberá considerarse las causas no fisiológicas, por ejemplo, sangrado oculto o una deficiente absorción gastrointestinal de hierro debido a hipoclorhidria o aclorhidria gástrica, o por la presencia de alguna condición infecciosa o de una enfermedad inflamatoria intestinal.
Si puede descartarse la deficiencia de hierro, deberá efectuarse una evaluación en mayor detalle de la anemia, dependiendo de la historia y del origen étnico; por ejemplo, los niveles plasmáticos de folato y de cobalamina, un examen en busca de anemia hemolítica y de hemoglobinopatías.
Consecuencias de la deficiencia de hierro y de la anemia en las mujeres gestantes
Los síntomas de la deficiencia de hierro sin anemia son inespecíficos. La depleción de las reservas corporales de hierro puede producir fatiga y una menor capacidad para realizar actividad física, las cuales ceden después del tratamiento con hierro(48,49). Cuando se ha desarrollado anemia por deficiencia de hierro, los síntomas se tornan más específicos y progresivamente pronunciados con la severidad de la anemia.
La anemia por deficiencia de hierro durante la gestación puede tener consecuencias profundamente negativas para el bienestar físico y psíquico de las mujeres, así como afectar significativamente su calidad de vida (tabla 5). Son más frecuentes la fatiga, la debilidad general y las disfunciones psíquicas, incluyendo un deterioro de las capacidades cognitivas, malestar, inestabilidad emocional y depresión(10); y existe una mayor frecuencia de desarrollo de infecciones (50). Las mujeres con deficiencia de hierro pueden experimentar problemas en cuanto a manejar las actividades de la vida diaria, en realizar sus actividades laborales usuales, sea su trabajo como amas de casa o en su empleo fuera del hogar. Se alteran las relaciones de las mujeres con sus familias y sus allegados, afectándose negativamente.

La deficiencia de hierro y la anemia durante la gestación inevitablemente se agravarán después de dar a luz (anemia posparto), debido a las pérdidas de sangre asociadas con el parto. La anemia posparto está asociada con un compromiso de la calidad de vida, desde los puntos de vista físico y psicológico; y constituye un problema significativo de salud pública tanto en los países desarrollados(10,51,52) como en los países subdesarrollados(27).
La deficiencia de hierro en las madres afecta negativamente las interacciones entre la madre y el niño; y la suplementación con hierro protege contra estos efectos negativos(53). Este espectro de síntomas puede hacer que las mujeres experimenten dificultades en el cuidado de sus bebés; y puede afectar los lazos emocionales entre la madre y su bebé(54).
¿Cómo la deficiencia de hierro y la anemia en las mujeres gestantes afectan a los bebés recién nacidos?
En general, el estado del hierro del feto y del recién nacido dependen de la condición del hierro en la madre gestante; y, en consecuencia, la deficiencia de hierro en la futura madre significa que el feto en crecimiento también puede presentar deficiencia de hierro. El hierro es un elemento esencial para el desarrollo y crecimiento normales de la mayoría de los órganos en el feto, especialmente en los órganos hematopoyéticos; y, lo más importante, también para el desarrollo normal del cerebro. Estudios realizados en animales han demostrado que el hierro es importante para el desarrollo temprano del cerebro; y la deficiencia de hierro a principios de la vida fetal induce un deterioro permanente e irreversible en la función cerebral después del nacimiento(55-57). Múltiples estudios han demostrado que los infantes y los niños nacidos de madres con deficiencia de hierro tienen un menor desarrollo cognitivo, motor, social, emocional y neurofisiológico de las funciones cerebrales, así como valores más bajos en el cociente intelectual en comparación con los infantes y niños nacidos de madres con buenos niveles de hierro (tabla 6). Estos hallazgos pueden tener consecuencias profundas para el desarrollo posterior y en el funcionamiento social del niño en crecimiento. Si la deficiencia de hierro fuera muy prevalente en la población femenina, ello puede afectar el perfil de salud, así como la estructura de la sociedad en una dirección negativa. En consecuencia, la anemia durante la niñez es un problema serio y frecuente en los niños nacidos de madres con anemia por deficiencia de hierro; y, por tanto, pueden comenzar la vida desde el nacimiento con deficiencia de hierro y quizás hasta con anemia. La deficiencia congénita de hierro puede ser responsable de la prevalencia muy elevada de la anemia en los infantes peruanos y posteriormente ello puede agravarse por una nutrición tanto cualitativa como cuantitativamente insuficiente.

Adicionalmente, la deficiencia de hierro en las madres, especialmente a principios del embarazo, está significativamente asociada con parto prematuro, peso bajo del recién nacido, peso bajo para la edad gestacional y una mayor mortalidad perinatal del neonato(58-60).
Cuando la madre está afectada por la anemia por deficiencia de hierro, el infante nacerá también con deficiencia de hierro. En la encuesta realizada en el Perú, un 73% de los infantes entre 6 a 11 meses de edad tenía anemia(26). Una frecuencia tan elevada de dicha condición posee serias consecuencias negativas para el crecimiento y el desarrollo psicomotor de los infantes y los preescolares.
INFLUENCIA DE LA ALTITUD
Los infantes nacidos de mujeres que viven en grandes altitudes, a más de 2 000 metros por encima del nivel del mar, tienen un menor peso al nacer en comparación con los nacidos de madres que viven en altitudes más bajas. Ello se debe a una menor tasa de crecimiento en el útero en las etapas tardías de la gestación, después de las 33 semanas. Habiendo mencionado ello, los bebés nacidos a grandes alturas no tienen consecuencias negativas ni riesgos en su salud debido a su peso más bajo, a diferencia de los bebés con un peso bajo nacidos de madres fumadoras. Información reciente de un estudio realizado en Colorado no muestra un aumento en las tasas de mortalidad infantil en los bebés nacidos en grandes altitudes en comparación con los nacidos en altitudes bajas; sin embargo, la hipertensión asociada a la gestación y la preeclampsia son ligeramente más comunes en las gestantes que viven a gran altitud.
CONCLUSIONES Y RECOMENDACIONES
Se ha reconocido durante muchos años que la anemia en las mujeres en edad reproductiva y en las gestantes es un problema mayor de salud en los países subdesarrollados; aun así, el problema básico no ha sido resuelto; y continúa afectando la salud, la calidad de vida y la capacidad para trabajar en millones de personas en todo el mundo. La mayoría de los casos de anemia se deben a la deficiencia de hierro, la cual a menudo se da concurrentemente con deficiencia de folato y de la vitamina B12, así como con la presencia de infecciones/infestaciones. El diagnóstico de la anemia por deficiencia de hierro está basado en la medición de la concentración de la hemoglobina en la sangre y de los niveles plasmáticos de ferritina. En las mujeres en edad reproductiva, un 40% de las mujeres escandinavas y posiblemente entre 70 a 80% de las mujeres peruanas (dependiendo de su condición social y de su lugar de residencia) tienen niveles bajos de hierro con respecto a un embarazo futuro. La prevalencia de la anemia en las mujeres peruanas no gestantes y de edad reproductiva es 22%; y en las mujeres gestantes, dicho valor aumenta a 27%, demostrando que la prevalencia se incrementa durante la gestación. La prevalencia de la anemia en el tercer trimestre puede variar de 14 a 52% en las mujeres que no toman suplementos de hierro (dependiendo del país y de la condición social); y de 0 a 25% en las mujeres que toman suplementos de hierro (dependiendo de la dosis de hierro).
La deficiencia de hierro y la anemia tienen consecuencias severas en las mujeres gestantes, asociándose con lo siguiente: una menor capacidad para trabajar, fatiga, debilidad y disfunción psíquica, lo cual en su totalidad afecta la calidad de vida, tanto a nivel físico como psíquico.
En el feto/el neonato, la deficiencia de hierro puede tener consecuencias serias para el desarrollo del funcionamiento cerebral, aumenta la prevalencia del parto prematuro y la frecuencia del peso bajo al nacer, así como la mortalidad perinatal. Los niños nacidos de madres con deficiencia de hierro tienen un menor desarrollo cognitivo, motor, social-emocional y neurofisiológico, así como un menor cociente de inteligencia en comparación con los infantes y niños nacidos de madres con niveles normales de hierro. La Organización Mundial de la Salud ha iniciado campañas exitosas contra diversas enfermedades infecciosas, pero la batalla contra la anemia está lejos de ganarse; y en el futuro deberán concentrarse mayores esfuerzos en enfrentar este problema tan significativo - ¡tenemos las herramientas y conocemos la manera de hacerlo!
Referencias
1. Bruner A, Joffe A, et al. Randomised study of cognitive effects of iron supplementation in non-anemic iron-deficient adolescent girls. Lancet. 1996;348:992-6.
2. Rowland TW, Deisroth MB, Green GM, Kelleher JF. The effect of iron therapy on the exercise capacity of nonanemic iron-deficient adolescent runners. Am J Dis Childhood. 1988;142:165-9.
3. Beard JL, Hendricks MK, Perez EM, et al. Maternal iron deficiency anemia affects postpartum emotions and cognition. J Nutr. 2005;135:267-72.
4. Sagen N, Nielsen ST, Kim HC, Bjergsø P, Koller O. Maternal hemoglobin concentration is closely related to birth weight in normal pregnancies. Acta Obstet Gynecol Scand. 1984;63:245-8.
5. Murphy JF, Newcombe RG, ORiordan J, Coles EC, Pearson JF. Relation of hemoglobin levels in the first and second trimesters to outcome of pregnancy. Lancet. 1986;1:992-4.
6. Steer P, Alam MA, Wadsworth J, Welch A. Relation between maternal hemoglobin concentration and birth weight in different ethnic groups. Br Med J. 1995;310:489-91.
7. Scanlon KS, Yip R, Schieve LA, Cogswell ME. High and low hemoglobin levels during pregnancy: differential risks for preterm birth and small for gestational age. Obstet Gynecol. 2000;96:741-8.
8. Ren A, Wang J, Ye RW, Li S, Liu JM, Li Z. Low first-trimester hemoglobin and low birth weight, preterm birth and small for gestational age newborns. Int J Gynaecol Obstet. 2007;98:124-8.
9. Milman N. Iron and pregnancy- a delicate balance. Ann Hematol. 2006;85:559-65.
10. Milman N. Postpartum anemia I: definition, prevalence, causes and consequences. Ann Hematol. 2011;90:1247-52.
11. World Health Organization. Iron deficiency Anemia. Assessment, prevention and control. 2001;WHO/ NHD/01.3.
12. Milman N, Agger OA, Nielsen OJ. Iron supplementation during pregnancy. Effect on iron status markers, serum erythropoietin and human placental lactogen. A placebo controlled study in 207 Danish women. Dan Med Bull. 1991;38:471-6.
13. Milman N, Bergholt T, Eriksen L, Byg K-E, Graudal N, Pedersen P, Hertz J. Iron prophylaxis during pregnancy – how much iron is needed? A randomised, controlled study of 20 to 80 mg ferrous iron daily to pregnant women. Acta Obstet Gynecol Scand. 2005;84:238-47.
14. Walters GO, Miller FM, Worwood M. Serum ferritin concentration and iron stores in normal subjects. J Clin Pathol. 1973;26:770-2.
15. Milman N. Serum ferritin in Danes: Studies of iron status from infancy to old age, during blood donation and pregnancy. Int J Hematol. 1996;63:103-35.
16. Milman N, Strandberg NS, Visfeldt J. Serum ferritin in healthy Danes: relation to marrow haemosiderin iron stores. Dan Med Bull. 1983;30:115-20.
17. Worwood M. Laboratory determination of iron status. In Brock JH, Halliday JW, Pippard MJ, Powell LW, eds. Iron Metabolism in health and disease. London: WB Saunders. 1994:449-76.
18. Baynes RD. Iron deficiency. In Brock JH, Halliday JW, Pippard MJ, Powell LW (eds) Iron metabolism in health and disease. London: Saunders. 1994:204-7.
19. Carriage MT, Skikne S, Finley B, Cutler B, Cook JD. Serum transferrin receptor for the detection of iron deficiency. Am J Clin Nutr. 1991;54:107-81.
20. Akesson A, Bjellerup P, Berglund M, Bremme K, Vahter M. Serum transferrin receptor: a specific marker of iron deficiency in pregnancy. Am J Clin Nutr. 1998;68:1241-6.
21. Bothwell TH. Iron requirements in pregnancy and strategies to meet them. Am J Clin Nutr. 2000;72:257S-64S.
22. Milman N, Byg K-E , Ovesen L. Iron status in Danes updated 1994. II. Prevalence of iron deficiency and iron overload on 1319 women aged 40-70 years. Influence of blood donation, alcohol intake, and iron supplementation. Ann Hematol. 2000;79:612-21.
23. Milman N, Clausen J, Byg K-E. Iron status in 268 Danish women aged 18-30 years. Influence of menstruation, method of contraception, and iron supplementation. Ann Hematol. 1998;76:13-9.
24. Milman N, Graudal N, Galløe A, Agger AO. Serum ferritin and selective iron prophylaxis in pregnancy? J Intern Med. 1996;240:47-50.
25. de Benoist B, McLean E, Egll E, Cogswell M (eds). Worldwide prevalence of anemia 1993–2005. WHO Global Database on Anemia. World Health Organization 2008.
26. Instituto Nacional de Estadistica e Informatica Peru. Encuesta demográfica y de salud familiar-ENDES 2009.
27. Milman N. Anemiastill a major health problem in many parts of the world! Ann Hematol. 2011;90:369-77.
28. Milman N, Byg K-E, Hvas A-M, Bergholt T, Eriksen L. Erythrocyte folate, plasma folate and plasma homocysteine during normal pregnancy and postpartum: a longitudinal study comprising 404 Danish women. Eur J Haematol. 2006;76:200-5.
29. Milman N, Byg K-E, Bergholt T, Eriksen L, Hvas A-M. Cobalamin status during normal pregnancy and postpartum. A longitudinal study comprising 406 Danish women. Eur J Haematol. 2006;76:521-5.
30. Frisancho OE, Ichiyanagui Rodríguez C. Infarto de bazo y hemoglobinopatía en la altura. Rev Gastroenterol Peru. 2012;32:68-78.
31. Milman N. Iron in pregnancy – how do we secure an appropriate iron status in the mother and child? Ann Nutr Metab. 2011;59:50-4.
32. Pedersen AN, Fagt S, Groth MV, et al; National Food Agency of Denmark. Danish dietary habits 2003–2008. National Food Institute. Danish Technical University Copenhagen. 2010.
33. Barrett FR, Whittaker PG, Williams JG, Lind T. Absorption of non-haem iron from food during normal pregnancy. BMJ. 1994;309;79-82.
34. OBrien KO, Zavaleta N, Caulfield LE, Yang D-X, Abrams SA. Influence of prenatal iron and zinc supplements on supplemental iron absorption, red blood cell iron incorporation, and iron status in pregnant Peruvian women. Am J Clin Nutr. 1999;69:509-15.
35. Milman N. Iron prophylaxis in pregnancy – general or individual and in which dose? Ann Hematol. 2006;85:821-8.
36. Milman N, Byg K-E, Graudal N, Agger AO. Reference values for hemoglobin and erythrocyte indices during normal pregnancy in 206 women with and without iron supplementation. Acta Obstet Gynecol Scand. 2000;78:89-98.
37. Milman N, Bergholdt T, Byg K-E, Eriksen L, Hvas A-M. Reference intervals for haematological variables during normal pregnancy and postpartum in 433 healthy Danish women. Eur J Haematol. 2007;79:39-46.
38. Svanberg B. Absorption of iron in pregnancy. Acta Obstet Gynecol Scand. 1975;Suppl 48:87-108.
39. Puolakka J, Jänne O, Pakarinen A, Järvinen PA, Vihko R. Serum ferritin as a measure of iron stores during and after normal pregnancy with and without iron supplements. Acta Obstet Gynecol Scand. 1980;Suppl. 95:43-51.
40. Taylor DJ, Mallen C, McDougall N, Lind T. Effect of iron supplementation on serum ferritin levels during and after pregnancy. Br J Obstet Gynaecol. 1982;89:1011-7.
41. Romslo I, Haram K, Sagen N, Augensen K. Iron requirement in normal pregnancy as assessed by serum ferritin, serum transferrin saturation, and erythrocyte protoporfyrin determination. Br J Obstet Gynaecol. 1983;90:101- 7.
42. Galan P, Wainer R, De Benaze C, Hercberg S. Prevention de lanemie ferriprive au cours de la grossesse: effet de la supplementation precoce en fer. En: Hercberg S, Galan P, Dupin H, ed. Recent knowlegde on iron and folate deficiencies in the World. Paris: Colloque INSERM. 1990;197:615.
43. Eskeland E, Malterud K, Ulvik RJ, Hunskaar S. Iron supplementation in pregnancy: is less enough? Acta Obstet Gynecol Scand. 1997;76:822-8.
44. Rutstein SO, Rojas G. Guide to DHS statistics. Demographic and Health Surveys 2006. Calverton, Maryland: ORC Macro.
45. Fleming AF, Martin JD, Hahnel R, Westlake AJ. Effects of iron and folic acid antenatal supplements on maternal haematology and fetal wellbeing. Med J Austr. 1974;2:429-36.
46. Foulkes J, Goldie DJ. The use of ferritin to assess the need for iron supplements in pregnancy. J Obstet Gynaecol. 1982;3:11-6.
47. Makrides M, Crowther CA, Gibson RA, Gibson RS, Skeaff CM. Efficacy and tolerability of low-dose iron supplements during pregnancy: a randomised controlled trial. Am J Clin Nutr. 2003;78:145-53.
48. Verdon F, Burnand B, Stubi CL, et al. Iron supplementation for unexplained fatigue in non-anaemic women: double blind randomised placebo controlled trial. BMJ. 2003;326:1124-6.
49. Basta SS, Soekirman, Karyadi D, Scrimshaw NS. Iron deficiency anemia and the productivity of adult males in Indonesia. Am J Clin Nutr. 1979;32:916-25.
50. Brock JH. Benefits and dangers of iron during infection. Curr Opin Clin Nutr Metab Care. 1999;2:507-10.
51. Bodnar LM, Siega-Riz AM, Miller WC, Cogswell ME, Mc- Donald T. Who should be screened for postpartum anemia? An evaluation of current recommendations. Am J Epidemiol. 2002;156:903-12.
52. Bergmann RL, Richter R, Bergmann KE, Dudenhausen JW. Prevalence and risk factors for early postpartum anemia. Eur J Obstet Gynecol Reprod Biol. 2010;150:126-31.
53. Murray-Kolb LE, Beard JL. Iron deficiency and child and maternal health. Am J Clin Nutr. 2009;89:946S-50S.
54. Gilbert L, Porter W, Brown VA. Postpartum haemorrhage - a continuing problem. Br J Obstet Gynaecol. 1987;94:67-71.
55. Grantham-McGregor S, Ani C. A review of studies on the effect of iron deficiency on cognitive development in children. J Nutr. 2001;131:649S-66S.
56. Beard J. Iron deficiency alters brain development and functioning. J Nutr. 2003;133:1468S-1472S
57. Lozoff B, Georgieff MK. Iron deficiency and brain development. Sem Pediatr Neurol. 2006;13:158-65.
58. Allen LH. Anemia and iron deficiency: effects on pregnancy outcome. Am J Clin Nutr. 2000;71:1280S-4S.
59. Cogswell ME, Parvanta I, Ickes L, Yip R, Brittenham GM. Iron supplementation during pregnancy, anemia, and birth weight: a randomized controlled trial. Am J Clin Nutr. 2003;78:773–81.
60. Ribot B, Aranda N, Viteri F, Hernández-Martínez C, Canals J, Arija V. Depleted iron stores without anemia early in pregnancy carries increased risk of lower birth weight even when supplemented daily with moderate iron. Hum Reprod. 2012;27:1260–6.Leyendas de las Figuras
Correspondencia:
Nils Milman, MD
Lindevangen 87B, DK-2830 Virum, Denmark
Fax: +45 35 45 26 48 Teléfono: +45 20103577
Correo electrónico: nils.mil@dadlnet.dk















