Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. v.58 n.4 Lima 2012
SIMPOSIO: ANEMIA
Tratamiento de la anemia por deficiencia de hierro en el embarazo y en el posparto
Treatment of iron-deficiency anaemia in pregnancy and postpartum
Christian Breymann1,2
1 Departamento de Obstetricia y Ginecología, Hospital Universitario de Zurich
2 Obstetric Research, Feto Maternal Haematology Research Group
Resumen
Está claro que los estados de deficiencia de hierro y la anemia deben ser tratados. Incluso en las formas más leves de anemia, a menudo es imposible predecir el curso de la enfermedad, o si es probable que la situación empeore, y los riesgos maternos y fetales aumentan a medida que la anemia se vuelve más severa. Los factores a tener en cuenta a la hora de decidir sobre el tratamiento a utilizar incluyen el tiempo que queda hasta el parto, la severidad de la anemia, los riesgos adicionales (por ejemplo, parto prematuro), comorbilidad materna y los deseos de la propia paciente (por ejemplo, rechazo para recibir sangre de donantes para tratar la anemia severa). Así, por ejemplo, un testigo de Jehová con anemia severa dos semanas antes del término necesita un tratamiento diferente que una mujer con anemia moderada y sin factores de riesgo adicionales durante el segundo trimestre. En la actualidad, las principales opciones de tratamiento para la anemia incluyen hierro por vía oral, hierro parenteral, la estimulación de la hematopoyesis con factores de crecimiento (por ejemplo, eritropoyetina recombinante humana) y la administración de sangre heteróloga.
Palabras clave: Hierro, deficiencia; anemia, factores.
Abstract
It is clear that iron-deficiency states and anaemia should be treated. Even in milder forms of anaemia, it is often impossible to predict the course of the condition, or whether the situation is likely to worsen, and maternal and foetal risks increase as anaemia becomes more severe. Factors to be taken into account when deciding on the treatment approach to use include the time remaining until delivery, the severity of the anaemia, additional risks (e.g. premature labour), maternal co morbidity and the patients own wishes (e.g. refusal to receive donor blood to treat severe anaemia). Thus, for example, a Jehovahs Witness with severe anaemia two weeks before term needs different treatment than a woman with moderate anaemia and no additional risk factors during the second trimester. At present, the main treatment options for anaemia include oral iron, parenteral iron, the stimulation of haemopoiesis with growth factors (e.g. recombinant human erythropoietin) and the administration of heterologous blood.
Key words: Iron, deficiency states; anemia; pregnancy.
HIERRO ORAL
Hierro por vía oral es el tratamiento estándar para el tratamiento de la anemia leve a moderada. No está claro si la administración semanal o intermitente de hierro por vía oral es equivalente, o incluso mejor que la administración oral diaria de hierro. Los estudios que investigan esta cuestión están actualmente en curso. La dosis ideal para la administración intermitente o semanal tampoco está definida.
Como se muestra en la tabla 1, la tasa de absorción es inversamente proporcional a la dosis administrada. La dosis diaria de hierro de 100-200 mg, es una relación entre el aumento óptimo de la hemoglobina y la tolerabilidad del hierro.

La dosis recomendada es de 80-160 mg de hierro elemental por día.
Si la respuesta al tratamiento con hierro oral es buena, la reticulocitosis se desarrolla dentro de 3 a 5 días, y sigue aumentando hasta 8 a 10 días después del tratamiento. En condiciones ideales, el aumento de la hemoglobina es de aproximadamente 0,2 g/dL/día o aproximadamente 2,0 g/dL dentro de 3 semanas. Una vez que los niveles de hemoglobina se han normalizado, se debe continuar con el hierro por vía oral durante al menos 4 a 6 meses, hasta un nivel de ferritina objetivo de aproximadamente 50 μg/L y una saturación de transferrina de al menos 30%.
Los efectos secundarios gastrointestinales, como el estreñimiento, ardor de estómago y náuseas, que se produce hasta en 30% de los pacientes, limitan la dosis. Esto representa una desventaja importante de los preparados orales de hierro. Si estos efectos adversos ocurren, la dosis debe ser reducida o se debe usar un producto diferente.
Asimismo, la falta de cumplimiento del tratamiento, es un problema común. Se ha demostrado que solo 36% de las mujeres embarazadas toman regularmente hierro por vía oral; incluso, si se les ha informado específicamente sobre los problemas de deficiencia de hierro. Algunos estudios realizados en países, como Tanzania e Indonesia, muestran una tasa de cumplimiento de solo 36% a 42%. Esta puede ser una de las razones de los desalentadores resultados de estudios de la OMS destinados a reducir la prevalencia de anemia por deficiencia de hierro con hierro por vía oral. Otras posibles razones para la falla de la terapia con hierro por vía oral son resumidas en la tabla 2.

PREPARACIONES DE HIERRO ORAL
Hierro (II) sales
Las sales de hierro (II) son las preparaciones más utilizadas de hierro por vía oral para el tratamiento de la anemia. Se las administra ya sea en forma de comprimidos o como soluciones. El más comúnmente utilizado es el sulfato de hierro (II). Otros tipos de hierro (II) son el fumarato, succinatos y gluconatos. Todos ellos son comparables con respecto a la farmacodinamia y farmacocinética, y también con respecto a la tasa de efectos secundarios.
Los compuestos de hierro (III), en forma de sales, tienen una biodisponibilidad muy baja y por tanto no son indicados para la administración oral. La razón de esto es que se forman complejos de hidróxidos de hierro (III) insolubles y prácticamente no absorbibles en el entorno ácido del intestino.
Las preparaciones líquidas se las utiliza sobre todo en la aclorhidria intestinal (por ejemplo, luego de cirugía gastrointestinal), ya que las tabletas muestran baja solubilidad en estos casos y la absorción de la forma líquida es mejor. Sin embargo, estas preparaciones no son ni más eficaces ni tienen un mejor perfil de efectos secundarios.
Complejo de hierro (III) polimaltosado
El complejo de hierro (III) polimaltosado (Maltofer ®, Ferrum Hausmann ®) es uno de los pocos disponibles por vía oral (III) y pertenece a la clase de los llamados preparados de hierro de liberación lenta. La polimaltosa actúa como una envoltura alrededor del hierro trivalente, asegurando una liberación más lenta del complejo de hierro.
Las ventajas de esta preparación de hierro son, en primer lugar, su perfil favorable de efectos secundarios en comparación con sales de hierro (II), como consecuencia de la liberación lenta; y, en segundo lugar, que pueden ser tomados con las comidas.
Diversos autores han postulado que los complejos de hierro polimaltosado tienen una menor toxicidad en comparación con las sales de sulfato de hierro, debido a la reducción de la formación de radicales de oxígeno y por lo tanto disminuye la peroxidación de lípidos en el plasma.
En estudios llevados a cabo hasta la fecha, su biodisponibilidad es comparable a la de hierro (II), sulfatos y fumaratos.
Las dosis de hierro (III) complejo de polimaltosa (Maltofer®) (Fe III = 50 mg) son las siguientes:
-
Gotas: 40 a 120 gotas/día
-
Tabletas: 200 a 400 mg/día
Esto es cierto, ya sea durante o después de las comidas, en contraste con los compuestos de hierro (II)
Compuestos de hierro en forma de preparados combinados
Aditivos tales como el ácido succínico, ácido fumárico, ácido glucónico, ácido glutámico, ácido aspártico y ácido láctico, ciertas vitaminas y elementos traza (Cu, Co, Mn) forman quelatos con el hierro y así mantienen el hierro divalente disponible para la absorción. El ácido ascórbico es un complemento útil para la estabilización de iones de Fe (II) contra la oxidación. La combinación de sales de hierro (II) con ácido ascórbico aumenta la absorción de hierro. De acuerdo con la literatura, esto puede conducir a un aumento de la tasa de efectos secundarios, debido a la liberación más rápida de hierro. Además, la combinación con el ácido ascórbico puede conducir a una mayor formación de radicales hidroxilos tóxicos.
Sales de hierro por vía oral están disponibles en una gran variedad de preparados combinados; su inclusión en los preparados multivitamínicos y de oligoelementos, en particular, no ofrece ninguna ventaja sobre la administración de hierro por sí solo. La presencia de magnesio, calcio y zinc en productos combinados pueden inhibir la absorción de hierro. La combinación de diferentes sales de hierro (II) en una preparación, tampoco ofrece ventajas. Las tetraciclinas, antiácidos como el omeprazol y de ácidos biliares como colestiramina pueden alterar la absorción de hierro. A la inversa, la biodisponibilidad de algunos agentes, tales como inhibidores de la girasa, L-tiroxina y penicilamina, puede reducirse por la administración concomitante oral de hierro.
Preparaciones parenterales de hierro
El hierro parenteral es la alternativa más importante para los preparados de hierro por vía oral. Las indicaciones para la administración parenteral de hierro son presentadas en la tabla 3.

La administración parenteral de hierro no pasa por el mecanismo natural de absorción intestinal de hierro y por la proteína de unión asociada. Esto permite la liberación, no unida a proteínas de hierro para circular por la sangre. El hierro libre es tóxico, ya que favorece la formación de radicales hidroxilo y radicales de oxígeno que, a su vez, conducen a daños en las células y los tejidos, como resultado de la peroxidación. Por lo tanto, el hierro parenteral debe ser administrado solo si el estado de hierro del paciente es conocido, para evitar la sobrecarga potencial de hierro.
En principio, podemos distinguir tres grupos diferentes de preparaciones. Ellas difieren entre sí con respecto a la farmacocinética, la estabilidad del complejo, masa molecular, la toxicidad y efectos secundarios.
Complejos de tipo I (hierro dextrina, hierro dextrano)
Estos complejos de hierro se distinguen por su peso molecular alto (> 100 000 Dalton) y su alta estabilidad (por ejemplo, Imferon ®). El hierro es así entregado lentamente, para el transporte de proteínas y en competencia con hierro endógeno. El hierro se libera, ya sea unido a la transferrina y luego se usa para la síntesis de hemo, o transportado al sistema retículo-endotelial (RES). La vida media en plasma de los complejos de tipo I es de 3 a 4 días. Mientras que esta estabilidad y la liberación lenta de hierro pueden ser consideradas como algo favorable, también se cree que el componente de dextrano, en particular, puede conducir a reacciones alérgicas severas. Esta reacción parece ser menos pronunciada con las dextrinas. Los pacientes que generalmente tienen reacciones alérgicas a los fármacos también están en riesgo alto de desarrollar una alergia al hierro dextrano. La causa de las reacciones alérgicas severas no ha sido completamente aclarada; sin embargo, son consistentes con una reacción anafiláctica que implica la liberación de mediadores de los mastocitos.
Otra hipótesis se refiere a la formación de complejos anticuerpo-dextrano, que pueden conducir a reacciones graves, incluso en el primer contacto. Las cadenas de dextrano forman polímeros biológicos de diferentes tamaños, que podrían ser responsables de esta observación. Un hallazgo que apoya esta hipótesis es que el dextrano-1, por ejemplo, un polímero de solo 1 000 Dalton, no causa reacción en absoluto.
Complejos de tipo II (complejo de hidróxido de sacarosa)
Estos son los llamados complejos de estabilidad media, con un peso molecular de 30 a 100 000 Dalton (Venofer ®). Las concentraciones plasmáticas máximas son alcanzadas a los 10 minutos después de la administración en bolo (30 mg/L). Los niveles en plasma volverán a los valores pre-tratamiento 24 horas después de la administración. La vida media es de 5,5 horas, y los estudios de tomografía por emisión de positrones (PET) muestran la acumulación inmediata en la médula ósea, que se producen en paralelo con la caída en los niveles plasmáticos. En los pacientes, 70% a 97% del hierro se utiliza para la eritropoyesis, dependiendo de la gravedad de su deficiencia de hierro.
En estudios en humanos, no se observó los cambios morfológicos de órganos ni la peroxidación lipídica por los radicales libres con la dosis estándar (1 a 4 mg/kg de peso corporal). La sustancia puede ser calificada como muy segura para el uso clínico de rutina y, además, no se forman polímeros biológicos (véase la sección anterior sobre dextranos), de manera que las reacciones anafilácticas son extremadamente raras. Los efectos secundarios generales incluyen: sabor metálico, sensación de calor, náusea, irritación local y mareos.
Carboximaltosa férrico (Ferinject® Vifor Int. St. Gallen, Switzerland)
Carboximaltosa férrico es un agente de hierro intravenoso que no contiene dextrano, diseñado para ser administrado en dosis grandes mediante infusiones i.v. rápidas (15 minutos). La capacidad de suministrar con seguridad una sola dosis tan grande como 1 000 mg reduce la necesidad de repetir infusiones i.v. y hace que este agente sea un candidato ideal para varias indicaciones en la terapia de la anemia. En la actualidad, no existen estudios controlados sobre el uso de carboximaltosa de hierro durante el embarazo. Los informes de casos con carboximaltosa férrico y su uso en casos de anemia durante el embarazo muestran un buen perfil de seguridad y eficacia hasta ahora; pero, se necesita estudios prospectivos. Se ha demostrado recientemente que el hierro carboximaltosa no cruza la barrera placentaria fetal en un modelo de perfusión.
Complejos tipo III (hierro gluconato, citrato de amonio de hierro, complejo hiróxido sorbitol)
Los sustancias más conocidas en este grupo son los gluconatos de hierro (por ejemplo Ferrlicit ®). Son complejos inestables, lábiles, con pesos moleculares de menos de 50 000 Dalton.
Debido a su estabilidad baja en comparación con los hierros dextranos y los complejos de hierro sacarosa, los complejos del tipo III muestran una menor unión a proteínas de transporte, con mayores cantidades de hierro libre siendo liberadas en el corto plazo. La máxima saturación de la transferrina tras la administración de gluconato de hierro ha sido descrita en varios estudios.
Se cree que más hierro libre se deposita en el parénquima de varios órganos. Los radicales libres conducen a la peroxidación lipídica y, en comparación con los complejos de tipo I/II, a una mayor toxicidad del tejido.
Los gluconatos de hierro, en particular, son comparables a las sacarosas de hierro con respecto a las reacciones alérgicas o anafilácticas, y, por tanto, al igual que las sacarosas de hierro, tienen un perfil de efectos secundarios mejor que los dextranos de hierro.
La experiencia en obstetricia con el complejo de hierro sacarosa (Venofer ®) (Hospital Universitario de Zúrich)
Desde principios de la década de 1990, el hierro sacarosa (Venofer ®) ha sido el único producto de hierro por vía parenteral usado durante el embarazo y el puerperio, en la Clínica de Obstetricia del Hospital Universitario de Zúrich. Los datos sobre la seguridad del complejo de hierro sacarosa fueron recogidos por primera vez en un estudio multicéntrico, en 1998. La tasa de efectos secundarios después de la administración de 2 000 ampollas, con una dosis i.v. única máxima de 200 mg, se encontró que era menos de 0,5%. De acuerdo con las Guías de Obstetricia (Obstetrics Clinic Guidelines), para la anemia se usa un plan de tratamiento incremento progresivo. Los requisitos previos para el uso del hierro parenteral incluyen extensas investigaciones de diagnóstico y el cumplimiento de los siguientes criterios de inclusión (tabla 4).

La primera prueba de hemoglobina se lleva a cabo normalmente durante el primer trimestre, con hierro oral prescrito en primera instancia, solo si el valor es no inferior a 10,0 g/dL. Si el nivel de hemoglobina de hierro por vía oral cae por debajo de 10,0 g/dL dentro de 2 a 4 semanas, o si el nivel de Hb en la primera prueba ya está a menos de 10,0 g/dl, se utiliza el complejo de hierro sacarosa como primera opción de tratamiento.
USO PRÁCTICO DEL HIERRO SACAROSA
La sustancia es administrada a través de una cánula venosa mariposa, con posicionamiento correcto una vez en la vena, que ha sido probado con NaCl. Hierro sacarosa puede ser administrado sin diluir como un bolo, o diluida (por ejemplo, 100 a 200 mL con NaCl), como una infusión corta. Se requiere la administración de una dosis de prueba (1 mL) en los distintos países. La inyección en bolo posterior se da durante 5 a 10 minutos; la infusión corta es durante aproximadamente 20 minutos. La dosis única máxima es de 200 mg. Por lo general, se administra dos dosis a la semana hasta alcanzar un valor de Hb de 11,0 g/dL. En nuestra experiencia, el tratamiento puede ser administrado de forma ambulatoria, sin ningún problema; por lo general, no es necesario un largo período de seguimiento después de la administración.
EFICACIA DEL HIERRO SACAROSA DURANTE EL EMBARAZO
Hay varios estudios y experiencia clínica con el uso de la sacarosa de hierro durante el embarazo y después del parto. En general, un alto nivel de eficacia y seguridad se demostró en todos los estudios. Del mismo modo, la terapia de hierro por vía parenteral con el complejo de hierro sacarosa es superior al hierro por vía oral en todos los estudios. Además, el perfil de efectos secundarios del tratamiento con hierro por vía oral se encontró incluso ser menos favorable. Varios estudios han descrito el uso del hierro sacarosa en el embarazo; el aumento de la Hb 28 días después de comenzar la terapia se encuentra entre 1,3 a 2,5 g/dL después de hierro sacarosa en comparación con un rango de aumento de 0,6 a 1,3 g/dL después de hierro por vía oral (figura 1).
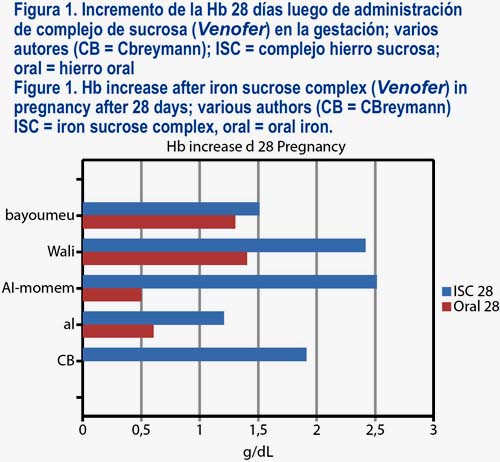
LA ESTIMULACIÓN DE LA ERITROPOYESIS CON ERITROPOYETINA RECOMBINANTE (RHEPO)
El factor de crecimiento de la eritropoyetina humana recombinante (rhEPO), una glicoproteína (peso molecular 30 400 Dalton), es idéntica a la eritropoyetina endógena y actúa como un crecimiento selectivo y el factor de supervivencia para las células eritroides.
Se ha utilizado clínicamente desde 1986, principalmente en pacientes con anemia renal, que tienen deficiencia de eritropoyetina endógena. Otras indicaciones se han añadido en los últimos años, incluyendo la anemia en los recién nacidos, después de la donación de sangre autóloga en pacientes oncológicos, en pacientes con VIH y para el tratamiento de la anemia perioperatoria, por ejemplo, en los testigos de Jehová.
Desde entonces, se ha adquirido mayor experiencia en el campo de la obstetricia, en la forma de estudios aleatorios sobre el tratamiento de la anemia después del parto, principalmente en forma de informes de casos en pacientes con insuficiencia renal y en los testigos de Jehová, y también en el tratamiento de la anemia ferropénica severa durante el embarazo. Los resultados de los estudios y las observaciones son muy prometedores. La administración de eritropoyetina recombinante reduce el tiempo necesario para que la concentración de hemoglobina se normalice, siempre que se administre suficiente hierro. La forma más eficaz de lograr esto es con hierro parenteral. Si la disponibilidad concomitante de hierro es insuficiente, el paciente desarrolla lo que se conoce como deficiencia funcional de hierro, que previene la síntesis de cantidades adecuadas de hemoglobina.
Según los resultados disponibles, la combinación de rhEPO y hierro parenteral es superior al tratamiento de hierro solo con respecto a lograr un aumento en la concentración de hemoglobina, y se puede considerar como una opción en el tratamiento de la anemia grave o si el paciente se niega a una donación de sangre.
El efecto de la rhEPO es dosis-dependiente. De acuerdo a nuestra propia experiencia, una sola dosis por vía intravenosa de 150 a 300 U/kg es suficiente, a pesar de que se necesite repetir una dosis en algunos casos. En nuestra clínica, tratamos de asegurar una óptima relación costo- beneficio con el objetivo de tratar la anemia durante el embarazo y el puerperio, de acuerdo a un plan gradual, según el cual tratamos la anemia, ya sea con hierro solo o en combinación con rhEPO, dependiendo de la gravedad. Este plan puede ser adaptado individualmente al paciente, teniendo en cuenta los riesgos adicionales.
Así, por ejemplo, si el tratamiento de un paciente Testigo de Jehová con placenta previa, usaríamos la eritropoyetina recombinante, incluso en anemia moderada.
Además de las modernas técnicas anestésicas y quirúrgicas, nuestro plan de incremento progresivo de tratamiento de la anemia tiene un papel importante en la prevención de la anemia que requiere transfusión después de grandes pérdidas de sangre en el periparto. Por lo tanto, menos de 1% de nuestras pacientes obstétricas ahora requieren transfusiones de sangre de donantes.
En este punto, hay que subrayar que, hasta la fecha, rhEPO solo se ha utilizado en el embarazo dentro del contexto de protocolos de estudio.
TRATAMIENTO DE LA ANEMIA PUERPERAL
El tratamiento de la anemia después del parto depende de la severidad de la anemia y/o de otros factores de riesgo maternos o comorbilidad.
Una mujer joven y sana puede compensar las pérdidas de sangre mucho mejor que una puérpera con un defecto cardíaco, que puede descompensarse incluso con pérdidas menos severas. Además, las pérdidas de sangre deben ser consideradas en relación con la masa corporal y el volumen estimado total de sangre. Otra consideración es que se puede cometer errores significativos sobre todo cuando se estima la pérdida de sangre, ya que la pérdida de sangre es a menudo subestimada, algo que fácilmente se puede comprobar mediante la comparación de los niveles de hemoglobina preparto y posparto.
Además de la reposición de volumen, las opciones de tratamiento incluyen la administración de hierro por vía oral, hierro parenteral y la sangre heteróloga (de donantes). Otra opción a considerar, como se mencionó anteriormente, es la administración de eritropoyetina recombinante.
En los informes de ensayos de la Colaboración Cochrane que compararon diferentes compuestos de hierro (con o sin rhEPO) para el tratamiento de la anemia después del parto, los autores concluyen que un resultado favorable se observó en pacientes que fueron tratados además con rhEPO y que los ensayos adicionales se centraron en la administración de hierro; es necesario conocer el papel del hierro en la dieta y la transfusión de sangre.
Cabe señalar que los estudios con el uso de complejo de hierro sacarosa y hierro carboximaltosa (Ferinject) que fueron publicados después de 2004 muestran una clara ventaja de la vía parenteral en hierro que por la vía oral, que no han sido incluidos todavía.
HIERRO ORAL
El hierro por vía oral debe ser prescrito para niveles de hemoglobina de más de 9,5 g/dL; 80 a 100 mg/día es suficiente en estos casos. El suplemento de hierro debe continuarse durante un período de varios meses, para proporcionar hierro no solo para la normalización de hemoglobina, sino también para normalizar los depósitos de hierro. En un estudio, hemos sido capaces de demostrar que las puérperas con deficiencia de hierro, pero no con anemia, pueden reponer sus reservas de hierro a través de la suplementación con hierro solo. Por lo tanto, las puérperas que tienen deficiencia de hierro y anemia son particularmente propensas a tener un requerimiento de hierro mayor. Por ello, debemos seguir administrando hierro durante al menos seis meses. En la mayoría de los casos, la administración de hierro por vía oral no es suficiente en el tratamiento de la anemia grave, ya que generalmente las reservas de hierro endógenos se agotan y no se proporciona suficiente hierro para asegurar la eritropoyesis suficiente.
Como se mencionó anteriormente, las razones para esto incluyen la absorción limitada, falta de cumplimiento en dosis altas debido a efectos adversos, y los niveles bajos de plasma, lo que conlleva a la deficiencia funcional de hierro. Además, una reacción inflamatoria puede ocurrir en particular después de partos asistidos quirúrgicamente y cesáreas, dando lugar a la retención de hierro, de modo que el hierro administrado no está disponible para la hematopoyesis.
HIERRO PARENTERAL
Una alternativa es la administración de hierro sacarosa (Venofer ®). Las concentraciones plasmáticas altas de hierro que se producen poco después de la administración intravenosa no pasan por la liberación limitada del hierro del sistema retículo endotelial e inhibición de la absorción del hierro por la mucosa intestinal; por lo tanto, la entrega es de cantidades suficientes de hierro para la eritropoyesis. Al igual que en el embarazo, seguimos un plan de tratamiento gradual, utilizando hierro sacarosa por vía parenteral, en los niveles de hemoglobina menor a 9,5 g/dL. La figura 2 muestra el aumento de la Hb después del parto en diversos estudios, utilizando complejos de hierro sacarosa.
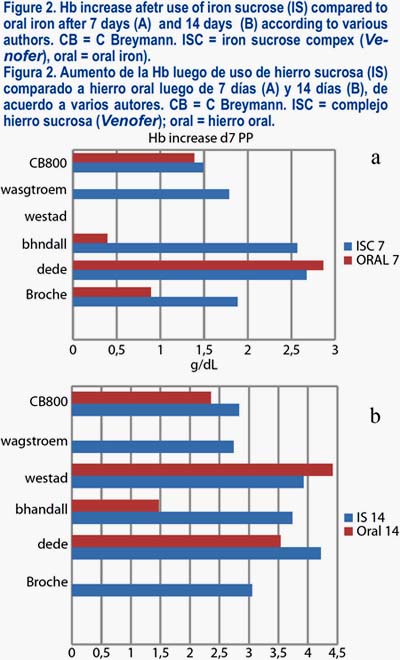
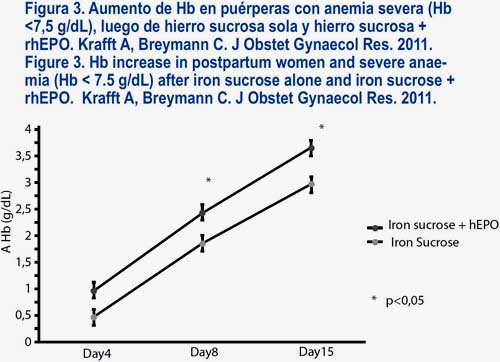
Carboximaltosa férrica (Ferinject® Vifor Int. St. Gallen, Switzerland)
Carboximaltosa férrica es hierro intravenoso que no contiene dextrano, diseñado para ser administrado en dosis grandes en rápidas infusiones intravenosas (15 minutos). La capacidad de infundir con seguridad una sola dosis tan grande como 1 000 mg reduce la necesidad de repetir infusiones i.v. y hace que este agente sea un candidato ideal para varias indicaciones en la terapia de la anemia.
Cuatro estudios clínicos aleatorios han sido publicados recientemente (Seid, Derman et al. 2008)). En estos, un total de 1 001 pacientes con anemia después del parto han sido asignados al azar para recibir ya sea sulfato de hierro por vía oral (200 mg/día) o hasta 1 000 mg de hierro carboximaltosa en 1 o 2 infusiones (un total de 545 pacientes). La dosis media total de hierro carboximaltosa fue de 1 346, 1 403 mg y 1 503, respectivamente. Todos los estudios mostraron alta afectividad concerniente al incremento de Hb y aumento de ferritina y un excelente perfil de seguridad de Ferinject ®, en comparación con hierro por vía oral, lo cual hace que este agente sea muy adecuado para el tratamiento de la anemia posparto, como una alternativa al hierro oral.
Eritropoyetina recombinante
La estimulación de la eritropoyesis con rhEPO (por ejemplo, Eprex / Epogen ®) es una alternativa muy prometedora para la transfusión de sangre para la anemia grave en los casos en que el uso de la sangre del donante no es esencial, o cuando un paciente se niega a recibir la sangre del donante. Se sabe que la eritropoyesis se inhibe, particularmente en asociación con la reacción inflamatoria después del parto y, además, los niveles endógenos de EPO se reducen. Este ciclo vicioso posparto (inhibición la eritropoyesis, la reducción de la disponibilidad de hierro y la reducción de los niveles de EPO) puede ser roto por la administración combinada de rhEPO y hierro parenteral. Asimismo, la combinación tiene un perfil de tolerabilidad muy bueno.
TRANSFUSIÓN DE DONANTES DE SANGRE
La anemia severa durante el embarazo y en el período posparto puede requerir el uso de transfusiones de sangre, productos de plasma y expansores de volumen.
Es importante contar con criterios estrictos a favor o en contra de la administración de productos de reemplazo de la sangre, y ser conscientes de los riesgos potenciales de estas sustancias.
La administración sangre donada y/o productos derivados de plasma son indicados si se demuestra que los productos en cuestión han sido fabricados y adecuadamente testeados en forma segura, y si su uso puede evitar una situación potencialmente mortal para el paciente. Por otra parte, es necesario que haya una probabilidad suficientemente alta de que la muerte y morbilidad materna no puede ser evitada mediante el solo uso de alternativas equivalentes (mediante la reposición de volumen solamente, por ejemplo).
La administración no selectiva e indiscriminada de los productos sanguíneos debe ser evitada en todo momento. De acuerdo con la literatura, la tasa de transfusiones de sangre de donantes en los centros de tratamiento especializados es 1 a 2% (en relación con el número de nacimientos). En la actualidad, en el Zurich University Hospitals Obstetrics Clinic la tasa es de 0,5 a 1%.
Los centros de Atención Médica que brindan servicios de Obstetricia y sus especialistas deben estar preparados para las transfusiones de sangre de emergencia. La disponibilidad de sangre refrigerada (en especial el grupo sanguíneo 0 Rh negativo) y los derivados del plasma (por ejemplo, plasma fresco congelado) es esencial.

OTRAS MEDIDAS OBSTÉTRICAS
El principio más importante para decidir a favor o en contra de una transfusión de sangre o el uso de productos sanguíneos es que representen solo una de las muchas opciones en el tratamiento del paciente.
El principio fundamental en el manejo de una hemorragia aguda y grave es la sustitución de los fluidos (reposición de volumen) para mantener la perfusión de los órganos. Otras medidas incluyen mantener al mínimo el número de muestras de sangre tomadas para los análisis y el uso de las mejores técnicas quirúrgicas y anestesiológicas para reducir al mínimo la pérdida de sangre.
RESUMEN DE LOS PRINCIPIOS FUNDAMENTALES PARA EL USO DE TRANSFUSIONES DE SANGRE EN OBSTETRICIA:
-
Cualquier tipo de anemia (incluyendo las formas leves) deben ser tratadas rápidamente para evitar la necesidad de posteriores transfusiones de sangre
-
En general, las pérdidas de sangre deben ser reducidas al mínimo
-
El nivel de hemoglobina (hematocrito) por sí solo no puede ser el único criterio para una transfusión de sangre de donantes. Los factores clave son los hallazgos clínicos, la situación de la hemorragia y la probabilidad de prevenir la morbilidad significativa o incluso la muerte. En nuestra experiencia, el nivel crítico de hemoglobina, siempre que la circulación es estable, es de aproximadamente 6,0 g/ dL (hematocrito aproximadamente 18 a 20%)
-
En caso de pérdida aguda de sangre, comenzar a dar oxígeno y expansores de volumen de inmediato
-
Las transfusiones de sangre representan solo una de las muchas opciones disponibles
-
La decisión de administrar una transfusión de sangre debe hacerse de acuerdo con Guías de Manejo relevantes.
-
Los riesgos de la transfusión debe ser ponderado al momento de tomar la decisión de hacerlo
-
Los deseos del paciente deben ser tenidos en cuenta, si es posible
-
El personal capacitado debe llevar a cabo y supervisar la transfusión
-
Las indicaciones y las circunstancias de una transfusión de sangre debe ser registrada, al igual que cualquier complicación
-
En la obstetricia moderna, las transfusiones de sangre deben ser la excepción y no la regla.
Selección de Referencias
1. Al A, Unlubilgin E, Kandemir O, Yalvac S, Cakir L, Haberal A. Intravenous versus oral iron for treatment of anemia in pregnancy. Obstet Gynecol. 2005;106:1335-40.
2. Bayoumeu F, Vial F, Zaccabri A, Agullès O, Laxenaire MC. Iron therapy in iron deficiency anemia in pregnancy: intravenous route versus oral route. Am J Obstet Gynecol. 2002;186:518-22.
3. Beguin Y, Lipcsei G, Thoumsin H, Fillet G. Blunted erythropoietin production and decreased erythropoiesis in early pregnancy. Blood. 1991;78:89–91.
4. Braga J, Marques R, Branco A, Jorge C.Maternal and perinatal implications of the use of human recombinant erythropoietin. Acta Obstet Gynecol Scand. 1996;75:449– 53.
5. Breymann C, Huch R. Anemia in pregnancy and the puerperium. UNI-MED Science, 3rd edition. 2008. ISBN 978-3-8374-1022-8.
6. Breymann C, Gliga F, Bejenariu C, Strizhova N. Comparative efficacy and safety of intravenous ferric carboxymaltose in the treatment of postpartum iron deficiency anemia. Int J Gynaecol Obstet. 2008;101:67- 73.
7. Breymann C, Visca E, Huch R, Huch A. Efficacy and safety of intravenously administered iron sucrose with and without adjuvant recombinant human erythropoietin for the treatment of resistant iron-deficiency anemia during pregnancy. Am J Obstet Gynecol. 2001;184:662–7.
8. Breymann C, Zimmermann R, Huch R, Huch A. Use of recombinant erythropoietin in combination with parenteral iron in the treatment of postpartum anaemia. Eur J Clin Invest. 1996;26:123–30.
9. Bridges K. Iron imbalance during pregnancy. En: Bern M, Frigoletto F (eds) Hematologic disorders in maternal-fetal medicine. Wiley & Liss, New York, 1990;113–28.
10. CDC. CDC Criteria for anemia in children and childbearing-aged women. Morbid Mortal Weekly Rep. 1989;38:400–4.
11. Charache S. Hemoglobinopathies. In: Bern M, Frigoletto F (eds) Hematologic disorders in maternal-fetal medicine. Wiley & Liss, New York, 1990;171–81.
12. Ekeroma A, Ansari A, Stirrat G. Blood transfusion in obstetrics and gynaecology. Br J Obstet Gynaecol. 1997;104:278–84.
13. Hallberg L. Prevention of iron deficiency. Baillieres Clin Haematol. 1994;7:805–14.
14. Hemminki E, Meriläinen J. Long-term follow- up of mothers and their infants in a randomized trial on iron prophylaxis during pregnancy. Am J Obstet Gynecol. 1995;173:205–9.
15. Hollan S, Johansen K. Adequate iron stores and the »nil nocere« principle. Haematologia. 1993.
16. Huch R, Huch A. Erythropoietin in obstetrics. Hematol Oncol Clin North Am. 1994;8:1021–40.
17. Krafft A, Bencaiova B, Breymann C. Selective use of recombinant human erythropoietin in pregnant patients with severe anemia or nonresponsive to iron sucrose alone. Fetal Diagn Ther. 2009;25:239-45.
18. Malek A. In vitro studies of ferric carboxymaltose on placental permeability using the dual perfusion model of human placenta. Drug Res. 2009;in press.
19. Seid M, Derman R, Banach W, Goldberg C, Rogers R. Ferric carboxymaltose injection in the treatment of iron deficiency anemia: a randomized controlled clinical trial. Am J Obstet Gynecol. 2008;199:435. e 1-7.
20. Van Wyck D, Martens M, Baker J, Mangione A. Intravenous ferric carboxymaltose compared with oral iron in the treatment of postpartum anemia: a randomized controlled trial. Obstet Gynecol. 2007;110:267-78.
21. Wali A., Mushtaq A. Efficacy, safety and compliance of intravenous iron sucrose and intramuscular iron sorbitol in iron deficiency anemia in pregnancy. J Pak Med Assoc. 2002;52:392-5.
Correspondencia:
Schmelzbergstr 12 /PF 125
Correo electrónico: Christian.breymann@usz.ch













