Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.60 no.1 Lima 2014
SIMPOSIO AVANCES EN INFERTILIDAD
Modelo predictivo de fragmentación de ADN espermático usando parámetros evaluados en un espermatograma
Predictive model of sperm DNA fragmentation using spermatogram-determined parameters
Jimmy Portella1, Rosmary López2, Luis Noriega-Hoces3, Luis Guzmán1,2
1 Grupo PRANOR
2 Reprogenetics Latinoamerica
3 Clínica Concebir
RESUMEN
Introducción: El análisis de espermatograma es utilizado como una prueba diagnóstica de la calidad seminal. Recientemente, el análisis de fragmentación espermática ha tomado importancia dado los diversos estudios que han demostrado que la integridad del ADN en el espermatozoide afectaría los resultados clínicos en los tratamientos de reproducción asistida. Objetivos: Identificar las variables analizadas en un espermatograma que predecirían independientemente el índice de fragmentación de ADN espermático (IFE). Diseño: Estudio retrospectivo, comparativo. Instituciones: Grupo PRANOR, Reprogenetics Latinoamerica, Clínica Concebir, Lima, Perú. Material biológico: Espermatozoides. Métodos: Se comparó variables individuales y dos modelos: el primero consideró el porcentaje de vialidad espermática y la edad del paciente; el segundo modelo incluyó el porcentaje de espermatozoides motiles y la edad. Se hizo análisis de regresión logística. Principales medidas de resultados: Viabilidad espermática, edad. Resultados: El análisis multivariado demostró que los dos modelos fueron significantemente superiores a las variables individuales (p<0,01). El primer modelo tuvo valores de coeficiente no estandarizados (IC95%) de 0,200 (0,082 a 0,318) y -0,146 (-0,206 a -0,086), respectivamente. El segundo modelo tuvo valores de coeficiente no estandarizados (IC95%) de -0,099 (-0,157 a -0,042) y 0,219 (0,99 a 0,339), respectivamente. El análisis de regresión logística demostró que el porcentaje de viabilidad espermática y la edad del paciente predijeron la probabilidad de tener un IFE superior al 30% con valores de coeficiente no estandarizados de edad de IC95% 0,034 (0,015 a 0,053) y porcentaje de viabilidad de -0,043 (0,034 a 0,052). Adicionalmente, el segundo modelo tuvo IC95% de -0,04 (-0,031 a -0,049) y 0,035 (0,017 a 0,053), respectivamente. Finalmente, una curva ROC construida para determinar la superioridad de algún modelo sobre las variables individuales demostró que las áreas bajo la curva (ABC) del modelo 1 (edad y viabilidad espermática) fue 0,727 (IC95% = 0,665 a 0,790) y el modelo 2 (edad y motilidad total de espermatozoides) 0,675 (IC95% = 0,606 a 0,744), comparadas con las ABC del porcentaje de viabilidad espermática = 0,295 (IC95% = 0,229 a 0,362), motilidad total de espermatozoides ABC = 0,333 (IC95% = 0,264 a 0,403) y edad de paciente con ABC 0,584 (IC95% = 0,510 a 0,658). Conclusiones: La edad, motilidad y viabilidad espermática correlacionaron de manera independiente con el IFE y, por tanto, estas variables podrían ser usadas como predictores del porcentaje de fragmentación de ADN.
Palabras clave: Infertilidad masculina, espermatozoides, edad, el índice de fragmentación de ADN espermático.
ABSTRACT
Introduction: The spermatogram is used as a test of seminal quality. Recently, the sperm fragmentation test has demonstrated importance as sperm DNA integrity would affect clinical results in assisted reproduction treatments. Objectives: To determine spermatogram variables that would independently predict sperm DNA fragmentation index (SFI). Design: Retrospective, comparative study. Settings: Grupo PRANOR, Reprogenetics Latinoamerica, Clinica Concebir, Lima, Peru. Biologic material: Sperm. Methods: Individual variables and two models were compared: the first model considered percentage of sperm viability and patients age; the second model included percentage of motile sperms and age. Logistic regression analysis was done. Main outcome measures: Sperm viability, age. Results: Multivariate analysis showed that both models were significantly superior to individuals variables (p<0.01). The first model had non standardized coefficient values (95%CI) respectively of 0.200 (0.082 to 0.318) and -0.146 (-0.206 to -0.086). The second model had non standardized coefficient values (95%CI) respectively of -0.099 (-0.157 to -0.042) and 0.219 (0.99 to 0.339). Logistic regression analysis showed that the percentage of sperm viability and patients age predicted the probability of having an SFI over 30% with age non standardized coefficient values of 95%IC 0.034 (0.015 to 0.053) and viability percentage of -0.043 (0.034 to 0.052). Additionally the second model had 95%CI respectively of -0.04 (-0.031 to -0.049) and 0.035 (0.017 to 0.053). Finally, a ROC curve to determine the superiority of some model over individual variables showed that areas under the curve (ABC) of model 1 (age and sperm viability) was 0.727 (95%CI = 0.665 to 0.790) and model 2 (age and sperm total motility) 0.675 (95%CI = 0.606 to 0.744), compared with ABC of percentage of sperm viability = 0.295 (95%CI = 0.229 to 0.362), sperm total motility ABC = 0.333 (95%CI = 0.264 to 0.403) and patients age with ABC 0.584 (95%CI = 0.510 to 0.658). Conclusions: Age, and sperm motility and viability independently correlated with SFI and consequently these variables could be used as predictors of DNA fragmentation percentage.
Keywords: Male infertility, sperm, age, sperm DNA fragmentation index.
INTRODUCCIÓN
La infertilidad es una enfermedad del sistema reproductivo definida como la incapacidad de lograr un embarazo clínico después de 12 meses o más de relaciones sexuales no protegidas(1). Adicionalmente, se considera que el factor masculino contribuye con el 50% de los casos(2). El análisis del semen por observación macroscópica y microscópica es utilizado como un diagnóstico de la calidad seminal(3). Sin embargo, estos valores no son buenos predictores del potencial fértil en los hombres(4). La infertilidad masculina es un problema multifactorial que puede ser el resultado de anormalidades congénitas, infecciones del tracto reproductor, varicocele, trastornos endocrinos, factores genéticos, inmunológicos y factores ocupacionales o ambientales(5-7). No obstante, en un grupo de pacientes se desconoce la etiología de la infertilidad(8), razón por la cual son categorizados con infertilidad masculina inexplicada, con una incidencia aproximada de 15% (9).
En el espermatozoide, la cromatina espermática está ultra empaquetada con proteínas básicas ricas en arginina, denominadas protaminas(10). El recambio de histonas por protaminas se da en el transcurso de la espermiogénesis, permitiendo el super empaquetamiento del ADN. Como consecuencia se logra disminuir el volumen nuclear hasta 10 veces comparado con el volumen nuclear en una célula somática, lo cual favorecería la motilidad del espermatozoide y a su vez protegería el material genético (11).
A pesar de que el material genético está protegido, existen factores que podrían afectarlo, produciendo rupturas en el ADN(12). Actualmente, este daño sobre el espermatozoide no es evaluado en los análisis de rutina que los especialistas en fertilidad emplean para diagnosticar infertilidad masculina(13). No obstante, en la última década diversos estudios han demostrado que la integridad del ADN en el espermatozoide afectaría los resultados clínicos en los tratamientos de reproducción asistida(14,15). Es por ello que el presente trabajo busca determinar cuáles son las variables analizadas en el espermatograma que independientemente correlacionarían con los índices de fragmentación espermática (IFE).
MÉTODOS
Entre agosto de 2010 y diciembre de 2012; 316 nuevos pacientes que llegaron a nuestro centro por una consulta de fertilidad, emitieron muestra seminal para análisis de espermatograma y fragmentación espermática por dispersión de cromatina espermática (SCD). Los parámetros seminales fueron evaluados según las recomendaciones de la OMS(3). Brevemente, 30 minutos luego de emitida la muestra, el volumen y la viscosidad fueron evaluadas usando una pipeta volumétrica descartable; el pH fue evaluado usando una tira indicadora de pH entre valores de 6,5 y 10 (Merck). La concentración espermática fue calculada en una cámara Makler. Finalmente, la viabilidad de los espermatozoides fue cuantificada con tinción de eosina al 0,5% bajo microscopio (Olympus) y la morfología fue evaluada al siguiente día.
Posterior al análisis de espermatograma, una fracción del semen fue separada mediante gradiente de densidad. La prueba de SCD se basó en lo descrito por Fernandez y colaboradores (16,17). Brevemente, el pellet de espermatozoides fue lavado en buffer fosfato alcalino (PBS) y resuspendido a una concentración máxima de 10 millones/mL. Los espermatozoides fueron diluidos a una solución de 0,7% de agarosa. La solución fue expandida sobre una lámina portaobjeto e incubada con una solución ácida (buffer de lisis). La muestra fue contrastada con el colorante 4,6 diamino-2-fenilindo (DAPI) (2µg/mL) y evaluada bajo microscopio de fluorescencia. Se contabilizó 500 espermatozoides por muestra, tomándose como criterio de evaluación la formación de un halo de cromatina alrededor de la cabeza del espermatozoide, para ser considerado como espermatozoide no fragmentado. El IFE fue determinado dividiendo el número total de espermatozoides fragmentados respecto al total de analizados.
Los datos de características de los pacientes y parámetros del análisis seminal fueron colectados retrospectivamente. Como criterio de inclusión se consideró a pacientes que emitieron muestras seminales para su primer estudio de espermatograma y fragmentación espermática por SCD y con al menos 1% de espermatozoides motiles. Como criterios de exclusión, se consideró las muestras de biopsias testiculares o epididimales y necrozoospermia.
Para establecer un modelo predictivo de fragmentación espermática, el punto de corte establecido fue de 30% de IFE. Este número representa el punto de corte propuesto por Bungum y col. (18) como el valor máximo de fragmentación para que un paciente tenga un hijo nacido vivo usando inseminación intrauterina como método de fecundación.
El análisis de correlación usando el método de Sperman´s Rank y sus respectivos valores de p fueron calculados entre los parámetros seminales y la fragmentación espermática. El análisis multivariado de regresión fue ejecutado con el objetivo de identificar las variables predictivas con los valores de fragmentación espermática (IFE). Para evitar colinerialidad entre los variables incluidas en los modelos, se usó el método de stepwise; para ello, valores de p entre 0,05 y 0,1 fueron considerados para la adición o eliminación de una variable en el modelo predictivo. Finalmente, el modelo que incorporara las variables, una curva de característica operativa del receptor (del inglés: receiver operating characteristic –ROC-) (COR) fue construida. Se definió valor de p<0,05 como diferencia estadística significativa. Todas las pruebas estadísticas fueron realizadas usando el SPSS 20.0.
RESULTADOS
Todos los pacientes incluidos en el presente estudio retrospectivo fueron pacientes que por primera vez asistieron a nuestro centro y se realizaron la prueba de espermatograma y fragmentación espermática por SCD en la misma muestra de semen. Se incluyó 316 pacientes durante en el periodo de estudio; el promedio de edad de los pacientes fue 39,6 ± 7,4, con un rango de 22 a 68 años.
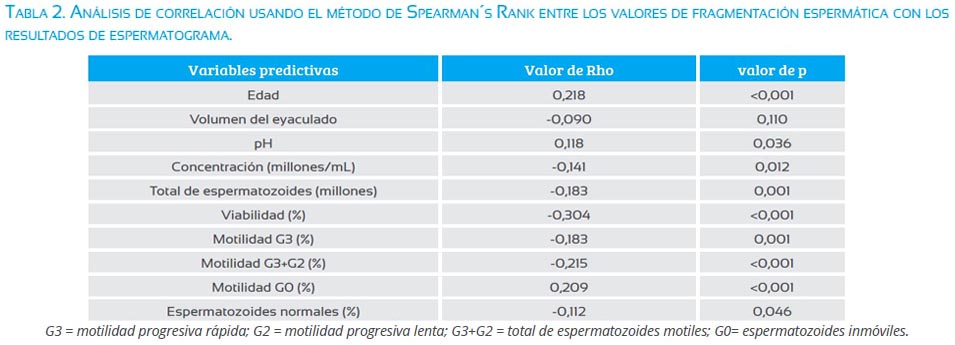
Los resultados de los espermatogramas son presentados en la tabla 1. La misma tabla presenta los resultados subdividiendo la población de estudio en grupos etarios. El promedio de fragmentación espermática en la población de estudio fue 25,1 ± 8,1 (IC95% 24,1 a 26). El análisis de correlación de Sperman Rank demostró que la edad, pH, concentración de espermatozoides por mililitro, concentración total de espermatozoides en el eyaculado, porcentaje de viabilidad espermática, porcentaje de motilidad progresiva rápida (G3), porcentaje total de espermatozoides motiles (G3+G2), porcentaje de espermatozoides inmóviles (G0) y porcentaje de espermatozoides normales correlacionaron significativamente con fragmentación espermática (tabla 2).
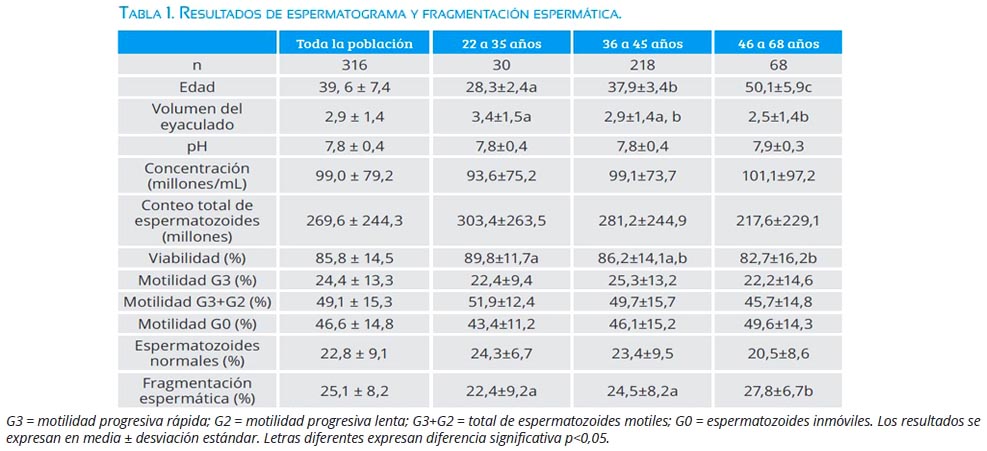
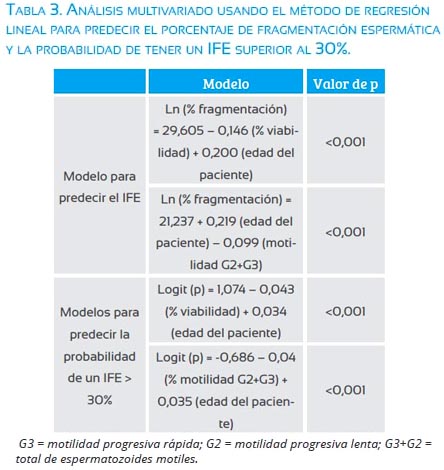
Sin embargo, el análisis multivariado demostró que dos modelos pueden ser propuestos para predecir el IFE. El primero considera al porcentaje de vialidad espermática y la edad del paciente, con valores de coeficiente no estandarizados de 0,200 (IC95% = 0,082 a 0,318) y -0,146 (IC95% = -0,206 a -0,086), respectivamente. El segundo modelo incluye al porcentaje de espermatozoides motiles (G3+G2) y la edad con valores de coeficiente no estandarizados de -0,099 (IC95% = -0,157 a -0,042) y 0,219 (IC95% = 0,99 a 0,339), respectivamente. Adicionalmente, con un análisis de regresión logística se identificó las variables que predicen la probabilidad de tener valores de fragmentación superior al 30%, siendo edad y el porcentaje de viabilidad espermática las variables independientes incluidas en el modelo, con valores de coeficiente no estandarizados de edad de 0,034 (IC95% = 0,015 a 0,053) y porcentaje de viabilidad de -0,043 (IC95% = 0,034 a 0,052). Sin embargo, motilidad total de espermatozoides y edad predijeron significativamente (p<0,001) con valores de coeficiente no estandarizados de -0,04 (IC95% = -0,031 a -0,049) y 0,035 (IC95% = 0,017 a 0,053), respectivamente (tabla 3).
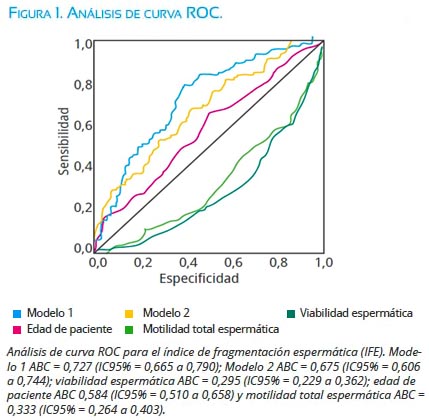
Finalmente, se realizó una curva de ROC para determinar la superioridad del modelo sobre las variables individuales, demostrándose que las áreas bajo la curva (ABC) del modelo 1 (edad y viabilidad espermática) fue 0,727 (IC95% = 0,665 a 0,790) y del modelo 2 (edad y motilidad total de espermatozoides) 0,675 (IC95% = 0,606 a 0,744), comparadas con las ABC del porcentaje de viabilidad espermática, con una ABC = 0,295 (IC95% = 0,229 a 0,362), motilidad total de espermatozoides ABC= 0,333 (IC95% = 0,264 a 0,403) y edad de paciente con una ABC 0,584 (IC95% = 0,510 a 0,658); fueron significativamente superiores (p=0,01), aunque no existió diferencias entre los modelos 1 y 2 (p=0,127) (figura 1).
DISCUSIÓN
El espermatograma es usado como la principal herramienta para conocer el perfil reproductivo en el hombre(3), pero la falta de correlación con el potencial fértil(4) hace necesaria la búsqueda de nuevos marcadores, como la fragmentación del ADN en el espermatozoide (13).
A diferencia del impacto de la edad femenina sobre la función reproductiva (19), el hombre no experimenta un cese repentino en su capacidad reproductiva(20). Sin embargo, el envejecimiento masculino puede ejercer un ligero efecto negativo sobre los órganos y tejidos reproductivos (20). Cambios en el volumen testicular fueron observados a una edad por encima de los 80 años en hombres sanos, con una reducción del 31% en comparación al grupo de edad entre 18 y 40 años(21). De otro modo, el efecto de la edad sobre las variables analizadas en el espermatograma ha sido estudiado, sin resultados concluyentes. Al parecer, la disminución en el volumen seminal es la variable con mayor frecuencia asociada con el incremento de la edad masculina, mientras que otras variables (concentración, motilidad y morfología) no disminuyeron con la edad (22). Sin embargo, otro estudio demostró que el incremento de la edad masculina se asocia con una disminución del volumen del eyaculado, motilidad y morfología espermática, pero no con la concentración espermática(23). En el presente trabajo, similares resultados han sido obtenidos, observándose una disminución en el volumen seminal en el grupo de edad entre 46 y 68 años en comparación al grupo de 22 a 35 años de edad. Además, la viabilidad espermática fue significativamente menor en el grupo de edad entre 46 y 68 años comparado con en el grupo entre 22 y 35 años de edad. Este último parámetro no ha sido comunicado por otros estudios, enfocados principalmente en la motilidad, concentración y morfología espermática (22,23).
La fragmentación del ADN espermático puede ser evaluado por una serie de pruebas, entre las que destacan el TUNEL (marcación de la desoxiuridina trifosfato (UTP) final mediada por la desoxinucleotidil transferasa terminal, terminal deoxynucleotidyl transferase mediated DUTP end labelling), cometa, dispersión de cromatina espermática (SCD) y SCSA (ensayo de la estructura de la cromatina espermática) (24). La técnica de SCD es una prueba para el análisis de la fragmentación de ADN que puede ser aplicada con facilidad en cualquier laboratorio de andrología(17). Esta prueba tiene una fuerte relación con TUNEL y SCSA en la evaluación de la fragmentación del ADN espermático (25). La etiología de la fragmentación del ADN puede deberse a varios mecanismos, como la apoptosis abortiva durante la espermatogénesis, rotura de las cadenas de ADN durante el remodelamiento de la cromatina espermática en la espermiogénesis, daño del ADN post-testicular (epidídimo) inducido por especies reactivas de oxígeno, radioterapia/quimioterapia y tóxicos ambientales(26).
En un estudio prospectivo de un programa de reproducción asistida, los parámetros espermáticos de concentración, motilidad y morfología de 622 hombres correlacionaron negativamente con la tasa de fragmentación de ADN evaluado por SCD(27). Moskovtsev y col.(28) evaluaron la muestra seminal de 2 586 pacientes no azoospérmicos no seleccionados, mediante un análisis de semen computarizado y evaluación del daño del ADN espermático por SCSA expresado como IFE. El IFE fue negativamente correlacionado con parámetros espermáticos (volumen seminal, concentración, motilidad, morfología y viabilidad espermática) y positivamente con la edad del paciente. Similarmente, en el presente estudio el IFE, correlacionó negativamente con los principales parámetros espermáticos (concentración, motilidad, morfología y viabilidad espermática) y positivamente con la edad del paciente que acudieron al centro por una consulta de fertilidad. Sin embargo, Winkle y col.(29) no demostraron una asociación entre IFE y la edad del paciente. Posiblemente, la falta de correlación se debía al uso de una técnica no validada para el análisis de fragmentación de ADN en espermatozoides.
En el presente estudio se propone dos modelos para predecir el IFE. Estos involucran la edad del paciente con viabilidad espermática (modelo 1) y la edad del paciente con motilidad progresiva (modelo 2). Estos dos modelos fueron significativamente superiores al compararlos con las variables individuales. EL valor predictivo de estas variables podría ser explicado debido a que la fragmentación del ADN espermático ha sido asociada con las especies reactivas de oxígeno (ERO), aunque bajo niveles fisiológicos estas cumplen un importante rol en el proceso de capacitación(30). Sin embargo, diversos estudios han mostrado que niveles elevados de ERO pueden alterar la motilidad y viabilidad del espermatozoide por mecanismos como pérdida del potencial de membrana mitocondrial, peroxidación lipídica y fragmentación de ADN, que finalmente conducen a muerte celular(31-33). Además, la proporción de espermatozoides muertos inducen significativamente un aumento en la generación de EROS y fragmentación de ADN en la población espermática, con resultados negativos en el potencial reproductivo (34).
Finalmente, nuestros resultados pueden ayudar al diagnóstico y tratamiento del factor masculino. En caso que estos pacientes ingresen a un programa de reproducción asistida, la predicción del IFE usando los modelos propuestos junto a otras técnicas nos permiten abordar con mayor certeza la técnica de inseminación (35) y ayudarnos en el uso de técnicas alternativas que seleccionen espermatozoides con contenido de protamina normal y menor fragmentación de ADN, tales como el procedimiento de selección espermática por unión al ácido hialurónico en casos de inyección intracitoplasmática (ICSI)(36).
En conclusión, el presente trabajo demuestra que la edad, motilidad y viabilidad espermática correlacionaron independientemente con el IFE y, por tanto, estas variables podrían ser usadas como predictores del porcentaje de fragmentación de ADN.
REFERENCIAS BIBLIOGRÁFICAS
1. Zegers-Hochschild F, Adamson GD, de Mouzon J, Ishihara O, Mansour R, Nygren K, et al. International Committee for Monitoring Assisted Reproductive Technology (ICMART) and the World Health Organization (WHO) revised glossary of ART terminology, 2009. Fertil Steril. 2009;92(5):1520-4. [ Links ]
2. Eisenberg ML, Lathi RB, Baker VL, Westphal LM, Milki AA, Nangia AK. Frequency of the male infertility evaluation: data from the national survey of family growth. J Urol. 2013;189(3):1030-4. [ Links ]
3. World Health Organization. WHO laboratory manual for the examination and processing of human semen. 5th ed. Geneva: World Health Organization; 2010, xiv: 271 pp. [ Links ]
4. Guzick DS, Overstreet JW, Factor-Litvak P, Brazil CK, Nakajima ST, Coutifaris C, et al. Sperm morphology, motility, and concentration in fertile and infertile men. N Engl J Med. 2001;345(19):1388-93. [ Links ]
5. Irvine DS. Epidemiology and aetiology of male infertility. Hum Reprod. 1998;13 (Suppl 1):33-44. [ Links ]
6. Shah K, Sivapalan G, Gibbons N, Tempest H, Griffin DK. The genetic basis of infertility. Reproduction. 2003;126(1):13-25. [ Links ]
7. Younglai EV, Holloway AC, Foster WG. Environmental and occupational factors affecting fertility and IVF success. Hum Reprod Update. 2005;11(1):43-57. [ Links ]
8. OFlynn OBrien KL, Varghese AC, Agarwal A. The genetic causes of male factor infertility: a review. Fertil Steril. 2010;93(1):1-12. [ Links ]
9. Hamada A, Esteves SC, Nizza M, Agarwal A. Unexplained male infertility: diagnosis and management. International braz j urol. 2012;38(5):576-94. [ Links ]
10. DeRouchey J, Hoover B, Rau DC. A comparison of DNA compaction by arginine and lysine peptides: a physical basis for arginine rich protamines. Biochemistry. 2013;52(17):3000-9. [ Links ]
11. Miller D, Brinkworth M, Iles D. Paternal DNA packaging in spermatozoa: more than the sum of its parts? DNA, histones, protamines and epigenetics. Reproduction. 2010;139(2):287-301. [ Links ]
12. Noblanc A, Damon-Soubeyrand C, Karrich B, Henry-Berger J, Cadet R, Saez F, et al. DNA oxidative damage in mammalian spermatozoa: where and why is the male nucleus affected? Free radical biology & medicine. 2013.
13. Shamsi MB, Imam SN, Dada R. Sperm DNA integrity assays: diagnostic and prognostic challenges and implications in management of infertility. J Assist Reprod Genet. 2011;28(11):1073-85. [ Links ]
14. Schulte RT, Ohl DA, Sigman M, Smith GD. Sperm DNA damage in male infertility: etiologies, assays, and outcomes. J Assist Reprod Genet. 2010;27(1):3-12. [ Links ]
15. Robinson L, Gallos ID, Conner SJ, Rajkhowa M, Miller D, Lewis S, et al. The effect of sperm DNA fragmentation on miscarriage rates: a systematic review and meta-analysis. Hum Reprod. 2012;27(10):2908-17. [ Links ]
16. Fernandez JL, Cajigal D, Lopez-Fernandez C, Gosalvez J. Assessing sperm DNA fragmentation with the sperm chromatin dispersion test. Methods Mol Biol. 2011;682:291-301. [ Links ]
17. Fernandez JL, Muriel L, Goyanes V, Segrelles E, Gosalvez J, Enciso M, et al. Simple determination of human sperm DNA fragmentation with an improved sperm chromatin dispersion test. Fertil Steril. 2005;84(4):833-42. [ Links ]
18. Bungum M, Humaidan P, Axmon A, Spano M, Bungum L, Erenpreiss J, et al. Sperm DNA integrity assessment in prediction of assisted reproduction technology outcome. Hum Reprod. 2007;22(1):174-9. [ Links ]
19. Balasch J. Ageing and infertility: an overview. Gynecol Endocrinol. 2010;26(12):855-60. [ Links ]
20. Amann RP. The cycle of the seminiferous epithelium in humans: a need to revisit? J Androl. 2008;29(5):469-87. [ Links ]
21. Handelsman DJ, Staraj S. Testicular size: the effects of aging, malnutrition, and illness. J Androl. 1985;6(3):144-51. [ Links ]
22. Dain L, Auslander R, Dirnfeld M. The effect of paternal age on assisted reproduction outcome. Fertil Steril. 2011;95(1):1-8. [ Links ]
23. Kidd SA, Eskenazi B, Wyrobek AJ. Effects of male age on semen quality and fertility: a review of the literature. Fertil Steril. 2001;75(2):237-48. [ Links ]
24. Lewis SE, John Aitken R, Conner SJ, Iuliis GD, Evenson DP, Henkel R, et al. The impact of sperm DNA damage in assisted conception and beyond: recent advances in diagnosis and treatment. Reprod Biomed Online. 2013. [ Links ]
25. Chohan KR, Griffin JT, Lafromboise M, De Jonge CJ, Carrell DT. Comparison of chromatin assays for DNA fragmentation evaluation in human sperm. J Androl. 2006;27(1):53-9. [ Links ]
26. Sakkas D, Alvarez JG. Sperm DNA fragmentation: mechanisms of origin, impact on reproductive outcome, and analysis. Fertil Steril. 2010;93(4):1027-36. [ Links ]
27. Velez de la Calle JF, Muller A, Walschaerts M, Clavere JL, Jimenez C, Wittemer C, et al. Sperm deoxyribonucleic acid fragmentation as assessed by the sperm chromatin dispersion test in assisted reproductive technology programs: results of a large prospective multicenter study. Fertil Steril. 2008;90(5):1792-9. [ Links ]
28. Moskovtsev SI, Willis J, White J, Mullen JB. Sperm DNA damage: correlation to severity of semen abnormalities. Urology. 2009;74(4):789-93. [ Links ]
29. Winkle T, Rosenbusch B, Gagsteiger F, Paiss T, Zoller N. The correlation between male age, sperm quality and sperm DNA fragmentation in 320 men attending a fertility center. J Assist Reprod Genet. 2009;26(1):41-6. [ Links ]
30. OFlaherty C, de Lamirande E, Gagnon C. Positive role of reactive oxygen species in mammalian sperm capacitation: triggering and modulation of phosphorylation events. Free radical biology & medicine. 2006;41(4):528-40.
31. Koppers AJ, Mitchell LA, Wang P, Lin M, Aitken RJ. Phosphoinositide 3-kinase signalling pathway involvement in a truncated apoptotic cascade associated with motility loss and oxidative DNA damage in human spermatozoa. Biochem J. 2011;436(3):687-98. [ Links ]
32. Benedetti S, Tagliamonte MC, Catalani S, Primiterra M, Canestrari F, De Stefani S, et al. Differences in blood and semen oxidative status in fertile and infertile men, and their relationship with sperm quality. Reprod Biomed Online. 2012;25(3):300-6. [ Links ]
33. Aitken RJ, Jones KT, Robertson SA. Reactive oxygen species and sperm function--in sickness and in health. J Androl. 2012;33(6):1096-106. [ Links ]
34. Roca J, Martinez-Alborcia MJ, Gil MA, Parrilla I, Martinez EA. Dead spermatozoa in raw semen samples impair in vitro fertilization outcomes of frozen-thawed spermatozoa. Fertil Steril. 2013. [ Links ]
35. Pregl Breznik B, Kovacic B, Vlaisavljevic V. Are sperm DNA fragmentation, hyperactivation, and hyaluronan-binding ability predictive for fertilization and embryo development in in vitro fertilization and intracytoplasmic sperm injection? Fertil Steril. 2013;99(5):1233-41. [ Links ]
36. Nasr-Esfahani MH, Razavi S, Vahdati AA, Fathi F, Tavalaee M. Evaluation of sperm selection procedure based on hyaluronic acid binding ability on ICSI outcome. J Assist Reprod Genet. 2008;25(5):197-203. [ Links ]
Trabajo ganador del concurso Premio Merck Serono, XVI Congreso Peruano de Medicina Reproductiva y I Congreso Latinoamericano de ISMAAR, Lima, setiembre de 2013
Los autores declaramos que el presente trabajo es inédito
Se señala que no existen conflictos de interés
Correspondencia:
Luis Guzmán Masías, PhD(c)
Teléfono: +511-4225246
lguzman@fertilidadperu.com














