Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Ginecología y Obstetricia
On-line version ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.60 no.1 Lima 2014
SIMPOSIO AVANCES EN INFERTILIDAD
Descarga de la maduración final ovocitaria con gonadotropina coriónica humana o un agonista de la GnRH en donantes de ovocitos: análisis retrospectivo de cohortes
Final oocyte maturation discharge with either human chorionic gonadotropin or GnRH agonist in oocyte donors: cohort retrospective analysis
Jimmy Portella1, Pedro Bendezú1,2, Luis Noriega-Hoces1,2, Luis NoriegaPortella1,2, Soledad Sepúlveda1
1 Grupo PRANOR
2 Clínica Concebir
RESUMEN
El protocolo de antagonistas de la GnRH (antGnRH) ha permitido el uso del agonista de la GnRH (aGnRH) como inductor de la descarga ovulatoria (DO), en reemplazo de la gonadotropina coriónica humana (hCG). Una ventaja importante con respecto al uso del aGnRH en la DO es que disminuye significativamente el riesgo del síndrome de hiperestimulación ovárica (SHEO), debido a su efecto luteolítico, de importancia en casos de donantes de ovocitos. Objetivos: Comparar la proporción de ovocitos obtenidos, calidad ovocitaria/embrionaria, resultado reproductivo y la incidencia de SHEO en ciclos de donación de ovocitos consecutivos, donde la DO fue con hCG o aGnRH. Adicionalmente, se comparó los ciclos con diagnóstico genético preimplantacional. Diseño: Estudio retrospectivo de cohortes. Institución: Grupo PRANOR, Clínica Concebir, Lima, Perú. Participantes: Donantes y receptoras de ovocitos. Intervenciones: Se utilizó un protocolo antGnRH en 43 donantes de ovocitos para 203 ciclos de estimulación consecutiva y DO con hCG (n=127) o aGnRH (n=76) basados en una decisión clínica y del conteo folicular. Los ovocitos fueron asignados, parte de ellos, a un banco de ovocitos (vitrificación) o a 303 ciclos de receptoras de ovocitos. Principales medidas de resultados: Ovocitos aspirados, tasa de fecundación, calidad embrionaria, formación a blastocisto. Resultados: Se observó diferencias significativas en el número de ovocitos aspirados a favor del grupo aGnRH sobre el grupo hCG (24,09±12,24 versus 18,69±8,93, p=0,002, respectivamente). No hubo diferencias significativas en el resultado global de proporción de ovocitos maduros, tasa de fecundación, calidad embrionaria, formación a blastocisto entre los grupos comparados. La proporción de embriones cromosómicamente normales fueron similares entre los grupos aGnRH (35,2%) y hCG (34,53%), mientras que las tasas globales de embarazo (64,49% versus 62,59%), implantación (45,41% versus 42,38%) y aborto (8,7% versus 8,7%) fueron comparables. La incidencia de SHEO fue reducida significativamente en el grupo de DO con aGnRH (0%), en comparación al grupo hCG (18,9%, p<0,0001). Conclusiones: La DO con el aGnRH es un método seguro y eficaz para ser aplicado en pacientes con alto riesgo de SHEO, como las donantes de ovocitos, eliminando por completo el SHEO. La calidad embrionaria y resultados reproductivos fueron idénticos entre los grupos de DO con aGnRH y hCG.
Palabras clave: Antagonistas de GnRH, agonistas de GnRH, ovocitos, calidad ovocitaria/embrionaria, resultado reproductivo, síndrome de hiperestimulación ovárica.
ABSTRACT
The GnRH antagonists (GnRHant) protocol has allowed the use of GnRH agonist (GnRHa) as inductor of ovulatory discharge (OD) replacing human chorionic gonadotropin (hCG). An important advantage of GnRHa use in OD is that it significantly decreases the risk of ovarian hyperstimulation syndrome (OHSS) due to its luteolytic effect, important in cases of oocyte donors. Objectives: To compare proportion of oocytes obtained, oocyte/embryo quality, reproductive result and OHSS incidence in consecutive oocyte donation cycles when OD was done with hCG or GnRHa. Cycles with preimplantation genetic diagnosis were compared. Design: Cohort retrospective study. Setting: Grupo PRANOR, Clinica Concebir, Lima, Peru. Participants: Oocyte donors and receptors. Interventions: A GnRHant protocol was used in 43 oocyte donors for 203 consecutive stimulation cycles and OD with hCG (n=127) or GnRHa (n=76) based in clinical decision and follicular count. Oocytes were assigned either to an oocyte bank (vitrification) or to 303 cycles of oocyte receptors. Main outcome measures: Oocytes aspired, fecundation rate, embryo quality, blastocyst formation. Results: There were significant differences in number of oocytes aspired in favor of the GnRHa group with regards to the hCG group (24.09±12.24 versus 18.69±8.93, p=0.002 respectively). There were no significant differences among the groups compared in the global result of mature oocytes proportion, fecundation rate, embryo qulity, blastocyst formation. The proportion of chromosomically normal embryos was similar between GnRHa (35.2%) and hCG (34.53%) groups, and pregnancy (64.49% versus 62.59%), implantation (45.41% versus 42.38%) and abortion (8.7% versus 8.7%) global rates were comparable. OHSS incidence reduced significantly in the OD group with GnRHa (0%) compared with the hCG group (18.9%, p<0.0001). Conclusions: OD with GnRHa is a safe and efficacious method to use in patients with high risk of OHSS such as oocyte donors, as it completely eliminates OHSS. Embryo quality and reproductive results were identical between OD groups with GnRHa and hCG.
Keywords: GnRH antagonists, GnRH agonists, oocytes, oocyte/embryo quality, reproductive result, ovarian hyperstimulation syndrome.
INTRODUCCIÓN
En la reproducción asistida (RA), la gonadotropina coriónica humana (hCG) ha sido utilizada por muchos años para simular el pico endógeno de la hormona luteinizante (LH), debido a que existen considerables similitudes estructurales entre la hCG y la LH humana (1). Tanto la hCG urinaria como recombinante han demostrado ser eficaces para generar la descarga ovulatoria (DO) e inducción de la maduración ovocitaria final en ciclos de estimulación ovárica controlada (EOC) con análogos de la hormona liberadora de gonadotropina (GnRH) para la fecundación in vitro con transferencia embrionaria (FIV-TE) (2-3). Sin embargo, esta molécula exhibe una farmacocinética particular caracterizada por una larga vida media y por una actividad LH/hCG detectable incluso hasta por 10 días post-administración(4-5). Esto conlleva a una estimulación continua y prolongada de los receptores de LH/ hCG, lo que puede resultar en un síndrome de hiperestimulación ovárica (SHEO)(6,7).
El uso de protocolos con antagonistas de la GnRH (antGnRH) ha permitido inducir la DO y la maduración ovocitaria final mediante la administración de un aGnRH. Este concepto se fundamenta en la propiedad del agonista de producir un aumento súbito y por un plazo breve de los niveles de gonadotropinas endógenas (efecto flare up) en una aproximación más fisiológica que la hCG para inducir la maduración final ovocitaria(8). Una ventaja importante con respecto al uso de la GnRH en la DO es que disminuye significativamente el riesgo de SHEO debido a su efecto luteolítico(8-10).
Una característica del efecto flare up inducido por el aGnRH y que lo diferencia de la administración de la hCG es que el incremento de la actividad LH se acompaña además de un aumento en la actividad de la hormona folículo estimulante (FSH)(9,10). Este perfil endocrino podría ser beneficioso para el resultado del tratamiento. De interés, algunos estudios donde se utilizó algún aGnRH para la DO han mostrado una mayor incidencia de ovocitos maduros aspirados(11,12) y también mejores tasas de fecundación(13). Sin embargo, el efecto luteolítico del agonista podría generar un cuerpo lúteo disfuncional y una fase lútea (FL) pronunciadamente insuficiente con niveles bajos de estradiol (E2) y progesterona (P) (8,10). Una serie de estudios prospectivos y aleatorizados (EPA) realizados en pacientes normo-respondedoras han mostrado una disminución significativa en los resultados gestacionales en ciclo de FIV-TE(14).
La FIV con donación de ovocitos (FIV-OD) es un modelo apropiado para evaluar el efecto de un tratamiento sobre la calidad de los ovocitos y embriones, debido a la exclusión de la influencia que los protocolos de EOC ejercen sobre la receptividad endometrial en las receptoras(15). Por tanto, el efecto negativo sobre la fase lútea de la DO con aGnRH no representa un inconveniente que afecte los resultados del tratamiento. Adicionalmente, este tratamiento en donantes de ovocitos permite reducir el riesgo de SHEO, complicación de la EOC que es más frecuente en mujeres jóvenes hiperestimuladas(16). Por otro lado, se desconoce si la DO con el aGnRH o hCG en FIV-OD influye en el contenido cromosómico de los ovocitos y consecuentemente de los embriones.
Nuestro programa de FIV-OD ha ido introduciendo la estrategia de inducir la DO con un aGnRH, puesto que son pacientes de alto riesgo de SHEO. El objetivo del presente estudio retrospectivo fue comparar la proporción de ovocitos obtenidos, ovocitos maduros, tasas de fecundación y de calidad embrionaria; así como también la incidencia de SHEO moderado y severo en ciclos de FIV-OD cuando la DO fue realizada con hCG o aGnRH en la misma población de donantes en ciclos consecutivos. Adicionalmente, se evaluó los resultados (tasas de embarazo, implantación y aborto en las receptoras) de forma global, por técnica de inseminación y en casos con diagnóstico genético preimplantacional (DGP).
MÉTODOS
El presente es un estudio retrospectivo, de cohortes, realizado en una institución privada, donde 43 donantes voluntarias en 203 ciclos de donación de ovocitos fueron estimuladas con un protocolo de antGnRH y DO con hCG o con aGn-RH en las mismas donantes, en ciclos consecutivos; los ovocitos fueron asignados a vitrificación para un banco de ovocitos y a 333 receptoras de ovocitos (figura 1). El periodo de estudio estuvo comprendido entre enero 2010 y abril 2013. Todas las donaciones fueron anónimas, siendo aceptadas como donantes las mujeres con edad entre los 20 y 30 años con una evaluación física completa, psicológica, exámenes de laboratorio, cariotipo, entre otras enfermedades transmisibles genéticamente.
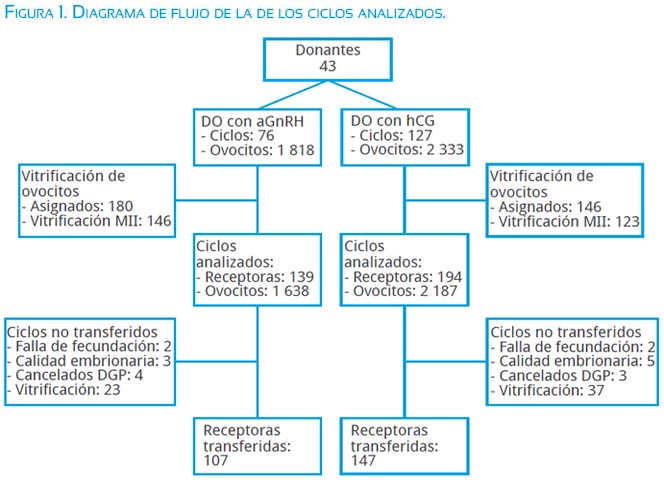
Las donantes fueron estimuladas, desde el segundo día del ciclo menstrual o luego de dos días de haber suspendido la toma de anticonceptivos orales, con FSH recombinante (FSHr) (Puregón®, MSD) o gonadotropina menopáusica humana ultra-pura (hMG-HP) (Menopur®, Ferring Biopas) o FSH ultra-pura (uFSH-HP) (Bravelle®, FerringBiopas) o una combinación de ellas y con una dosis inicial promedio de FSH de 200 UI. El antGnRH (Orgalutrán®, MSD) fue iniciado según el protocolo de dosis múltiple flexible (0,25 mg/día) cuando al menos un folículo alcanzó los 14 mm de diámetro mayor y máximo al octavo día de estimulación. La DO fue inducida cuando al menos tres folículos alcanzaron un diámetro mayor a 17 mm, ya fuera con 250 µg de coriogonadotropina alfa (hCG recombinante Ovidrel®, Merck Peruana) o bien con 0,5 mg de acetato de leuprolida (Luprón®, Abbott Perú). El agente inductor de la maduración ovocitaria fue elegido por el médico a cargo del tratamiento y quien realizó el último control ecográfico, teniendo en cuenta el número total de folículos y/o nivel final de E2 sérico. La aspiración folicular fue realizada 35 a 36 horas post DO.
Después de la captura de los ovocitos, todas las donantes fueron citadas para una evaluación a los 3 a 5 días; luego pasaron a un seguimiento sistemático por vía telefónica hasta por 10 días (periodo de riesgo para un SHEO precoz); fueron además instruidas sobre los posibles síntomas de un SHEO. Identificado algún síntoma o signo de SHEO, las donantes fueron citadas para evaluación clínica, ecográfica vaginal y abdominal y exámenes séricos (hemograma completo, perfil de coagulación, función renal y hepática y electrolitos). El SHEO fue clasificado de acuerdo a los criterios descritos por Rizk y Aboulghar(17).
A las receptoras con función ovárica se les suprimió la hipófisis mediante la administración de un aGnRH de depósito (Luprón depot® 3,75 mg, Abbott), en la mitad de la fase lútea del ciclo. Posteriormente, fue administrado el valerato de E2 oral (Progynova®, Schering) a una dosis inicial progresiva (2 a 6 mg/día) y posteriormente a un régimen de dosis constante (usualmente 6 mg/ día), para inducir el desarrollo endometrial. Se consideró apropiada una línea endometrial evaluada por ecografía ≥ 8 mm. Desde el día de la aspiración folicular de la donante, se adicionó 600 mg/día de P micronizada vaginal (Geslutín®, Tecnofarma), incrementándose además la dosis de valerato de E2 oral a 8 mg/día. Si la prueba de embarazo era positiva (cuantificación sérica de la subunidad beta de la hCG), el régimen de P y E2 se mantuvo hasta las 8 semanas de gestación.
Los ovocitos fueron colectados en medio Globlal® w/HEPES (IVF online, Canadá) suplementado al 10% con suero sintético sustituto (SSS) (Irvine Scientific, USA). Posteriormente, fueron transferidos y cultivados en medio Global® for Fertilization (IVF online, Canadá) suplementado al 10% SSS, bajo aceite mineral, a 37°C, en una atmósfera de 6,5% de CO2, 5% de O2 y 88,5% de N2. Para la inseminación en la FIV convencional, aproximadamente 50 000 a 100 000 espermatozoides fueron cocultivados con los complejos cúmulo-corona-ovocito. Para la ICSI, solo se inyectó aquellos ovocitos en el estadio de metafase II (MII), mediante procedimientos ya descritos previamente(18).
Los ovocitos fecundados (2PN) fueron cultivados individualmente en gotas de 10 µL de medio Global® (IVF online, Canadá) + 10% SSS, hasta el quinto o sexto día de desarrollo embrionario, cuando fueron transferidos o vitrificados. La evaluación del desarrollo embrionario se realizó de acuerdo a su apariencia morfológica, mediante métodos descritos(18).
Un exceso de ovocitos obtenidos y no asignados a las receptoras fue vitrificado. Solo se vitrificó ovocitos en metafase II (MII), dos horas después de la aspiración folicular. El protocolo usado fue el Cryotop method(19) con medios Kitazato® (KITAZATO BioPharma, Japón). El procedimiento fue desarrollado a temperatura ambiente (24°C).
Se realizó el DGP bajo recomendación clínica con diagnóstico de factor masculino, cuando los pacientes lo solicitaron. La biopsia se realizó en el día tres de desarrollo embrionario, en medio de biopsia (PGD Biopsy Medium, IVF online, Canadá). Para ello, se realizó una perforación en la zona pelúcida, con una solución de Tyrode ácido (IVF online, Canadá), y se retiró una célula con micropipeta. La blastómera fue expuesta a una solución hipotónica [0,075 mol/L KCl suplementada con 0,6% BSA (p/v)] y luego fijada con solución Carnoy sobre una lámina portaobjeto, para después ser sometida al análisis por hibridación fluorescente in situ (FISH), por un laboratorio de genética de referencia (Reprogenetics Latinoamérica, Perú).
Los resultados primarios medidos fueron las tasas de ovocitos maduros (MII), ovocitos fecundados, embriones de buena calidad en día 3, embriones euploides luego del DGP y formación a blastocisto. Adicionalmente, se comparó la incidencia de SHEO moderado y severo en las donantes de ovocitos. El resultado secundario medido fueron las tasas de embarazo, implantación y aborto por transferencia.
Los embriones de buena calidad en el día 3 de desarrollo tenían entre 6 y 10 blastómeras, <10% de fragmentación y ausencia de multinucleación.
El análisis estadístico fue desarrollado usando las pruebas t de Student, U de Mann – Whitney o chi cuadrado de Pearson, según correspondía. Un valor de P <,05 fue considerado significativo. Los datos fueron analizados utilizando el paquete estadístico STATA 12.0 (StataCorp, CollegeStation, TX, USA).
RESULTADOS
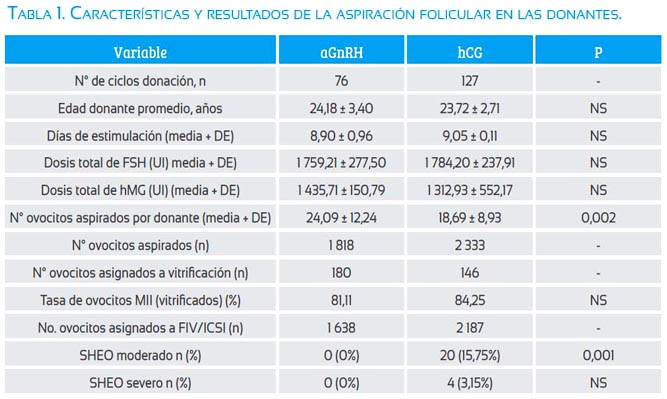
En la tabla 1 se muestra las características y resultados de la aspiración folicular en las donantes. No se observa diferencias significativas entre la edad, días de estimulación, dosis de FSH, dosis de hMG y la proporción de ovocitos maduros MII asignados a vitrificación. Sin embargo, dado que una de las condiciones para inducir la DO con aGnRH dependía del número de folículos previos antes de colocar el mismo o algún antecedente de SHEO en la donante, el número de ovocitos aspirados fue significativamente mayor en el grupo aGnRH (24,09±12,24) en comparación al grupo hCG (18,69±8,93; p=0,002). No se observó casos de SHEO moderado o severo en el grupo aGnRH, mientras que en el grupo hCG el SHEO moderado fue 15,75% (p=0,0001) y el SHEO severo fue 3,15% (p=NS), que hacen un global de 18,9% (p<0,0001, resultado no mostrado en la tabla).
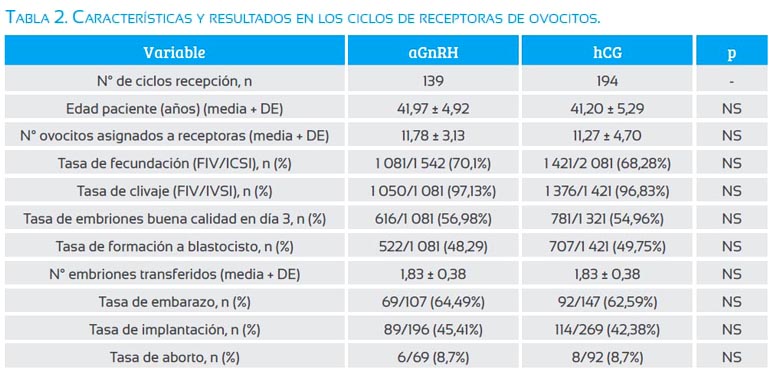
No se observó diferencias significativas en los ciclos de receptoras de ovocitos entre el grupo aGnRH y hCG (tabla 2), en cuanto a la edad de la paciente, número de ovocitos asignados, tasa de fecundación, tasa de clivaje, tasa de embriones de buena calidad en día 3, tasa de formación a blastocisto, número de embriones transferidos, tasa de embarazo, tasa de implantación y tasa de aborto.
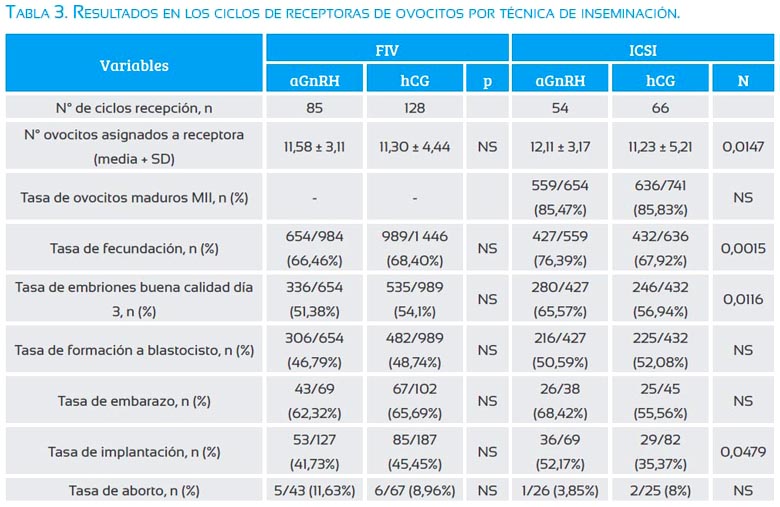
Cuando se analizó los ciclos de receptoras de ovocitos por técnica de inseminación (tabla 3) no se observó diferencias en FIV entre los grupos aGnRH y hCG. Mientras que en el caso de los ciclos de ICSI, el número de ovocitos asignados (12,11±8,93 versus 11,23±5,21, p=0,0147), tasa de fecundación (76,39 versus 67,92%, p=0,0015), tasa de embriones de buena calidad en día 3 (65,57 versus 56,94%, p=0,0116) y tasa de implantación (52,17 versus 35,37%, p=0,0479) fueron significativamente mayor en el grupo aGnRH comparado al grupo hCG, respectivamente; no se observó diferencia en la tasa de ovocitos MII, tasa de formación a blastocisto, tasa de embarazo y tasa de aborto.
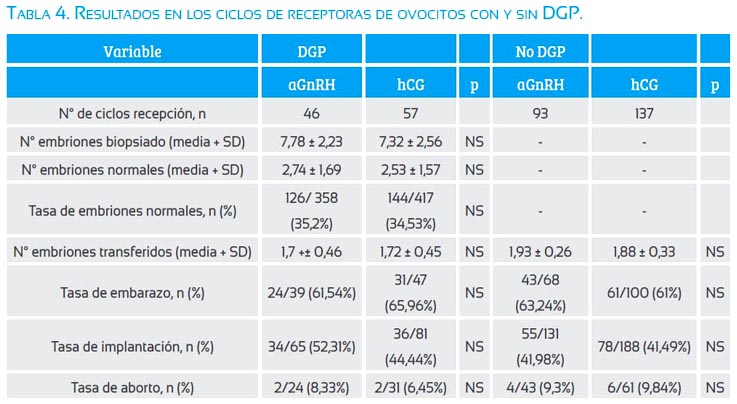
La tabla 4 muestra los resultados de los ciclos de receptoras de ovocitos con y sin DGP, comparando los grupos aGnRH y hCG en cada caso. No se observó diferencias significativas entre los casos de DGP con aGnRH o hCG para el número de embriones biopsiados, número de embriones normales, tasa de embriones normales, número de embriones transferidos, tasa de embarazo, tasa de implantación y tasa de aborto. En los ciclos en los que no se realizó DGP no se observó diferencias entre el número de embriones transferidos, tasa de embarazo, tasa de implantación y tasa de aborto entre los grupos de aGnRH y hCG.
DISCUSIÓN
Mucho esfuerzo se ha invertido en los últimos años por hacer los protocolos de EOC más eficaces, siendo el objetivo primordial obtener un adecuado número de ovocitos maduros, minimizando las complicaciones. El desarrollo de protocolos de EOC simples, amigables y seguros es de crucial importancia, sobre todo en el contexto de una FIV-DO, en el cual los riesgos relacionados al tratamiento de la donante debieran reducirse tanto como sea posible.
La DO con aGnRH demostró ser un método seguro y eficiente en reemplazo del hCG, para evitar el SHEO, principalmente en las donantes de ovocitos(20). No se detectó signos tempranos de SHEO evaluado por la ausencia de hemoconcentración o acumulación de ascitis en donantes de ovocitos de riesgo alto(21). Adicionalmente, no es necesario el monitoreo de las concentraciones de estradiol, por lo que la evaluación ecográfica es suficiente para un adecuado seguimiento del ciclo de estimulación(22), recomendando así el uso de protocolos ant-GnRH combinado con una DO de aGnRH en este tipo de pacientes(21,22).
El SHEO moderado/severo encontrado en las donantes de ovocitos en los diferentes estudios que comparan la DO de hCG y aGnRH fluctúan entre 0% y 16,6% a favor del hCG y ningún caso con aGnRH(20,23-28). Similarmente, nuestro estudio no presentó caso alguno de SHEO, utilizando el aGnRH, mientras que la DO con hCG desencadenó el SHEO en 18,9% de los casos (p<0,0001), que correspondieron 15,75% a la forma moderada y 3,15% a la forma severa.
Una ventaja adicional de utilizar el aGnRH en la maduración final del ovocito es la liberación de FSH y LH con niveles cercanos a lo fisiológico(10,29), aunque con una duración más corta en comparación con el pico preovulatorio del ciclo natural o a aquel inducido por la administración de hCG(8). Este pico de LH asociado además a uno de FSH (efecto flare up), podría tener algunas repercusiones en relación a la calidad de los ovocitos y embriones en un programa de FIV. Estudios prospectivos y aleatorizados han encontrado una mayor proporción de ovocitos maduros (MII) y mejores tasas de fecundación en el grupo en el cual se indujo la DO con un aGnRH en comparación con hCG(11-13).
En nuestro estudio con FIV-DO, la decisión de inducir la DO con el aGnRH en vez del hCG se basó en el conteo folicular previo a la DO (>20 folículos) o antecedente de SHEO en la donante. Además, durante el período analizado se observó un aumento en la tendencia al uso del aGnRH para la DO. Es por ello, que el número de ovocitos obtenidos tras aspiración folicular en las donantes fue estadísticamente mayor en el grupo aGnRH sobre el grupo hCG. Sin embargo, el número de ovocitos asignados a un banco de ovocitos (vitrificación) o a las receptoras no fue estadísticamente diferente entre ambos grupos. Además, la proporción de ovocitos maduros en los ovocitos vitrificados o en los casos de ICSI no fueron diferentes. En una aproximación similar, Bodri y col.(26), en su estudio retrospectivo obtuvieron un mayor número de ovocitos en el grupo aGnRH, pero no encontraron diferencias en la proporción de ovocitos maduros. Esto, debido a que fue una decisión del clínico, dependiendo del conteo folicular, inducir la DO con uno de los dos agentes farmacológicos. En cambio, en estudios aleatorizados de FIV-DO comparando la DO con aGnRH o hCG, el número promedio de ovocitos obtenidos y la proporción de ovocitos maduros no fueron diferentes(20,23,25,27).
El inducir la DO con aGnRH para obtener un efecto similar al pico fisiológico(10,29) parece no ser favorable en ciclos de FIV-DO. Las tasas de fecundación(20,23-25,27,28) y calidad embrionaria(23,25-27) fueron similares si se utilizó el aGnRH o el hCG para la DO. Solo algunos estudios encontraron diferencias a favor del aGnRH en cuanto a la tasa de fecundación(26) y la calidad embrionaria(20,28). En el presente estudio, las resultados globales y en los ciclos de FIV las tasas de fecundación, clivaje, embrión de buena calidad en día 3 y formación a blastocisto no mostraron diferencias significativas entre ambos grupos analizados (tabla 2). Aunque en los ciclos de ICSI, las diferencias en cuanto a tasa de fecundación y de embrión de buena calidad en día 3 entre los dos grupos alcanzaron significancia estadística, esto podría deberse a un hallazgo al azar y sin relevancia final, dado que las tasas de formación a blastocistos no fueron estadísticamente diferentes.
La desventaja al utilizar el aGnRH en la DO es el efecto de un cuerpo lúteo disfuncional, generando una FL insuficiente(8,10) y tasas gestacionales más bajas en ciclos de FIV-TE(14). Sin embargo, en la FIV-OD no tenemos este inconveniente. La preparación endometrial se realiza en las receptoras de ovocitos. Las tasas de embarazo, implantación y aborto entre los grupos de aGnRH y hCG en FIV-DO fueron similares(20,23-28). En este estudio, similar a lo encontrado por otros investigadores las tasas de embarazo, implantación y aborto, no fueron diferentes entre los grupos comparados a nivel global y en los ciclos de FIV (tabla 2). Sin embargo, en los ciclos de ICSI, a pesar de una similar tasa de embarazo y aborto, se observó una mayor tasa de implantación a favor del grupo aGnRH.
Este estudio es el primero en comunicar el efecto de la DO con aGnRH o hCG en casos de FIVDO con DGP. La tasa de embriones biopsiados y embriones normales por FISH fueron similares entre los dos grupos. Además, no se observó diferencias en el número de embriones transferidos ni en las tasas de embarazo, implantación y aborto. A pesar de un pico más fisiológico en la DO con el aGnRH, este no tiene influencia sobre la maduración final del ovocito sobre su contenido cromosómico, el cual fue observado en la proporción similar de embriones cromosómicamente normales tras la biopsia de una blastómera en día 3 y analizada por la técnica de FISH.
Se concluye que la DO con el aGnRH es un método seguro y eficaz para ser aplicado en pacientes con riesgo alto de SHEO, como son las donantes de ovocitos, eliminando por completo las formas moderadas y severas del SHEO. La calidad ovocitaria y embrionaria es similar a lo mostrado con el grupo hCG, corroborado por la proporción de embriones que alcanzaron la etapa de blastocisto o por la proporción de embriones cromosómicamente normales. Los resultados reproductivos fueron idénticos entre los grupos aGnRH y hCG.
REFERENCIAS BIBLIOGRÁFICAS
1. Pierce JG, Parsons TF. Glycoprotein hormones: structure and function. Annu Rev Biochem. 1981;50:465–95. [ Links ]
2. Wikland M, Borg J, Forsberg AS, Jakobsson AH, Svalander P, Waldenstrom U. Human chorionic gonadotropin self-administered by the subcutaneous route to induce oocyte maturation in an in-vitro fertilization and embryo transfer programme. Hum Reprod. 1995;10:1667–70. [ Links ]
3. Fonjallaz P, Loumaye E. Recombinant hCG (OVIDREL) and recombinant interferon-β1a (REBIF) (no. 13 in a series of articles to promote a better understanding of the use of genetic engineering). J Biotechnol. 2001;87:279–81. [ Links ]
4. Mannaerts BM, Geurts TB, Odink J. A randomized three-way crossover study in healthy pituitary-suppressed women to compare the bioavailability of human chorionic gonadotrophin (Pregnyl) after intramuscular and subcutaneous administration. Hum Reprod. 1998;13:1461–4. [ Links ]
5. Trinchard-Lugan I, Khan A, Porchet HC, Munafo A. Pharmacokinetics and pharmacodynamics of recombinant human chorionic gonadotrophin in healthy male and female volunteers. Reprod Biomed Online. 2002;4:106–15. [ Links ]
6. Elchalal U, Schenker JG. The pathophysiology of ovarian hyperstimulation syndrome--views and ideas. Hum Reprod. 1997;12(6):1129-37. [ Links ]
7. Whelan JG 3rd, Vlahos NF. The ovarian hyperstimulation syndrome. Fertil Steril. 2000;73(5):883-96. [ Links ]
8. Itskovitz-Eldor J, Kol S, Mannaerts B. Use of a single bolus of GnRH agonist triptorelin to trigger ovulation after GnRH antagonist ganirelix treatment in women undergoing ovarian stimulation for assisted reproduction, with special reference to the prevention of ovarian hyperstimulation syndrome: preliminary report: short communication. Hum Reprod. 2000;15(9):1965-8. [ Links ]
9. Humaidan P, Kol S, Papanikolaou EG, on behalf of the The Copenhagen GnRH Agonist Triggering Workshop Group. GnRH agonist for triggering of final oocyte maturation: time for a change of practice? Hum Reprod Update. 2011;17:510–24. [ Links ]
10. Kol SK. Luteolysis induced by a gonadotropin-releasing hormone agonist is the key to prevention of ovarian hyperstimulation syndrome. Fertil Steril. 2004;81(1):1-5. [ Links ]
11. Humaidan P, Bredkjaer HE, Bungum L, Bungum M, Grøndahl ML, Westergaard L, Andersen CY. GnRH agonist (buserelin) or hCG for ovulation induction in GnRH antagonist IVF/ICSI cycles: a prospective randomized study. Hum Reprod. 2005;20(5):1213-20. [ Links ]
12. Orvieto R, Rabinson J, Meltzer S, Zohav E, Anteby E, Homburg R. Substituting HCG with GnRH agonist to trigger final follicular maturation--a retrospective comparison of three different ovarian stimulation protocols. Reprod Biomed Online. 2006;13(2):198-201. [ Links ]
13. Oktay K, Türkçüoğlu I, Rodriguez-Wallberg KA. GnRH agonist trigger for women with breast cancer undergoing fertility preservation by aromatase inhibitor/FSH stimulation. Reprod Biomed Online. 2010;20(6):783-8.
14. Griesinger G, Diedrich K, Devroey P, Kolibianakis EM. GnRH agonist for triggering final oocyte maturation in the GnRH antagonist ovarian hyperstimulation protocol: a systematic review and meta-analysis. Hum Reprod Update. 2006;12(2):159-68. [ Links ]
15. Melo MA, Meseguer M, Garrido N, Bosch E, Pellicer A, Remohí J. The significance of premature luteinization in an oocyte-donation programme. Hum Reprod. 2006;21(6):1503-7. [ Links ]
16. Delvigne A. Symposium: Update on prediction and management of OHSS. Epidemiology of OHSS. Reprod Biomed Online. 2009;19(1):8-13. [ Links ]
17. Rizk B, Aboulghar, M.A. Classification, pathophysiology and management of ovarian hyperstimulation syndrome. En: Brinsden P. (ed.) In-Vitro Fertilization and Assisted Reproduction. New York, London: The Parthenon Publishing Group. 1999;131-55. [ Links ]
18. Sepúlveda S, Garcia J, Arriaga E, Diaz J, Noriega-Portella L, Noriega-Hoces L. In vitro development and pregnancy outcomes for human embryos cultured in either a single medium or in a sequential media system. Fertil Steril. 2009;91:1765-70. [ Links ]
19. Kuwayama M. Highly efficient vitrification for cryopreservation of human oocytes and embryos: the Cryotop method. Theriogenology. 2007;67(1):73-80. [ Links ]
20. Melo M, Busso CE, Bellver J, Alama P, Garrido N, Meseguer M, Pellicer A, Remohí J. GnRH agonist versus recombinant HCG in an oocyte donation programme: a randomized, prospective, controlled, assessor-blind study. Reprod Biomed Online. 2009;19(4):486-92. [ Links ]
21. Bodri D, Guillén JJ, Trullenque M, Schwenn K, Esteve C, Coll O. Early ovarian hyperstimulation syndrome is completely prevented by gonadotropin releasing-hormone agonist triggering in high-risk oocyte donor cycles: a prospective, luteal-phase follow-up study. Fertil Steril. 2010;93(7):2418-20. [ Links ]
22. Castillo JC, Dolz M, Moreno J, Gijón L, Ferrer R, Ferrero E, Bonilla-Musoles F. Triggering with GnRH agonist in oocyte-donation cycles: oestradiol monitoring is not necessary during ovarian stimulation. Reprod Biomed Online. 2012;24(2):247-50. [ Links ]
23. Acevedo B, Gomez-Palomares JL, Ricciarelli E, Hernández ER. Triggering ovulation with gonadotropin-releasing hormone agonists does not compromise embryo implantation rates. Fertil Steril. 2006;86(6):1682-7. [ Links ]
24. Shapiro BS, Daneshmand ST, Garner FC, Aguirre M, Ross R. Comparison of human chorionic gonadotropin and gonadotropin-releasing hormone agonist for final oocyte maturation in oocyte donor cycles. Fertil Steril. 2007;88(1):237-9. [ Links ]
25. Sismanoglu A, Tekin HI, Erden HF, Ciray NH, Ulug U, Bahceci M. Ovulation triggering with GnRH agonist vs. hCG in the same egg donor population undergoing donor oocyte cycles with GnRH antagonist: a prospective randomized cross-over trial. J Assist Reprod Genet. 2009;26(5):251-6. [ Links ]
26. Bodri D, Guillén JJ, Galindo A, Mataró D, Pujol A, Coll O. Triggering with human chorionic gonadotropin or a gonadotropin-releasing hormone agonist in gonadotropin-releasing hormone antagonist-treated oocyte donor cycles: findings of a large retrospective cohort study. Fertil Steril. 2009;91(2):365-71. [ Links ]
27. Galindo A, Bodri D, Guillén JJ, Colodrón M, Vernaeve V, Coll O. Triggering with HCG or GnRH agonist in GnRH antagonist treated oocyte donation cycles: a randomised clinical trial. Gynecol Endocrinol. 2009;25(1):60-6. [ Links ]
28. Erb TM, Vitek W, Wakim AN. Gonadotropin-releasing hormone agonist or human chorionic gonadotropin for final oocyte maturation in an oocyte donor program. Fertil Steril. 2010;93(2):374-8. [ Links ]
29. Fauser B, Devroey P. Why is the clinical acceptance of gonadotropin-releasing hormone antagonist cotreatment during ovarian hyperstimulation for in vitro fertilization so slow? Fertil Steril. 2005;83:1607–11. [ Links ]
Los autores señalan que el presente trabajo tiene carácter de inédito
Se indica no existir conflictos de interés
Trabajo presentado al concurso Premio Merck Serono, XVI Congreso Peruano de Medicina Reproductiva y I Congreso Latinoamericano de ISMAAR, Lima, setiembre de 2013
Correspondencia:
Lic. Jimmy Portella Ruiz
Telefono: 511-422 5246
jportella@fertilidadperu.com














