Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.60 no.4 Lima oct./dic. 2014
SIMPOSIO PREECLAMPSIA, VIEJO PROBLEMA AÚN NO RESUELTO: CONCEPTOS ACTUALES
Significancia del desbalance de los factores angiogénicos en preeclampsia
Significance of angiogenic factors imbalance in preeclampsia
Julio Mateus, MD, PhD1
1 Profesor Asistente, Director de Sala de Partos, Departamento de Ginecología y Obstetricia, División de Medicina Materno-Fetal, Medical University of South Carolina, Charleston, South Carolina, USA.
RESUMEN
La participación de los factores antiangiogénicos, la forma soluble de la fms-semejante a la tirosina quinasa (Flt-1s) y la endoglina soluble (Engs), en el desarrollo de la preeclampsia (PE) se ha demostrado en múltiples estudios clínicos y experimentales. Estos estudios están complementados por estudios en animales, en los cuales la sobreexpresión de estos factores antiangiogénicos origina manifestaciones clínicas muy similares a la PE. El origen de esta enfermedad permanece desconocido. Sin embargo, factores genéticos, ambientales e inmunológicos parecen alterar el desarrollo normal de la placenta, lo cual conduce últimamente a la PE. Flt-1s y Engs inhiben la producción y las propiedades proangiogénicas del factor de crecimiento vascular endotelial (FCVE) y del factor de crecimiento placentario (FCP), necesarios para el desarrollo normal vascular de la placenta y las adaptaciones vasculares fisiológicas del embarazo. Cantidades exageradas de Flt-1s y Engs se producen en la placenta disfuncional y se liberan en la circulación materna. Altas concentraciones de Flt-1s y Engs se encuentran en la circulación materna semanas antes de que la enfermedad sea detectada clínicamente. Las capacidades de los factores angiogénicos para predecir PE en embarazos asintomáticos de riesgo bajo y alto son inconsistentes y no útiles para el uso clínico. Por otro lado, proporciones de los factores Flt-1s/FCP, FCP/Flt-1s, y FCP/Eng poseen valores predictivos más altos para diagnosticar PE y predecir sus complicaciones en mujeres con sintomatología de PE. En estas condiciones, el uso clínico de estos marcadores biológicos podría ser implementado en un futuro cercano. Las propiedades biológicas y farmacocinéticas de las estatinas las convierten en uno de los medicamentos con más potencial preventivo para la PE. Otros opciones terapéuticas que se están estudiando son medicamentos que directamente inhiban los factores antiangiogénicos circulantes. Estudios in vitro y estudios pilotos clínicos se están realizando actualmente examinando la seguridad materno-fetal, la transferencia placentaria y la efectividad de estas terapias.
Palabras clave: Factores angiogénicos, preeclampsia, factor de crecimiento placentario, factor de crecimiento vascular endotelial, endoglina, forma soluble de la fms-semejante a la tirosina quinasa.
ABSTRACT
The role of the antiangiogenic factors, the soluble form of the fms-like tyrosine kinase receptor 1 (sFlt1) and the soluble endoglin (sEng), in the development of preeclampsia (PE) has been demonstrated in multiple clinical and experimental studies. These studies are complemented by animal studies, in which overexpression of these antiangiogenic factors leads to clinical manifestations similar to PE. Although, the origin of this disease remains unknown, genetic, environmental, and immunological factors appear to affect the normal placental development, resulting ultimately in PE. sFlt-1 and sEng inhibit the proangiogenic properties of the vascular endothelial growth factor (VEGF) and the placental growth factor (PlGF), affecting the normal vascular development in the placenta and the physiological vascular adaptations that occur in pregnancy. Exaggerated amounts of sFlt-1 and sEng, produced in the dysfunctional placenta, are released into the maternal circulation and elevated circulating concentrations of these antiangiogenic factors are found several weeks prior to the clinical manifestations of the disease. Multiple studies have reported the capacity of circulating antiangiogenic factor concentrations to predict PE in asymptomatic low and high risk pregnancies. The reported predictive values of sFlt-1 and sEng are inconsistent across these studies and therefore their clinical use in this population is not recommended. On the other hand, maternal plasma concentrations of these factors appear to have a better performance in women with symptoms of PE. Among the possible combinations, the ratios of sFlt-1/PlGF, PlGF/sFlt-1, and PlGF/Engs seem to have the highest sensitivities and specificities to diagnose PE as well as the highest predictive values for PE-related adverse outcomes. These properties support their clinical use in this setting and it is likely those ancillary tests will be incorporated to the clinical practice in the near future. The participation of antiangiogenic factors in the pathogenesis of PE, also have stimulated investigation of new targeted therapies. The biological and pharmacokinetic properties of statins have converted them in one of the most promising preventive therapies for this disease. Others are investigating agents that directly inhibit the circulating antiangiogenic factors. In-vitro and pilot clinical studies are currently evaluating the effectiveness, maternal-fetal safety, and placental transference of these therapies.
Keywords: Angiogenic factors, preeclampsia, placenta growth factor, endothelial vascular growth factor, endoglin, soluble fms-like tyrosine kinase-1.
INTRODUCCIÓN
Los trastornos hipertensivos del embarazo son causa mayor de complicaciones maternas y perinatales serias y de mortalidad. En los Estados Unidos (EE UU), la tasa de hipertensión asociada con el embarazo fue informada recientemente en 39,1 por 1 000 nacimientos vivos y su incidencia ha aumentado 38% desde 1990(1). La preeclampsia (PE) es la segunda causa de muerte materna en el Perú, contribuyendo con 17 a 21% de todas las muertes perinatales en este país(2).
Complicaciones asociadas con preeclampsia (PE), como el desprendimiento prematuro de la placenta, rotura hepática, eclampsia y accidente cerebrovascular, contribuyen significativamente con la mortalidad materna(3). La morbilidad y mortalidad fetal y neonatal también están incrementadas en los embarazos con PE. Esta enfermedad es responsable de 15% de todos los partos prematuros y predispone a restricción del crecimiento intrauterino (RCIU)(4). La mortalidad perinatal incrementa proporcionadamente a la severidad de la enfermedad(5).
La PE es un trastorno multisistémico tradicionalmente diagnosticado por una presión arterial sistólica (PAS) ≥ 140 mmHg o presión arterial diastólica (PAD) ≥ 90 mmHg después de la semana 20 de gestación en una mujer previamente normotensa, y proteinuria ≥ 300 mg en un periodo de 24 horas(6). En el más reciente reporte del grupo de trabajo sobre hipertensión en el embarazo de los EE UU, la PE puede ser diagnosticada en ausencia de proteinuria cuando la hipertensión materna gestacional es asociada con trombocitopenia (plaquetas < 100 000/uL), insuficiencia renal (creatinina sérica > 1,1 mg/dL o aumento doble de los niveles de base), impedimento de la función hepática (elevación de la concentración sérica de las enzimas hepáticas dos veces o mas por encima de los valores normales), síntomas cerebrales o visuales, o edema pulmonar(7).
Las anormalidades de los niveles de los factores angiogénicos en la circulación materna han sido asociadas recientemente con la fisiopatología de la PE. Un desbalance entre los factores proangiogénicos, encargados del desarrollo vascular placentario y el mantenimiento de la función vascular, y los factores antiangiogénicos, antagonistas de los factores proangiogénicos, conducen a anormalidades vasculares en la placenta y el sistema cardiovascular materno. Este artículo presenta la evidencia científica más reciente sobre el papel que cumplen los factores antiangiogénicos en el desarrollo de la PE y la utilidad clínica de estos marcadores biológicos para la predicción y diagnóstico de esta enfermedad.
METODOLOGÍA
Una investigación bibliográfica fue realizada en PubMed (U.S. National Library of Medicine, enero de 1999 a septiembre de 2014) de todos los artículos publicados, evaluando la significancia de los factores angiogénicos en la fisiopatología, predicción y detección de la PE. La búsqueda literaria fue realizada en inglés e incluyó las palabras angiogenic factors, antiangiogenic factors, pathogenesis of preeclampsia´, prediction of preeclampsia, diagnosis of preeclampsia, animal models of preeclampsia y treatment of preeclampsia. Los operadores AND y OR fueron usados para realizar las diferentes combinaciones de estas palabras clave. Los resúmenes de los artículos encontrados en esta búsqueda fueron revisados y los artículos completos de los resúmenes seleccionados fueron usados para este artículo de revisión.
Solamente se incluyó los manuscritos escritos en inglés y español. Las investigaciones en humanos y animales fueron extraídos, ya que gran parte de nuestro conocimiento acerca de la fisio-patología de la PE y de la función de los factores angiogénicos proviene de experimentos en modelos de animales de la PE. Si hubo varios manuscritos que investigaban la misma población, únicamente se incluyó la publicación más reciente. Igualmente, si varios manuscritos fueron publicados acerca del mismo experimento animal, se escogió el más recientemente publicado. No se realizó un intento de localizar documentos no publicados. Esta revisión usó una metodología analítica acerca de la influencia de los factores angiogénicos en el desarrollo de la PE y del valor predictivo de estos factores en la predicción y detección de esta enfermedad.
FISIOPATOLOGÍA DE LA PREECLAMPSIA
La actual evidencia científica señala que la placenta es el órgano central en el desarrollo de la PE. En el embarazo normal, la formación vascular placentaria ocurre mediante tres mecanismos: 1) vasculogénesis, en la cual hay nueva formación de vasos sanguíneos; 2) angiogénesis caracterizada por crecimiento de nuevos capilares en preexistentes vasos sanguíneos; y, 3) pseudovasculogénesis o remodelación de la arterias espirales uterinas(8).
Desde el día 21 de la gestación, los factores angiogénicos solubles son expresados en células trofoblásticas, decidua materna y macrófagos y median el proceso de angiogénesis(9). Diferentes factores angiogénicos son expresados en la placenta; sin embargo, los más importantes mediadores del desarrollo vascular placentario son el factor de crecimiento vascular endotelial (FCVE) y el factor de crecimiento placentario (FCP). Existen varias formas del FCVE incluyendo el FVCE-A, el FVCE-B, el FVCE-C, y el FVCE-D(10). FVCE-A se expresa extensivamente en la unidad útero-placentaria e induce angiogénesis y desarrollo vascular placentario a través de la unión a los receptores de alta afinidad tirosina quinasas Flt1 and KDR localizados en la membrana de la célula endotelial(11). El FCP esta expresado esencialmente en el sincitiotrofoblasto y estimula también angiogénesis al unirse exclusivamente al receptor Flt1(12). La remodelación de las arterias espirales es el otro mecanismo esencial para el establecimiento de la circulación útero-placentaria. Este es caracterizado por la invasión del citotrofoblasto a la pared de las arterias espirales, donde reemplaza las células endoteliales, disminuyendo la resistencia vascular sanguínea e incrementando el flujo sanguíneo a la placenta y el trasporte de nutrientes y oxígeno al feto(13).
Una de las teorías más aceptadas acerca del origen de la PE sugiere que la enfermedad ocurre en dos etapas. La primera etapa es caracterizada por una invasión superficial del citotrofoblasto hacia las arterias espirales, lo cual origina impedimento a la perfusión placentaria. La segunda etapa ocurre como consecuencia de la progresión de la disfunción placentaria causando las manifestaciones clínicas de la enfermedad(14). La falla de la invasión trofoblástica ha sido atribuida a dos factores interrelacionados: 1) una maladaptación inmune paterno-materna; y, 2) un proceso inflamatorio generalizado y estrés oxidativo que últimamente conduce a disfunción placentaria y disfunción endotelial (figura 1).
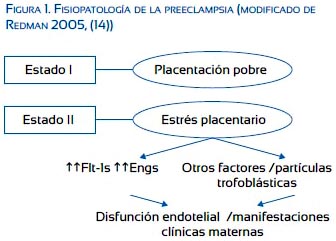
INFLUENCIA DE LOS FACTORES ANTIANGIOGÉNICOS EN EL DESARROLLO DE LA PE
Factores genéticos, ambientales e inmunológicos, inflamación, estrés oxidativo y anormalidades metabólicas influencian el desarrollo de la disfunción placentaria que ocurre en la PE. Excesivas cantidades de factores antiangiogénicos, como el Flt1 soluble (Flt1s) y la endoglina soluble (Engs)(15,16), son producidas en la placenta de embarazos con PE. Flt1s es una forma truncada del receptor Flt-1 del FVCE-A. Engs es una forma truncada de la Eng (CD105), un receptor celular que se une y antagoniza el factor transformador de crecimiento-β e interfiere con la vasodilatación mediada por el óxido nítrico(17). Flt-1s inhibe la funciones proangiogénicas de FVCE-A y FCP mediante la unión directa a estos factores en la circulación y a través de la unión a receptores de la membrana celular endotelial, bloqueando la fosforilización y activación de la señales de la cascada del FVCE(18,19).
Engs y Flt-1s causan disfunción vascular en la placenta y en el sistema circulatorio materno(16). Recientemente, se ha descubierto varias variantes de Flt-1, incluyendo la Flt1s-14, la cual se encuentra expresada en grandes cantidades en la PE(20,21). El Flt1s-14 es producido primordialmente en áreas degenerativas del sincitiotrofoblasto conocidas como nudos sincitiales(20). Se ha encontrado concentraciones elevadas de Flt1s en el líquido amniótico y la expresión de Flt-1s y Engs es elevada en la placenta de embarazos complicados por PE(16,21). También se ha encontrado Flt1s y Engs en circulación materna semanas antes de las manifestaciones de la PE y los niveles caen rápidamente después del parto, lo cual se relaciona con el mejoramiento clínico de la enfermedad(15). Inversamente, los niveles sanguíneos del FCP están disminuidos en mujeres destinadas a desarrollar PE(15). La severidad de la PE se relaciona directamente con las concentraciones en sangre materna de Flt-1s y Engs(15,23). La interacción de factores maternos, placentarios y el desbalance angiogénico es esquematizado en la figura 2.
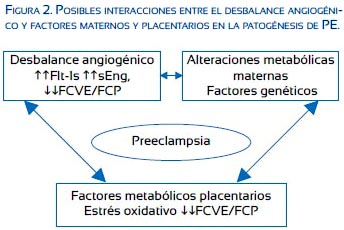
MODELOS DE ANIMALES DE PE INDUCIDOS POR FACTORES ANTIANGIOGÉNICOS
Los investigadores han creado modelos de animales de la PE caracterizados por la sobreproducción de factores antiangiogénicos. La administración de Flt-1s a través de un adenovirus a ratas embarazadas ocasiona manifestaciones similares a la PE, como hipertensión, proteinuria y endoteliosis glomerular(16). La administración crónica de Flt-1s originó RCIU en otro modelo animal en roedores(24). La administración de Engs en un vector de adenovirus a ratas embarazadas también produjo hipertensión y proteinuria, mientras que la coadministración de Flt-1s y Engs induce manifestaciones similares al síndrome de HELLP(25). Mi grupo previo de investigación validó un modelo de PE en ratones embarazadas inducido por la sobreproducción de Flt-1s. En este modelo, ratones embarazadas inyectadas en el día 8 de gestación con un vector de adenovirus con Flt-1s desarrollaron hipertensión, disfunción endotelial y las crías presentaron RCIU(26).
MARCADORES ANGIOGÉNICOS PARA LA PREDICCIÓN Y DIAGNÓSTICO DE PE
Los estudios en animales mencionados previamente(16,24-26) y estudios in vitro motivaron la realización de estudios clínicos para valorar la importancia de los factores angiogénicos en la PE. Levine y colaboradores condujeron estudios de casos y controles en pacientes sanas y con PE enroladas en un estudio aleatorio multicéntrico en EE UU, en el que se evaluó la efectividad de la suplementación de calcio para la prevención de la PE. En estos estudios de 120 casos de PE y 120 controles, los niveles plasmáticos maternos de Flt-1s y Engs fueron significativamente más altos y los niveles de PLGF fueron significativamente más bajos en las pacientes destinadas a desarrollar PE(15,27). La elevación de los factores antiangiogénicos y la disminución del FCP ocurrió varias semanas antes de las manifestaciones clínicas de la enfermedad y la severidad del incremento se asoció directamente con el inicio temprano de la PE y peso bajo al nacer. A partir de estos estudios, múltiples investigaciones se han realizado para evaluar el valor predictivo de los niveles plasmáticos de los factores angiogénicos en anticipación de la aparición clínica de la PE. Este artículo presenta la evidencia científica más pertinente acerca del valor predictivo de estos factores en tres poblaciones de mujeres diferentes: 1) embarazos sin factores de riesgo para PE; 2) pacientes consideradas de riesgo alto para la PE; y, 3) pacientes que desarrollan síntomas o signos de PE.
1 Significancia de los factores angiogénicos en el embarazo de riesgo bajo para PE
La capacidad de los niveles plasmáticos maternos de los factores angiogénicos para predecir PE en mujeres nulíparas sin factores de riesgo reconocidos ha sido evaluada en varios estudios clínicos(28-31) (tabla 1). En estos estudios, los niveles de Flt-1s, Engs, y FCP fueron medidos en diferentes edades gestacionales y comparados entre mujeres que desarrollaron PE y las gestantes que tuvieron un curso normal del embarazo. La mayoría de los estudios encontraron una baja sensibilidad y una baja área debajo de la curva (ADC) en el análisis de las características del receptor de estos factores angiogénicos para predecir PE(28-30). En contraste, un estudio realizado en India halló que los niveles elevados de Flt-1s al final del primer trimestre y en el segundo trimestre poseen una alta sensibilidad para predecir el desarrollo de la PE(31). Este estudio tiene limitaciones, como ser una muestra pequeña (39 casos y 39 controles) y haber sido realizado en una población con poca variabilidad étnica.
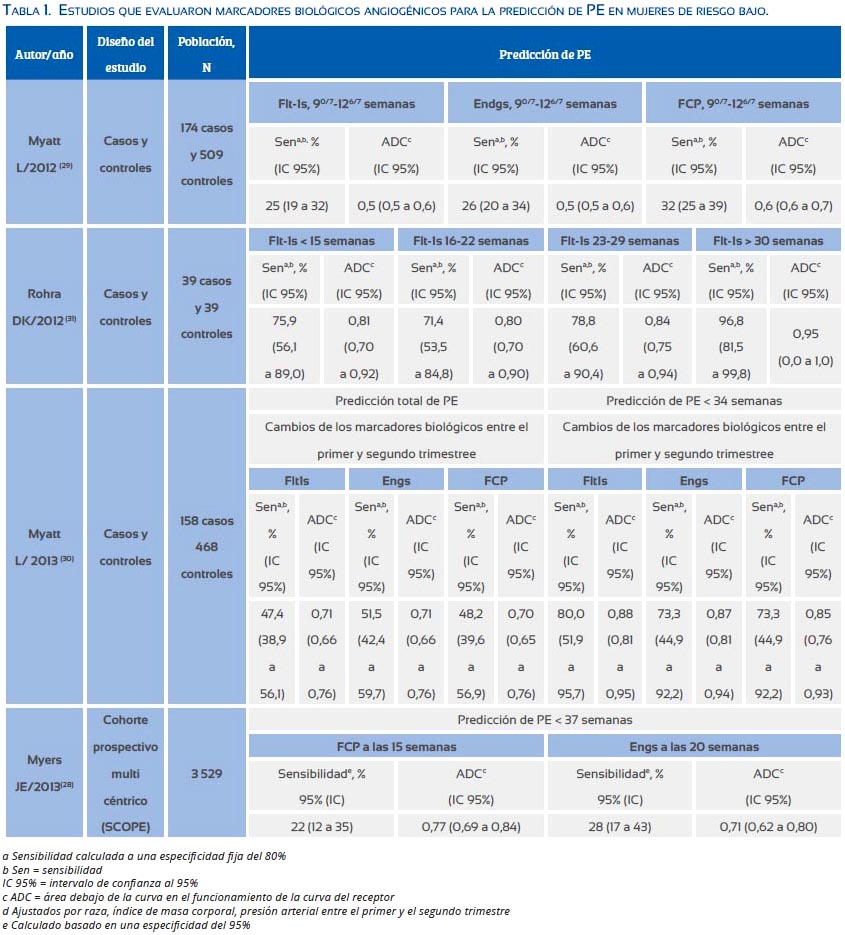
Los valores predictivos de los factores angiogénicos mejoraron cuando características clínicas como la raza, el peso, y la presión arterial fueron incluidas en el modelo predictivo de la PE(29,32). En otros modelos, la inclusión de historia familiar de PE, uso de tabaco y resultados de estudios Doppler de las arterias uterinas en mujeres consideradas de riesgo bajo para PE no aumentó considerablemente los valores predictivos de los factores angiogénicos(28,33).
En resumen, los niveles de los factores angiogénicos en sangre materna en el primer y segundo trimestre en embarazos de riesgo bajo no tienen una capacidad predictiva lo suficientemente alta para predecir PE y por lo tanto su uso en la práctica clínica no es recomendable. Razones para las inconsistencias de sus valores predictivos son las diferencias en la edad gestacional en las cuales los niveles fueron medidos, las diferencias de la metodología usada para medir los factores angiogénicos y la variada selección de factores angiogénicos entre los estudios. La complejidad de la PE per se es también una razón fundamental para la baja predictividad de estos marcadores biológicos. Las características demográficas, genéticas, del medio ambiente tienen un gran impacto en las manifestaciones clínicas de la PE y también influencian los niveles circulantes de los factores angiogénicos.
2 Factores angiogénicos en embarazos de riesgo alto para PE
Algunos investigadores se han enfocado en estudiar la utilidad de los niveles circulantes angiogénicos para predecir PE en las poblaciones de riesgo alto. La incidencia de PE en estas poblaciones puede ser hasta del 20%(34,35). Son factores de riesgo la obesidad (índice de masa corporal ≥ 30 kg/m2), diabetes tipo I o tipo II, hipertensión crónica, e historia previa de PE. En un estudio de cohortes de 50 embarazos de riesgo bajo y 157 embarazos de riesgo alto, niveles elevados de Flt-1s al final del segundo trimestre y la elevación de los niveles de Engs entre el segundo y el tercer trimestre tuvieron una sensibilidad de 86%, especificidad de 96% y una ADC de 91% para la predicción temprana de PE (< 34 semanas)(35). Sibai y colaboradores(36) hallaron en un estudio de cohortes de 704 mujeres con historia previa de PE y/o historia de hipertensión crónica una asociación significativa entre los niveles bajos de FCP y los niveles altos de Flt-1s en el segundo y comienzo del tercer trimestre con el desarrollo de PE < 37 semanas. Sin embargo, las sensibilidades y los valores predictivos positivos de Flt-1s fueron entre 26% y 55% y entre 19% y 28%, respectivamente. Para el FCP, las sensibilidades fueron entre 38% y 52% y los valores predictivos positivos entre 21% y 28%(36). Un análisis secundario de un estudio aleatorizado del uso de aspirina para prevenir PE en poblaciones de alto riesgo en EE UU publicó resultados consistentes con el estudio de Sibai(37).
En conclusión, niveles anormales de los factores angiogénicos en el segundo y comienzo del tercer trimestre en poblaciones de riesgo alto se asociaron con la aparición subsecuente de la PE, pero sus valores predictivos no han sido lo suficientemente altos para recomendar su uso clínico. Una reciente revisión sistemática y meta-análisis de 34 estudios evaluó los niveles de varios factores angiogénicos en la circulación materna antes de la semana 30 del embarazo para predecir el consecuente desarrollo de PE(38). En este estudio, la capacidad predictiva de los marcadores biológicos evaluados fue baja en poblaciones de riesgo bajo y alto.
3. Uso de factores angiogénicos en mujeres con síntomas y signos de PE
El diagnóstico de la PE se basa en hallazgos clínicos apoyados por exámenes de laboratorio, como el cuadro hemático, las enzimas hepáticas, la creatinina sérica y la deshidrogenasa láctica. Sin embargo, el diagnóstico actual de la PE es impreciso, lo cual incrementa los riesgos maternos y fetales y las intervenciones innecesarias como hospitalizaciones y partos inducidos prematuramente. En el pasado, los niveles de proteinuria fueron usados para asignar la severidad de la PE. Sin embargo, la falta de correlación entre proteinuria masiva (≥ 5 gramos en 24 horas) con resultados adversos maternos y fetales motivaron su exclusión en el diagnóstico de PE severa(7).
En los últimos años, múltiples estudios clínicos han examinado la precisión de los niveles circulantes de los factores angiogénicos para diagnosticar PE y predecir sus resultados perinatales(39-42) (tabla 2). Estos estudios han evaluado los valores predictivos de factores angiogénicos individuales y/o las proporciones de los factores antiangiogénicos/proangiogénicos o viceversa, en mujeres con síntomas de PE. Entre los posibles candidatos, un valor alto de Flt-1s/FCP (≥ 85(39,42) o valores bajos de FCP/ Flt-1s y FCP/Engs(40) son los que más se asocian con las formas más severas de la enfermedad, con una mayor tasa de complicaciones perinatales y con un intervalo más corto entre el diagnóstico y el parto. Esta herramienta diagnóstica es superior cuando es usada antes de las 34 semanas del embarazo y es más precisa que cualquier examen de laboratorio y signo clínico usado corrientemente en la evaluación de la PE(39). En uno de estos estudios, sin embargo, los niveles de los factores angiogénicos tuvieron un valor predictivo bajo para predecir peso bajo al nacer(41). La tabla 2 resume los valores predictivos de los factores angiogénicos publicados en varios estudios en mujeres con sintomatología de PE.
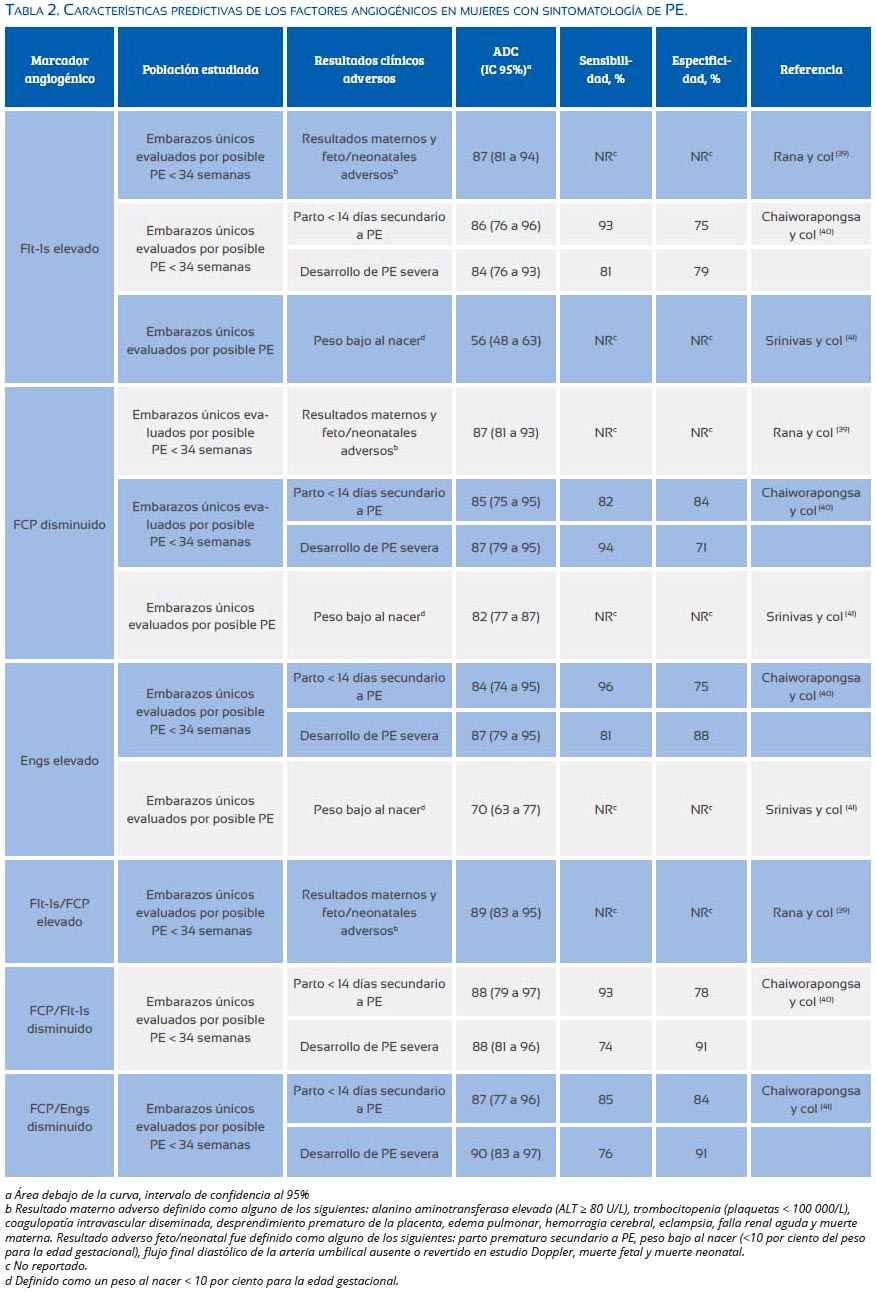
Recientemente, se finalizó un estudio grande de cohortes realizado en 20 centros médicos de los EE UU (estudio PETRA), en el cual se midió los niveles plasmáticos maternos de varios factores angiogénicos en mujeres con sospecha clínica de PE. El objetivo de este estudio fue examinar la predictividad de estos factores en dicha población y proponer su uso clínico. Los resultados del estudio podrían originar un cambio importante en el diagnóstico actual de la enfermedad, incorporando los niveles angiogénicos para mejorar la precisión del diagnóstico clínico tradicional. De todas maneras, el diseño de estudios aleatorizados con un tamaño de muestra adecuada brindaría la mejor calidad de evidencia científica para definitivamente determinar la utilidad clínica de estos marcadores biológicos en el discernimiento y manejo de embarazos con alto sospecha clínica de la PE.
OPCIONES TERAPÉUTICAS PARA MEJORAR AL DESBALANCE DE LOS FACTORES ANGIOGÉNICOS
El reconocido rol de los niveles circulantes maternos elevados de los factores antiangiogénicos Flt-1s y Engs en la fisiopatología, sintomatología y pronóstico de la PE, ha despertado el interés científico para estudiar nuevos agentes terapéuticos y preventivos para esta enfermedad. La PE se asemeja a la enfermedad cardiovascular en el adulto, ya que tienen mecanismos patogénicos comunes como la disfunción endotelial, la activación de cascadas inflamatorias y el estrés oxidativo. Los inhibidores de la 3-hidroxi-3-metil-glutaril-coenzima A reductasa (HMG-CoA) o estatinas han sido esenciales en la prevención primaria y secundaria de las complicaciones y mortalidad asociadas con la enfermedad cardiovascular. Sus propiedades y mecanismos de acción las convierte en candidatos atractivos para la prevención de la PE. El uso de la pravastatina en un modelo de PE en ratones inducido por la sobreexpresión de Flt-1s ha mejorado la función vascular materna, la presión arterial y el desbalance de factores angiogénicos(43-44). No se observó efectos adversos. Las estatinas son categorizadas como X (contraindicado) en el embarazo, según la Food and Drug Administration (FDA) de los EE UU. Una de la razones para esta categorización es la posibilidad biológica de que las estatinas inhiben la producción de colesterol en el feto. Además, se ha comunicado efectos teratogénicos en series de casos pequeños(45). Estos resultados no han sido confirmados en estudios observacionales más grandes(46,47). Adicionalmente, la pravastatina es una de las estatinas más hidrofílicas, posee propiedades farmacocinéticas especiales, como una absorción rápida, una vida corta y, teóricamente, una mínima transferencia placentaria. Estudios in vitro se están realizando actualmente para examinar la transferencia bidireccional de este medicamento y un estudio piloto en los EE UU está estudiando la seguridad y la efectividad del uso de la pravastatina en el embarazo de riesgo alto para PE (ClinicalTrials.gov, NCT10717586).
Otros investigadores han estudiado terapias que directamente inhiben la exagerada producción de los factores anti-angiogénicos(48-50). El uso de agentes proangiogénicos como el FCVE-121 en modelos de PE en roedores que sobrexpresan Flt-1s normaliza la función vascular, disminuye la presión arterial, restaura el balance de los factores angiogénicos y aumenta el peso de las crías sin causar efectos adversos en el embarazo(48,49). Un estudio clínico piloto evaluó la efectividad de tratamientos de aféresis extra corporal usando sulfato de dextrán celulosa para remover Flt-1s en 5 mujeres con PE severa prematura(50). Las pacientes tratadas con esta terapia mostraron mejoría, como estabilización de la presión arterial, reducción de la proteinuria, disminución de los niveles de Flt-1s y prolongación del embarazo entre 15 y 29 días. Otros tratamientos, como FVEC recombinante, anticuerpos que bloqueen Flt-1s o tratamientos que inhiban translación de Flt-1s con tecnología de interferencia del RNA, podrían en teoría restaurar el balance angiogénico. Sin embargo, como en el caso de la pravastatina, son necesarios estudios pilotos de seguridad materno-fetal e in-vitro para evaluar la transferencia placentaria de estas sustancias, antes de poderse usar en estudios aleatorios clínicos.
REFERENCIAS BIBLIOGRÁFICAS
1. Martin JA, Hamilton BE, Sutton PD, Ventura SJ, Mathews TJ, Kirmeyer S, Osterman MJ. Births: final data for 2007. Natl Vital Stat Rep. 2010;58(24):1-85.
2. Pacheco J, Wagner P, Williams MA, Sánchez S. Enfermedades hipertensivas en la gestación. En: Pacheco J. Ginecología, Obstetricia y Reproducción. Segunda edición. Lima: REP SAC. 2007:1097-1130.
3. Clark SL, Belfort MA, Dildy GA, Herbst MA, Meyers JA, Hankins GD. Maternal death in the 12st century: causes, prevention, and relationship to cesarean delivery. Am J Obstet Gynecol. 2008 Oct;199(1):36.e1-5. doi: 10.1016/j. ajog.2008.03.007.
4. Roberts JM, Pearson G, Cutler J, Lindheimer M; NHLBI Working Group on Research on Hypertension During Pregnancy. Summary of the NHLBI Working Group on Research on Hypertension During Pregnancy. Hypertension. 2003;41(3):437-45.
5. Odegård RA, Vatten LJ, Nilsen ST, Salvesen KA, Austgulen R. Preeclampsia and fetal growth. Obstet Gynecol.2000 Dec;96(6):950-5.
6. Report of the National High Blood Pressure Education Program Working Group on High Blood Pressure in Pregnancy. Am J Obstet Gynecol. 2000;183:S1-S22.
7. Hypertension in Pregnancy. Task Force on Hypertension in Pregnancy. The American College of Obstetricians and Gynecologists, 2013.
8. Cross JC, Werb Z, Fisher SJ. Implantation and the placenta: key pieces of the development puzzle. Science. 1994;266(5190):1508-18.
9. Zygmunt M, Herr F, Munstedt K, Lang U, Liang OD. Angiogenesis and vasculogenesis in pregnancy. Eur J Obstet Gynecol Reprod Biol. 2003 Sep 22;110 Suppl 1:S10-8.
10. Ferrara N, Gerber HP. The role of vascular endothelial growth factor in angiogenesis. Acta Haematol. 2001;106(4):148–56.
11. Shibuya M. Structure and function of VEGF/VEGF-receptor system involved in angiogenesis. Cell Struct Funct. 2001;26(1):25–35.
12. Carmeliet P, Moons L, Luttun A, Vincenti V, Compernolle V, De Mol M, Wu Y, et al. Synergism between vascular endothelial growth factor and placental growth factor con-tributes to angiogenesis and plasma extravasation in pathological conditions. Nat Med. 2001 May;7(5):575–583.
13. Maynard S, Epstein FH, Karumanchi SA. Preeclampsia and angiogenic imbalance. Annu Rev Med. 2008;59:61–78.
14. Redman CW, Sargent IL. Latest advances in understanding preeclampsia. Science. 2005;308(5728):1592-4.
15. Levine RJ, Lam C, Qian C, Yu KF, Maynard SE, Sachs BP, Sibai BM, et al. Soluble endoglin and other circulating angiogenic factors in preeclampsia. N Engl J Med. 2006 Sep 7;355(10):992-1005.
16. Maynard SE, Min JK, Merchan J, Lim KH, Li J, Mondal S, Libermann TA, et al. Excess placental soluble fms-like tyrosine kinase (sFlt-1) may contribute to endothelial dysfunction, hypertension, and proteinuria in preeclampsia. J Clin Invest. 2003 Mar;111(5):649-58.
17. Podjarny E, Losonczy G, Baylis C. Animal moderls of preeclampsia. Semin Nephrol. 2004;24(6):596-606.
18. Kendall RL, Thomas KA. Inhibition of vascular endothelial cell growth factor activity by an endogenously encoded soluble receptor. Proc Natl Acad Sci USA. 1993;90(22): 10705-9.
19. Kendall RL, Wang G, Thomas KA. Identification of a natural soluble form of the vascular endothelial growth factor receptor. FLT-1, and its heterodimerization with KDR. Biochem Biophys Res Commun. 1996;226(2):324-8.
20. Sela S, Itin A, Natanson-Yaron S, Greenfield C, Goldman-Wohl D, Yagel S, Keshet E. A novel human-specific soluble vascular endothelial growth factor receptor 1: cell-type-specificsplicing and implications to vascular endothelial growth factor homeostasis and preeclampsia. Circ Res. 2008 Jun 20;102(12):1566-74. doi: 10.1161/CIRCRESAHA.108.171504.
21. Thomas CP, Anfrews JI, Raikwar NS, Kelley EA, Herse F, Dechend R, Golos TG, Liu KZ. A recently evolved novel trophoblast-enriched secreted form of fms-like tyrosine kinase-1 variant is up-regulated in hypoxia and preeclampsia. J Clin Endocrinol Metab. 2009 Jul;94(7):2524-2530. doi: 10.1210/jc.2009-0017.
22. Vuorela P, Helske S, Hornig C, Alitalo K, Weich H, Halmesmäki E. Amniotic fluidsoluble vascular endothelial growth factor receptor-1 in preeclampsia. Obstet Gynecol. 2000 Mar;95(3):353-7.
23. Chaiworapongsa T, Romero R, Espinoza J, Bujold E, Mee Kim Y, Gonçalves LF, Gomez R, Edwin S. Evidence supporting a role for blockade of the vascular endothelial growth factor system in the pathophysiology of preeclampsia. Young investigator award. Am J Obstet Gynecol. 2004 Jun;190(6):1541-7.
24. Bridges JP, Gilbert JS, Colson D, Gilbert SA, Dukes MP, Ryan MJ, Granger JP. Oxidative stress contributes to soluble fms-like tyrosine kinase-1 inudced vascular dysfunction in pregnant rats. Am J Hypertens. 2009 May;25(5):564-8. doi: 10.1038/ajh.2009.24.
25. Venkatesha S, Toporsian M, Lam C, Hanai J, Mammoto T, Kim YM, et al. Soluble endoglin contributes to the pathogenesis of preeclampsia. Nat Med. 2006 Jun;12(6):642-9.
26. Lu F, Longo M, Tamayo E, Maner W, Al-Hendy A, Anderson GD, Hankins GD, Saade GR. The effect of over-expression of sFlt-1 on blood pressure and the occurrence of other manifestations of preeclampsia in unrestrained conscious pregnant mice. Am J Obstet Gynecol. 2007 Apr;196(4):396.e1-7.
27. Levine RJ, Maynard SE, Qian C, Lim KH, England LJ, Yu KF, et al. Circulating angiogenic factors and the risk of preeclampsia. N Engl J Med. 2004 Feb 12;350(7):672-83.
28. Myers JE, Kenny LC, McCowan LME, Chan EH, Dekker GA, Poston L, Simpson NA, North RA; SCOPE consortium. Angiogenic factors combined with clinical risk factors to predict preterm pre-eclampsia in nulliparous women: a predictive test accuracy study. BJOG. 2013 Sep;120(10):1215-23. doi: 10.1111/14710528.12195.
29. Myatt L, Clifton RG, Roberts JM, et al; Eunice Kennedy Shriver National Institute of Child Health and Human Development (NICHD) Maternal-Fetal Medicine Units Network (MFMU). First-trimester prediction of preeclampsia in low-risk nulliparous women. Obstet Gynecol. 2012 Jun;119(6):1234-42. doi: 10.1097/AOG.0b013e3182571669.
30. Myatt L, Clifton RG, Roberts JM, et al; Eunice Kennedy Shriver National Institute of Child Health and Human Development (NICHD) Maternal-Fetal Medicine Units Network (MFMU). Can changes in angiogenic biomarkers between the first and second trimester predict development of pre-eclampsia in a low-risk nulliparous patient population? BJOG. 2013 Sep;120(10):1183-91. doi: 10.1111/1471-0528.12128.
31. Rohra DK, Zeb A, Qureishi RN, Azam SI, Khan NB, Zuberi HS, Sikandar R. Prediction of pre-eclampsia during early pregnancy in primiparas with soluble fms-like tyrosine kinase-1 and placental growth factor. Natl Med J India. 2012 Mar-Apr;25(2):68-73.
32. Levine RJ, Qian C, Maynard SE, Yu KF, Epstein FH, Karumanchi SA. Serum sFlt1 concentration during preeclampsia and mid trimester blood pressure in healthy nulliparas women. Am J Obstet Gynecol. 2006 Apr;194(4):1034-41.
33. Parra-Cordero M, Rodrigo R, Barja P, Bosco C, Rencoret G, Sepúlveda-Martinez A, Quezada S. Prediction of early and late pre-eclampsia from maternal characteristics, uterine artery Doppler and markers of vasculogénesis during first trimester of pregnancy. Ultrasound Obstet Gynecol. 2013 May;41(5):538-44. doi: 10.1002/uog.12264.
34. Poston L, Briley AL, Seed PT, et al; Vitamins in preeclampsia (VIP) trial consortium. Vitamin C and vitamin E in pregnant women in pregnant women at risk for preeclampsia (VIP trial): randomized placebo-controlled trial. Lancet. 2006 Apr 8;367(9517):1145-54.
35. Moore Simas TA, Crawford SL, Bathgate S, Yan J, Robidoux L, Moore M, Maynard SE. Angiogenic biomarkers for prediction of early preeclampsia onset in high-risk women. J Matern Neonatal Med. 2014 Jul;27(10):1038-48. doi: 10.3109/14767058.2013.847415.
36. Sibai BM, Koch MA, Freire S, Pinto e Silva JL, Rudge MV, Martins-Costa S, et al. Serum inhibin A and angiogenic factor levels in pregnancies with previous preeclampsia and/or chronic hypertension: are they useful markers for prediction of subsequent preeclampsia? Am J Obstet Gynecol. 2008 Sep;199(3):268.e1-9. doi: 10.1016/j.ajog.2008.06.071.
37. Powers RW, Jeyabalan A, Clifton RG, et al; Eunice Kennedy Shriver National Institute of Child Health Human Development Maternal-Fetal Medicine Units Network. Soluble fms-Like tyrosine kinase 1 (sFlt-1), endoglin and placen-tal growth factor (PlGF) in preeclampsia among high risk pregnancies. PloS ONE. 2010 Oct 11;5(10):e13263. doi: 10.1371/journal.pone.0013263.
38. Kleinrouweler CE, Wiegerinck MMJ, Ris-Stalpers C; EBM CONNECT Collaboration. Accuracy of circulating placen-tal growth factor, vascular endothelial growth, soluble fms-like tyrosine kinase 1 and endoglina in the prediction of pre-eclampsia: a systematic review and meta-analysis. BJOG. 2012 Jun;119(7):778-87. doi: 10.1111/j.14710528.2012.03311.x.
39. Rana S, Powe CE, Salahuddin S, Verlohren S, Perschel FH, Levine RJ, Lim KH, Wenger JB, Thadhani R, Karumanchi SA. Angiogenic factors and the risk of adverse outcomes in women with suspected preeclampsia. Circulation. 2012 Feb 21;125(7):911-9. doi: 10.1161/CIRCULATIONAHA.111.054361.
40. Chaiworapongsa T, Romero R, Savasan ZA, Kusanovic JP, Ogge G, Soto E,et al. Maternal plasma concentrations of angiogenic/anti-angiogenic factors are of prognostic value in patients presenting to the obstetrical triage area with the suspicion of preeclampsia. J Matern Neonatal Med. 2011 Oct;24(10):1187-207. doi: 10.3109/14767058.2011.589932.
41. Srinivas SK, Larkin J, Sammel MD, Appleby D, Bastek J, Andrela CM, Ofori E, Elovitz MA. The use of angiogenic factors in discriminating preeclampsia: are they ready for prime time? J Matern Neonatal Med. 2010 Nov;23(11):1294-300. doi: 10.3109/14767051003677988.
42. Moore AG, Young H, Keller JM, Ojo LR, Yan J, Simas TA, Maynard SE. Angiogenic biomarkers for prediction and neonatal complications in suspected preeclampsia. J Matern Neonatal Med. 2012 Dec;25(12):2651-7. doi: 10.3109/14767058.2012.713055.
43. Costantine M, Tamayo E, Bytautiene E, Longo M, Hankins GD, Saade GR. Using pravastatin to improve the vascular reactivity in a mouse model of soluble Fms-like tyrosine kinase-1-induced preeclampsia. Obstet Gynecol. 2010 Jul;116(1):114-20. doi: 10.1097/AOG.0b013e3181e10ebd.
44. Fox KA, Longo M, Tamayo E, Kechichian T, Bytautiene E, Hankins GD, Saade GR, Costantine MM. Effects of pravastatin on mediators of vascular function in a mouse model of soluble Fms-like tyrosine kinase-1-induced preeclampsia. Am J Obstet Gynecol. 2011 Oct;205(4):366.e1-5. doi: 10.1016/j.ajog.2011.06.083.
45. Kazmin A, Garcia-Bournissen F, Koren G. Risk of statin use during pregnancy: a systematic review. J Obstet Gynaecol Can. 2007;29:906.
46. Edison R, Muenke M. Mechanistic and epidemiologic considerations in the evaluation of adverse birth outcomes following gestational exposure to statins. Am J Med Gen. 2004;131A:287.
47. Ofori B, Rey E, Berard A. Risk of congenital anomalies in pregnant users of statin drugs. Br J Clin Pharmacol. 2007;64:496.
48. Mateus J, Bytautiene E, Lu F, Tamayo EH, Betancourt A, Hankins GD, Longo M, Saade GR. Endothelial growth factor therapy improves preeclampsia-like manifestations in a murine model induced by overexpression of sVEGFR-1. Am J Physiol Heart Circ Physiol. 2011 Nov;301(5):H1781-7. doi: 10.1152/ajpheart.00373.2011.
49. Li Z, Zhang Y, Ying Ma, Kapoun AM, Shao Q, Kerr I, et al. Recombinant vascular endothelial growth factor 121 attenuates hypertension and improves kidney dama-ge in a rat model of preeclampsia. Hypertension. 2007 Oct;50(4):686-92.
50. Thadhani R, Kisner T, Hagmann H, Bossung V, Noack S, Schaarschmidt W, Kisner T, Hagmann H, et al. Pilot study of extracorporal removal of soluble fms-like tyrosine kinase 1 in preeclampsia. Circulation. 2011 Aug 23;124(8):940-50. doi: 10.1161/CIRCULATIONAHA.111.034793.
Conflicto de interés: El autor no reportó algún conflicto de interés.
Correspondencia:
Julio Mateus, MD, PhD
Dirección: 96 Jonathan Lucas Street Suite 634, MUSC 619 Charleston SC 29425, USA
mateusan@musc.edu














