Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.61 no.2 Lima abr./jun. 2015
ARTÍCULO DE REVISIÓN
Flujo sanguíneo uterino en el embarazo
Uterine blood flow during pregnancy
John Apaza Valencia1, Moisés Huamán Guerrero2,3
1 Ginecólogo Obstetra, Unidad de Bienestar fetal y Ecografía, Departamento de Ginecología y Obstetricia, Hospital III Honorio Delgado de Arequipa, Perú.
2 Doctor en Medicina, Profesor de la Facultad de Medicina, Universidad Nacional Mayor de San Marcos, Lima, Perú.
3 Instituto Latinoamericano de Salud Reproductiva (ILSAR), Lima, Perú.
RESUMEN
Los cambios fisiológicos cardiovasculares en el embarazo a nivel sistémico y uterino son fundamentales para el incremento del flujo sanguíneo uterino, la microcirculación y circulación en el espacio intervelloso. Los cambios fisiopatológicos de la circulación uterina y placentaria tienen relación con la preeclampsia y la restricción del crecimiento intrauterino. En esta revisión se describirá la anatomía de la circulación sanguínea uterina, el flujo sanguíneo uterino en el embarazo y sus implicancias clínicas.
Palabras clave: Flujo sanguíneo uterino, preeclampsia, restricción del crecimiento intrauterino.
ABSTRACT
Both systemic and uterine cardiovascular physiological changes in pregnancy are fundamental for blood flow increase in the uterus, microcirculation and circulation in the intervillous space. Pathophysiological changes in uterine and placental circulation are associated to preeclampsia and intrauterine growth restriction. In this review the anatomy of the uterine blood flow, uterine blood flow during pregnancy and clinical implications are described.
Keywords: Uterine blood flow, preeclampsia, intrauterine growth restriction.
INTRODUCCIÓN
En el Perú la preeclampsia (PE) tiene gran impacto en la salud pública, porque es la segunda causa de muerte materna (MM), representando 17 a 21% de las muertes, y es la primera causa de MM en los hospitales de EsSalud del país y en Lima Ciudad(1). En Arequipa, la tasa de MM es 110,6/100 mil NV; 60% es de causa directa y 54% son muertes evitables; la PE representa el 17% de las causas y comparte igual porcentaje con las hemorragias(2).
La preeclampsia es una enfermedad temprana del embarazo que se expresa tarde en el embarazo. Aún no existe una prueba clínicamente útil para predecir el desarrollo de la preeclampsia. Es promisorio el combinar marcadores de insuficiencia placentaria y de función endotelial, entre ellos los niveles séricos o urinarios de PlGF y sFlT-1 en el primer trimestre. Tan o más importante es la historia clínica personal y familiar de hipertensión(1).
Actualmente, el flujo sanguíneo uterino es valorado mediante los índices de pulsatilidad y resistencia de la onda de velocidad de flujo (OVF) de la arteria uterina, cuyos valores están determinados por la relación de velocidades del flujo en sístole y en diástole; cuando dichos valores se encuentran por encima de los puntos de corte (percentil 95), tienen asociación con la PE y la restricción del crecimiento intrauterino (RCIU). Sin embargo, la PE y la RCIU son estadios avanzados de la enfermedad y la sensibilidad de los índices Doppler de las arterias uterinas es baja a moderada y la especificidad es mejor que la sensibilidad(3). Por lo tanto, desde el punto de vista fisiopatológico de perfusión uterina, parece razonable cuantificar las velocidades y el flujo sanguíneo uterino de la gestante, lo cual podría dar resultados más representativos del estado funcional de la circulación útero-placentaria, inclusive antes de la etapa sintomática de la enfermedad.
ANATOMÍA DE LA CIRCULACIÓN SANGUÍNEA UTERINA
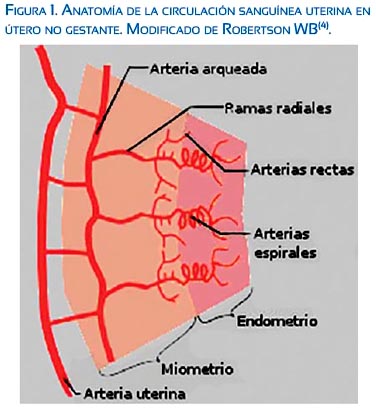
Es importante recordar que el útero es irrigado por las dos arterias uterinas, derecha e izquierda, las cuales recorren lateralmente al útero en forma ascendente en el ligamento ancho, anastomosándose con la arteria ovárica. En este recorrido dan origen a las arterias arqueadas o arcuatas que pasan medialmente y penetran el miometrio. Las arterias arcuatas se dividen casi inmediatamente en ramas anteriores y posteriores, recorren circunferencialmente entre el tercio medio y externo de miometrio y se anastomosan libremente con ramas del lado opuesto en la línea media. Durante su recorrido, las arterias arcuatas dan origen a las arterias radiales que se dirigen directamente hacia el lumen uterino.
Cerca de la unión endometrio-miometrio, la arteria radial da ramas laterales rectas que irrigan el miometrio y la parte basal del endometrio, de modo tal que en el embarazo el desarrollo decidual es dependiente de estos vasos. La continuación de la arteria radial dentro del endometrio basal y funcional da origen a la arteria espiral, que tiene forma ensortijada. Al llegar al lumen uterino, se angosta y divide en varias pequeñas ramas que siguen un curso recto antes de terminar en el plexo capilar, justo debajo del epitelio endometrial, dando irrigación al endometrio y a las glándulas uterinas.
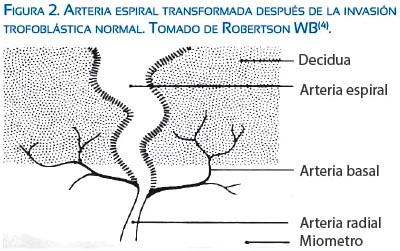
Lo interesante de conocer estos pequeños vasos es que tanto la pared de las arterias radial y espiral son ricas en músculo liso e inervación autonómica frente al estímulo adrenérgico endógeno y exógeno. Esto le da particular importancia en estados de vasoconstricción, especialmente en el segmento miometrial cerca de la unión endometrio-miometrio (figura 1)(4). Posteriormente, durante la invasión trofoblástica, las arterias espirales pierden el músculo liso de su pared y se convierten en vasos espirales dilatados que en su segmento distal llegan a medir 2 a 3 mm de diámetro formando una cámara en forma de embudo; se abren a través de la placa basal, sin reactividad a estímulos vasoactivos, reduciendo el riesgo de vasoconstricción espontánea y perfusión intermitente; ello representa una de las principales adaptaciones morfológicas maternas (figura 2)(4,5).
Conforme avanza el desarrollo placentario, la extensión de la conversión de la arteria espiral mencionada varía a lo largo del lecho placentario, siendo mayor en la región central, donde la invasión es más amplia. Por otro lado, se ha observado que la remodelación vascular de dilatación de los otros vasos uterinos es generalizada, pero no uniforme, a medida que avanza la gestación, habiendo considerable variación del tamaño de las arterias dentro del mismo individuo y aún en diferentes puntos dentro de cada arteria individual(6). En este proceso de remodelación, los vasos uterinos en general y especialmente la arteria uterina doblan su diámetro a las 6,5 semanas de gestación. A mitad de la gestación, el diámetro de la arteria arcuata excede en diámetro a la arteria uterina. Y a término, algunos tienen el doble de su diámetro(7). Según el estudio de Thaler y col.(8) la media del diámetro de la arteria uterina en la no gestante es de 1,6 mm, incrementando a 3,7 mm a término. Es probable que esta dilatación no inducida por la invasión trofoblástica sea una respuesta al estímulo endocrino y señal de dilatación mediada por óxido nítrico. De cualquier modo, el incremento del diámetro de los vasos permite incrementar el flujo sanguíneo en el útero para satisfacer las demandas metabólicas.
Es importante recordar también que el útero recibe circulación sanguínea de las arterias ováricas y arterias comunicantes, siendo de mucho menor diámetro y por consiguiente el flujo sanguíneo que lleva al útero resulta insuficiente, salvo cuando incrementan su diámetro en el embarazo de forma similar al incremento del diámetro de la arteria uterina(9).
FLUJO SANGUÍNEO UTERINO EN EL EMBARAZO
De acuerdo a algunos estudios, el útero gestante a término recibe el 12% del gasto cardiaco total en comparación del gasto cardiaco que recibe al inicio de la gestación, 3,5%(8). Por lo tanto, el flujo sanguíneo uterino en el embarazo comprende la parte funcional de la anatomía vascular uterina frente a los cambios fisiológicos cardiovasculares que se producen en el embarazo, como el aumento del gasto cardiaco y la significativa reducción de la resistencia vascular periférica, permitiendo así un mayor flujo sanguíneo en el útero y en el espacio intervelloso.
El desarrollo vascular en la gestación que da lugar a la reducción de la resistencia vascular se debe a un crecimiento coordinado y remodelamiento global de la circulación uterina, así como la creación de un nuevo órgano vascular fetal, la placenta. Estructuralmente, el remodelamiento vascular comprende un complejo número de procesos celulares como hipertrofia e hiperplasia, reacomodo de los elementos existentes y cambios en la matriz extracelular. Cada uno de estos procesos está sujeto a múltiples factores reguladores e influencias interactivas, fuerzas físicas como presión/tensión y shear stress (tensión tangencial), influencias endocrinas, humorales como VEGF y esteroides sexuales, factores locales generados dentro de la pared vascular como óxido nítrico endotelial, angiotensina y endotelina(10). De esta manera y como consecuencia de la remodelación, el incremento del flujo sanguíneo ejerce un efecto como fuerza hemodinámica sobre los componentes celulares de la sangre y sobre las paredes de los vasos sanguíneos. Esta fuerza mediante el fenómeno denominado mecanotransducción deforma el glicocálix del endotelio y por diferentes mecanismos produce la liberación de óxido nítrico y vasodilatación, favoreciendo el flujo sanguíneo hacia el útero; contrariamente, el efecto sería de vasoconstricción y disminución del flujo sanguíneo(11,12).
El flujo tisular o de la microcirculación es regulado por la modificación de las resistencias vasculares en las pequeñas arterias y arteriolas que modifican su diámetro, y el flujo sanguíneo distal a las arteriolas se distribuye de manera pasiva por la red capilar. Dos factores controlan el flujo capilar: primero, las resistencias que son el resultado de la interacción entre el diámetro de los vasos y la longitud de los capilares, y segundo, la reología que depende sobre todo de la viscosidad de la sangre y de la deformación de los eritrocitos. En condiciones de reposo, la velocidad media del flujo sanguíneo de la aorta es de 33 cm/s y 1/1000 de esta cifra en los capilares (0,3 mm/s), indispensables para la difusión de nutrientes en 1 a 3 segundos. Sin embargo, cuando las velocidades caen o el flujo sanguíneo es insuficiente a las demandas, la circulación a nivel microvascular o capilar se compromete ocasionando hipoperfusión(13). Por otro lado, el flujo en la interfase uteroplacentaria tiene la siguiente particularidad: la dilatación del segmento distal de la arteria espiral permite una disminución de la presión y velocidad del flujo sanguíneo conforme avanza en la zona de dilatación, siendo la presión sanguínea a nivel del segmento distal de la arteria espiral comparable a la presión del espacio intervelloso. De lo contrario, podría haber un daño mecánico potencial de la vellosidad por la entrada a velocidad del jet sanguíneo de alta presión al espacio intervelloso(14).
En general, por tratarse la sangre de un fluido no newtoniano, la tasa de flujo sanguíneo (Q) a través de cada arteria obedece a las leyes físicas de los fluidos, como la relación de flujo local de Poiseuille:
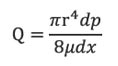
Donde (r) es el radio local de la arteria, (x) es la distancia del segmento del vaso, (p) es la presión y (µ) la viscosidad de la sangre. Debe notarse la relación directa del flujo Q con el radio y presión del vaso, a mayor diámetro y presión habrá mayor flujo sanguíneo; también la relación inversa con la viscosidad, a mayor viscosidad de la sangre menor flujo sanguíneo. La hemodilución fisiológica del embarazo favorece el flujo sanguíneo, no así la hemoconcentración asociada con la PE. La vasoconstricción en los estados hipertensivos disminuye el calibre de los vasos y el flujo sanguíneo, siendo crítica a nivel capilar en un estado de hemoconcentración.
Otra consecuencia de la conversión de la arteria espiral que tiene particular importancia es el efecto del flujo sanguíneo en el espacio intervelloso sobre la estructura placentaria. Así por ejemplo, el flujo sanguíneo que va de la boca de la arteria espiral a la cavidad central de la vellosidad libre de un lóbulo se dispersa radialmente entre las vellosidades determinando un sistema abierto de circulación, el cual es esencialmente un gran lago de sangre con poca impedancia de flujo (figura 3). De esta manera, la placenta actúa como un gran shunt arteriovenoso y dispersa el flujo radialmente entre las vellosidades(14). La falta de conversión de las arterias espirales establece un flujo sanguíneo turbulento que separa las vellosidades, dando lugar a los lagos intraplacentarios llenos de material trombótico. Ecográficamente pueden ser identificados como lesiones quísticas ecogénicas (ECL) y son de valor cuando el Doppler de las arterias uterinas son anormales(15).
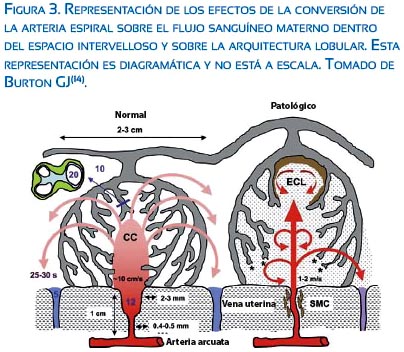
Paralelamente a los cambios morfológicos vasculares en el espacio uteroplacentario durante la gestación, se ha demostrado anatómica y funcionalmente el desarrollo de shunts vasculares intramiometriales, los cuales forman una red anastomótica localizada en el lecho placentario y permanecen funcionales después de la expulsión de la placenta (16). La presencia de este shunt es un ejemplo de cómo una gestación normal exitosamente reduce la resistencia vascular uterina y sistémica para lograr una adecuada perfusión a nivel del espacio intervelloso y capilar uterino. Sin embargo, es difícil de estimar la contribución relativa de este efecto descrito por Schaaps JP y col.(16) sobre el flujo sanguíneo uterino comparado a los cambios de la invasión trofoblástica. Por lo tanto, estos datos sugieren que la evaluación del flujo de la arteria uterina debería ser un próximo marcador de invasión trofoblástica y liberación de mediadores vasoactivos sobre el remodelamiento del árbol vascular uterino(14).
Conocida ahora la parte funcional de las arterias espirales, falta destacar que de los cientos de arteriolas espirales del útero solo 200 aproximadamente son transformadas en arterias uteroplacentarias, es decir, un pequeño número de arteriolas radiales y espirales son transformadas y un número mucho más grande de arteriolas no son transformadas. Por lo tanto, estas últimas arteriolas son vasos de alta resistencia vascular y llevan flujo sanguíneo a la decidua y miometrio formando un subsistema de circulación paralela placentaria y no placentaria, con flujo sanguíneo terminal no compartido en cada subsistema dependiente del flujo global adecuado de las arterias uterinas(9). Patológicamente en el embarazo, se ha descrito en estos vasos espirales deciduales y arterias espirales de la circulación uteroplacentaria lesiones vasculares como aterosis aguda (necrosis fibrinoide de la pared vascular, acumulación de macrófagos cargados de lípidos e infiltrado perivascular mononuclear), y vellosidades terminales pequeñas e hipoplasia vellosa distal como signos placentarios de hipoperfusión vascular materna relacionados con PE, RCIU idiopática y displasia broncopulmonar(17-19). Se puede deducir entonces y como se ha sugerido de acuerdo con diferentes estudios, que la PE y la RCIU comparten fisiopatología común de inflamación vascular similar a la aterosclerosis y enfermedad arterial crónica, cuyos factores de riesgo aterogénicos también podrían ser factores de riesgo de preeclampsia y RCIU(20).
INTERCAMBIO MATERNO-FETAL Y FLUJO SANGUÍNEO
Al inicio del embarazo, la perfusión placentaria intermitente puede tener pocas consecuencias en la circulación del espacio intervelloso, no así en la gestación de término, donde la extracción de oxígeno fetal es máxima. Por lo tanto, una disminución del flujo sanguíneo materno disminuye el tamaño de los poros intervellosos (espacios intervellositarios), reduce el reservorio sanguíneo placentario y el intercambio materno-fetal y, por concentraciones de oxígeno fluctuantes, induce estrés oxidativo placentario con consecuencias fisiológicas relacionadas con la preeclampsia y otras complicaciones(21,22).
Cuando se da el intercambio materno-fetal al pasar la sangre sobre la superficie de la vellosidad placentaria para un efectivo intercambio difusional en la circulación materna y fetal, es esencial que la presión en el espacio intervelloso sea baja en relación con la presión capilar fetal, evitando así la compresión de este último. Cuando ello no ocurre, el incremento de presión en el espacio intervelloso hace que incremente la resistencia vascular umbilical, siendo la presión diferencial entre las dos circulaciones el determinante crítico del tamaño capilar y del grosor de membrana indispensables para un adecuado intercambio difusional(23).
Se ha descrito también que el flujo sanguíneo en el espacio intervelloso es un determinante de la concentración de enzimas antioxidantes en la placenta. La dirección del flujo sanguíneo que llega a la placenta de la parte central a la periferia hace que la tensión de oxígeno prevalente y maduración de la vellosidad bien oxigenada sea mayor en la región central comparada con la periferia. De igual modo, las actividades de catalasa y glutationperoxidasa refleja gradientes de tensión de oxígeno mayor en la parte central, lo cual es una prueba de que la tensión de oxígeno tiene un rol regulador de la actividad enzimática reflejada en gradientes establecidos por el patrón de flujo sanguíneo(24).
CUANTIFICACIÓN DEL FLUJO SANGUÍNEO UTERINO
Muchos investigadores han estimado la cantidad de flujo sanguíneo uterino utilizando una variedad de técnicas(25). Thaler y col.(8) han demostrado un incremento constante en la tasa de volumen de flujo de la arteria uterina de 94,5 mL/min antes de la gestación a una media de 342 mL/min en la gestación tardía (incremento de 3,5 veces).
Konge JC (26) utilizó angiografía power Doppler y estableció que este es un método simple no invasivo para determinar el volumen de flujo de la arteria uterina. Acharya G(27) validó la ecografía Doppler de la arteria uterina utilizando un equipo de ultrasonido con sonda convexa de 4 MHz con Doppler color para medir el diámetro del vaso y calcular el flujo mediante la medición de la velocidad media tiempo promedio (TAMEANV); el área del vaso fue calculada con la siguiente fórmula: Área (A) = π (diámetro/2)2. El volumen de flujo sanguíneo uterino fue calculado con la siguiente fórmula: QUtA(mL/min) = TAMEANV (cm/s) × A (cm2) × 60 (figura 4).
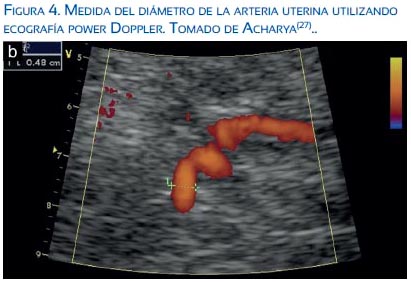
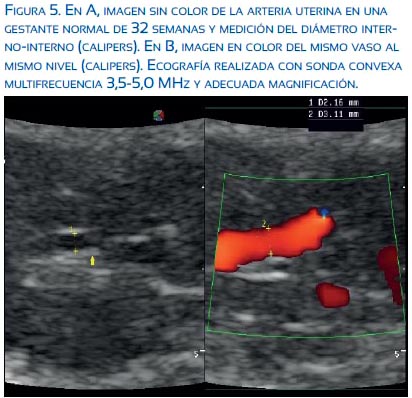
En la práctica, se conoce que la medición del diámetro de la arteria uterina en Doppler color es mayor que el diámetro real del vaso, lo cual induciría a sesgo de medición del flujo sanguíneo uterino. Sin embargo, con una adecuada magnificación de la imagen es posible medir el diámetro real de la arteria uterina sin Doppler color hasta en 30% de los casos (figura 5) (estudio piloto con datos no publicados). De lo contrario, podría ser adecuado simplemente medir las velocidades, dado que las velocidades tienen relación directa con el flujo sanguíneo y la perfusión uterina. De todas las velocidades que se pueden medir con el Doppler, la velocidad media de la arteria uterina tendría ventaja por tratarse de la velocidad integral de un flujo laminar relacionado con el ciclo cardiaco (estudio piloto con datos no publicados). El incremento del flujo sanguíneo uterino en el embarazo tiene relación con los cambios hemodinámicos que ocurren en la gestación, disminución de la resistencia periférica e incremento del gasto cardiaco materno(28).
CONCLUSIONES
La base anatómica de la circulación sanguínea uterina y los cambios fisiológicos cardiovasculares en el embarazo a nivel sistémico y uterino son fundamentales para el incremento del flujo sanguíneo uterino, la microcirculación y circulación del espacio intervelloso, cuyo mecanismo de regulación es múltiple incluyendo las leyes físicas de los fluidos. La circulación uterina y placentaria está estrechamente conectada no solo en lo anatómico sino en lo funcional y cuya anormalidad trae consecuencias no solo funcionales sino también anatómicas. La dilatación de los vasos espirales secundaria a la invasión trofoblástica representa una de las principales adaptaciones morfológicas maternas para un efectivo intercambio difusional en el espacio intervelloso. La estimación del flujo sanguíneo uterino en el embarazo mediante ecografía Doppler de arterias uterinas es factible y requiere mayor investigación para establecer su verdadero rol en el embarazo normal, preeclampsia y RCIU.
REFERENCIAS BIBLIOGRÁFICAS
1. Pacheco J. Preeclampsia/eclampsia: Reto para el ginecoobstetra. Acta Med Per. 2006;23(2):100-11.
2. Pérez MA. Análisis de la mortalidad materna en la región Arequipa. Periodo 2003-2007. DIRESA Arequipa. Disponible en Archivos GERESA – Arequipa.
3. Sosa A, Zurita J, Larrazábal N, Huamán M. Flujometría Doppler de las arterias uterinas durante el embarazo. Ultrasonografía Embrio – Fetal. Volumen 1. Valencia, Estado de Carabobo, Venezuela: Sociedad Venezolana de Ultrasonido en Obstetricia y Ginecología. 2005:1-6.
4. Robertson WB. Uteroplacental vasculature. J Clin Path. 1976; 29 Suppl. (Roy Coll Path.) 10:9-17.
5. Harris JWS, Ramsey EM. The morphology of human uteroplacental vasculature. Contrib Embryol. 1966;38:43–58.
6. Brosens IA. The utero-placental vessels at term – the distribution and extent of physiological changes. Trophoblast Res. 1988;3:61–7.
7. Burchell C. Arterial blood flow in the human intervillous space. Am J Obstet Gynecol. 1969;98:303–11.
8. Thaler I, Manor D, Itskovitz J, Rottem S, Levit N, Timor-Tritsch I, et al. Changes in uterine blood flow during human pregnancy. Am J Obstet Gynecol. 1990;162:121-5.
9. Burbank F. Hemodynamic changes in the uterus and its blood vessels in pregnancy. Excerpted from selected chapters in: Burbank F. Fibroids, Menstruation, Childbirth, and Evolution: The Fascinating Story of Uterine Blood Vessels. Tucson, AZ: Wheatmark, 2009:177-82.
10. Osol G, Mandala M. Maternal uterine vascular remodeling during pregnancy. Physiology. 2009;24:58-71.
11. Gielen S, Schuler G, Adams V. Cardiovascular effects of exercise training: molecular mechanisms. Circulation. 2010;122:1221-38.
12. Johnson BD, Mather KJ, Wallace JP. Mechanotransduction of shear in the endothelium: basic studies and clinical implications. Vascular Med. 2011;16(5):365–77. doi: 10.1177/1358863X11422109.
13. Guyton – Hall. Tratado de Fisiología Médica. 12° Edición. Mc Graw Hill. 2011.
14. Burton GJ, Woods AW, Jauniaux E, Kingdom JC. Rheological and physiological consequences of conversion of the maternal spiral arteries for uteroplacental blood flow during human pregnancy. Placenta. 2009 Jun;30(6):473–82. doi: 10.1016/j.placenta.2009.02.009..
15. Viero S, Chaddha V, Alkazaleh F, Simchen MJ, Malik A, Kelly E, et al. Prognostic value of placental ultrasound in pregnancies complicated by absent end-diastolic flow velocity in the umbilical arteries. Placenta. 2004;25:735–41.
16. Schaaps JP, Tsatsaris V, Goffin F, Brichant JF, Delbecque K, Te-bache M, et al. Shunting the intervillous space: new concepts in human uteroplacental vascularization. Am J Obstet Gynecol. 2005;192:323–32.
17. Labarrere CA. Acute atherosis. A histopathological hallmark of immune aggression? Placenta. 1988;9(1):95-108.
18. Mestan KK, Check J, Minturn L, Yallapragada S, Farrow KN, Liu X, et al. Placental pathologic changes of maternal vascular underperfusion in bronchopulmonary dysplasia and pulmonary hypertension. Placenta. 2014 Aug;35(8):570-4. doi: 10.1016/j.placenta.2014.05.003.
19. Ogge G, Chaiworapongsa T, Romero R, Hussein Y, Kusanovic JP, Yeo L, et al. Placental lesions associated with maternal underperfusion are more frequent in early-onset than in late-onset preeclampsia. J Perinat Med. 2011 Nov;39(6):641–52. doi: 10.1515/JPM.2011.098.
20. Staff AC, Dechend R, Redman CWG. Review: Preeclampsia, acute atherosis of the spiral arteries and future cardiovascular disease: Two new hypotheses. Placenta. 2013 Mar;34 Suppl:S73-8. doi: 10.1016/j.placenta.2012.11.022.
21. Mayhew TM, Wadrop E. Placental morphogenesis and the star volumes of villous trees and intervillous pores. Placenta. 1994;15:209–17.
22. Hung TH, Skepper JN, Burton GJ. In vitro ischemia–reperfusion injury in term human placenta as a model for oxidative stress in pathological pregnancies. Am J Pathol. 2001;159:1031–43
23. Karimu AL, Burton GJ. The effects of maternal vascular pressure on the dimensions of the placental capillaries. Br J Obstet Gynaecol. 1994;101:57–63.
24. Hempstock J, Bao YP, Bar-Issac M, Segaren N, Watson AL, Charnock-Jones DS, et al. Intralobular differences in antioxidant enzyme expression and activity reflect oxygen gradients within the human placenta. Placenta. 2003;24:517–23.
25. Assali NS, Rauramo L, Petonen T. Measurement of uterine blood flow and uterine metabolism. VIII. Uterine and fetal blood flow and oxygen consumption in early human pregnancy. Am J Obstet Gynecol. 1960;79:86-98.
26. Konje JC, Kaufmann P, Bell SC, Taylor DJ. A longitudinal study of quantitative uterine blood flow with the use of color power angiography in appropriate for gestational age pregnancies. Am J Obstet Gynecol. 2001;185:608–13.
27. Acharya G, Sitras V, Erkinaro T, Mäkikallio K, Kavasmaa T, Päkkilä M, Huhta JC, Räsänen J. Experimental validation of uterine artery volume blood flow measurement by Doppler ultrasonography in pregnant sheep. Ultrasound Obstet Gynecol. 2007 Apr;29(4):401-6.
Declaración: Se declara que el material contenido en el manuscrito no ha sido publicado previamente o remitido a otra revista biomédica.
Financiamiento: Autofinanciado.
Conflicto de intereses: ninguno
Correspondencia:
Dr. John Apaza Valencia
Urb. Quinta El Sol Mz B Lote 11, Cerro Colorado, Arequipa.
Correo electrónico: john_apaza@hotmail.com
Artículo recibido el 11 de octubre de 2014 y aceptado para publicación el 15 de enero de 2015.














