Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.61 no.2 Lima abr./jun. 2015
CASO CLÍNICO
Mujer con falla ovárica prematura a los 15 años de edad, logra embarazo con ovodonación
Woman with premature ovarian failure at age 15 becomes pregnant with ovodonation
Roly Hilario1, Julio Dueñas1, Rita De los Santos2, Javier Garcia3, Luis Velarde4
1 Centro de Fertilidad PROCREAR, Lima, Perú.
2 Médico Residente de Ginecología, Universidad Nacional del Altiplano, Puno, Perú.
3 Biólogo del Laboratorio de Reproducción Asistida Fertilab, Lima, Perú.
4 Biólogo de GenticsLab, Lima, Perú.
RESUMEN
Se presenta el caso de una mujer de 22 años de edad, con 3 años de convivencia y búsqueda de embarazo, que acudió por infertilidad, con antecedente de menarquía y falla ovárica prematura (FOP) a los 15 años de edad. Sus caracteres sexuales secundarios eran normales, tuvo FSH de 69 mUI/mL, LH 21,5 mUI/mL, estradiol 5 pg/mL, perfil tiroideo normal, prolactina 0,22 ng/mL, glucosa e insulina dentro de valores normales, con resonancia magnética nuclear de hipófisis sin alteraciones. Cariotipo en sangre 46, XX. La ecografía transvaginal mostró útero hipotrófico de 46 x 20 x 25 mm, endometrio 2,2 mm, ovarios hipotróficos. Se indicó valerato de estradiol/dienogest, con ecografía de control que mostró útero 69 x 22 x 33 mm (al mes) y 72 x 24 x 30 mm (al año). El espermatograma del esposo mostró 55,6 millones de espermatozoides/mL, motilidad progresiva 24%, morfología normal 4%, fragmentación de ADN 14,2%. No se estudió autoinmunidad ni el gen FMR-1. Se realizó ovodonación-ICSI-columna de anexina, obteniéndose 15 ovocitos; fecundaron 12, llegaron a blastocisto 4 embriones, se transfirió 2 embriones y se congeló 2. Se logró embarazo único, actualmente en curso. La frecuencia de casos de falla ovárica prematura a los 15 años se estima en 1/10 000 mujeres menores de 20 años, sin causa aparente.
Palabras clave: Falla ovárica prematura, ovodonación, cariotipo.
ABSTRACT
The case of an infertile 22 year-old woman with 3 years of cohabitation and history of menarche and premature ovarian failure (POF) at age 15 is presented. Secondary sex characteristics were normal, FSH was 69 mIU/mL, LH 21.5 mIU/mL, estradiol 5 pg/mL, normal thyroid profile, prolactin 0.22 ng/mL, glucose and insulin within normal limits; no alterations of the pituitary gland were detected by magnetic resonance. Karyotype was 46, XX. Transvaginal ultrasound showed a 46 x 20 x 25 mm hypothrophic uterus, endometrium 2.2 mm, hypotrophic ovaries. Administration of estradiol valerate/dienogest enlarged uterus to 69 x 22 x 33 mm (in one month) and 72 x 24 x 30 mm (in one year). Husband’s sperm count was 55.6 million/mL, progressive motility 24%, normal morphology 4%, and DNA fragmentation 14.2%. Autoimmunity and FMR-1 gene were not studied. Egg donation-ICSI-annexin column were performed obtaining 15 oocytes; fecundation occurred in in 12, and 4 embryos reached blastocyst stage, 2 embryos were transferred and 2 frozen. Single pregnancy was obtained with ongoing pregnancy. The frequency of premature ovarian failure cases at age 15 is estimated at 1/10 000 in women younger than 20 years, without apparent cause.
Keywords: Premature ovarian failure, egg donation, karyotype.
INTRODUCCIÓN
La falla ovárica prematura o precoz (FOP), también denominada insuficiencia ovárica prematura o hipogonadismo hipergonadotrópico, consiste en una amenorrea secundaria de más de seis meses, antes de los 40 años de edad, con aumento de las hormonas FSH y LH, además de la disminución de estrógenos. Se la considera una enfermedad genética compleja, con presentación familiar en 12% a 50%. Puede originarse de genes diferentes y diversas interacciones entre gen y ambiente(1-5).
La falla ovárica prematura afecta alrededor de una en cien mujeres menores de 40 años, una en 250 mujeres de 35 años, una en mil mujeres de 30 años y una en diez mil mujeres de 20 años de edad. No siempre significa que ya ocurrió una menopausia temprana, pues la mitad de ellas tendrá función ovárica intermitente e impredecible por algunos años(2,5). Se define el diagnóstico basado en la amenorrea durante 3 a 6 meses, la demostración de FSH superior a 40 mUI/mL en al menos dos ocasiones y niveles bajos de estrógeno. Las mujeres con FOP pueden experimentar síntomas de la menopausia, tales como sofocos, sudores nocturnos y sequedad vaginal, similar a los de la menopausia natural
La presentación clínica es variable y tiene prevalencia de 10 a 28% en pacientes con amenorrea primaria y de 4 a 18% en los casos de amenorrea secundaria(3,4). Puede ocurrir en la etapa prepuberal, puberal o reproductiva. La noxa en la edad reproductiva determinará además esterilidad primaria o secundaria.
En la mayoría de los casos no se identifica la causa subyacente(4). Las causas conocidas incluyen:
(a) aberraciones genéticas, que podrían implicar el cromosoma X o autosomas. Del gran número de genes candidatos para causar FOP, se ha identificado algunas mutaciones claras, como el gen FMR-1; (b) daño autoinmune del ovario, según lo sugerido por la asociación de FOP con otros trastornos autoinmunitarios. Se encuentra anticuerpos antiováricos en la FOP, pero su especificidad y papel patogénico son cuestionables; (c) iatrogénicos después de cirugía, radio terapia o quimioterapia en tumores malignos; y, (d) factores ambientales como las infecciones virales, y para los cuales destaca un mecanismo claro de toxinas.
La detección de trastornos autoinmunes asociados y cariotipo, particularmente en la enfermedad de aparición temprana, constituyen parte del estudio para el diagnóstico(4). No habría lugar para la biopsia ovárica. El manejo esencialmente consiste en reemplazo hormonal y el tratamiento de la infertilidad. El único medio probado para la infertilidad es la concepción con ovocitos donados. Se recomienda la criopreservación de embriones, tejido ovárico u ovocitos en casos donde es previsible el fallo ovárico, como en las mujeres sometidas a tratamientos contra el cáncer.
En 8 a 9% de las pacientes se ha descrito anomalías del cromosoma X, tanto familiares como esporádicas. Estas incluyen anomalías numéricas, como la monosomía o trisomía X, aneuploidías parciales como deleciones o isocromosomas, y anomalías estructurales como las translocaciones X, autosoma (TXA)(5,6). El síndrome de Turner es uno de los trastornos cromosómicos más frecuentes, con una incidencia de 1 cada 2 500 a 3 000 recién nacidas vivas(7). Los signos casi constantes son la talla baja y la disgenesia gonadal. Pero existe gran variabilidad clínica que se correlaciona con el amplio espectro de anomalías cromosómicas asociadas. Aproximadamente la mitad de las pacientes presenta monosomía X en línea pura (cariotipo 45, X), 20% en mosaico y, el resto, diferentes alteraciones estructurales, como deleciones, translocaciones, cromosomas en anillo o marcadores(8,9). Alrededor de 15% de las pacientes inician espontáneamente la pubertad y muchas de ellas presentan menarca con posterior desarrollo de amenorrea secundaria a edades variables(10,11).
Aparte del síndrome de Turner, la causa congénita más común de insuficiencia ovárica primaria es la premutación FMR1. La ampliación a más de 200 repeticiones de un trinucleótido CGG en el extremo 5’ del FMR1 conduce al síndrome X frágil. Los alelos con repeticiones en las longitudes 59 a 199 confieren un estado de premutación inestable que puede ampliarse a una mutación completa dentro de una generación.
Las mujeres con el alelo premutado tienen un riesgo considerablemente mayor de insuficiencia ovárica primaria, posiblemente debido a que las concentraciones intracelulares de ARNm aumentadas (dentro de un rango particular) podrían secuestrar proteínas unidas al CGG, que son importantes para la transformación del ARN. El 2 a 5% de las mujeres con trastorno idiopático tienen un alelo premutado, y 13 a 15% de las que proceden de familias con síndrome de X frágil y premutación FMR1 sufrirán de insuficiencia ovárica primaria. El síndrome de X frágil (SXF) es una causa frecuente de retraso mental (RM); se presenta en 1 de 4 000 hombres y en 1 de 8 000 mujeres.
CASO CLÍNICO
Mujer de 22 años que consultó al centro de fertilidad PROCREAR por deseos reproductivos, conviviente con varón de 29 años de edad desde hacía 3 años. Con ocupación ama de casa, tenía como antecedentes menarquía a los 15 años, solo 2 menstruaciones, seguida de amenorrea secundaria por 3 años. A los 18 años de edad recibió valerato de estradiol en forma intermitente, que ocasionó sangrado uterino, abandonando el tratamiento 5 meses antes de su ingreso al servicio. Acudió con amenorrea de 5 meses. No tenía antecedentes familiares y patológicos de importancia.
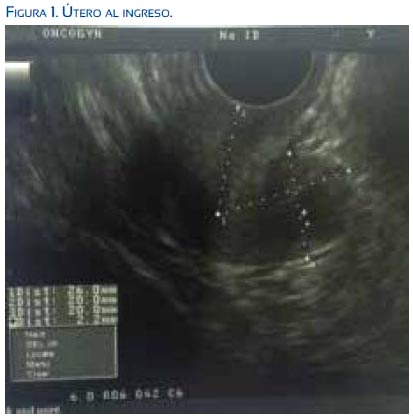
Desarrollo de caracteres sexuales secundarios normales. La ecografía transvaginal de ingreso (figura 1) mostró útero de 42 x 20 x 33 mm, endometrio 2,2 mm, ovario derecho 17,8 x 9,4 mm e izquierdo 17 x 10,4 mm. Estradiol 5,7 pg/dL, FSH 69 mUI/mL, LH 21,5 mUI/ mL, prolactina 0,218 ng/mL, testosterona 0,04 ng/mL, insulina 23,3 uU/mL, glicemia 87 mg/ dL, TSH 2,9 uUI/mL, T3L 3,91 uUI/mL, T4L 1,11 uUI/mL. La resonancia magnética fue referida como normal. En otro control hormonal, estradiol 5,74 pg/dL, FSH 36,38 mUI/mL, LH 17,8 mUI/mL. El cariotipo fue 46, XX. La histerosonografía demostró la cavidad endouterina libre, el canal cervical permeable.
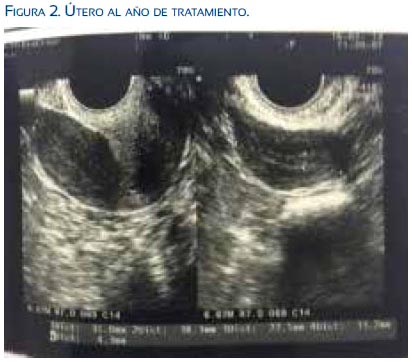
Se le indicó valerato de estradiol/dienogest (QLAIRA®), con ecografía de control del útero 69 x 22 x 33 mm al mes y 72 x 24 x 30 mm al año (figura 2). El espermatograma del esposo mostró 55,6 millones de espermatozoides/ mL, motilidad progresiva 24%, morfología normal 4%, fragmentación de ADN 14,2%.
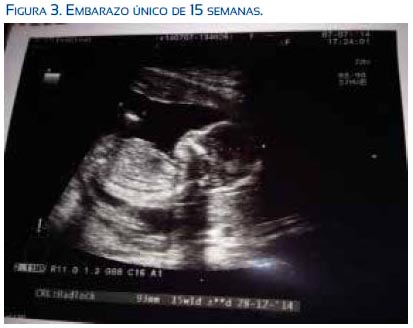
Se realizó ovodonación-ICSI-columna de anexina, obteniéndose 15 ovocitos; fecundaron 12, llegaron a blastocisto 4 embriones, se transfirió 2 embriones y se congeló 2. Logró embarazo único, actualmente en curso; el último control a las 15 semanas (figura 3).
DISCUSIÓN
Los casos de FOP son esporádicos, la mayoría sin causa aparente, con presentación antes de los 20 años de edad en 1/10 000. Se comunica casos de menopausia a los 16 y 18 años, pero también pueden presentarse como amenorrea primaria. El caso que comunicamos ocurrió a los 15 años, aparentemente idiopático, aunque no se estudió autoinmunidad ni el gen FMR-1. En estos casos es importante la determinación del cariotipo y la investigación de la premutación del gen FMR-1, de modo que todas las afectadas obtengan el diagnóstico adecuado y el correspondiente asesoramiento genético.
En un caso publicado en el 2011, se trató de una paciente con diagnóstico de hipogonadismo hipergonadotrófico a los 18 años, en la que el estudio citogenético reveló cariotipo 46,X,t(X;11)(q23;q22), interpretándose como translocación X, autosoma balanceada con punto de ruptura en la región crítica para la función ovárica normal. Gestó a los 25 años de edad, con tratamiento hormonal sustitutivo. Nació una niña con crecimiento y desarrollo normales, con telarca y pubarca a los 11 años. A los 13 años y 3 meses, debido a detención en el desarrollo puberal, se le diagnosticó hipogonadismo hipergonadotrófico. El estudio cito-genético detectó translocación X, autosoma balanceada heredado de su madre. Las mujeres con translocaciones X, autosoma balanceadas frecuentemente desarrollan falla ovárica prematura por interrupción de la región crítica del cromosoma X, que se extiende entre Xq13 a Xq27. Se concluyó que estas dos mujeres (madre e hija) tenían TXA balanceada(13).
Se describe embarazos espontáneos, incluso durante el tratamiento hormonal sustitutivo. Por ello, se debe realizar estudio genético adecuado, por los posibles riesgos en la descendencia. El tratamiento reproductivo único aprobado para obtener una gravidez es la donación de óvulos con fertilización in vitro y transferencia posterior de embriones, como la mejor opción(14).
REFERENCIAS BIBLIOGRÁFICAS
1. Janse F, Knauff EA, Niermeijer MF, Eijkemans MJ, Laven JS, Lambalk CB, Fauser BC, Goverde AJ; On behalf of the Dutch Premature Ovarian Failure Consortium. Similar phenotype characteristics comparing familial and sporadic premature ovarian failure. Menopause. 2010;17(4):758-65. doi: 10.1097/gme.0b013e3181cf8521.
2. Kokcu A. Premature ovarian failure from current perspective. Gynecol Endocrinol. 2010;26(8):555-62. doi: 10.3109/09513590.2010.488773.
3. Coulam CB, Adamson SC, Annegers JF. Incidence of premature ovarian failure. Obstet Gynecol. 1986 67:604-6.
4. Goswami D, Conway GS. Premature ovarian failure. Human Reproduction Update. 2005;11(4):391–410.
5. Pacheco J. Falla ovárica precoz. An Fac med. 2010;71(3):191-200.
6. Nelson LM. Clinical practice. Primary ovarian insufficiency. N Engl J Med. 2009 Feb;360(6):606-14. doi: 10.1056/NEJMcp0808697.
7. Welt CK. Primary ovarian insufficiency: a more accurate term for premature ovarian failure. Clin Endocrinol (Oxf). 2008;68(4):499-509.
8. Therman E, Laxova R, Susman B. The critical region on the human Xq. Hum Genet. 1990;85:455-61.
9. Powell CM, Taggart RT, Drumheller TC, Wangsa D, Qian C, Nelson LM, White BJ. Molecular and cytogenetic studies of an X;autosome translocation in a patient with premature ovarian failure and review of the literature. Am J Med Genet. 1994;52:19-26.
10. Saenger P. Turner’s syndrome. N Engl J Med. 1996;335:1749-54.
11. Elsheikh M. Turner’s Syndrome in adulthood. Endocr Rev. 2002;23:120-40.
12. Frías J, Davenport ML. Health supervision for children with Turner Syndrome. Pediatrics. 2003;111:692-702.
13. Pasquino AM, Passeri F, Pucarelli I, Segni M, Municchi G. Spontaneous pubertal development in Turner’s syndrome. On behalf of Italian Study Group for Turner’s Syndrome. J Clin Endocrinol Metab. 1997;82:1810-3.
14. Marsha L, Davenport ML. Approach to the patient with Turner Syndrome. J Clin Endocrinol Metab. 2010;95:1487-95
15. Dra. Manrique / Dr. Fontes. Clases de Residentes 2010. Clasificación y diagnóstico de amenorrea de la OMS (1970) a Granada (2010). Servicio de Obstetricia y Ginecología, Hospital Universitario Virgen de las Nieves, Granada. Disponible en: http://www.hvn.es/servicios_asistenciales/ginecologia_y_obstetricia/ficheros/clasif_diag_amenorrea.pdf.
16. Gilligan M, Boquete H, Llano M, Suárez M, Azaretzky M, Arroyo MV, Rozental S, Fideleff H. Insuficiencia ovárica primaria familiar asociada a una translocación X;autosoma. Rev argentina endocrin metab. 2011;48(3):164-8.
17. Arrestia D. Falla ovárica prematura. Clínica de Endocrinología y Metabolismo, 2013 Mar 8, Ateneo Montevideo. Disponible en: http://es.slideshare.net/indromac/ateneo-falla-ovarica-precoz.
Fuente de financiamiento: Autofinanciado.
Conflicto de interés: ninguno.
Artículo presentado en la sección Temas Libres del XX Congreso Peruano de Obstetricia y Ginecología, Lima, 30 de setiembre al 3 de octubre de 2014.
Correspondencia:
Roly Hilario
Av. Petit Thouars 4737, Lima, Perú
Celular: 993553184
Correo electrónico: walterichard@hotmail.com














