Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.61 no.3 Lima jul./set. 2015
CONTROVERSIAS EN GINECOLOGÍA Y OBSTETRICIA
Mamografía como instrumento de tamizaje en cáncer de mama
Mammogram as a screning tool in breast cancer
Julio Abugattas Saba1,a; Javier Manrique Hinojosa1,b; Tatiana Vidaurre Rojas1,c
1 Instituto Nacional de Enfermedades Neoplásicas (INEN) "Dr. Eduardo Cáceres Graziani"
a Sub-Jefe Institucional del OPE, Médico Asistente del Departamento de Mamas, Tejidos Blandos y Piel
b Director Ejecutivo del Departamento de Promoción de la Salud, Prevención y Control Nacional del Cáncer, Jefe del Departamento de Prevención y Diagnóstico
c Jefe Institucional del OPE, Médico Asistente del Departamento de Oncología Médica
RESUMEN
El cáncer de mama constituye la segunda neoplasia maligna más frecuente en el mundo y es la quinta causa de muerte por cáncer en las mujeres. En el Perú, ocupa el segundo lugar en incidencia y es la tercera causa de muerte por cáncer en la mujer. La mamografía como tamizaje se empieza a utilizar en la década de 1960 con el objeto de detectar lesiones sospechosas de cáncer antes de que sean clínicamente evidentes, lo más pequeñas, para mejorar el pronóstico y la sobrevida de las pacientes portadoras de este tumor. Se han realizado múltiples estudios para evaluar la importancia de la mamografía como tamizaje, así como también para definir a qué edad comenzar con el tamizaje, cuál es la frecuencia con la que se debe recomendar y hasta qué edad mantener su indicación. En este artículo de revisión se expone el rol de la mamografía como despistaje, las controversias sobre su uso, incluido los efectos colaterales y el estado de la mamografía como tamizaje en el Perú con las recomendaciones existentes.
Palabras clave: Mama; Neoplasias de la mama; Cáncer de mama; Mamografía.
ABSTRACT
Breast cancer is the second most frequent malignant neoplasm in the world and the fifth cause of death from cancer in women. In Peru, breast cancer is second in incidence and the third cause of death from cancer in women. Mammography screening began in 1960 with the goal of detecting cancer at its smallest size before clinically evident in order to have better prognosis and survival. Several trials have been done since to determine mammography importance as a screening method and to establish age to begin, frequency and when to stop screening. In this article the role of mammography as screening tool is reviewed, as well as controversies on use, side effects, and recommendations on its use in Peru.
Keywords: Breast; Breast neoplasms; Mammography.
INTRODUCCIÓN
El cáncer de mama constituye la segunda neoplasia maligna más frecuente en el mundo y es la quinta causa de muerte por cáncer en las mujeres. Hay diferencia entre los países desarrollados y aquellos que están en vías de desarrollo(1). En el Perú constituye la segunda causa de muerte y es la tercera causa de muerte por cáncer en la mujer(1).
No existe un método para determinar quién va a desarrollar cáncer de mama en algún momento de su vida, de tal forma que podamos tomar acción para evitar esta enfermedad. Disponemos de algunos métodos para detectar el tumor de manera temprana (prevención secundaria). Uno de esos métodos es tamizaje por mamografía. La idea de realizar despistaje mamográfico es encontrar lesión(es) en la mama que correspondan a cáncer en estadio lo más temprano posible, teniendo en cuenta que la sobrevida de pacientes con cáncer de mama depende en buena parte de la precocidad del diagnóstico.
El uso masivo de la mamografía se inicia en Estados Unidos de Norteamérica y en Europa en la década de 1960 de manera programada o por requerimiento de las pacientes. Como resultado se encuentra en décadas posteriores un aumento en la incidencia de cáncer de mama así como aumento en la incidencia de estadios tempranos y disminución de estadios tardíos. Diversas instituciones empiezan a promover el uso de la mamografía como tamizaje y de acuerdo a evaluaciones estadísticas sugieren iniciar dicho tamizaje a determinada edad, con determinada frecuencia y hasta determinada edad o hasta el fin de la vida. Estas acciones llevaron a que personas sanas estuvieran alertas con relación al cáncer de mama, pero invariablemente se empezó a hablar de costos y de complicaciones y/o efectos adversos del tamizaje(2).
Para que una prueba de tamizaje sea eficaz y eficiente se tiene que cumplir varios requisitos, entre ellos, que la enfermedad a 'tamizar' debe tener una incidencia importante, la prueba debe tener una alta sensibilidad y especificidad, su costo debe ser relativamente bajo/asequible, debe ser relativamente fácil de realizar y con mínimos efectos secundarios y/o complicaciones.
Diversos países han establecido guías para realizar tamizaje de cáncer de mama con mamografía, existiendo controversia sobre cuándo iniciar el tamizaje, el intervalo recomendado y hasta qué edad realizarlo. Es de notar que en un mismo país hay controversia en relación a la edad de inicio del tamizaje. Por ejemplo, en Estados Unidos la United States Preventive service Task Force (USPSTF) recomienda el tamizaje para mujeres entre 50 y 74 años en forma biannual(3), mientras que el National Comprehensive Cancer Network (NCCN-USA) recomienda el tamizaje en mujeres de 40 a más en forma anual(4), creando conflicto.
En este artículo revisaremos la información sobre las indicaciones del tamizaje para cáncer de mama con mamografía así como las guías y/o indicaciones que existen en nuestro país.
EPIDEMIOLOGÍA
El cáncer de mama es la segunda neoplasia maligna más frecuente en el mundo y el tipo de cáncer más frecuente en la población femenina mundial, con un estimado de 1,67 millones de casos nuevos diagnosticados en el año 2012 (25% de todos los cánceres). Su frecuencia es común tanto en regiones desarrolladas (794 000 casos) como en las regiones en vías de desarrollo (883000 casos). Las tasas de incidencia varían a través de las diferentes regiones del mundo, oscilando entre 96 x 100 000 en el oeste de Europa y 27 x 100 000 en África Central y Este de Asia. El cáncer de mama es la quinta causa de muerte por cáncer en las mujeres (522 000), afectando predominantemente a las regiones menos desarrolladas (324 000 muertes). En las regiones más desarrolladas es la segunda causa de muerte por cáncer (198 000) después del cáncer del pulmón. Las tasas de mortalidad varían también ampliamente, siendo menor en las regiones más desarrolladas por tener en ellas supervivencia favorable debida al diagnóstico temprano y mejores estrategias terapéuticas(1).
En el Perú, el cáncer de mama representa la segunda neoplasia más frecuente en la mujer, estimándose 3 952 casos nuevos en el año 2012, tasa cruda (TC) 26,6 x 100000 Y tasa estandarizada por edad (TEE) 28,0 x 100 000; es la tercera causa de muerte por cáncer en la mujer con 1 208 muertes en este mismo periodo (TC 8,1 x 100000 y TEE 8,5 x 100000)(1).
En el Registro de Cáncer de Lima Metropolitana 2004-2005, se reporta que los cinco tipos de cáncer más frecuentes en las mujeres son: mama, cuello uterino, estómago, pulmón y linfoma no Hodgkin; el riesgo acumulado de desarrollar cualquier tipo de cáncer a los 74 años es 18,64% (1 de cada 5 mujeres). El cáncer de mama es la neoplasia maligna más común en la mujer limeña, representa el 17,6% de todas las neoplasias malignas en mujeres, registrándose 2 867 casos nuevos (Te 33,4 x 100000 y TEE 33,8 x 100 000), siendo su distribución muy variada a nivel distrital. Se encuentra en distritos con mayor poder adquisitivo, TEE 48,2 a más x 100000, que se asemeja a la encontrada en países desarrollados, y distritos con TEE de menos de 10 x 100000, que se parece a la de países en vías de desarrollo. El riesgo acumulado para desarrollar la enfermedad hasta los 74 años es 3,69% (1 de cada 27 mujeres); es la segunda causa de muerte por cáncer, registrándose 918 muertes (TEE 10,7 x 100 000)(5).
El cáncer de mama es una neoplasia de lenta evo lución (aproximadamente 8 a 10 años), lo que nos permite, conociendo la historia natural de enfermedad, desarrollar estrategias de control basadas en el tamizaje, que tiene como objetivo principal disminuir la mortalidad, identificando el cáncer en estadios clínicos tempranos, mejorando el pronóstico de las pacientes. Se debe tener en cuenta la exposición a posibles daños y riesgos, como el sobrediagnóstico y sobretratamiento.
En los países de altos ingresos que han puesto en marcha programas organizados de detección temprana y tratamiento oportuno han logrado disminuir la tasa de mortalidad por cáncer de mama en aproximadamente 2,2% por año(6). Esta reducción se atribuye a los Programas de tamizaje basados en mamografía, herramienta eficaz en la detección de lesiones tempranas, considerando que los beneficios de la mamografía varían según la edad de la paciente a tamizar y a mayor disponibilidad y variedad de terapias (endocrinas, quimioterapia, inmunoterapia, cirugía y radioterapia), sin que sea posible desagregar el efecto que cada una de estas intervenciones aporta a la reducción de la mortalidad(7).
MAMOGRAFÍA COMO PRUEBA DE TAMIZAJE
La efectividad de la mamografía como prueba (única o combinada) de tamizaje para la disminución de la mortalidad por cáncer de mama se empezó a evaluar desde 1960 en grandes estudios aleatorizados. La validez de estos estudios ha sido cuestionada por diversas razones(8,9). Los resultados del seguimiento a 7 años de los ensayos individuales se presenta en la tabla 1(10).
En un metaanálisis desarrollado para comparar tamizaje con mamografía(11-16) versus seguimiento clínico sin mamografía de tamizaje (RR 0,90, IC95% 95% 0,79 a 1,02) no se muestra una reducción significativa de la mortalidad. Sin embargo, se ha considerado que esto podría deberse a estudios con sesgos en los procedimientos de aleatorización, inconsistencias en el análisis por considerar grupos de edad con bajo riesgo « 50 años) y la realización de tamizaje combinado (mamografía + EC).
Una revisión sistemática de la literatura de buena calidad publicada por Gotzche y Nielsen en 2011(17) estima que el tamizaje con mamografía probablemente reduzca la mortalidad por cáncer de mama. Pero, la magnitud del efecto no se ha definido porque varía significativamente con la edad de las pacientes. El tamizaje mamográfico para mujeres entre 50 y 69 años está recomendado de manera global. Un metaanalisis(18) mostró una reducción significativa de las muertes debida a cáncer de 14% en el grupo de mujeres de 50 a 59 años y de 32% en el grupo de 60 a 69 años; la mayor reducción en el grupo de mujeres mayores refleja el aumento de sensibilidad del tamizaje mamográfico con la edad que está asociado a la disminución de la densidad mamaria y al crecimiento tumoral más lento.
En las mujeres de 40 a 49 años, el riesgo bajo de cáncer, la sensibilidad disminuida de la mamografía y la elevada tasa de resultados falsos positivos entre mujeres jóvenes comparadas con mujeres mayores fueron tomados en cuenta por la USPSTF para cambiar su recomendación de no considerar el tamizaje en mujeres menores de 50 años. Debemos anotar que este tema permanece en controversia. En relación a mujeres mayores de 74 años, el beneficio del tamizaje es mínimo(19). Hay acuerdo que el tamizaje no está indicado en mujeres que tienen morbilidad co-existente y que su expectativa de vida es menor de 5 a 10 años.
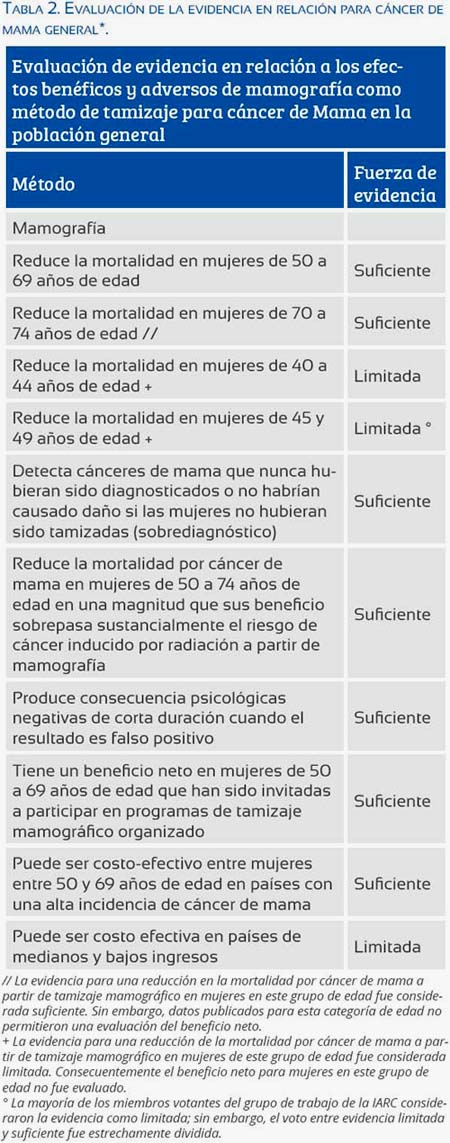
En una publicación reciente, la Internatianal Agency far Research on Cancer (IARC)(20) resume la evaluación de la evidencia científica revisada en una reunión científica con la participación de expertos de 16 países, realizada en noviembre del 2014; tomamos la información que se refiere al tamizaje con mamografía en la tabla 2 y que hemos traducido al español.
EDAD DE INICIO DEL TAMIZAJE CON MAMOGRAFÍA
No hay consenso sobre el valor del tamizaje con mamografía para las mujeres de 40 a 49 años, dado que la incidencia de cáncer de mama en esta población es menor y el estudio mamográfico es menos sensible por la alta densidad mamaria. La reducción de la mortalidad por cáncer de mama es de 15 a 16%, cifras cuestionadas porque incluyen beneficios que se acumularon por el tamizaje antes de que esas mujeres cumplieran 50 años. Los dos estudios diseñados específicamente para evaluar la disminución de la mortalidad por cáncer de mama en mujeres de 40 a 49 años mostraron que no hubo una reducción significativa de la mortalidad luego de 10 a 14 años de seguimiento (RR 0,84, IC95% 0,74 a 0,95)(21). Evaluando el beneficio tardío versus daños por falsos positivos, el tamizaje de rutina no debe ser indicado en mujeres de 40 a 49 años, excepto cuando la decisión es compartida entre el médico y la paciente, con la declaración explícita de los potenciales daños y beneficios(21). La Guías de Práctica Clínica (GPC) no recomiendan el tamizaje con mamografía antes de los 50 años; sin embargo, la Sociedad Americana de Cáncer (ACS) recomienda iniciar a partir de los 40 años.
La evidencia de resultados controversia les no ha dejado de lado la recomendación de realizar tamizaje con mamografía a los 50 años de edad en mujeres con riesgo promedio para desarrollar cáncer de mama(22,23). Múltiples estudios han realizado la evaluación del intervalo de tiempo para el tamizaje; los resultados obtenidos se presentan de forma resumida en la tabla 1, Aunque los resultados difieren, la mayoría de autores está de acuerdo en realizar tamizaje con mamografía cada 2 años entre los 50 y 69 años, En los países donde se acepta el tamizaje con mamografía a partir de los 40 años, el examen se debería realizar anualmente.
FRECUENCIA DE TAMIZAJE MAMOGRÁFICO
Un cambio polémico en las directrices de la United State Preventive Service Task Force (USPSTF) 2002 a las directrices 2009 fue modificar la recomendación del tamizaje de cada 1 a 2 años a cada 2 años(24), Este cambio se debía a la observación de que la reducción en la mortalidad de cáncer de mama en los ensayos aleatorios era similar para el tamizaje anual y los que se realizaban cada 18 a 33 meses(19). Además, no se observó diferencia en la probabilidad de detectar el cáncer de mama avanzado con tamizaje anual frente a programas de tamizaje bianual(25). En los modelos estadísticos, el tamizaje de las mujeres de 50 a 69 años de edad cada 2 años mantiene el beneficio de 81 % de detección asociado con el tamizaje anual(26), evitando alrededor de dos muertes adicionales de cáncer de mama por cada 1 000 mujeres examinadas.
En los análisis basados en datos de la Vigilancia, Epidemiología y Resultados Finales (SEER) del Instituto Nacional del Cáncer de los Estados Unidos, el intervalo bianual de tamizaje no se asoció con un mayor riesgo de enfermedad en estadios tardíos en las mujeres de 50 años de edad o más, en comparación con el tamizaje anual, pero se asocia con un aumento del riesgo en mujeres de 40 a 49 años de edad (odds ratio 1,35; IC95% 1,01 a 1,81), observación atribuida a la tasa de crecimiento más rápido de los tumores que ocurren en mujeres más jóvenes, Aunque esta observación pareciera apoyar el tamizaje anual para mujeres de 40 años, un estudio reciente mostró que el crecimiento tumoral más rápido era un factor importante, pero a su vez menor a la baja sensibilidad de la mamografía en las mujeres más jóvenes, debiéndose a la mayor densidad mamaria y la baja detección en este grupo de edad(26), La guía para la detección temprana del cáncer de mama del Instituto Nacional de Cancerología Colombiano (INC), recomienda adicionalmente, la detección temprana en mujeres sintomáticas(23).
CARACTERÍSTICAS OPERATIVAS DE LA MAMOGRAFÍA
La sensibilidad de la mamografía es aproximadamente 63% en mamas muy densas y 87% en mamas con mayor contenido graso; su especificidad está entre 87% y 99%(23).
La mamografía digital como prueba diagnóstica y de tamizaje fue aprobada desde el año 2000, por la Federal Drug Administration (FDA) para uso clínico en Estados Unidos de América. Su empleo se ha ido extendiendo en forma progresiva, pasando de 30% en el 2006 a 70% en el 2011, del total de mamografías tomadas en ese país.
El rendimiento de la mamografía digital ha sido evaluado en forma comparativa con la mamografía analógica en términos de sensibilidad y especificidad para detectar cáncer de mama. La mayoría de los trabajos ha mostrado que, al considerar en forma global ambas técnicas, las dos demuestran al menos igual exactitud diagnóstica. Otros trabajos encuentran que la técnica digital presenta un ligero incremento en la tasa de detección(28,29). En una cohorte de casi 330 000 mujeres, con seguimiento de 12 meses(30), la sensibilidad en detección de cáncer de mama invasivo e in situ con mamografía digital versus analógica fue 84% y 81,9%, la especificidad 90,4% y 91%, respectivamente. De igual forma, al analizar los diferentes subgrupos se encontró que con mamografía digital existe una mayor sensibilidad para detectar tumores malignos con receptores de estrógeno negativos (RE -) Y en el subgrupo de mujeres con parénquima extremadamente denso (característica frecuente en mujeres jóvenes); se observa mayor sensibilidad con mamografía digital que con analógica (82,4% versus 75,6%) en el grupo de mujeres de 40 a 49 años(31-33). Las desventajas de la mamografía digital no son muchas y se muestran contradictorias, pero se ha informado mayor tasa de rellamado (exámenes repetidos)(34), yen otros estudios menor especificidad. El valor predictivo positivo (VPP) de ambas pruebas son similares(31,35).
El contraste entre el tejido mamario y los tumores mamarios es mayor con mamografía digital que con analógica, en especial en mujeres con mamas densas. Los estudios demuestran mayor sensibilidad con mamografía digital que con mamografía analógica en mujeres jóvenes (57% versus 27%) (p=0,0013)(35).
DAÑOS y RIESGOS DEL TAMIZAJE CON MAMOGRAFÍA
Un riesgo importante es el sobrediagnóstico, aunque no es clara la magnitud de este problema en el cáncer invasor. Una persona sobrediagnosticada acumulará los efectos adversos de todas las intervenciones (cirugía, radioterapia, quimioterapia, hormonoterapia), sin recibir beneficios. El diagnóstico del carcinoma ductal in situ (CDIS) se conoció con la introducción del tamizaje mamográfico y actualmente representa más del 25% de todos los cánceres de mama detectados; el 90% de esta patología se identifica por imágenes. La mayoría de CDIS no se asocia a cáncer invasivo; sin embargo, un grupo importante de estas pacientes podría ser sobretratada.
Otro efecto no deseado es el dolor causado por compresión de la mama durante el examen, que es considerado de moderado a grave por 20% a 30% de las mujeres.
El nivel de exposición a radiación con mamografía digital es la misma o menor que con mamografía analógica(35). El riesgo acumulado estimado de muerte por cáncer de mama debido a radiación por tamizaje mamográfico es de 1 a 10 por 100 000 mujeres, dependiendo de la edad, frecuencia y duración del tamizaje analógico. Se ha considerado que hay un beneficio neto, luego de sopesar beneficios versus efectos adversos de realizar tamizaje en mujeres de 50 a 69 años de edad(21).
En el Perú se realizó un estudio de costo efectividad del tamizaje mamográfico, detección temprana, cuidados paliativos y tratamiento; el perfil demográfico y epidemiológico fue tomado del Global Burden of Diseose de la OMS y del Instituto Nacional de Estadística e Informática (INEI). Los estimados de los efectos de la intervención se basaron en estudios observacionales y en información del Instituto Nacional de Enfermedades Neoplásicas(36). Las recomendaciones producto de este análisis fueron:
-
Iniciar el tamizaje mamográfico bi o trianual a la edad de 50 años; no se recomienda tamizaje anual.
-
Realizar tamizaje mamográfico en población objetivo >50 y <70 años.
-
Combinar el examen clínico de las mamas (ECM) con la mamografía de tamizaje.
-
Tamizaje con examen clínico de las mamas en mujeres <50.
-
Decidir entre ECM versus mamografía móvil en zonas rurales.
-
Considerar la BAAF como alternativa de diag nóstico en entornos apropiados.
RECOMENDACIONES ACTUALES DE LAS GUÍAS DE PRÁCTICA CLÍNICA
Las recomendaciones internacionales descartan la mamografía de base a las menores de 40 años. Todas ellas recomiendan mamografía de tamizaje rutinario para mujeres entre los 50 y 69 años con intervalos de uno a dos años, con base en los datos de ensayos aleatorizados. Solamente las entidades estadounidenses hacen recomendaciones positivas para la mamografía de tamizaje en mujeres entre los 40 y 49 años y en mujeres mayores de 70 años. La mayoría de organizaciones concluye que no hay evidencia suficiente para hacer una recomendación a favor o en contra del tamizaje en estos grupos de edad. Las recomendaciones para el examen clínico (EC) son paralelas a las de la mamografía con la excepción de que el grupo de trabajo de servicios preventivos de Estados Unidos (USPS TF) considera el examen clínico opcional. La Sociedad Americana de Cáncer (ACS) recomienda que el tamizaje con examen clínico comience a los 20 años. El grupo canadiense de servicios preventivos (Canadian Task Force) y el Reino Unido recomiendan no enseñar a las mujeres el autoexamen.
La ACS recomienda informar a las mujeres sobre el autoexamen en la tercera década y sus potenciales beneficios y daños.
La mamografía sigue siendo el pilar del tamizaje de cáncer de mama; hay poca controversia de que la mamografía reduce el riesgo de mortalidad por cáncer de mama en 23% en las mujeres entre los 50 y 69 años, aunque los daños asociados a los resultados falsos positivos y el sobrediagnóstico limitan el beneficio neto de la mamografía. Las mujeres entre 70 y 80 años pueden obtener beneficio del tamizaje, pero en este grupo de edad aumenta el sobrediagnóstico así como otras causas de mortalidad. Aunque hay nuevos datos que sustentan una reducción de 16% en la mortalidad de cáncer de mama para mujeres entre los 40 y 49 años luego de 10 años de tamizaje, el beneficio neto es menos evidente, en parte por su menor incidencia de cáncer de mama y porque la mamografía es menos sensible y específica en las mujeres menores de 50 años. Es particularmente importante informar a las mujeres en este grupo de edad acerca de su probabilidad de obtener un resultado falso positivo, de ser llevada a biopsia mamaria, así como acerca del cáncer de mama.
La mamografía digital es más sensible que la mamografía analógica sin que pierda su especificidad en mujeres jóvenes. Sin embargo, no se ha demostrado mejoría en el desenlace de cáncer de mama ni mejoría en exactitud diagnóstica en mujeres mayores. Así, la mamografía digital tiene el mayor potencial de beneficio cuando se usa para tamizaje de mujeres premenopáusicas con mamas densas; la resonancia magnética (RM) beneficia a las mujeres con riesgo alto de cáncer de mama, como las portadoras de mutación genética BRCA1 y BRCA2.
En el Departamento de Prevención, Detección y Diagnóstico del OPE Instituto Nacional de Enfermedades Neoplásicas (INEN) de Lima-Perú, en el periodo comprendido entre mayo de 2013 y abril de 2014 se realizaron 5649 estudios mamográficos en pacientes asintomáticas que acudieron voluntariamente a su evaluación (tamizaje de oportunidad); se detectaron 107 (1,9%) mamo grafías con lesiones sospechosas de cáncer; las pacientes en quienes se detectó tales lesiones fueron a procedimiento de diagnóstico, confirmándose diagnóstico de cáncer (in situ e invasivo) en 54 pacientes (0,95%).
CONCLUSIONES y RECOMENDACIONES
La estrategia más efectiva para realizar tamizaje de cáncer de mama en la población general (asintomática) es la mamografía bilateral en 2 proyecciones (digital o analógico); en poblaciones donde no se disponga de mamógrafo, la indicación es tamizaje con examen clínico de mamas.
La edad de inicio del tamizaje con mamografía para detección de cáncer de mama en la población general es a los 50 años, recomendándose continuar hasta los 69 años. Para el tamizaje con examen clínico de las mamas, la recomendación de edad de inicio es a los 40 años, continuándose hasta los 69 años.
La frecuencia recomendada para el tamizaje mamográfico es de cada dos años (bianual) y para el tamizaje con examen clínico de la mama es anual.
Otras recomendaciones:
-
Implementar un programa de sensibilización a la población, a los profesionales de salud y autoridades para garantizar la efectividad de las recomendaciones planteadas.
-
Establecer un sistema de acreditación para los centros mamográficos de tamizaje.
-
Fortalecer las redes de salud y sistemas de referencia y contrarreferencia.
-
Fortalecer e implementar centros de enseñan za del examen clínico de mamas con el fin de diseminar y estandarizar la técnica.
-
En mujeres sintomáticas se recomienda que, in dependientemente de su edad, se realice la detección temprana utilizando las estrategias diagnósticas adecuadas: mamografía y/o ecografía.
-
No se recomienda la realización del autoexamen de la mama como estrategia de tamizaje, recomendándose la enseñanza del autoexamen como estrategia de concientización y autoconocimiento.
-
No se recomienda tamizaje con mamografía en mujeres de 40 a 49 años, ni en mujeres de 70 años a más.
Referencias Bibliográficas
1. Globocan 2012, Estimated cancer incidence, mortality and prevalence worldwide in 2012, International Agency for Research on Cancer, World Health Organization.
2. Bleyer A, Welch G. Effect of three decades of screening mammography on breast-cancer incidence. N Engl J Med. 2012;367:1998-2005. doi: 10.1056/NEJMoa1206809.
3. United States Preventive Service Task Force. Breast Cancer Screening Draft Recommendation. Julio, 2015. Disponible en: www.screeningforbreastcancer.org
4. NCCN Clinical Practice Guidelines in Oncology. Breast Cancer Screening and Diagnosis. Version I.2014. NCCN.org.
5. Registro de Cáncer de Lima Metropolitana 2004 – 2005 Volumen IV.
6. Warner E. Clinical practice. Breast-cancer screening. N Engl J Med. 2011 Sep;365(11):1025-32. doi: 10.1056/NEJMcp1101540.
7. Autier P, Boniol M, La Vecchia C, LaVecchia C, Vatten L, Gavin A, Héry C, Heanue M. Disparities in breast cancer mortality trends between 30 European countries: retrospective trend analysis of WHO mortality database. BMJ. 2010;341:c3620. doi: 10.1136/bmj.c3620.
8. Olsen O, Gøtzsche PC. Screening for breast cancer with mammography. Cochrane Database Syst Rev. 2001;(4):CD001877.
9. Gøtzsche PC, Nielsen M. Screening for breast cancer with mammography. Cochrane Database Syst Rev. 2009;(4):CD001877. doi: 10.1002/14651858.CD001877.pub4.
10. Paesmans M, Ameye L, Moreau M, Rozenberg S. Breast cancer screening in the older woman: an effective way to reduce mortality? Maturitas. 2010 Jul;66(3):263-7. doi: 10.1016/j.maturitas.2010.03.016.
11. Miller AB, Baines CJ, To T, Wall C. Canadian National Breast Screening Study: 1. Breast cancer detection and death rates among women aged 40 to 49 years. CMAJ. 1992 Nov;147(10):1459-76.
12. Andersson I, Janzon L, Sigfússon BF. Mammographic breast cancer screening--a randomized trial in Malmö, Sweden. Maturitas. 1985 May;7(1):21-9.
13. Moss SM, Cuckle H, Evans A, Johns L, Waller M, Bobrow L, et al. Effect of mammographic screening from age 40 years on breast cancer mortality at 10 years follow-up: a randomised controlled trial. Lancet. 2006 Dec;368(9552):2053-60.
14. Shapiro S. Periodic screening for breast cancer: the HIP Randomized Controlled Trial. Health Insurance Plan.J Natl Cancer Inst Monogr. 1997 (22):27-30.
15. Nyström L, Andersson I, Bjurstam N, Frisell J, Nordenskjöld B, Rutqvist LE. Long-termeffects of mammography screening: updated overview of the Swedish randomised trials. Lancet. 2002 Mar;359(9310):909-19.
16. Tabár L, Vitak B, Chen HH, Duffy SW, Yen MF, Chiang CF, et al. The Swedish Two-County Trial twenty years later. Updated mortality results and new insights from long-term follow-up. Radiol Clin North Am. 2000 Jul;38(4):625-51.
17. Gøtzsche PC, Nielsen M. Screening for breast cancer with mammography. Cochrane Database of Systematic Reviews. 2011;Issue 1:Art. No.: CD001877. DOI: 10.1002/14651858.CD001877.pub4.
18. Kerlikowske K, Grady D, Rubin SM, Sandrock C, Ernster VL. Efficacy of screening mammography: a meta-analysis. JAMA 1995;273:149-54. doi:10.1001/jama.1995.03520260071035.
19. Preventive Services Task Force. Screening for breast cancer: recommendations and rationale. Ann Intern Med. 2002;137:344-6.
20. Lauby‑Secretan B, Scoccianti C, Loomis D, Benbrahim‑Tallaa L, Bouvard V, Bianchini F, Straif K, for the International Agency for Research on Cancer Handbook Working Group Breast-Cancer Screening Viewpoint of the IARC Working Group. N Engl J Med. 2015 Jun 11;372(24):2353-8. doi: 10.1056/NEJMsr1504363.
21. Tice JA, Kerlikowske K. Screening and prevention of breast cancer in primary care. Prim Care. 2009 Sep;36(3):533-58. doi: 10.1016/j.pop.2009.04.003.
22. Nelson HD, Tyne K, Naik A, Bougat- sos C, Chan BK, Humphrey L. Screening for breast cancer: an update for the U.S. Preventive Services Task Force. Ann Intern Med 2009;151:727-37. doi: 10.7326/0003-4819-151-10-200911170-00009.
23. Instituto Nacional de Cancerología (INC). Recomendaciones para la tamización y la detección temprana del cáncer de mama en Colombia. Bogotá: INC; 2006.
24. US Preventive Services Task Force. Screening for breast cancer: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med. 2009 Nov;151(10):716-26, W-236. doi: 10.7326/0003-4819-151-10-200911170-00008.
25. Wai ES, Dyachkova Y, Olivotto IA, Tyldesley S, Phillips N, Warren LJ, Coldman AJ. Comparison of 1- and 2-year screening intervals for women undergoing screening mammography. Br J Cancer 2005 Mar;92(5):961-6.
26. Goel A, Littenberg B, Burack RC. The association between the pre-diagnosis mammography, screening interval and advanced breast cancer. Breast Cancer Res Treat 2007;102:339-45. doi: 10.1007/s10549-006-9334-5.
27. White E, Miglioretti DL, Yankaskas BC, Geller BM, Rosenberg RD, Kerlikowske K, Saba L, et al. Biennial vs. annual mammography and the risk of late-stage breast cancer. J Natl Cancer Inst. 2004;96:1832-9. doi: 10.1093/jnci/djh337.
28. 28 Bailey SL, Sigal BM, Plevritis SK. A simulation model investigating the impact of tumor volume doubling time and mammographic tumor detectability on screening outcomes in women aged 40-49 years. J Natl Cancer Inst. 2010;102:1263-71. doi: 10.1093/jnci/djq271.
29. Kerlikowske K, Hubbard RA, Miglioretti DL, Geller BM, Yankaskas BC, Lehman CD, et al. Comparative effectiveness of digital versus filmscreen mammography in community practice in the United States: a cohort study. Ann Intern Med. 2011 Oct;155(8):493-502. doi: 10.7326/0003-4819-155-8-201110180-00005.
30. Skaane P. Studies comparing screen-film mammography and full-field digital mammography in breast cancer screening: updated review. Acta Radiol. 2009 Jan;50(1):3-14. doi: 10.1080/02841850802563269.
31. Pisano ED, Gatsonis C, Hendrick E, Yaffe M, Baum JK, Acharyya S, et al. Diagnostic performance of digital versus film mammography for breast-cancer screening. N Engl J Med. 2005 Oct;353(17):1773-83. DOI: 10.1056/NEJMoa052911.
32. Pisano ED, Hendrick RE, Yaffe MJ, Baum JK, Acharyya S, Cormack JB, et al. Diagnostic accuracy of digital versus film mammography: exploratory analysis of selected population subgroups in DMIST. Radiology. 2008 Feb;246(2):376-83. doi: 10.1148/radiol.2461070200.
33. Hambly NM, McNicholas MM, Phelan N, Hargaden GC, ODoherty A, Flanagan FL. Comparison of digital mammography and screen-film mammography in breast cancer screening: a review in the Irish breast screening program. AJR Am J Roentgenol. 2009 Oct;193(4):1010-8. doi: 10.2214/AJR.08.2157.
34. Skaane P, Hofvind S, Skjennald A. Randomized trial of screen-film versus full-field digital mammography with soft-copy reading in population-based screening program: follow-up and final results of Oslo II study. Radiology. 2007 Sep;244(3):708-17.
35. Brodersen J, Jørgensen KJ, Gøtzsche PC. The benefits and harms of screening for cancer with a focus on breast screening. Pol Arch Med Wewn. 2010 Mar;120(3):89-94.
36. Zelle SG, Abugattas JE, Vidaurre T, Manrique JE, Sarria G, Jeronimo J, Seinfeld JE, Lauer JA, Sepulveda CR, Venegas D, Baltussen R. Cost-effectiveness analysis of breast cancer control interventions in Peru, PLoS One. 2013 Dec 10;8(12):e82575. doi: 10.1371/journal.pone.0082575.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses con esta publicación
Correspondencia:
Dr. Julio Abugattas Saba
jeabugattas@hotmail.com