Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.61 no.4 Lima oct./dic. 2015
ARTÍCULO DE REVISIÓN
Implicancias neurológicas de la preclampsia, más que solo eclampsia
Neurological implications of preclampsia, more than eclampsia only
Rommel Omar Lacunza Paredes1; José Pacheco-Romero2
1 Médico gineco-obstetra, Unidad de Medicina Materno Fetal. Hospital Nacional Daniel Alcides Carrión, Callao, Perú
2 Profesor Principal de Obstetricia y Ginecología, Facultad de Medicina, Universidad Nacional Mayor de San Marcos, Lima, Perú
RESUMEN
La preeclampsia es una enfermedad multisistémica que afecta a la gestante; se constituye en la segunda causa de muerte materna en el Perú y produce una alta morbilidad. La disfunción neurológica producida por la preeclampsia abarca múltiples síntomas, siendo el más conocido la eclampsia. El entendimiento de la encefalopatía posterior reversible como fenómeno que explica todas las manifestaciones neurológicas de la preeclampsia abre un sinnúmero de posibilidades terapéuticas y plantea la interrogante sobre el pronóstico a largo plazo de las pacientes afectadas. El sulfato de magnesio se muestra como la mejor alternativa terapéutica para bloquear los fenómenos fisiopatológicos que podrían devenir en eclampsia, entendiéndola como una forma de encefalopatía posterior reversible.
Palabras clave: Preeclampsia; Eclampsia; Encefalopatías; Isquemia Encefálica; Hipoxia Encefálica.
ABSTRACT
Preeclampsia is a multisystemic disease that affects pregnant women; it is the second cause of maternal death in Peru and morbidity is high. The neurologic dysfunction in preeclampsia includes various symptoms, and eclampsia is the most known. Understanding reversible posterior encephalopathy as the explanation of all neurological manifestations in preeclampsia would evolve to endless therapeutic possibilities and interrogations on long term prognosis. Magnesium sulfate appears as the best therapeutic alternative in blocking pathophysiologic phenomena resulting in eclampsia, if it is considered as a reversible posterior encephalopathy.
Keywords: Preeclampsia; Eclampsia; Hypertensive Encephalopathy; Hypoxic-Ischemic Encephalopathy; Posterior Reversible Encephalopathy Syndrome.
INTRODUCCIÓN
La preeclampsia afecta entre 2 y 10% de las gestantes, según las series en diversos países, Actualmente constituye la segunda causa de muerte materna en el Perú (23,3%), Pacheco-Romero(1) reporta una incidencia de preeclampsia de 5,1% en 28 hospitales del MINSA a nivel nacional, don de la eclampsia ocurrió en 0,24% de la población y fue causa de un importante aumento de morbilidad (mayor riesgo de desprendimiento prematuro de placenta y cesárea); la muerte materna aconteció en 0,7% de los casos de preeclampsia y 1% de los casos de eclampsia falleció, Anteriormente, en un hospital de la seguridad social de Lima se halló una incidencia de 0,038% en 30 años, con mortalidad materna de 19%.(2)
Las manifestaciones de la preeclampsia en el sistema nervioso central abarcan cefalea y alteraciones visuales, tales como visión borrosa, escotomas y raramente ceguera cortical. La eclampsia, que es la más severa, se constituye en la fase convulsiva de la preeclampsia y es una causa significativa de muerte materna.
La patogénesis de la eclampsia es motivo de controversia, algunas hipótesis plantean la existencia de coagulopatía y depósito de fibrina, así como de encefalopatía hipertensiva(3). Sin embargo, ¿cómo así puede la madre convulsionar con hipertensión leve? La vasoconstricción podría ser selectiva, y los estudios con ecografía Doppler sugieren que un vasoespasmo cerebral severo puede ocurrir aún con vasoconstricción periférica poco evidente(4). En autopsias realizadas antes de que transcurrieran dos horas de la muerte se halló diversos grados de hemorragias y petequias, vasculopatía con daño de la pared del vaso y necrosis fibrinoide (¿relacionada a hipertensión crónica?), isquemia cerebral y microinfartos(5). La evaluación con tomografía y resonancia magnética ha sido informada como normal en algunos casos, pero se ha descrito variedad de anormalidades, generalmente transitorias, consistentes con edema cerebral y hemorragia, así como áreas hipodensas que re presentarían edema localizado por hipoxia(6,7). También existen modificaciones en los hemisferios cerebrales posteriores y en las áreas di visorias vasculares, relacionadas a la isquemia global inducida por el vasoespasmo, explicando así las alteraciones visuales de la preeclampsia/eclarnpsia(8).
En los últimos años, el avance en entender la fisiopatología de las manifestaciones neurológicas en las mujeres con preeclampsia puede ayudar a comprender las implicancias a corto y largo plazo y revalorizar al sulfato de magnesio como un fármaco de primera línea en el manejo de la preeclarnpsia.
DEFINICIÓN DE PREECLAMPSIA y SUS IMPLICANCIAS
La eclampsia se define como la presencia de convulsiones tónico clónicas generalizadas en el contexto de una gestante con preeclampsia, habiendo excluido otras causas, y que puede acontecer antes, durante o después del parto(9). La afectación neurológica está siendo revalorada a la luz de nuevas investigaciones, considerando a la eclampsia como una manifestación tardía del daño en el cerebro relacionado a la preeclampsia(10). Recientemente, la definición de preeclampsia propuesta por el Colegio Americano de Obstetras y Ginecólogos (ACOG) refleja la naturaleza multisistémica de la enfermedad, Las alternativas de proteinuria son, entre otros, la presencia de alteraciones neurológicas o visuales entre las cuales podríamos mencionar a la eclampsia, cefalea, visión de luces, escotomas, ceguera, tinnitus o alteración del estado de conciencia(9).
Se define la preeclampsia severa (la que podría devenir en eclampsia) como la hipertensión mayor de 160/110 mm Hg en más en dos ocasiones, separadas en 4 horas, plaquetopenia, enzimas hepáticas por encima del doble del valor normal, dolor severo persistente en hipocondrio derecho o epigastrio, sin respuesta a analgésicos, insuficiencia renal progresiva, edema pulmonar y alteraciones cerebrales o visuales(9). El valor considerado para toda esta sintomatología es el mismo tanto para lograr un diagnóstico de preeclampsia como para la definición de criterios de severidad, pues cualquiera de ellas implicaría severidad (punto sobre el cual el documento no es totalmente claro, aunque pudiera destacar un continuum),
LA ECLAMPSIA COMO UNA FORMA DE ENCEFALOPATíA POSTERIOR REVERSIBLE
En el año 1996, Hinchey(11) describe un síndrome caracterizado por cefalea, convulsiones, deterioro del estado de conciencia, alteraciones visuales y lesiones neurológicas evidencia bies en tomografía axial computarizada (TAC) o resonancia magnética (RM) a nivel de la sustancia blanca, a predomino de los lóbulos occipitales y parietales, sugestivos de edema, el cual revertía luego de eliminarse el agente agresor, definiéndolo entonces como leucoencefalopatía posterior reversible (PRES por sus siglas en inglés: posterior reversible encephalopathy syndrome). Esta descripción de 15 pacientes incluyó 3 casos de puérperas con eclampsia. Posteriormente, se ha ido describiendo distintas etiologías que pueden producir este síndrome clínico radiológico (tabla 1).

Las características clínicas que describen el PRES son: dolor de cabeza, alteraciones visuales, pérdida de visión, hemianopsia, déficit neurológico focal, alteración del estado de conciencia, convulsiones y coma. Los cuales pueden ser de progresión rápida (horas) o días(12).
Las características radiológicas que lo definen varían según la prueba radiológica utilizada. En la TAC se observan áreas hipodensas consistentes con edema; en la resonancia magnética se evidencian hiperintensidades en T2 que afectan la sustancia blanca. Estas lesiones se encuentran en diversas áreas del cerebro, como lóbulos occipitales, parietales, temporales, frontales, ganglios basales y cerebelo. Estas zonas con imágenes compatibles con edema confluyen entre la corteza, subcorteza y sustancia blanca profunda y son casi en su totalidad reversibles(13).
La presencia del PRES en 46 de 47 casos de pacientes (23 anteparto y 24 posparto) ha sido comunicada por Brewer(14) en una serie retrospectiva de mujeres con eclampsia; incluyó estudios de TAC o RM realizados entre el día O y 14 del evento. Los síntomas más frecuentes fueron cefalea (87,2%), alteración del estado de conciencia (51,1%), alteraciones visuales (34%). El 16,6% de casos no presentó hipertensión arterial. Los hallazgos radiológicos fueron encontrados en múltiples zonas del cerebro (en su mayoría en los lóbulos occipital, parietal y frontal), tal y como ha sido descrito en otras patologías(10,13).
LA FISIOPATOLOGÍA DE LA PRES EN LA PREECLAMPSIA y LA ADAPTACIÓN DE LA CIRCULACIÓN CEREBRAL A LA GESTACIÓN
El fenómeno fisiopatológico esencial en la mayo ría de casos con PRES es el edema cerebral a predominio de los lóbulos occipitales, parietales y temporales. Sea cual sea la etiología primaria, es constante que cursen con hipertensión arterial al momento de desarrollar el síndrome(10,12,13,15). Surge entonces la pregunta por qué se produce el edema cerebral en los casos de preeclampsia y eclampsia.
Es necesario comprender la adaptación fisiológica de la autorregulación del flujo vascular cerebral (FVC) en la gestante para poder entender este complejo fenómeno.
-
Existe en la gestación una modificación de los umbrales límites de autorregulación del FVC (la autorregulación consiste en vasoconstricción ante los aumentos de presión arterial y vasodilatación cuando la presión desciende, de manera de mantener constante el FVC), con un aumento del umbral de control para presiones arteriales elevadas y una disminución del umbral a las bajas presiones. Ello ocurre con la finalidad de proteger al cerebro tanto de los picos hipertensivos como de los episodios de hipotensión que podrían acontecer durante el parto(16,17).
-
Durante la gestación, la barrera hematoencefálica (BHE) mantiene su estado basal impidiendo el paso de sustancias o de agua, brindando protección contra la formación de edema cerebral; se propone que esto se con sigue y mantiene por el equilibrio de sustancias inflamatorias y factores angiogénicos en la gestación(16,17).
-
La mayor expresión en la gestación de glicoproteínas P (PgP) en el endotelio vascular de la BHE encargadas del eflujo de esteroides, citoquinas y quimoquinas cumple un rol regulador contra los factores circulantes que podrían afectar la BHE(17).
-
Existe remodelamiento selectivo de los vasos cerebrales en algunas zonas del cerebro, con adelgazamiento y aumento del lumen de los vasos penetrantes (no afecta los vasos piales), manteniendo el tono vascular a presiones normales, Hay aumento de la densidad capilar en el parénquima, fenómeno que se lleva a cabo probablemente en relación a la acción paracrina de astrocitos que expresan el receptor gamma de activación de la proliferación de peroxisomas (PPARy) ante el estímulo de la relaxina(16,17), Adicionalmente, el endotelio de los vasos cerebrales tiene -como lo menciona johnson- "una resistencia a las sustancias vasoconstrictoras o un aumento de sensibilidad a las vasodilatadoras" para mantener el equilibrio ante la mayor presencia sérica de vaso constrictores en la gestación(17).
Estos fenómenos buscan proteger al cerebro de los cambios vasculares inherentes a la gestación, como son el aumento del volumen plasmático, la anemia dilucional, el aumento del gasto cardiaco y para brindar protección ante la hipovolemia e hipotensión en el parto.
En los casos de gestaciones que cursan con hipertensión inducida por la gestación existe un estado de disfunción endotelial materna producido por una sumatoria de eventos, como son el aumento de sustancias inflamatorias, desequilibrio angiogénico, entre otras(18). Sin embargo, no está totalmente aclarado el mecanismo por el cual se afecta la permeabilidad de la BHE, aumentando la susceptibilidad de la gestante a las convulsiones ya la formación de edema cerebral ante súbitos aumentos de la presión arterial. Los mecanismos involucrados serían (figura 1):
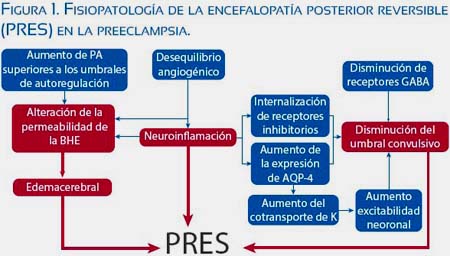
-
Al producirse un aumento súbito de la presión arterial por encima del umbral de autorregulación, las arterias piales se vasodilatarán y transmitirán esta presión a los vasos penetrantes (que tienen paredes delgadas y tole rancia baja a las altas presiones); estos a su vez transmitirán toda la presión hidrostática a los capilares, produciendo edema cerebral y pérdida de la permeabilidad de la BHE(19-21),
-
La disrupción de la BHE produce más edema, el cual puede llevar a fenómenos isquémicos y edema citotóxico; a esto también contribuyen los picos hipertensivos, que con una BHE alterada producen más edema por aumento de la presión hidrostática(17,19,21),
-
Existe un aumento de la susceptibilidad a las convulsiones en la gestación al disminuir los receptores A del ácido gamma aminobutirico (GABA-A), los cuales mantienen inhibición neuronal; esto ocasiona un descenso del umbral convulsivo(22).
-
La existencia de neuroinflamación en la preeclampsia afecta la permeabilidad de la BHE y también disminuye el umbral convulsivo al internalizar los receptores neuronales inhibidores(16,23).
-
El aumento de la aquaporina 4 (AQP4) en los pies de los astrocitos (en los últimos trimestres de la gestación) involucrados en el transporte de agua generan mayor susceptibilidad al edema; conjuntamente, el cotransporte de potasio asociado ocasiona aumento de la excitabilidad neuronal(13-28) (figura 2),
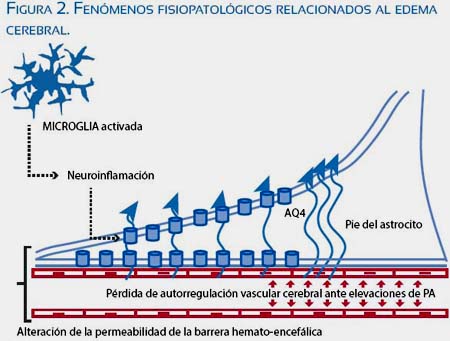
Contrario a lo que podríamos suponer, el des equilibrio angiogénico no produce disfunción del endotelio cerebral, como lo demostró Cipolla. Los factores antiangiogénicos (sFlt1 y sEnd), que están aumentados en la preeclampsia y eclampsia, preservan la permeabilidad de la BHE y por el contrario son los factores de crecimiento endotelial (VEGF) los que sí producen disrupción de la barrera, aumentando la susceptibilidad a desarrollar edema cerebral(19,29). Entre los factores que afectarían la permeabilidad de la BHE, los factores inflamatorios (neuroinflamación) asoman como los más prometedores en el camino al entendimiento de la fisiopatología(23,28). Esto podría explicar por qué existen casos de eclampsia con presiones arteriales no muy elevadas o normales, lo cual dentro del modelo multisistémico de la preeclampsia justifica no solamente las convulsiones sino todos los síntomas neurológicos(10).
ALTERACIÓN DE LA AUTORREGULACIÓN VASCULAR CEREBRAL y BAROTRAUMA
En las gestaciones normales existe un aumento del flujo vascular cerebral, el cual es controlado por la autorregulación vascular. En los casos de gestaciones que cursan con hipertensión se propone que la autorregulación está alterada (por los fenómenos moleculares antes explicados) y ante los picos hipertensivos produciría barotrauma vascular (disrupción de la BHE, escape de fluido al intersticio, edema vasogénico) de los capilares y vasos distales (como se mencionó anteriormente)(19-21); sin embargo, los estudios muestran que esta alteración de la autorregulación no es constante en todos los casos de preeclampsia(30).
La alteración en la autorregulación vascular cerebral en los casos de desórdenes hipertensivos en la gestante se muestra claramente en los estudios de van Veen(31,32); él describe que la alteración de la autorregulación no está relacionada a los valores de presión arterial en la preeclampsia, lo cual explicaría los casos que cursan con síntomas neurológicos pero sin hipertensión arterial severa. También demuestra que según el desorden hipertensivo el grado de afectación de la autorregulación es mayor, mostrando una gradiente progresiva de alteración desde la hipertensión gestacional, hipertensión crónica, preeclampsia y finalmente hipertensión crónica con preeclampsia sobreagregada (HTA+ PE). En la figura 3 se muestra en porcentaje el grado de conservación de la autorregulación para los distintos desórdenes hipertensivos valorados según el índice autorregulatorio (ARI). Se puede plantear la hipótesis que la mayor alteración de la autorregulación en los casos con HTA+ PE se debe a disfunción endotelial basal de estas pacientes, lo que aumenta su susceptibilidad a desarrollar preeclampsia con leve desbalance angiogénico.(32)
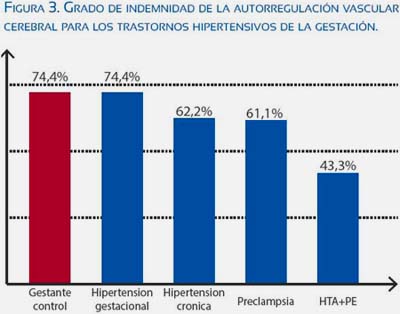
CLÍNICA DE LA PRES EN LA ECLAMPSIA
Los signos neurorradiológicos de la eclampsia descritos como síndrome de encefalopatía posterior reversible se manifiestan en la gestante como náusea, vómitos, cefalea, alteraciones visuales, estado mental alterado, convulsiones y coma, así como déficit neurológico focal(33). Estos hallazgos característicos también aparecen en la tomografía computarizada o en la resonancia magnética cerebral, indicando la presencia del edema vasogénico cerebral(34).
Berhan(35), en un reciente metaanálisis, encuentra que la eclampsia se presenta anteparto en 59%, posparto en 21% e intraparto en 20%. Además señala que los síntomas más frecuentes que preceden a la eclampsia fueron la cefalea y las alteraciones visuales (66% y 27%, respectivamente), hallando también que 25% de los casos no tuvo síntomas antes de la convulsión, En lo que respecta a la presencia de hipertensión, el 25% de los casos de eclampsia fue normotensa, 20% tuvo hipertensión leve-moderada (entre 140/90 y 160/110 mmHg) y únicamente en 32% se halló hipertensión severa (más de 160/110 mmHg).
EL SULFATO DE MAGNESIO: MECANISMOS DE ACCIÓN EN EL CONTEXTO DE LA PRES
El sulfato de magnesio es el medicamento de elección, tanto en la profilaxis como en el tratamiento de la eclampsia, Múltiples estudios han demostrado su mayor efectividad versus otros anticonvulsivantes(36-39). Su mecanismo de acción no es único y aparentemente actúa sobre diversos blancos terapéuticos que son actualmente mejor entendidos (figura 4).
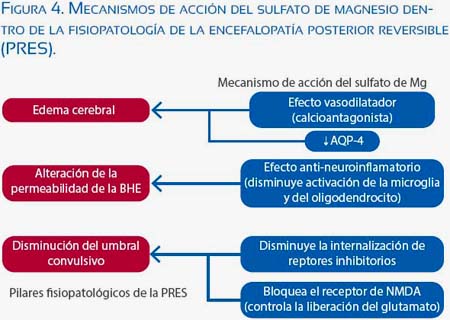
Inicialmente, el efecto vasodilatador cerebral del sulfato de magnesio fue indicado como su mecanismo de acción principal(22), pero al compararse con otros calcioantagonistas con mayor efecto vasodilatador, estos no mostraron ser superiores en su efecto anticonvulsivo(40). Si bien existe efecto vasodilatador, este dentro de la fisiopatología de la PRES no interrumpe los fenómenos que llevan a la afectación cerebral, entendiendo que se produce vasodilatación forzada luego de sobrepasar el umbral de autorregulación y con ello pérdida de la integridad de la BHE(10,13,15,17),
Estudios en animales han mostrado que el sulfato de magnesio mantiene la integridad de la BHE en ratas preñadas expuestas a elevación de la presión arterial, evitando la formación de edema cerebral vasogénico(20,21),
Recientes estudios muestran la existencia de neuroinflamación (activación de la microglia y astrocitos con liberación de citoquinas) en los modelos animales de eclampsia en comparación a gestaciones normales, La administración de sulfato de magnesio disminuye la activación de la microglia y de esta forma podría mantener la integridad de la BHE, Adicionalmente, al reducir los niveles de citoquinas como el TNF-α impediría también la internalización de los receptores inhibitorios de la neurona(23-27),
Es conocido que durante la gestación aumenta la expresión de AQP4 en los astrocitos(24,25); la neuroinflamación medida por la IL-1β incrementa aún más la expresión de AQP4, elevando el riesgo de edema cerebral ante eventos agudos de disrupción de la BHE(28), Los efectos del sulfato de Mg también podrían influir en la expresión de AQP4, aunque los resultados en estudios animales han sido contradictorios(21,23,24,36,37),
Otro mecanismo de acción propuesto es el efecto sobre los receptores de N-metil D-aspartato (NMDA), produciendo una reducción en el acopiamiento a su receptor del NMDA, limita los efectos del glutamato y evita la despolarización neuronal masiva, elevando así el umbral convulsivo en la gestante(22).
MEDICACIÓN ANTIHIPERTENSIVA EN LA ECLAMPSIA
Como se ha mencionado, la elevación de la presión arterial por encima del umbral de autorregulación contribuye al desencadenamiento de la PRES, Por ello es importante lograr el control de la presión arterial. Se considera allabetalol como el agente a usar en el tratamiento de las emergencias hipertensivas de la gestación, seguido de la hidralazina, nifedipino, nicardipina, urapidil, nitroglicerina y el nitroprusiato de sodio (en los casos refractarios), Es bueno recordar que los inhibidores de la enzima convertidora de angiotensina y los bloqueadores de la angiotensina están contraindicados en el embarazo, pero se puede usar captopril y enalapril durante la lactancia.
Se considera que el PRES de las pacientes con preeclampsia (PRES like) es completamente reversible cuando se hace un diagnóstico rápido y adecuado, administrando de forma inmediata tratamiento antihipertensivo intensivo asociado al sulfato de magnesio y a la terminación de la gestación(41).
CONSECUENCIAS NEUROLÓGICAS A LARGO PLAZO DE LA PREECLAMPSIA/ECLAMPSIA
La gran pregunta actualmente se centra en las consecuencias de la preeclampsia en el cerebro, si las alteraciones que se producen (sin necesariamente llegar a síntomas tan severos como la convulsión) tienen efectos deletéreos a largo plazo.
Algunos estudios han investigado sobre las lesiones cerebrales en la sustancia blanca en los exámenes de imágenes en las pacientes que cursaron con preeclampsia. Liman(42) describe que en 96 pacientes con lesiones en sustancia blanca, a los 9 días del evento 40% de ellos cursaron con PRES asociado a preeclampsia/eclampsia; cabe resaltar que estas lesiones asociadas a la gestación fueron menos severas en comparación a otras etiologías no obstétricas de PRES. Zeeman(43), en 27 casos de eclampsia encuentra 19% con lesiones en sustancia blanca entre 6 y 9 semanas después del evento. Aukes(44), luego de 6 años de seguimiento halla la presencia de lesiones en sustancia blanca en pacientes que cursaron con eclampsia; al comparar con gestantes normotensas, esto fue significativamente más frecuente (41% versus 17%, p<0,04); también se evidenció un aumento del volumen de las lesiones en relación a un mayor número de convulsiones. Estas lesiones se observaron en estudios tempranos a los dos meses del episodio. Entendiendo estos resultados en el contexto de la PRES, se especula que las lesiones podrían ser producidas por compromiso vascular asociado al edema cerebral vasogénico, el cual al ser severo produciría isquemia y edema cito tóxico; estas áreas se infartarían y desarrollarían posteriormente las lesiones de sustancia blanca visibles en resonancia magnética(10).
Considerando que las lesiones en sustancia blanca han sido encontradas en la población general y con mayor frecuencia en relación a la edad, es difícil determinar si las lesiones existían previamente a la gestación comportándose como un factor de riesgo para desarrollar eclampsia o que estas son en realidad consecuencia de la preeclampsia. El estudio de Postma(45) no halla diferencia en la presencia de lesiones en sustancia blanca entre primigestas y multigestas, sugiriendo que la gestación que cursa sin preeclampsia no aumenta el riesgo de lesiones de la sustancia blanca. Esto lleva a concluir que las gestaciones que cursan con preeclampsia/eclampsia y desarrollan PRES tienen más riesgo de desarrollar lesiones en la sustancia blanca.
El siguiente paso sería determinar si dichas lesiones tienen traducción en las funciones cerebrales para la vida diaria de la paciente. Existen pocos estudios respecto a este punto, con evaluaciones a corto plazo, en pequeñas poblaciones y con resultados divergentes(46,47). En un reciente estudio, Postma(48) evalúa por medio de múltiples pruebas la presencia de déficit en la función neurocognitiva a los 7 años, en 51 casos de preeclampsia y 46 de eclampsia, encontrando alteraciones en ambos grupos con respecto a gestaciones normotensas. Pero, atribuye esta alteración a los niveles altos de ansiedad y de presión de las pacientes que cursaron con preeclampsia/eclampsia.
En contraste, los estudios de PRES en otras etiologías no obstétricas (crisis hipertensiva aguda, trasplante de medula ósea, quimioterapia, enfermedades autoinmunes, entre otras) han mostrado lesiones en sustancia blanca en mayor número y severidad asociados con alteraciones en la función neurocognitiva a largo plazo(10). Una posible explicación a este fenómeno se sustenta en las características de la PRES en las gestantes, las cuales incluyen el carácter transitorio de la preeclampsia/eclampsia, que la gestante es una mujer sana, el término de la gestación elimina la causa originaria, el rápido control de la presión arterial elevada y el uso de un tratamiento oportuno con sulfato de magnesio; todas estas condiciones influirían en el aparente curso benigno de la PRES en la preeclampsia/eclarnpsia(17). El estudio de Lebriel(49) (CYPRESS) determina como factor de buen pronóstico a los 90 días post PRES severa que la causa originaria fuera preeclampsia/eclampsia y como factores de mal pronóstico la hiperglicemia el primer día, estatus epiléptico y demora en el control del factor desencadenante de más de 30 minutos.
Queda pendiente la investigación de la posible relación entre las lesiones de sustancia blanca y alteraciones cognitivas con seguimiento a largo plazo y en mayor población, para así poder determinar la significancia clínica de estas lesiones.
CONCLUSIONES
-
Las manifestaciones cerebrales de la preeclampsia involucran el desarrollo de PRES.
-
El origen de la mayoría de casos de PRES en preeclampsia/eclampsia está relacionado a la alteración de la barrera hematoencefálica, neuroinflamación y pérdida de la autorregulación vascular cerebral.
-
En los casos de PRES con presiones arteriales normales, el origen de la eclampsia está principalmente relacionada al aumento de la permeabilidad de la barrera hematoencefálica y la autorregulación cerebral.
-
Los múltiples mecanismos de acción del sulfato de magnesio se relacionan con los fenómenos fisiopatológicos de la PRES, lo que explicaría su efecto benéfico en las gestantes con preeclampsia.
-
El desarrollo de PRES en el contexto de una preeclampsia involucra el riesgo de lesión de la sustancia blanca cerebral, aunque su real implicancia a largo plazo aún no ha sido determinada con claridad.
REFERENCIAS BIBLIOGRÁFICAS
1. Pacheco-Romero J, Villacorta A, Del Carpio L, Velásquez E, Acosta O. Repercusión de la preeclampsia/eclampsia en la mujer peruana y su perinato, 2000-2006. Rev Per Ginecol Obstet. 2014;60(4):279-90.
2. Pacheco J, Valdivia E, Huaman M, Carrasco N, Yui L. Eclampsia: experiencia en 30 años en el Hospital Nacional Edgardo Rebagliati Martins – IPSS. Ginecol Obstet (Perú). 1989;35(9):10-5.
3. National High Blood Pressure Education Program Working Group on High Blood Pressure in Pregnancy. Report of the National High Blood Pressure Education Program Working Group on High Blood Pressure in Pregnancy. Am J Obstet Gynecol. 2000;183:S1-S22. DOI: 10.1067/mob.2000.107928.
4. Belfort MA, Saade GR, Grunewald C, Dildy GA, Abedejos P, Herd JA, et al. Association of cerebral perfusion pressure with headache in women with pre-eclampsia. Br J Obstet Gynaecol. 1999;106:814-21. DOI: 10.1111/j.1471-0528.1999.tb08403.x.
5. Richards A, Graham D, Bullock R. Clinico pathological study of neurological complications due to hypertensive disorders of pregnancy. J Neurol Neurosurg Psychiatry. 1988;51:416- 21. DOI: 10.1136/jnnp.51.3.416.
6. Dahmus MA, Barton JR, Sibai BM. Cerebral imaging in eclampsia: magnetic resonance imaging versus computed tomography. Am J Obstet Gynecol. 1992;167:935-41. DOI: 10.1016/s0002-9378(12)80015-9.
7. Drislane FW, Wang AM. Multifocal cerebral hemorrhage in eclampsia and severe pre-eclampsia. J Neurol. 1997;244:194- 8. DOI: 10.1007/s004150050072.
8. Morriss MC, Twickler DM, Hatab MR, Clarke GD, Peshock RM, Cunningham FG. Cerebral blood flow and cranial magnetic resonance imaging in eclampsia and severe preeclampsia. Obstet Gynecol. 1997;89:561-8. DOI: 10.1016/s0020- 7292(97)90062-x.
9. American College of Obstetricians and Gynecologists. Task force on Hypertension in pregnancy. Hypertension in pregnancy. Report of the American College of Obstetricians and Gynecologists Task Force on Hypertension in Pregnancy. Obstet Gynecol. 2013 Nov;122(5):1122-31. DOI: 10.1097/01. AOG.0000437382.03963.88.
10. Postma IR, Slager S, Kremer HP, de Groot JC, Zeeman GG. Long-term consequences of the posterior reversible encephalopathy syndrome in eclampsia and preeclampsia: a review of the obstetric and nonobstetric literature. Obstet Gynecol Surv. 2014;69(5):287-300. DOI: 10.1097/ OGX.0000000000000069.
11. Hinchey J, Chaves C, Appignani B, Breen J, Pao L, Wang A, Pessin MS, Lamy C, Mas JL, Caplan LR. A reversible posterior leukoencephalopathy syndrome. N Engl J Med 1996;334:494- 500.
12. Bartynski WS. Posterior reversible encephalopathy syndrome, Part 1: Fundamental imaging and clinical features. AJNR Am J Neuroradiol. 2008;29:1036-42. doi: 10.3174/ajnr.A0928.
13. Bartynski WS. Posterior reversible encephalopathy syndrome, Part 2: Controversies surrounding pathophysiology of vasogenic edema. AJNR Am J Neuroradiol. 2008;29:1043-49. doi: 10.3174/ajnr.A0929.
14. Brewer J, Owens MY, Wallace K, Reeves AA, Morris R, Khan M, LaMarca B, Martin JN Jr. Posterior reversible encephalopathy syndrome in 46 of 47 patients with eclampsia. Am J Obstet Gynecol. 2013;208:468.e1-6. doi: 10.1016/j. ajog.2013.02.015.
15. Marra A, Vargas M, Striano P, Del Guercio L, Buonanno P, Servillo G. Posterior reversible encephalopathy syndrome: the endothelial hypotheses. Med Hypotheses. 2014 May;82(5):619-22. DOI: 10.1016/j.mehy.2014.02.022.
16. Cipolla MJ. The adaptation of the cerebral circulation to pregnancy: mechanisms and consequences. J Cereb Blood Flow Metab. 2013 Apr;33(4):465-78. doi: 10.1038/jcbfm.2012.210.
17. Johnson AC, Cipolla MJ. The cerebral circulation during pregnancy: adapting to preserve normalcy. Physiology (Bethesda). 2015 Mar;30(2):139-47. DOI: 10.1152/physiol. 00048.2014.
18. Palei A, Spradley F, Warrington J, George E, Granger J. Pathophysiology of hypertension in pre-eclampsia: a lesson in integrative physiology. Acta Physiol. 2013 Jul;208(3):224–33. DOI: 10.1111/apha.12106.
19. Amburgey OA, Chapman AC, May V, Bernstein IM, Cipolla MJ. Plasma from preeclamptic women increases blood-brain barrier permeability: role of vascular endothelial growth factor signaling. Hypertension. 2010 Nov;56(5):1003-8. DOI: 10.1161/HYPERTENSIONAHA. 110.158931.
20. Warrington JP, Fan F, Murphy SR, Roman RJ, Drummond HA, Granger JP, Ryan MJ. Placental ischemia in pregnant rats impairs cerebral blood flow autoregulation and increases blood-brain barrier permeability. Physiol Rep. 2014 Aug 28;2(8). DOI: 10.14814/phy2.12134.
21. Euser AG, Bullinger L, Cipolla MJ. Magnesium sulphate treatment decreases blood–brain barrier permeability during acute hypertension in pregnant rats. Exp Physiol. 2008 Feb;93(2):254-61.
22. Euser AG, Cipolla MJ. Magnesium sulfate for the treatment of eclampsia: a brief review. Stroke. 2009 Apr;40(4):1169-75. DOI: 10.1161/STROKEAHA.108.527788.
23. Johnson AC, Tremble SM, Chan SL, Moseley J, LaMarca B, Nagle KJ, Cipolla MJ. Magnesium sulfate treatment reverses seizure susceptibility and decreases neuroinflammation in a rat model of severe preeclampsia. PLoS One. 2014 Nov 19;9(11):e113670. DOI: 10.1371/journal.pone.0113670.
24. Quick AM, Cipolla MJ. Pregnancy-induced up-regulation of aquaporin-4 protein in brain and its role in eclampsia. FASEB J. 2005 Feb;19(2):170-5.
25. Nagelhus EA, Ottersen OP. Physiological roles of aquaporin-4 in brain. Physiol Rev. 2013 Oct;93(4):1543-62. DOI: 10.1152/ physrev.00011.2013.
26. Ghabriel MN, Thomas A, Vink R. Magnesium restores altered aquaporin-4 immunoreactivity following traumatic brain injury to a pre-injury state. Acta Neurochir Suppl. 2006;96:402- 6.
27. Huang Q, Liu H, Bao J, Zhang G, Hu B, Brennecke SP. [122- POS]: Increased expression of aquaporin 4 and 9 in eclampsialike rat model. Pregnancy Hypertens. 2015 Jan;5(1):65. doi: 10.1016/j.preghy.2014.10.128.
28. Fukuda AM, Badaut J. Aquaporin 4: a player in cerebral edema and neuroinflammation. J Neuroinflammation. 2012(27);9:279. DOI: 10.1186/1742-2094-9-279.
29. Schreurs MP, Houston EM, May V, Cipolla MJ. The adaptation of the blood-brain barrier to vascular endothelial growth factor and placentalgrowth factor during pregnancy. FASEB J. 2012 ;26(1):355-62. DOI: 10.1096/fj.11-191916.
30. Belfort MA, Clark SL, Sibai B. Cerebral hemodynamics in preeclampsia: cerebral perfusion and the rationale for an alternative to magnesium sulfate. Obstet Gynecol Surv. 2006;61(10):655-665. DOI: 10.1097/01. ogx.0000238670.29492.84.
31. van Veen TR, Panerai RB, Haeri S, Griffioen AC, Zeeman GG, Belfort MA. Cerebral autoregulation in normal pregnancy and preeclampsia Obstet Gynecol. 2013;122:1064–9. DOI: 10.1097/AOG.0b013e3182a93fb5.
32. van Veen TR, Panerai RB, Haeri S, Singh J, Adusumalli JA, et al. Cerebral autoregulation in different hypertensive disorders of pregnancy. Am J Obstet Gynecol. 2015;212:513.e1-7. DOI: 10.1016/j.ajog.2014.11.003.
33. Pezzi M, Le Piane E, Giglio AM, Pagnotta L, Scozzafava A, Tortorella V, Sergi A, Verre M. Posterior reversible encephalopathy syndrome in late postpartum eclampsia. Clin Ter. 2015 Mar-Apr;166(2):68-71. doi: 10.7417/ CT.2015.1818.
34. Kutlesič MS, Kutlesič RM, Koratevič GP. Posterior reversible encephalopathy syndrome in eclamptic patients: neuroradiological manifestation, pathogenesis and management. Med Pregl. 2015 Jan-Feb;68(1-2):53-8. DOI: 10.2298/mpns1502053k.
35. Berhan Y, Berhan A. Should magnesium sulfate be administered to women with mild pre-eclampsia? A systematic review of published reports on eclampsia. J Obstet Gynaecol Res. 2015;41(6):831-42. doi: 10.1111/jog.12697.
36. Duley L, Henderson-Smart DJ, Walker GJ, Chou D. Magnesium sulphate versus diazepam for eclampsia. Cochrane Database Syst Rev. 2010 Dec 8;(12):CD000127. doi: 10.1002/14651858. CD000127.pub2.
37. Duley L, Henderson-Smart DJ, Chou D. Magnesium sulphate versus phenytoin for eclampsia. Cochrane Database Syst Rev. 2010 Oct 6;(10):CD000128. doi: 10.1002/14651858. CD000128.pub2.
38. Duley L, Gülmezoglu AM, Henderson-Smart DJ, Chou D. Magnesium sulphate and other anticonvulsants for women with pre-eclampsia. Cochrane Database Syst Rev. 2010 Nov 10;(11):CD000025. doi: 10.1002/14651858. CD000025. pub2.
39. Duley L, Gülmezoglu AM, Chou D. Magnesium sulphate versus lytic cocktail for eclampsia. Cochrane Database Syst Rev. 2010 Sep 8;(9):CD002960. doi: 10.1002/14651858. CD002960.pub2.
40. Belfort MA, Anthony J, Saade GR, Allen JC Jr, Nimodipine Study Group. A comparison of magnesium sulfate and nimodipine for the prevention of eclampsia. N Engl J Med. 2003 Jan 23;348(4):304-11.
41. Kutlesič MS, Kutlesič RM, Koratevič GP. Posterior reversible encephalopathy syndrome in eclamptic patients: neuroradiological manifestation, pathogenesis and management. Med Pregl. 2015 Jan-Feb;68(1-2):53-8. DOI: 10.2298/mpns1502053k.
42. Liman TG, Bohner G, Heuschmann PU, Scheel M, Endres M, Siebert E Clinical and radiological differences in posterior reversible encephalopathy syndrome between patients with preeclampsia-eclampsia and other predisposing diseases. Eur J Neurol. 2012;19:935–43. doi: 10.1111/j.1468-1331.2011.03629.x.
43. Zeeman GG, Fleckenstein JL, Twickler DM, Cunnigham FG. Cerebral infarction in eclampsia. Am J Obstet Gynecol. 2004;190:714–20.
44. Aukes AM, de Groot JC, Aarnoudse JG, Zeeman GG. Brain lesions several years after eclampsia. Am J Obstet Gynecol. 2009;200:504.e1-504.e5. doi: 10.1016/j.ajog.2008.12.033.
45. Postma IR, de Groot JC, Aukes AM, Aa,poudse JG, Zeeman GG. Cerebral white matter lesions and perceived cognitive dysfunction: the role of pregnancy. Am J Obstet Gynecol. 2014;211:257.e1-5. doi: 10.1016/j.ajog.2014.02.031.
46. Baecke M, Spaanderman ME, Van der Werf SP. Cognitive function after pre-eclampsia: an explorative study. J Psychosom Obstet Gynaecol. 2009;30:58-64. DOI:10.1080/01674820802546212.
47. Brussé I, Duvekot J, Jongerling J, Steegers E, De Koning I. Impaired maternal cognitive functioning after pregnancies complicated by severe pre-eclampsia: a pilot case control study. Acta Obstet Gynecol Scand. 2008;87:408-12. DOI: 10.1080/00016340801915127.
48. Postma IR, Wessel I, Aarnoudse JG, Zeeman GG. Neurocognitive functioning in women with a history of eclampsia: executive functioning and sustained attention. Am J Perinatol. 2010;27:685-90. DOI: 10.1055/s-0030-1253099.
49. Legriel S, Schraub O, Azoulay E, Hantson P, Magalhaes E, Coquet I, et al. Determinants of recovery from severe posterior reversible encephalopathy syndrome. PLoS One. 2012;7:e44534. doi:10.1371/journal.pone.0044534.
Fuente de financiarniento: Autofinanciado
Conflicto de interés: ninguno
Artículo recibido el 30 de junio de 2015 y aceptado para publicación el 11 de octubre de 2015.
Correspondencia:
Dirección: Av. Guardia Chalaca 2176, Bellavista. Callao
Celular: 985436784
drrlacunza@hotrnail.com













