Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Ginecología y Obstetricia
On-line version ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.62 no.1 Lima Jan./Mar. 2016
SIMPOSIO: DOLOR PÉLVICO CRÓNICO
Dolor pélvico crónico: Más allá de la endometriosis
Pelvic chronic pain: more than just endometriosis
Juan Diego Villegas-Echeverri, MD, FACOG1,2, José Duván López Jaramillo, MD1,2, Ana Lucía Herrera-Betancourt, MD, FACOG1,2, Jorge Dario López Isanoa, MD1,2
1 Unidad de Laparoscopia Ginecológica Avanzada y Dolor Pélvico ALGIA
2 Comité de Investigación Comfamiliar Risaralda
Resumen
El dolor pélvico crónico (DPC) es el dolor no cíclico de más de 3 meses de duración que se localiza en la zona anatómica de la pelvis, la pared abdominal anterior por debajo del ombligo, el periné, el área genital, la región lumbosacra o la cadera, y que tiene una severidad que causa discapacidad funcional y/o lleva a los pacientes a buscar atención médica. Estas pacientes no pueden hacer ejercicio, tienen trastornos del sueño, dificultad para disfrutar tiempo libre, pobre socialización, dificultades en la marcha, dificultades en la concentración, impacto negativo en su calidad de vida y en su sexualidad. La concepción general de que la endometriosis es la única causa de dolor pélvico crónico no solo está equivocada, sino que demora el diagnóstico y resulta en unas tasas de mejoría mucho menores de las esperadas. Es muy importante hacer un cambio profundo en la forma de enfrentarse a pacientes con DPC, sobre todo dejando de pensar en que la endometriosis es la única causa de dolor. La clave para el tratamiento es manejar al DPC como la enfermedad compleja que es. La evidencia actual demuestra que diagnosticar solo un componente de esta condición (como la endometriosis o las adherencias pélvicas) y tratar únicamente ese componente probablemente no tenga éxito. Dada la actual comprensión de la neuropatología de dolor pélvico crónico, el fracaso de la terapia tradicional es esperable si no se afronta la condición de manera integral y con un enfoque multidisciplinario y multimodal.
Palabras clave: Dolor Pélvico; Endometriosis.
Abstract
Chronic pelvic pain (CPP) is the non-cyclical pain of more than 3 months duration, located in the anatomical area of the pelvis, anterior abdominal wall below the umbilicus, perineum, genital area, lumbosacral region or hip, severe enough to cause functional impairment and / or to seek medical attention. These patients cannot exercise, suffer sleep disorders, cannot enjoy free time, have poor socialization, gait difficulties, poor concentration and a negative impact on their quality of life and sexuality. The general idea that endometriosis is the only cause of chronic pelvic pain is not only wrong, but delays diagnosis and results in improvement rates much lower than expected. A profound change in the way of dealing with patients with CPP is necessary, especially considering endometriosis as the only cause of pelvic pain. Treatment key is to manage CPP as a complex disease. Current evidence shows that diagnosing only one component of this condition (such as endometriosis or pelvic adhesions) and treatment of only that component will probably have no success. Given the current understanding of the neuropathology of chronic pelvic pain, failure of traditional therapy is expected if the condition is not faced with a multidisciplinary and multimodal approach.
Keywords: Pelvic Pain; Endometriosis.
Introducción
Es fundamental hacer claridad en algunas definiciones que nos permiten acercar varios de los conceptos que discutiremos más adelante. El dolor agudo es indiscutiblemente diferente al dolor crónico, y se debe saber la diferencia entre estos antes de decidir el tratamiento. Mientras el dolor agudo es síntoma de un daño tisular y una enfermedad subyacente, el dolor crónico se convierte, por sí mismo, en un diagnóstico y una enfermedad. Por lo menos 116 millones de adultos en Estados Unidos sufren de dolor crónico y ese número es superior al número de pacientes que tienen hipertensión arterial, diabetes mellitus y cáncer juntos. Por lo tanto, el dolor crónico tiene inmensos efectos no solo en la calidad de vida de las pacientes sino también en los sistemas de salud y la prestación asistencial(1,2).
A pesar de que no hay consenso definitivo con respecto a la definición, podemos decir que el dolor pélvico crónico (DPC) es el dolor no cíclico de más de tres meses de duración que se localiza en la zona anatómica de la pelvis, la pared abdominal anterior por debajo del ombligo, el periné, el área genital, la región lumbosacra o la cadera y que tiene una severidad que causa discapacidad funcional y/o lleva a buscar atención médica. Como vemos, en esta definición se excluye el dolor cíclico(3,4).
La dismenorrea se especifica como el dolor pélvico que se presenta exclusivamente durante el sangrado menstrual. Esta definición publicada por el Colegio Americano de Obstetras y Ginecólogos (ACOG) desde el 2004, tiene además una consideración muy importante, dice también que la ausencia de hallazgos clínicos positivos no minimiza el significado del dolor de las pacientes. Un examen físico normal no descarta la posibilidad de patología pélvica. Es más probable que las pacientes estén mal evaluadas y no que el examen físico sea normal(3,4).
Pero, ¿por qué preocuparse? ¿Cuál es la dimensión real del problema?
El impacto real que tiene el dolor pélvico crónico es muy importante. Se dice que aproximadamente el 30% de todas las consultas ambulatorias de ginecología, 15 a 20% de todas las consultas de urgencias de ginecología y casi la mitad de todas las laparoscopias ginecológicas se realizan por cuenta de diagnósticos relacionados con el dolor pélvico crónico. Y, además, 60% de las pacientes viven sin un diagnóstico preciso o un tratamiento adecuado. También se ha dicho que 75% de la incapacidad y discapacidad por causa ginecológica en Estados Unidos se debe a DPC.
Y el impacto que tiene el DPC en la calidad de vida de las pacientes también es abrumador. Estas pacientes no pueden hacer ejercicio, tienen trastornos del sueño, dificultad para disfrutar tiempo libre, pobre socialización, dificultades en la marcha, impacto negativo en su sexualidad y dificultades en la concentración. Entre otros, 41% de ellas tiene además imposibilidad para trabajar y tiene faltas laborales de 2 a 7 días por mes. Se calcula que el DPC genera en Estados Unidos un costo médico de aproximadamente US$1.200 millones al año y pérdidas por productividad laboral de más de US$ 15.000 millones al año(5-12).
No todas las pacientes con DPC tienen endometriosis
Es claro que la endometriosis es una muy importante causa de DPC. Además, también está claro en la literatura que la endometriosis es un hallazgo frecuente en las pacientes con DPC y que es un generador primario de dolor. Pero, también está demostrado que el dolor puede persistir incluso después de tratamiento quirúrgico y médico adecuados y que la endometriosis puede ser el origen de otros generadores de dolor. Pero no todas las pacientes con DPC tienen endometriosis y no todas las pacientes con endometriosis tienen DPC. Incluso, hasta 30% de pacientes asintomáticas llevadas a ligadura de trompas, la endometriosis puede ser un hallazgo incidental(13-15).
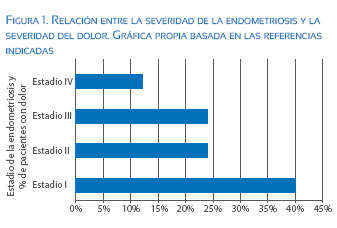
La severidad del dolor y el estadio de la endometriosis no están relacionados. Inclusive se ha demostrado que el porcentaje de pacientes con dolor asociado a endometriosis mínima y leve (estados I-II de la Sociedad Americana de Medicina Reproductiva - ASRM) es superior al de pacientes con endometriosis severa o infiltrativa profunda, como se muestra en la Figura 1(16-18).
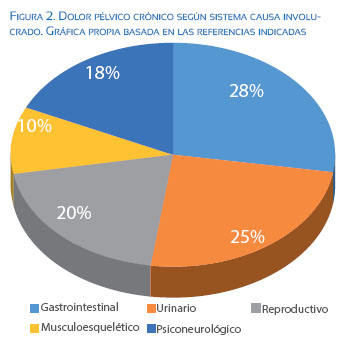
Las tasas de falla luego del manejo del DPC asociado a endometriosis dependen de haber realizado un diagnóstico equivocado antes de la intervención, de tratamientos incompletos o insuficientes o de haber pasado por alto otros diagnósticos que contribuyen al dolor. En la figura 2 se puede ver cómo el origen reproductivo (donde la endometriosis es una de las más importantes) solo representa alrededor de 20% de causas de DPC(16-18).
Asimismo, numerosos estudios ya demostraron que el diagnóstico de endometriosis se sobrepone a varias otras patologías y tener un diagnóstico confirmado de endometriosis no excluye la presencia de otros generadores dolorosos. En el año 2002, el doctor Maurice Chung publicó su estudio referente al llamado evil twins syndrome (síndrome de los gemelos malvados), donde demostró que las pacientes con endometriosis tienen además el componente vesical doloroso en 65% de los casos(19,20).
Lo mismo sucede con la relación de endometriosis e intestino irritable (presentes simultáneamente en aproximadamente 50% de los casos) y la relación entre endometriosis y síndrome miofacial/mialgia por tensión del piso pélvico, entre 21 y 31% de los casos(19,21-24).
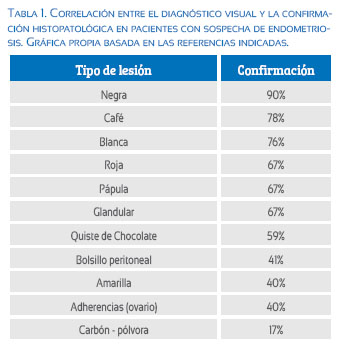
Una consideración fundamental al enfrentar pacientes con DPC y sospecha de endometriosis es la forma de realizar el diagnóstico. Está claro que el diagnóstico visual de endometriosis es inadecuado y lleva a muchos errores. Actualmente, el diagnóstico de endometriosis tiene que, necesariamente, estar confirmado por anatomía patológica. La Tabla 1 demuestra la pobre exactitud del diagnóstico visual de endometriosis comparado con el diagnóstico histológico(25,26).
La correlación entre los hallazgos laparoscópicos y el resultado positivo de patología depende del sitio de la lesión y el estadio de la endometriosis. Y, sabiendo que la endometriosis no es usualmente un diagnóstico aislado en las pacientes con DPC y que suele acompañarse de otros varios generadores dolorosos, en estas pacientes siempre debe incluirse una búsqueda sistemática de todas las otras causas viscerales o somáticas de dolor, ya que las pacientes con DPC asociado o no a endometriosis suelen tener síntomas idénticos(14,27-31).
Dolor pélvico crónico: una nueva visión más allá de la endometriosis
Debemos alejarnos de la visión antigua del dolor pélvico crónico, donde el único diagnóstico era la endometriosis, cuando era muy frecuente la laparoscopia negativa y se ofrecía a las pacientes un enfoque disperso y poco claro. Y empezar a pensar de otra manera al evaluar y tratar pacientes con DPC. Se debe empezar a manejar a las pacientes partiendo de la base de que un porcentaje muy elevado de ellas tiene múltiples generadores dolorosos. Se aplicará en estas pacientes las teorías generales de dolor crónico, hablar de generadores dolorosos primarios y secundarios y tener clara las ‘asociaciones malvadas’ de patologías, pues, es clara la relación entre los generadores dolorosos primarios y secundarios, incluyendo entre otros a la endometriosis, el síndrome miofascial, la fibromialgia, el síndrome de intestino irritable, las causas músculo esqueléticas, la disfunción del piso pélvico, el síndrome vesical doloroso y las neuropatías periféricas(19,22-24,32-34).
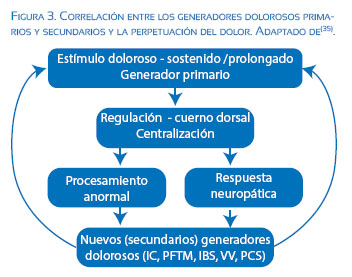
Cuando una paciente tiene un generador doloroso primario que produce un estímulo doloroso y prolongado, se desencadena un fenómeno de sub regulación en el cuerno dorsal de la médula espinal que es responsable de procesamiento anormal y respuestas inadecuadas centrales y periféricas que, finalmente, dan origen generadores secundarios de dolor como lo muestra la Figura 3(35).
Cambios neurofisiopatológicos en el dolor crónico. Entendiendo el paso de dolor agudo a crónico
El dolor crónico está asociado a múltiples modificaciones del sistema nervioso central y periférico que generan la persistencia del dolor y dificultan su adecuado manejo. Los mecanismos exactos involucrados en la fisiopatología del dolor crónico no son aún totalmente entendidos. Sin embargo, se cree que tanto en el sistema nervioso central como en el periférico se producen cambios agudos y de largo plazo que generan alteraciones en las vías dolorosas, y terminan por generar respuestas anormales que perduran en el tiempo y perpetúan los síntomas. Las pacientes que caminan el trayecto desde el dolor agudo hasta el dolor crónico y que están involucradas en el círculo vicioso de dolor-discapacidad-dolor generalmente tienen una serie de cambios neuro-fisiopatológicos tanto centrales como periféricos que son responsables de su condición crónica. En el DPC, todas estas teorías se aplican de manera efectiva. Dentro de los varios mecanismos de dolor involucrados en estas pacientes podremos nombrar los siguientes:
a. Procesamiento alterado de dolor
Una paciente que está sometida a dolor severo y no contralado genera estimulación excesiva y prolongada de los recetores de N-metil-D-aspartato en la médula espinal que producen cambios plásticos neuropáticos de las neuronas receptoras y, finalmente, hiperexcitabilidad neuronal responsable en la periferia de alodinia (dolor con estímulos que, en personas normales, no son dolorosos) e hiperalgesia (dolor más severo que el realmente generado por una estímulo doloroso)( 36,37).
b. Conversación cruzada (cross–talk)
Las señales eléctricas muy fuertes originadas en las fibras nerviosas aferentes pobremente mielinizadas (o no mielinizadas) producen señales eléctricas de novo en las fibras nerviosas aferentes adyacentes que no están involucradas en los estímulos dolorosos. El desarrollo de cross-talk en los órganos pélvicos requiere un estímulo aferente cruzado en la pelvis. La información aferente de los principales órganos de la pelvis, como la vejiga, colon y recto y el útero, se conduce a través de los nervios hipogástricos, esplácnicos y pudendos a cuerpos celulares en los ganglios de la raíz dorsal toracolumbar y lumbosacra. Típicamente, el estímulo aferente prodrómico (de la periferia hacia el sistema nervioso central) desde un órgano pélvico enfermo produce un estímulo antidrómico (de central a periférico) y co-sensibilización de otro órgano pélvico ‘no comprometido’. Estas vías reflejas anormales pueden ocurrir localmente en la periferia a través de axones colaterales (dicotomización de los aferentes), en la médula espinal (reflejos de la raíz dorsal) y/o en el sistema nervioso central. En consecuencia, la vía antidrómica puede producir cambios funcionales en otro órgano pélvico con muy poca o ninguna patología orgánica( 38,39).
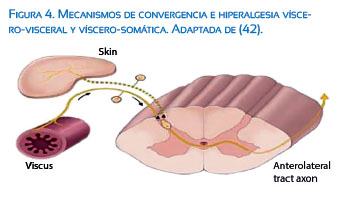
c. Convergencia visceral–somática y visceral-visceral
Existe convergencia tanto de aferentes somáticos como viscerales en la misma neurona de segundo orden en el cuerno dorsal de la médula espinal. Solo entre 2 y 7% de todas las fibras aferentes en cada ganglio de la raíz dorsal son viscerales y las interneuronas del cuerno dorsal están grandemente influenciadas por fibras somáticas. Por eso, por ejemplo, los estímulos que llegan a la espina dorsal desde el músculo son mucho más potentes que los generados en la piel. Esta es la razón por la cual muchas veces el dolor somático se refiere como dolor visceral especialmente en la pared abdominal. La activación aferente de una estructura pélvica influye en la salida eferente hacia otra. Por lo tanto, cualquier enfermedad o lesión en una vía puede influir en el desarrollo de activación anormal de otra vía. Esta teoría podría explicar la superposición de síntomas o trastornos de dolor pélvico crónico (Figura 4)(19,40-42).
d. Sensibilización periférica
Tanto la sensibilización central (CS) como la periférica son las principales razones de la hipersensibilidad al dolor después de un daño tisular. La sensibilización periférica puede ocurrir en el dolor inflamatorio, en algunas formas de dolor neuropático o luego de estimulación nociceptiva persistente. El daño tisular genera cambios drásticos en el ambiente químico de las terminales periféricas de los nociceptores, liberando iones de potasio, sustancia P, bradiquinina, prostaglandinas y otras sustancias proinflamatorias. Adicionalmente, algunos contenidos intracelulares como adenosintrifosfato e iones de hidrógeno se liberan de las células. En la sensibilización periférica, los mediadores infamatorios aumentan la percepción dolorosa en respuesta a los estímulos, disminuyendo el umbral. La sensibilización periférica se asocia con aumento de la sensibilidad, tanto a estímulos mecánicos como térmicos, sean estos inocuos (alodinia) o nocivos (hiperalgesia)(41,42).
e. Sensibilización central
La sensibilización central (SC) se refiere a un aumento de la excitabilidad de los circuitos neuronales espinales y supraespinales, como resultado de lesiones o la activación de receptores periféricos. La sensibilización central es un fenómeno fisiológico en el que las neuronas del sistema nervioso central se vuelven hiperexcitables, dando lugar a desregulación neuronal y provocando hipersensibilidad tanto a estímulos patológicos como inofensivos. La SC parece ser un proceso que combina una alteración mediada por neurotransmisores con la capacidad de los individuos para manejar sus experiencias cognitivas previas y su impacto en la vida cotidiana. La SC se asocia con alodinia, hiperalgesia, la ampliación del campo receptivo (dolor que se extiende más allá de la zona de inervación periférica) y dolor inusualmente prolongado después de que el estímulo doloroso se ha eliminado. Generalmente, la sensación referida por los pacientes es de dolor palpitante, ardor, hormigueo o entumecimiento.
En la SC hay una disociación del dolor que genera expansión de la hiperalgesia más allá del sitio de la noxa e hipersensibilidad cruzada entre varias estructuras somáticas y viscerales.
Dadas las implicaciones de la sensibilización, es importante tener en mente que al momento de decidir el manejo médico del dolor crónico debe indicarse el control de los síntomas somáticos y el manejo de los elementos dolorosos centrales y periféricos(41-43).
f. Wind-up (dar cuerda) de la médula espinal
La estimulación repetida y de baja frecuencia de las fibras C produce un aumento gradual de la frecuencia de descarga de las neuronas de segundo orden en la médula espinal, hasta que quedan en un estado de casi despolarización continua. Este estado genera expansión de los campos receptivos, cambios bioquímicos permanentes, disminución del umbral y, finamente, sobre regulación (up-regulation) del procesamiento sensorial(44,45).
Conclusiones
En conclusión, hay que hacer un cambio profundo en la forma de enfrentarse a pacientes con DPC, sobre todo dejando de pensar en que la endometriosis es la única causa de dolor. La clave para el tratamiento es manejar al DPC como la enfermedad compleja que es. La evidencia actual demuestra que diagnosticar solo un componente de esta condición (como la endometriosis o las adherencias pélvicas) y tratar únicamente ese componente probablemente no tenga éxito. Dada la actual comprensión de la neuropatología de dolor pélvico crónico, el fracaso de la terapia tradicional es esperable. En la actualidad el enfoque integrado de tratamiento tiene la mayor posibilidad de resultado exitoso. El objetivo del manejo del dolor pélvico crónico es identificar y tratar cada uno de los múltiples generadores de dolor.
Conflicto de intereses
Ninguno de los autores tiene conflictos de interés que declarar con respecto a este articulo
Reconocimientos
Agradecemos al grupo de investigación de Comfamiliar Risaralda y en especial a la Doctora Gloria Liliana Porras por su apoyo durante la elaboración de este artículo.
Referencias Bibliográficas
1. Crombez G, Eccleston C, Van Damme S, Vlaeyen JW, Karoly P. Fear-avoidance model of chronic pain: the next generation. Clin J Pain. 2012 Jul;28(6):475-83. doi: http.//dx.doi. org/10.1097/AJP0b013e3182385392 [ Links ]
2. Quinlan J, Carter K. Acute pain management in patients with persistent pain. Curr Opin Support Palliat Care. 2012 Jun; 6(2): 188-93. doi: http://dx.doi.org/10.1097/SPC.0b013e- 3283520fb6. [ Links ]
3. Howard F. ACOG Practice Bulletin: Clinical management guidelines for Obstetrician-Gynecologists. ACOG Number 51,March 2004. [ Links ]
4. Yunker A, Sathe NA, Reynolds WS, Likis FE, Andrews J. Systematic review of therapies for noncyclic chronic pelvic pain in women. Obstet Gynecol Surv. 2012; 67(7):417. doi: http// dx.doi.org/10.1097/OGX.0b013e31825cecb3. [ Links ]
5. Zondervan KT, Yudkin PL, Vessey MP, Jenkinson CP, Daves MG, Barlow DH. The community prevalence of chronic pelvic pain in women and associated illness behavior. Brit J Gen Practice. 2001;51(468):541-7. [ Links ]
6. Zondervan KT, Yudkin PL, Vessey MP, Jenkinson CP, Dawes MG, Barlow DH. Chronic pelvic pain in the community. Symptoms, investigations and diagnoses. Am J Obstet Gynecol. 2001;184:1149. doi: http//dx,doi.org/10.1067/ mob.2001.112904. [ Links ]
7. Pizzo PA, Clark NM. Alleviating suffering 101-pain relief in the United States. N Engl J Med. 2012;366(3):197. doi: http//dx. doi.org/10.1056/NEJMp1109084. [ Links ]
8. Purvis JM. Chronic non cancer pain. The Female Patient. 2002;27:21. [ Links ]
9. Andrew R, Derry S, Taylor RS, Straube S, Phillips CJ. The costs and Consequences of Adequately Managed Chronic Non-Cancer pain. Pain Pract. 14(1):79-94. doi: http//dx.doi. org/10.1111/papr.12050. [ Links ]
10. Mathias SD, Kuppermann M, Liberman RF, Lipschutz RC, Steege JF. Obstet Gynecol. 1996;87(3):321-7. doi: http://dx. doi.org/10.1016/0029-7844(95)00458-0. [ Links ]
11. Postgraduate course 5. Chronic Pelvic Pain. IPPS. 31stAAGL meeting. November 2002. Miami, Fla. [ Links ]
12. Yunker A, Sathe NA, Reynols WS, Likis FE, Andrews J. Systematic review of therapies for noncyclic chronic pelvic pain in women. Obstet Gynecol Surv 2012;67(7):417. doi: http:// dx.doi.org/10.1097/OGX.0b013e31825cecb3. [ Links ]
13. Kobayashi H, Yamada Y, Morioka S, Niiro E, Shigemitsu A, Ito F. Mechanism of pain generation for endometriosis- associated pelvic pain. Arch Gynecol Obstet. 2014 Jan;289(1):13-21. doi: http://dx.doi,org/10.1007/500404-013-3049-8. [ Links ]
14. Howard FM. Endometriosis and mechanisms of pelvic pain. J Minim Invasive Gynecol. 2009 Sep-Oct;16(5):540-50. doi: http://dx.doi.org/10.1016/j.jmig.2009.06.017. [ Links ]
15. Moen MH, Stokstad T. A long term follow-up study of diagnofrecuencia sed incidentally at sterilization. Fertil Steril. 2002;78:773. doi: http://dx.doi.org/10.1016/S0015-0282(02)03336-8. [ Links ]
16. Benjamin-Pratt AR, Howard FM. Management of chronic pelvic pain. Minerva Ginecol. 2010;62(5):447. [ Links ]
17. Vercellini P, Somigliana E, Viganó P, Abbiati A, Barbara G, Fedele L. Chronic pelvic pain in women: etiology, pathogenesis and diagnostic approach. Gynecol Endocrinol. 2009;25(3):149. doi: http://dx.doi.org/10.1080/09513590802549858. [ Links ]
18. Zondervan KT, Yudkin PL, Vessey MP, Dawes MG, Barlow DH, Kennedy SH. Patterns of diagnosis and referral in women consulting for chronic pelvic pain in UK primary care. BJOG. 1999;106(11):1156. doi: http://dx.doi.org/ 10.1111/j.1471-0528.1999.tb08141.x. [ Links ]
19. Chung MK, Chung RP, Gordon D. Intersticial cystitis and endometriosis in patients with chronic pelvic pain: The “evil twins” syndrome. JSLS. 2005 Jan-Mar;9(1):25-9. [ Links ]
20. Tirlapur SA, Kuhrt K, Chaliha C, Ball E, Meads C, Khan K. The “evil twin syndrome” in chronic pelvic pain: a systematic review of prevalence studies of bladder pain syndrome and endometriosis. Int J Surg. 2013;11(3):233-7 [ Links ]
21. doi: http://dx.doi.org/10.1016/j.ijsu.2013.02.003. [ Links ]
22. Castellanos M. Ehen surgery fails to relieve pain. Disponible en: http://www.aagl.org/aglnews/today-on-surgeryu-dr-mario- castellanos-on-when-surgery-fails-to-relieve-pain/. [ Links ]
23. Issa B, Onon TS, Agrawal A, Shekhar C, Morris J, Hamdy S, Whorwell PJ. Visceral hypersensitivity in endometriosis: a new target for treatment? Gut. 2012 Mar;61(3):367-72. doi: http://dx.doi.org/10.1136/gutjnl-2011-300306. [ Links ]
24. Koziol JA. Epidemiology of intersticial cystitis. Urol Clin North Am. 1994 Feb; 21(1):7-20. [ Links ]
25. Nickel JC, Tripp DA, Pontari M, Moldwin R, Mayer R, Carr LK. J. Interstitial cystitis/painful bladder syndrome and associated medical conditions with an emphasis on irritable bowel syndrome, fibromyalgia and chronic fatigue syndrome. J Urol. 2010 Oct:184(4):1358-63. doi: http://dx.doi.org/10.1016/j. juro.2010.06.005. [ Links ]
26. Fernando S, Soh PQ, Cooper M, Evans S, Reid G, Tsaltas J, Rombauts L. Reliability of visual diagnosis of endometriosis. J Minim Invasive Gynecol. 2013 Nov-Dec;20(6):783-9. doi: http://dx.doi.org/10.1016-j.jmig.2013.04.017. [ Links ]
27. As-Sanie S.Is a picture worth a thousand biopsies? Challenges in the diagnosis of endometriosis. J Minim Invasive Gynecol. 2013 Nov-Dec;20(6):733-4. doi: http://dx.doi.org/ 10.1016/j.jmig.2013.09.002. [ Links ]
28. El Bishry G, Tselos V, Pathi A. A correlation between laparoscopic and histological diagnosis in patients with endometriosis. J Obstet Gynaecol. 2008 Jul;28(5):511-5. doi: http:// dx.doi.org/10.1080/01443610802217918. [ Links ]
29. Practice Committee of American Society for Reproductive Medicine. Treatment of pelvic pain associated with endometriosis. Fertil Steril 2008;90:S260. doi: http://dx.doi.org/ 10.1016/j.fertnstert.2008.08.057. [ Links ]
30. Redwine DB. “Invisible” microscopic endometriosis: a review. Gynecol Obstet Invest. 2003;55(2):63. doi: http://dx. doi.org/10.1159/000070176. [ Links ]
31. Donnez J, Squifflet J, Casanas-Roux F, Pirard C, Jadoul P, Van Langendonckt A. Typical and subtle atypical presentations of endometriosis. Obstet Gynecol Clin North Am. 2003;30(1):83. doi: http://dx.doi.org/10.1016/s0889-8545(02)00054-2. [ Links ]
32. Walter AJ, Hentz JG, Magtibay PM, Cornella JL, Magrina JF. Endometriosis: correlation between histologic and visual findings at laparoscopic. A J Obstet Gynecol. 2001 Jun;184(7):1407-11;discussion 1411-3. [ Links ]
33. Parsons CL, Bullen M, Kahn BS, Stanford EJ, Willems JJ. Gynecologic presentation of interstitial cystitis as detected by intravesical potassium sensitivity. Obstet Ginecol. 2001;98:127. doi: http://dx.doi.org/10.1016/S0029-7844(01)01366-7. [ Links ]
34. Butrick CW, Sanford D, Hou Q, Mahnken JD. Chronic pelvic pain syndromes: clinical, urodynamic, and urothelial observations. Int Urogynecol J Pelvic Floor Dysfunct. 2009 Sep;20(9):1047-53. doi: http://dx.doi.org/10.1007/S00192- 009-0897-7. [ Links ]
35. Doggweiler-Wiygul R. Chronic pelvic pain. World J Urol. 2001;19:155. [ Links ]
36. Lewis GN, Rice DA, McNair PJ. Conditioned pain modulation in populations with chronic pain: a systematic review and meta-analysis. J Pain. 2012;13(10):936. doi: http://dx.doi.org/ 10.1016/j.jpain.2012.07.005. [ Links ]
37. Furuta A, Suzuki Y, Hayashi N, Egawa S, Yoshimura N. Transient receptor potencial A1 receptor-mediated neural crosstalk and afferent sensitization induced by oxidative stress: implication for the pathogenesis of interstitial cystitis/bladder pain syndrome. Int J Urol. 2012;19(5):429. [ Links ]
38. Ren K, Dubner R. Neuron-glia crosstalk gets serious: role in pain hypersensitivity. Curr Opin Anaesthesiol. 2008;21(5):570.doi: http://dx.doi.org/10.1097/ACO.0b013e32830edbdf. [ Links ]
39. Giamberardino MA, Berkley KI, Affaitati G, Lerza R, Centurione L, Lapenna D, Vecchiet L. Influence of endometriosis on pain behaviors and muscle hyperalgesia induced by ureteral calculosis in female rats. Pain. 2002;95:247-57. doi: http:// dx.doi.org/10.1016/S0304-3959(01)00405-5. [ Links ]
40. Staud R. Peripheral pain mechanisms in chronic widespread pain. Best Pract Res Clin Rheumatol. 2011;25(2):155. doi: http://dx.doi.org/10.1016/j.berh.2010.01.010. [ Links ]
41. Bloem B, Poorthuis RB, Mansvelder HD. Cholinergic modulation of the medial prefrontal cortex: the role of nicotinic receptors in attention and regulation of neuronal activity. Front Neural Circuits. Doi: http://dx.doi.org/10.3389/fncir. 2014.00017. Disponible en: http://journal.frontiersin. org/article/10.3389/fphar.2014.00017/full. [ Links ]
42. Lamvu G. Steege JF. The anatomy and neurophysiology of pelvic pain. J Minim Invasive Gynecol. 2006 Nov- Dec;13(06):516-22. doi: http://dx.doi.org/10.1016/j. jmig.2006.06.021. [ Links ]
43. Goicochea C, Martin MI. Mecanismos periféricos y centrales del dolor. Rheumatol Clin. 2006 Mar; 2 Suppl 1:S5-9. doi: http://dx.doi.org/10.1016/S1699-258x(06)73075-3. [ Links ]
44. Siddall PJ, Cousins MJ. Persistent pain as a disease entity: implications for clinical management. Anesth Analg. 2004 Aug;99(2):510-20. doi: http://dx.doi.org/10.1213/01. ANE.0000133383.17666.3A. [ Links ]
45. Puretic MB, Demarin V. Neuroplasticity mechanisms in the pathophysiology of chronic pain. Acta Clin Croat. 2012;51(3):425-9. [ Links ]
46. Herrero JF, Laird JM, Lopez-Garcia JA. Wind-up of spinal cord neurones and pain sensation: much ado about something? Prog Neurobiol. 2000;61(2):169. doi: http://dx.doi. org/10.1016/S0301-0082(99)00051-9. [ Links ]
Correspondencia Dr. Juan Diego Villegas-Echeverri Avenida Circunvalar No. 3 - 01 Clínica Comfamilair Pereira, Colombia Tel (+57) 6 3315772 - (+57) 6 3138700 Ext. 2363 (+57) 310 4225308