Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.62 no.2 Lima abr./jun. 2016
ARTÍCULO ORIGINAL
Anomalías cromosómicas en abortos espontáneos
Chromosomal abnormalities in spontan eous abortions
A. Pamela Mora-Alferez2,a, Denise Paredes1,b, Orlando Rodríguez1,c, Edwin Quispe1,b, Félix Chavesta1,c, Eva Klein de Zighelboim1,a, María de Michelena PhD1,a
1 Instituto de Medicina Genética, Lima, Perú
2 Instituto Nacional de Enfermedades Neoplásicas, Lima, Perú
a Médico Genetista b Tecnólogo Médico c Biólogo
Resumen
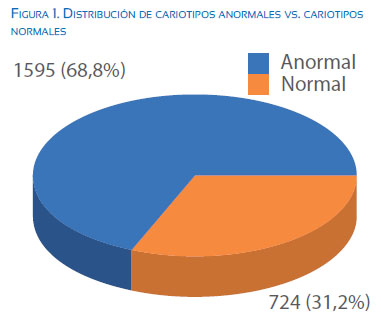
Introducción: El 15 a 20% de las gestaciones clínicas terminan en aborto espontáneo y 25% de las mujeres sufrirán un aborto a lo largo de su vida. En más del 50% de los casos de abortos espontáneos se puede identificar una o más anomalías cromosómicas. Objetivos: Determinar la frecuencia de anomalías cromosómicas en restos de abortos espontáneos y su relación con edad materna y otros parámetros como la edad gestacional. Diseño: Estudio de tipo observacional, descriptivo, transversal sobre base de datos secundaria. Institución: Laboratorio de Citogenética del Instituto de Medicina Genética. Material: Muestras de abortos espontáneos. Métodos: Se realizó el análisis de base de datos de 2 319 muestras de abortos espontáneos recibidos en el periodo de enero 1996 a diciembre 2013. Principales medidas de resultados: Frecuencia de anomalías cromosómicas. Resultados: De todos los casos analizados (2 319), 1 595 muestras presentaron cariotipo anormal (68,8%). De las anomalías numéricas (1 395/1 595), el 83,2% correspondió a aneuploidías y 16,8% a poliploidías. Los cariotipos mosaicos estuvieron presentes en 5,5% (87/1 595) y las anomalías estructurales en 3,5% (56/1 595). Se encontró dependencia entre las trisomías y la edad materna (X2 p<0,05). Conclusiones: El 68,8% de los abortos estudiados presentó alguna alteración cromosómica, siendo las aneuploidías las anomalías numéricas más frecuentes, con predominio de las trisomías (58,4%), las cuales estuvieron relacionadas con el incremento de la edad materna.
Palabras clave: Aborto Espontáneo; Anomalías Cromosómicas; Edad Materna; Edad Gestacional.
Abstract
Introduction: 15 to 20% of clinical pregnancies end in spontaneous abortion and 25% of women will have an abortion during her life. Over 50% of cases of spontaneous abortions carry one or more chromosomal abnormalities. Objectives: To determine the frequency of chromosomal abnormalities in spontaneous abortions and its relationship with maternal age and other parameters like gestational age. Design: Transversal, descriptive study on secondary database. Setting: Cytogenetic Laboratory of the Instituto de Medicina Genética. Material: Samples of spontaneous abortions. Methods: Database analysis of 2 319 samples of spontaneous abortions received between January 1996 and December 2013. Main outcome measures: Frequency of chromosomal abnormalities. Results: Of the 2 319 samples analyzed 1 595 showed abnormal karyotype (68.8%). Of all the numerical abnormalities (1 395/1 595) described, 83.2% consisted in aneuploidy and 16.8% polyploidy. Mosaicisms were present in 5.5% (87/1 595) and structural anomalies in 3.5% (56/1 595). Dependence was found between maternal age and trisomies (X2 p<0.05). Conclusions: 68.8% of abortions showed a chromosomal alteration; the aneuploidies were the most common numerical abnormalities with predominance of trisomies (58.4%) which were associated with increased maternal age.
Keywords: Spontaneous Abortion; Chromosomal Abnormalities; Maternal Age; Gestational Age.
Introducción
El aborto espontáneo es la complicación más frecuente del embarazo temprano. Según la Organización Mundial de la Salud se define como la expulsión natural o extracción de un embrión o feto no viable y su placenta con una edad gestacional menor a 20 o 22 semanas y/o un peso menor a 500 g(1).
De todas las gestaciones clínicamente reconocidas, 15 a 20% terminan en aborto espontáneo, principalmente durante las 13 primeras semanas del embarazo; además se ha estimado que aproximadamente 25% de las mujeres que se embarazan sufrirán un aborto a lo largo de su vida(2). Este porcentaje incrementa con la edad materna, ya que entre los 20 a 30 años es de 9 a 17%; mientras que a los 45 años es de 80%(3,4).
Existen diferentes factores como causa de aborto, que pueden ser genéticos, uterinos, endocrinos, infecciosos, inmunológicos y ambientales, aunque en algunos casos no se encontrará una causa(5).
La principal causa de aborto espontáneo son los defectos numéricos o estructurales de los cromosomas(5), que se identifican en más del 50% de abortos espontáneos. Se ha demostrado que el riesgo de aneuploidías aumenta proporcionalmente al incremento del número de abortos previos(6,7) y las anomalías numéricas, principalmente las trisomías libres, se asocian a edad materna avanzada(3,8).
Las alteraciones en el número de cromosomas (aneuploidías y poliploidías) se definen respecto a la variación del número haploide de cromosomas (n=23). La poliploidía es la adición de uno o más complementos haploides (3n, 4n…., etc.) mientras que la adición o pérdida de cromosomas que resulta en un número no múltiplo de 23 se denomina aneuploidía. La ganancia de uno o dos cromosomas homólogos se denominan trisomía y tetrasomía, respectivamente, mientras que la pérdida de un cromosoma se conoce como monosomía(4,9). En los abortos, las trisomías de los cromosomas 16, 22, 15, 21 y 13 son las más frecuentes en ese orden(5,10-12). Las aneuploidías se producen por la no disyunción cromosómica en la meiosis I y meiosis II, casi siempre durante la ovogénesis materna, siendo el más frecuente en la meiosis I. Se ha encontrado correlación entre la no disyunción cromosómica con la edad materna, aunque el mecanismo no se conoce con claridad(4,13).
Las anomalías estructurales se caracterizan por el intercambio (reordenamiento), pérdida o ganancia de material cromosómico. Las más frecuentes son las translocaciones, que pueden ser balanceadas si no hay pérdida ni ganancia de material cromosómico; generalmente, los portadores son fenotípicamente sanos, aunque existe el riesgo de transmitir derivados no balanceados a su descendencia, siendo esta una causa importante en el aborto espontáneo. Las translocaciones no balanceadas se caracterizan por la pérdida o ganancia de material cromosómico(14-16).
Las deleciones (del) se refieren a la pérdida de material cromosómico en regiones terminales o intersticiales. Las inserciones (ins) son la inclusión de material cromosómico de un cromosoma a otro. Las inversiones (inv) son regiones cromosómicas que se invierten dentro del mismo cromosoma; si esta inversión contiene el centrómero, se denominarán pericéntricas, y si no la incluye se las conoce como paracéntricas. Las adiciones (add) son las ganancias de material cromosómico de origen no determinado(4,9,14).
Este estudio representa el reporte con mayor número de casos descritos a la actualidad en nuestro país y América Latina, siendo esta información relevante ya que es indiscutible el valor de la contribución genética a la pérdida reproductiva.
Métodos
El presente es un estudio transversal descriptivo, que reporta las muestras de abortos referidos para estudio citogenético al Laboratorio de Citogenética del Instituto de Medicina Genética en el periodo enero 1996 a diciembre 2013. Se evaluaron un total de 2 319 casos, que cumplieron criterios de inclusión (muestras con fórmula de cariotipo de más de 20 metafases, que contaran con datos de edad materna y edad gestacional). Para catalogar los cariotipos se utilizó la nomenclatura ISCN para identificar las anomalías cromosómicas, según la versión(9). Se revisaron cuadernos de registros de pacientes y bases de datos virtuales; en casos necesarios se revisó las historias clínicas. El análisis de datos se realizó por medio del software SPSS 19. Se usó medidas de asociación de variables (X2) y pruebas paramétricas (t-student). Por ser un estudio de revisión de base de datos secundaria, no se necesitó la aplicación de consentimiento informado. En todo momento se mantuvo la confidencialidad de los casos. Este estudio tiene la aprobación del Comité de Ética de la Universidad Peruana Cayetano Heredia.
Resultados
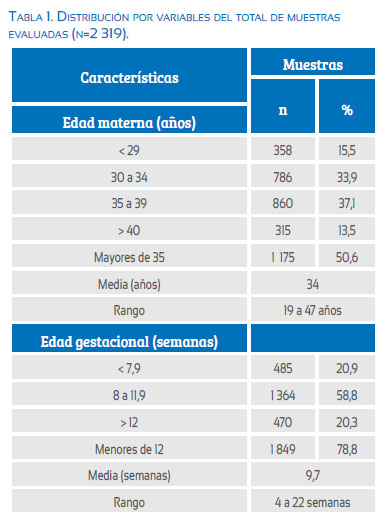
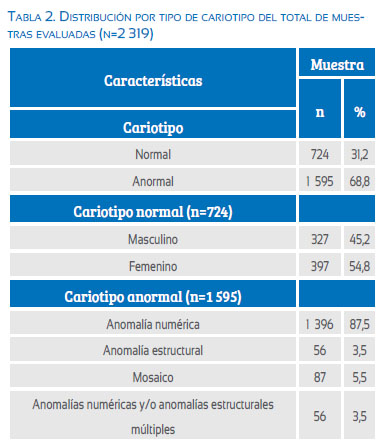
Se evaluaron 2 319 reportes de citogenética en abortos espontáneos, ocurridos durante el periodo enero 1996 a diciembre 2013. Las características demográficas se describen en las tablas 1 y 2 y la figura 1. Se presenta la distribución de los cariotipos evaluados, normales y con alteraciones.
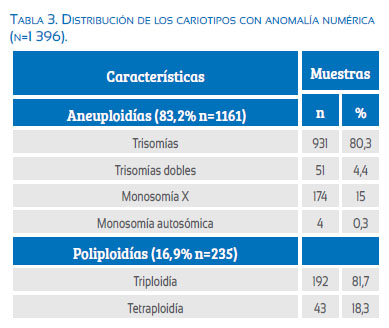
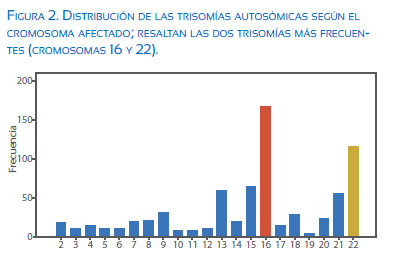
Dentro de las anomalías numéricas (n=1 395), el grupo más frecuente consistió en las aneuploidías (83,2%, n=1 160), de las cuales las trisomías fueron el grupo más descrito, representando un 80,3% (n=931); las trisomías más frecuentes fueron la trisomía del cromosoma 16 (23,3%, n=218) y del cromosoma 22 (15,9%, n=149) y la menos frecuente fue la trisomía del cromosoma 19 (0,4%, n=4). No se encontraron trisomías del cromosoma 1. En 4,4% de los casos presentaron trisomías dobles (n=51).
La monosomía del cromosoma X estuvo presente en 15% (n=174) y se encontraron 4 casos (0,3%) de monosomías autosómicas, exclusivamente del cromosoma 21.
Las poliploidías representaron un 16,8% de las anomalías numéricas; de estas las más frecuentes fueron las triploidías (81,7%, n=192) seguidas de las tetraploidías (18,3%, n=43). Tabla 3 y figura 2.
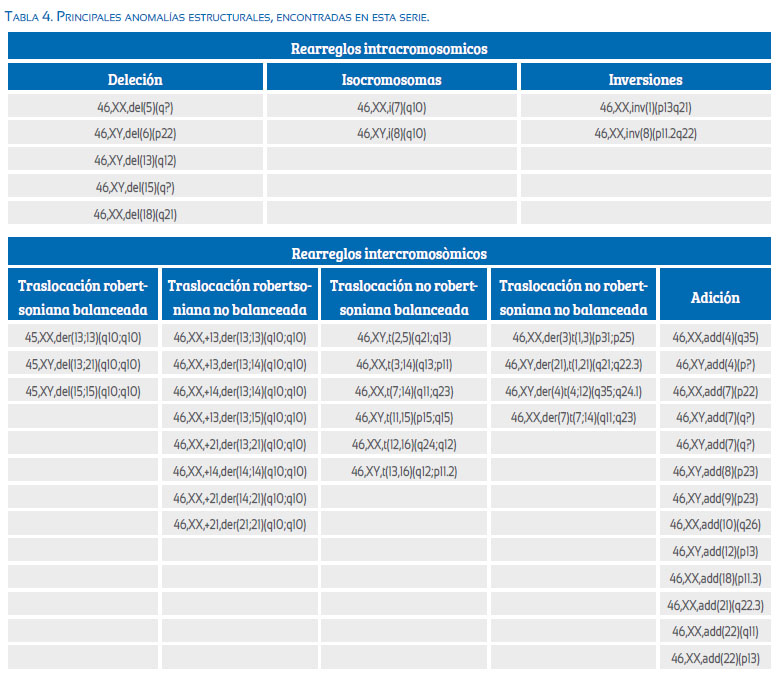
De los 56 casos de anomalías estructurales, la translocación robertsoniana no balanceada fue la más frecuente (30,4%, n=17); seguida de las adiciones (23,2%, n=13). Las alteraciones estructurales menos frecuentes fueron los isocromosomas (5,4%, n=3). Los cariotipos con anomalías numéricas y/o estructurales múltiples representaron el 3,5% de todos los casos, siendo el grupo más frecuente el que presentaba una poliploidía y aneuploidía (52,6%, n=30), seguida de los cariotipos en los cuales se evidenciaba alguna anomalía estructural y anomalía numérica (15,8%, n=9). Dentro del grupo menos frecuente, se describe un caso con monosomía del cromosoma 8 y trisomía del cromosoma 14 en la misma línea celular, representando el 1,8% de estos cariotipos (tabla 4).
En el análisis de la edad materna, se evidenció el aumento de la proporción de cariotipos anormales con el aumento de la edad. Por lo cual se asume que la variable cariotipo anormal no es independiente de la variable edad materna en intervalos (X2p<0,05). La media de edad materna 40 en el grupo de cariotipo normal fue 33,4 años, mientras que en el grupo con cariotipo anormal fue 34,8 años, siendo esta diferencia estadísticamente significativa (t de student p<0,05). El porcentaje de cariotipos anormales en gestantes menores de 29 años fue 58,1%, entre 30 y 34 años 64,5%, entre 35 y 39 años 73,3% y en mayores de 40 años llegó a representar 80,3% de todos los cariotipos evaluados en este grupo (figura 3).
Las aneuploidías fueron las anomalías numéricas más frecuentes y las únicas relacionadas con edad materna. En el grupo de edad materna mayor a 40 años, las aneuploidías representaron el 94% de todas las anomalías numéricas descritas para este grupo etario (X2p<0,05).
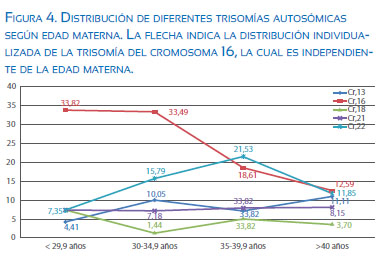
De las aneuploidías, las trisomías en general no son independientes de la edad materna (X2p<0.05), como se evidencia con la trisomía del cromosoma 16 que fue la más frecuente. La media de edad materna para los casos de trisomía del cromosoma 16 fue 33,9, mientras que la media en el resto de trisomías fue de 36 años (figura 4).
Las trisomías dobles se comportaron de manera similar a las trisomías simples con respecto a la edad materna (X2p<0,05); la edad media para este grupo fue de 38,7 años.
Las anomalías estructurales fueron independientes de la edad materna en todos los casos (X2p>0,05). Se encontraron 17 casos de trisomía por translocación robertsoniana no balanceada, de los cuales el más frecuente fue la trisomía del cromosoma 13 (42,1%), seguida de la trisomía del cromosoma 14 y 21 (26,3% cada una). La relación entre trisomía por translocación y trisomía libre fue de 0,02.
En el análisis de la edad gestacional (EG), se evidenció no independencia entre la variable cariotipo normal y anormal (X2p<0,05), con un aumento de la frecuencia de cariotipos anormales a menor edad gestacional. La media de edad gestacional para cariotipos normales fue de 10,49 semanas, mientras que para los cariotipos anormales fue 9,44 semanas, siendo esta diferencia estadísticamente significativa (t de student p<0,05). De todas las gestaciones con EG menor a 12 semanas, 72,9% presentaron cariotipos anómalos, a diferencia de las gestaciones mayores de 12 semanas, en las cuales el 53% tuvieron cariotipos anómalos.
Discusión
Este estudio transversal muestra la experiencia del Laboratorio de Citogenética del Instituto de Medicina Genética con respecto a las pruebas de citogenética en abortos en un periodo de 17 años; siendo una de las series más grandes descritas tanto en nuestro país como en América Latina. Se evaluó 2 319 casos de abortos espontáneos ocurridos entre enero de 1996 y diciembre 2013.
Dentro de las causas descritas en abortos espontáneos, las anomalías cromosómicas representan un porcentaje considerable; aunque este varía según los diferentes estudios(5,17,18). De los 2 319 casos incluidos en esta investigación, en 68,8% se encontró alguna alteración cromosómica; este valor está por encima de lo descrito en la literatura actual(1,19); esto podría deberse a que la mayoría de pacientes referidas era mayor de 35 años (66% de todas las pacientes).
Abortos y cariotipo normal
Un tercio de los estudios (31,2%) fueron reportados como cariotipos normales. La relación de sexo cromosómico fue diferente a 1 (XX:XY de 1,2), con un predominio del género femenino, de manera similar a lo reportado en otras series(20); este hallazgo podría ser generado por la concepción de un espermatozoide 23,X que duplica su genoma al penetrar un ovulo sin núcleo, lo que determina la formación de una mola hidatiforme que conlleva a alteraciones epigenéticas debidas a la presencia de una única dotación parental del genoma(21,22).
Abortos y cariotipo anormal
Se consideraron cariotipos anormales a todos aquellos con alguna alteración, ya fuera numérica y/o estructural. Las alteraciones más frecuentes fueron las anomalías numéricas por ganancia o pérdida de cromosomas en número aneuploide o poliploide (87,5%), seguidas de los cariotipos mosaicos (5,5%). Mientras que los cariotipos con alteraciones simultáneamente estructurales y numéricas y aquellos con alteraciones estructurales únicamente, fueron los menos frecuentes (3,5% y 3,5%, respectivamente).
Anomalías numéricas
1. Trisomías
Las trisomías autosómicas son las alteraciones cromosómicas más frecuentes en los reportes mundiales(17,23-25). En nuestra serie representaron el 58,4% (931/1 595) de todos los cariotipos con alteraciones cromosómicas en general. Existen múltiples teorías sobre el origen de las trisomías. Se asume que son generadas por errores de la segregación durante la meiosis, principalmente materna; estos errores se deben a un proceso de recombinación anómala con falla en la formación del quiasma, con separaciones tempranas de las cromátides durante este proceso de división reductora. Se ha sugerido además que la edad materna tardía se correlaciona también con recombinaciones atípicas, ya que la maquinaria de división es menos eficiente y más susceptible a errores. Pero, esta hipótesis no ha sido completamente comprobada, ya que no se ha encontrado diferencia entre el número de quiasmas en cigotos formados en gestaciones con trisomía del cromosoma 21 relacionados con un incremento de la edad materna comparados con cigotos normales. Otra hipótesis asume que el mosaicismo gonadal estaría involucrado en la génesis de aneuploidías (low-level ovarian mosaicism), aunque los resultados obtenidos en experimentos no son concluyentes(11,26).
La trisomía del cromosoma 16 es la más frecuente de las anomalías numéricas(23), lo cual se confirma en nuestra serie (23,3%, n=218), seguida de la trisomía del cromosoma 22 (15,9%, n=149). Se ha demostrado que ambas trisomías se deben a problemas durante la segregación en la meiosis 1 y están poco relacionadas con la recurrencia en las siguientes gestaciones(11,13), a diferencia de las trisomías de los cromosomas 13, 18, 21 que se ha visto tienen más riesgo de recurrencia. La trisomía menos frecuente fue la del cromosoma 19 (0,4%, n=4) y no se encontraron trisomías del cromosoma 1, lo cual concuerda con lo descrito en otras series(2,27).
La frecuencia de trisomía de los cromosomas 21, 13 y 18 fue 8,2%, 8,1% y 4,1%, respectivamente. El porcentaje descrito de trisomía 21 es menor al reportado en la serie de Salazar y col.(2), pero la frecuencia de las trisomías 13 y 18 es similar a las descritas en otras series(5,10,12). Con respecto a las trisomías, se considera dos hechos importantes: estas provienen principalmente de errores de la meiosis materna, y son más frecuentes los de meiosis I frente a meiosis II(10).
2. Trisomías Dobles
La presencia de trisomías dobles es rara; la mayoría se abortan y, generalmente, a la evaluación morfológica se encuentran sacos vacíos, aunque las trisomías dobles que comprometen los cromosomas 13, 18, 21 pueden completar la gestación y llegar a nacer(28). Y aunque poco se conoce acerca de los mecanismos moleculares en las trisomías dobles, se sabe que están relacionados con edad materna avanzada, antecedente de una gestación con aneuploidía, mosaicismo gonadal en los padres y otros factores asociados al incremento de riesgo de errores en la meiosis. En nuestra serie, 4,4% de los cariotipos con aneuploidías presentaron trisomías dobles (n=51), lo que está por encima de los valores descritos en la literatura, que van de 0,21 a 2,8%. Con respecto a los cromosomas frecuentemente involucrados, se describe el 15, 16, 18 y 21, siendo el 21 el predominante(28,29).
En nuestra serie, los más frecuentemente comprometidos fueron 13, 15, 16, 20, 22, y 21, con gran predominancia del cromosoma 21; los pares más descritos fueron 16-21 y 21-22. En la literatura se excluye a los cromosomas 1 y 19. Cabe resaltar que el cromosoma 1 tiene la mayor cantidad de genes, mientras que el cromosoma 19 tiene la mayor densidad génica, por lo que las anomalías de estos cromosomas harían inviable una gestación(29). Nuestra serie confirma este dato, ya que no se describió trisomías dobles que incluyeran los cromosomas 1 y 19; pero, a diferencia de otras series donde describen trisomías dobles que incluyen a los cromosomas 6 y 11(30), aquí no se tuvo casos que los incluyeran. Se encontró un caso de 3 y 17, combinación que contiene el cromosoma 3 que antes no era considerado dentro de las descripciones(28), y que la revisión de Micale y col. describe como un caso nuevo(29).
3. Monosomías
En la monosomía del cromosoma X, caracterizada por la pérdida del segundo cromosoma sexual, se ha evidenciado en 80% la pérdida del cromosoma sexual paterno(4). En nuestra serie, 15% de los casos de aneuploidías presentó monosomía del cromosoma X (n=174), lo cual está ligeramente por encima de los datos descritos en los reportes previos(2,23,27). Con respecto a las monosomías autosómicas, estas son raramente descritas; en nuestra serie se encontró 4 casos (0,3%) de monosomías autosómicas, exclusivas del cromosoma 21.
4. Poliploidías
Las poliploidías están descritas como la segunda causa en frecuencia dentro de las anomalías numéricas. En nuestra serie representaron un 16,8% del total de cariotipos con anomalías numéricas, siendo también la segunda causa en frecuencia. Dentro de las poliploidías, las triploidías son las más descritas, representando un 81,7% (n=192) de todas las poliploidías, mientras que las restantes fueron las tetraploidías en 18,3% (n=43).
El 60% de las triploidías fue 69,XXY, 38% fue 69,XXX y solo el 2% restante 69,XYY. La carga extra haploide puede ser materna, por la retención del cuerpo polar (primer o segundo cuerpo polar) y se relacionan con la presencia de placentas bien conformadas y fetos con múltiples malformaciones y severo retraso de crecimiento o fetos ausentes. Si la carga extra es paterna (doble fertilización espermática en un ovulo normal), el crecimiento fetal suele ser normal o tener retraso de crecimiento leve a moderado, simétrico, con placenta con degeneración hidrópica o molar. De las tetraploidías, 68% fueron 92,XXXX, 31% 92,XXYY y el 2% restante 92,XYYY. Las tetraploidías pueden producirse por la fertilización de 2 espermatozoides (dispermia) y la endorreplicación del núcleo materno, y se denomina cigoto tetraploide; mientras que la tetraploidía poscigótica se dará por la endorreplicación del núcleo diploide. El cariotipo 92,XYYY es el menos frecuente y se inicia a partir de la trispermia, que es la fertilización de 3 espermatozoides y un núcleo materno. La búsqueda de la carga extra necesita la correlación con las características morfológicas del aborto. En la actualidad, el uso de marcadores moleculares (STR) podrían ayudar a determinar estos orígenes, que aportarían en la asesoría genética de estos casos(31,32).
Anomalías estructurales
Las anomalías estructurales, rearreglos intercromosómicos (que implican dos cromosomas diferentes) e intracromosómicos (rearreglos dentro de un cromosoma), a diferencia de las anomalías numéricas, se relacionan con probabilidad de recurrencia más alta en la siguiente gestación y también con infertilidad en los padres. Es por eso realizar obligatoriamente estudios de cariotipo a los padres de aquellos abortos en los cuales se evidenciaron este tipo de alteraciones(14,33). El 3,5% de todos los cariotipos anómalos presentaron alteraciones cromosómicas estructurales en nuestra serie, como defecto único; este porcentaje no incluye los catalogados como mosaicos o los cariotipos con anomalías numéricas y estructurales complejas. Este valor se encuentra dentro de los parámetros descritos en las diferentes series(2,17,33). Dentro de los rearreglos intracromosómicos, las deleciones fueron más frecuentes y comprometieron los cromosomas 5, 6, 13, 15 y 18; menos frecuentes fueron las inversiones (cromosomas 1 y 8) y los isocromosomas (cromosomas 7 y 18). Los rearreglos intercromosómicos (translocaciones robertsonianas, no robertsonianas y sus derivados) representan el 77,2% de todos los rearreglos estructurales encontrados. En individuos adultos se describe que las translocaciones robertsonianas equilibradas (que implican la fusión de dos cromosomas acrocéntricos) son las anomalías más frecuentes, encontrándose en por lo menos en 1 de cada 1 000 individuos, y de estas las translocaciones der(13q;14q) y der(14q;21q); lo cual tendría correlación con nuestra serie, ya que las translocaciones robertsonianas no balanceadas fueron las anomalías estructurales más descritas (30,4%) y, de estas, la más frecuente fue 46,XX,+14,der(13;14)(q10;q10), que conlleva a trisomía del cromosoma 14(14).
De los 17 casos de translocación robertsoniana no balanceada, la trisomía por translocación más frecuente fue la del cromosoma 14 con 7 casos (41,2%), seguida de la trisomía del cromosoma 13 con 6 casos (35,3%) y 4 casos de trisomía 21 (23,5%), lo cual coincide con lo reportado en la literatura. La relación entre trisomía por translocación y trisomía libre fue de 0,02. Aunque la proporción de trisomías por translocación es muy baja, es importante su diagnóstico y el estudio complementario de los padres, ya que estos rearreglos podrían ser resultado del desbalance heredado de la segregación de los cromosomas derivados respectivos.
Mosaicos
De todos los casos descritos dentro del rubro cariotipo anormal, 5,5% fueron cariotipos mosaicos que se caracterizan por la presencia de diferentes líneas celulares originadas en un mismo cigoto. En nuestra serie, 56,3% de los mosaicos llevaba una línea femenina normal y siendo la otra línea masculina normal (9,8%), aneuploide (58,8% con predominio de la trisomía del cromosoma 16), poliploide (20,2%) y con rearreglos (11,2%). El 15% de los cariotipos mosaico tuvo una línea masculina normal y como segunda línea aneuploidías (69,2%), poliploidías y anomalías estructurales, en porcentajes similares (15,4%). Los casos restantes fueron mosaicos con líneas no normales (15%) con combinaciones aneuploides y poliploides (92%) y un caso de mosaico con ambas líneas con anomalías estructurales (8%).
Los casos más frecuentes fueron 46,XX/47,XX,+16 (8% de todos los casos de mosaicos), 46,XX/47,XX,+22, 46,XX/92,XXXX, cada uno representando el 6,9%, respectivamente.
El hallazgo de más de una línea celular puede tener varias explicaciones. La mayoría de las veces se trata de un mosaicismo verdadero, originado por una división anómala del cigoto posconcepción; también puede relacionarse con una gestación que originalmente fue gemelar, aunque uno de los gemelos no llegó a hacerse visible. En caso se encuentre más de una línea celular, es importante revisar más de una placa de cultivo o utilizar otros métodos para descartar alguna alteración cromosómica ocurrida in vitro, que estaría presente solo en uno de los cultivos. Cuando una de las líneas celulares muestra un cariotipo femenino normal, debe usarse los métodos necesarios para descartar que esta provenga de contaminación con células placentarias de origen materno.
Cariotipos con anomalías numéricas y estructurales múltiples
Son aquellos cariotipos que presentaron más de dos tipos diferentes de alteraciones, ya sean numéricas y/o estructurales. Se asume que estos errores se producen en etapas muy tempranas de la concepción y son gestaciones inviables. La presencia de una poliploidía con pérdida o ganancia de cromosoma en número no euploide fue el grupo de mayor frecuencia, con una predominancia de las triploidías frente a las tetraploidías. Dentro de las anomalías estructurales reportadas se encuentran translocaciones robertsonianas y no robertsonianas con un cariotipo diploide o poliploide. Solo se encontró un caso de monosomía autosómica del cromosoma 8 acompañada de la trisomía del cromosoma 14.
Abortos y edad materna
Se evidenció el incremento de la proporción de cariotipos anormales conforme el aumento de la edad materna (X2p<0,05), lo cual coincide con otros reportes. En general, la edad materna avanzada (con un punto de corte de 35 años) es un factor de riesgo para la pérdida fetal(3,8).
Andersen y col. determinaron que en mujeres mayores de 30 años existe riesgo incrementado de pérdidas fetales y que, hacia los 42 años, más de la mitad de gestaciones en general se perderán por abortos espontáneos, embarazos ectópicos o natimuertos. Se determinó que el antecedente de abortos espontáneos significaba un incremento de riesgo para pérdidas gestacionales. Y en mujeres de edad avanzada, en ausencia de mala historia obstétrica, el riesgo de pérdidas gestacionales también se vio incrementado, concluyendo que la edad materna avanzada es un factor de riesgo independiente para la pérdida gestacional y muerte fetal(3).
Fretts y col. concluyen que las mujeres mayores de 35 años tienen el doble de riesgo de pérdidas fetales con respecto a mujeres más jóvenes, aunque dentro de las variables consideradas no incluyen las características genéticas de estas pérdidas(8).
En nuestra serie, la edad materna promedio en el caso de cariotipos normales fue de 33,4 años, siendo superior al promedio de edad reportado en otros casos. Esto podría deberse a que el grupo de casos evaluados corresponde a muestras de pacientes referidas por alguna causa de sospecha, como mala historia obstétrica, evaluaciones ecográficas con hallazgos de malformaciones o historia de infertilidad en uno de los progenitores. En el caso de cariotipos anormales, el promedio de edad fue mayor (34,8 años). Siendo esta diferencia estadísticamente significativa (t de student p<0,05), lo que concuerda con lo reportado en la bibliografía acerca de que las anomalías cromosómicas son más frecuentes a mayor edad materna. El porcentaje de cariotipos anormales en gestantes menores de 29 años fue 58,1%, entre 30 y 34 años 64,5%, entre 35 y 39 años 73,3%, y en mayores de 40 años llegó a representar el 80,3% de todos los cariotipos evaluados en este grupo. Ello concuerda con otros reportes e implicaría que la edad materna avanzada sí está relacionada con el incremento de anomalías cromosómicas. Las aneuploidías fueron las anomalías numéricas más relacionadas con la edad materna. En el grupo de edad materna mayor a 40 años, las aneuploidías representaron el 94% de todas las anomalías numéricas descritas para este grupo etario (X2 p<0,05).
De las aneuploidías, las trisomías en general no son independientes de la edad materna (X2p<0,05). Aunque, en nuestra serie la trisomía más frecuente (trisomía del cromosoma 16) no sigue este patrón. La media de edad materna para los casos de trisomía del cromosoma 16 fue de 33,9 años, mientras que la media en el resto de trisomías fue de 36 años. La trisomía del cromosoma 16 es de origen eminentemente materno por una disminución en la recombinación y, a diferencia de otras trisomías, se ha hallado que no hay una alta proporción de bivalentes no intercambiados. Su relación con la edad no es muy descrita en otras series, ya que suelen relacionar la variable trisomía y edad materna, mas no realizan un análisis especifico por cromosoma(11).
Las trisomías dobles se comportan de manera similar a las trisomías simples, con respecto a la edad materna (X2p<0.05); la edad media para este grupo fue de 38,7 años.
No se ha llegado a correlacionar si el riesgo de recurrencia de las trisomías 13, 18 y 21 se relaciona con el incremento de la edad materna. De Souza y col. describen que tanto mujeres menores de 35 años como mayores de 35 años tienen el riesgo similar en cuanto al riesgo de recurrencia de trisomía del cromosoma 21 en una gestación siguiente; en algunos casos, el riesgo de las mujeres menores de 35 años parece ser mayor que el de las mujeres mayores de 35 años. Por lo cual, sin considerar la edad materna, una gestación con trisomía autosómica per se significa un riesgo ‘incrementado’ para la siguiente gestación(10).
Comparado con el grupo de aneuploidías, las monosomías del cromosoma X, triploidías y tetraploidías no dependieron de la edad materna, lo cual se correlaciona con lo descrito en la literatura actual(2,27).
De la misma manera, las anomalías estructurales fueron independientes de la edad materna en todos los casos (X2p>0,05), lo cual es similar a lo descrito en la literatura; cabe resaltar que en esta serie no se analizaron los datos de cariotipos en los padres.
Abortos y edad gestacional
En el análisis de la edad gestacional, considerada como el número de días desde la última menstruación hasta el momento de la finalización de la gestación, se evidenció aumento de la frecuencia de cariotipos anormales a menor edad gestacional (X2p<0,05). La media de edad gestacional para cariotipos normales fue de 10,49 semanas, mientras que para los cariotipos anormales fue 9,44 semanas, siendo esta diferencia estadísticamente significativa (t de student p<0,05). Muchos estudios describen que a menor edad gestacional hay mayor frecuencia de pérdidas gestacionales, así como a menor edad gestacional (<10 semanas) hay mayor probabilidad de abortos por aneuploidías(20). En nuestro estudio se evidenció un predominio de cariotipos anormales en las gestaciones menores de 12 semanas, pues 72,9% presentaron cariotipos anómalos a diferencia de las gestaciones mayores de 12 semanas, donde esta cifra disminuye a 53%.
Conclusiones
De todo lo analizado, con respecto a su impacto en cuanto al manejo de la pérdida gestacional y pronóstico de la pareja podemos concluir:
- La mayoría de abortos espontáneos se relaciona con errores cromosómicos en el concebido.
- La anomalía cromosómica más frecuente fue la trisomía autosómica, la cual no es heredada y está relacionada con edades maternas avanzadas (mayor de 35 años) y edades gestacionales tempranas (menor de 10 semanas).
- Otras anomalías numéricas (poliploidías, monosomías) y anomalías estructurales son independientes de la edad materna.
- La presencia de anomalías estructurales obliga a realizar estudios de cariotipo en ambos padres, para determinar los probables riesgos de recurrencia y establecer individualmente el manejo de estas parejas en riesgo.
- El cariotipo es un herramienta importante y fundamental en el estudio de los abortos, principalmente en el caso de los abortos recurrentes, ya que brinda información valiosa sobre las causas y posible recurrencia en estos casos.
- En presencia de cariotipos normales, es necesario ampliar el ámbito del estudio mediante el uso de pruebas de mayor sensibilidad de citogenética molecular, como la hibridación genómica comparada (CGH) o array de cromosomas; también será necesario realizar otros estudios adicionales para descartar causas no cromosómicas de los abortos (causas infecciosas inmunológicas, endocrinológicas, hematológicas, entre otras).
Fuente de financiamiento: autofinanciado
Declaración de conflictos de interés: ninguno
Aprobación Comité de Ética Universidad Peruana Cayetano Heredia
Este artículo es parte de la tesis: Mora-Alferez AP. Frecuencia de anomalías cromosómicas en restos de abortos espontáneos en el Instituto de Medicina Genética en el periodo 1996-2013 (Tesis de segunda especialidad). Facultad de Medicina. Universidad Peruana Cayetano Heredia. 2014.
Referencias Bibliográficas
1. Goddijn M, Leschot NJ. Genetic aspects of miscarriage. Baillières Best Pract Res Clin Obstet Gynaecol. 2000;14(5):855-65. doi:10.1053/beog.2000.0124. [ Links ]
2. Salazar UA, Álamos BC, Arriagada AM, Selman CE. Estudio citogenético en 677 casos de aborto espontáneo; Cytogenetic study of 677 spontaneous abortions. Rev ANACEM Impresa. 2011;5(2):74-7. [ Links ]
3. Andersen A-MN, Wohlfahrt J, Christens P, Olsen J, Melbye M. Maternal age and fetal loss: population based register linkage study. BMJ. 2000;320(7251):1708-12. doi: http://dx.doi. org/10.1136/bmj.320.7251.1708. [ Links ]
4. Rimoin DL, Pyeritz RE, Korf B. Emery and Rimoin’s Principles and Practice of Medical Genetics. Academic Press; 2013:4669 p.
5. Pacheco J, de Michelena MI, Orihuela P. Enfoque actual del aborto recurrente. An Fac Med. 2009;70(2):123-34. [ Links ]
6. Bianco K, Caughey AB, Shaffer BL, Davis R, Norton ME. History of miscarriage and increased incidence of fetal aneuploidy in subsequent pregnancy. Obstet Gynecol. 2006;107(5):1098-02. doi: 10.1097/01.AOG.0000215560.86673.22. [ Links ]
7. Regan L, Braude PR, Trembath PL. Influence of past reproductive performance on risk of spontaneous abortion. BMJ. 1989;299(6698):541-5. DOI: http://dx.doi.org/10.1136/ bmj.299.6698.541. [ Links ]
8. Fretts RC, Schmittdiel J, McLean FH, Usher RH, Goldman MB. Increased maternal age and the risk of fetal death. N Engl J Med. 1995;333(15):953-7. DOI: 10.1056/ NEJM199510123331501. [ Links ]
9. Nomenclature ISC on HC. ISCN 2013: An International System for Human Cytogenetic Nomenclature (2013). Karger Medical and Scientific Publishers; 2013:148 p. [ Links ]
10. De Souza E, Halliday J, Chan A, Bower C, Morris JK. Recurrence risks for trisomies 13, 18, and 21. Am J Med Genet A. 2009;149A(12):2716-22. doi: 10.1002/ajmg.a.33099. DOI: 10.1002/ajmg.a.33099. [ Links ]
11. Garcia-Cruz R, Casanovas A, Brieño-Enríquez M, Robles P, Roig I, Pujol A, et al. Cytogenetic analyses of human oocytes provide new data on non-disjunction mechanisms and the origin of trisomy 16. Hum Reprod Oxf Engl. 2010;25(1):179-91. doi: 10.1093/humrep/dep347. [ Links ]
12. Carp H, Toder V, Aviram A, Daniely M, Mashiach S, Barkai G. Karyotype of the abortus in recurrent miscarriage. Fertil Steril. 2001;75(4):678-82. doi:10.1016/S0015-0282(00)01801-X. [ Links ]
13. Hassold T, Hall H, Hunt P. The origin of human aneuploidy: where we have been, where we are going. Hum Mol Genet. 2007;16(R2):R203-8. doi: 10.1093/hmg/ddm243. [ Links ]
14. Shaffer LG, Lupski JR. Molecular mechanisms for constitutional chromosomal rearrangements in humans. Annu Rev Genet. 2000;34(1):297-329. DOI: 10.1146/annurev.genet.34.1.297. [ Links ]
15. Campana M, Serra A, Neri G, Reynolds JF. Role of chromoso me aberrations in recurrent abortion: a study of 269 balanced translocations. Am J Med Genet. 1986;24(2):341-56. DOI: 10.1146/annurev.genet.34.1.297. [ Links ]
16. Madan K. Balanced complex chromosome rearrangements: reproductive aspects. A review. Am J Med Genet A. 2012;158A(4):947-63. doi: 10.1002/ajmg.a.35220. [ Links ]
17. de Michelena MI, Díaz A, Paredes D, Rodríguez O, Quispe E, Klein. Estudio cromosómico en el aborto espontáneo y su aplicación clínica. Rev Per Ginecol Obstet. 2007;53(2):124-9. [ Links ]
18. Rolnik DL, Carvalho MHB de, Catelani ALPM, Pinto APAR, Lira JBG, Kusagari NK, et al. Cytogenetic analysis of material from spontaneous abortion. Rev Assoc Médica Bras. 2010;56(6):681-3. http://dx.doi.org/10.1590/S010442302010000600017. [ Links ]
19. Suzumori N, Sugiura-Ogasawara M. Genetic factors as a cause of miscarriage. Curr Med Chem. 2010;17(29):3431-7. DOI: 10.2174/092986710793176302. [ Links ]
20. Bastos R, Ramalho C, Dória S. [Prevalence of chromosomal abnormalities in spontaneous abortions or fetal deaths]. Acta Médica Port. 2014;27(1):42-8. [ Links ]
21. Castillo Taucher S, Soto F, María A, Paulos Millanao A, de la Rosa Rebaza E. Estudio cromosómico en abortos espontáneos. Rev Chil Obstet Ginecol. 2014;79(1):40-6. http://dx.doi. org/10.4067/S0717-75262014000100007. [ Links ]
22. Karaoguz MY, Nas T, Konaç E, Ince D, Pala E, Menevse S. Is cytogenetic diagnosis of 46,XX karyotype spontaneous abortion specimens erroneous? Fluorescence in situ hybridization as a confirmatory technique. J Obstet Gynaecol Res. 2005;31(6):508-13. http://dx.doi.org/10.4067/S071775262014000100007. [ Links ]
23. López ÁGA, Huerta SB, Galván RH, Posadas RA, del Ángel AG, González PG. Diagnóstico citogenético en aborto espontáneo del primer trimestre. Ginecol Obstet Mex. 2011;79(12):779-84. [ Links ]
24. Vega Conejo V, Viñas Portilla CI, Lantigua Cruz A, del Monte Sotolongo E. Defectos cromosómicos y fallas reproductivas: Un estudio en 452 pacientes. Rev Cuba Obstet Ginecol. 1999;25(1):19-23. [ Links ]
25. Muñetón Peña C, Peña CMM, Castro JLR, Jaramillo BA, Palacio GV. Estudio citogenético y morfológico en productos de aborto espontáneo procedentes de diferentes servicios de ginecoobstetricia de la ciudad de Medellín. Iatreia. 1998;11(4):145-61. [ Links ]
26. Morris CR, Haigh S, Cuthbert G, Crosier M, Harding F, Wolstenholme J. Origin of trisomy: no evidence to support the ovarian mosaicism theory. Prenat Diagn. 2012;32(7):668-73. doi: 10.1002/pd.3885. [ Links ]
27. Choi TY, Lee HM, Park WK, Jeong SY, Moon HS. Spontaneous abortion and recurrent miscarriage: A comparison of cytogenetic diagnosis in 250 cases. Obstet Gynecol Sci. 2014;57(6):518-25. DOI: 10.5468/ogs.2014.57.6.518. [ Links ]
28. Diego-Alvarez D, Ramos-Corrales C, Garcia-Hoyos M, Bustamante-Aragones A, Cantalapiedra D, Diaz-Recasens J, et al. Double trisomy in spontaneous miscarriages: cytogenetic and molecular approach. Hum Reprod. 2006;21(4):958-66. doi: 10.1093/humrep/dei406. [ Links ]
29. Micale M, Insko J, Ebrahim SAD, Adeyinka A, Runke C, Van Dyke DL. Double trisomy revisited—a multicenter experience. Prenat Diagn. 2010;30(2):173-6. DOI: 10.1002/pd.2429. [ Links ]
30. Ai-Kouatlv HB, Johnson C, Skupski D, Lita Alonso M. Double Trisomy in spontaneous abortions—an 11 year review. Genet Med. 2000;2(1):91-91. DOI: 10.1002/pd.2429. [ Links ]
31. Robinson WP, McFadden DE, Stephenson MD. The origin of abnormalities in recurrent aneuploidy/polyploidy. Am J Hum Genet. 2001;69(6):1245-54. doi: 10.1086/324468. [ Links ]
32. Sundvall L, Lund H, Niemann I, Jensen UB, Bolund L, Sunde L. Tetraploidy in hydatidiform moles. Hum Reprod. 2013;28(7):2010-20. doi: 10.1093/humrep/det132. [ Links ]
33. Farcas S, Belengeanu V, Popa C, Stoicanescu D, Stoian M, Veliscu M, et al. Role of chromosomal translocations in recurrent spontaneous abortion. Timisoara Med J. 2007;2:117 [ Links ]
Correspondencia:
A. Pamela Mora-Alferez Instituto de Medicina Genética, Lima, Perú Los Antares Nro. 320, Torre A, Of.901, Santiago de Surco, Lima, Perú Teléfonos: 272-2444 / 271-6776.
Artículo recibido el 16 de febrero de 2016 y aceptado para publicación el 11 de marzo de 2016.