Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.62 no.2 Lima abr./jun. 2016
SIMPOSIO MEDICINA FETAL
Terapéutica fetal no invasiva
Non-invasive fetal therapy
Alberto Sosa Olavarría1
1 Médico Cirujano, Especialista en Obstetricia y Medicina Materno Fetal, Doctor en Ciencias Médicas, Profesor Titular Jubilado de Obstetricia y Ginecología, Universidad de Carabobo, Valencia, Venezuela
Resumen
La terapia farmacológica fetal puede definirse como cualquier tratamiento prenatal administrado a la madre con la indicación primaria para mejorar los resultados perinatales o a largo plazo para el feto o el recién nacido. Esta revisión proporciona una actualización de los tratamientos farmacológicos dirigidos exclusivamente al feto con anomalías. Las anomalías fetales con posibilidad de farmacoterapia prenatal constituyen un grupo heterogéneo de condiciones estructurales, tales como las anomalías del cerebro y de la columna, prevención de la enfermedad hialina del pulmón, anomalías endocrinas y metabólicas, incluyendo la malformación adenomatoidea quística congénita (CCAM), hiperplasia suprarrenal congénita, bloqueo congénito de corazón, taquiarritmias fetales, errores innatos del metabolismo, trastornos de la tiroides fetal y polihidramnios. Hasta la fecha, la mayor parte de la farmacoterapia para anomalías fetales ha sido evaluada en estudios retrospectivos, no controlados. El camino a seguir será con un enfoque basado en la evidencia para intervenciones farmacológicas prenatales.
Palabras clave: Terapias Fetales; Farmacología Clínica.
Abstract
Fetal pharmacologic therapy can be defined as any prenatal treatment administered to the mother with the primary indication of improving perinatal or long-term outcomes for the fetus and the newborn. This review provides an update on the pharmacological therapies for the fetus with anomalies. Fetal anomalies targeted with prenatal pharmacotherapy are a heterogeneous group of structural, endocrine, and metabolic conditions, including brain and spine anomaly, hyaline membrane disease prevention, congenital cystic adenomatoid malformation (CCAM), congenital adrenal hyperplasia, congenital heart block, fetal tachyarrhythmia, inborn errors of metabolism, fetal thyroid disorders, and polyhydramnios. To date, most of the pharmacotherapy for fetal anomalies has been evaluated only in retrospective, uncontrolled studies. Future evaluation will be determined on evidence-based approach to prenatal pharmacological interventions.
Keywords: Fetal therapy; Pharmacologic Concepts.
Introducción
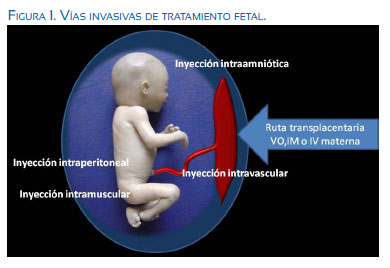
Desde que Albert W. Liley realizó la primera transfusión intraperitoneal fetal en 1963(1), seguida del trabajo de Graham Liggins(2), quien con su sólido estudio permitió entrar de manera pionera a la Obstetricia en el campo de la medicina basada en la evidencia - MBE, logró demostrar la inducción de la madurez fetal mediante el uso de esteroides administrados a la madre; que culmina con la demostración de la intervención farmacológica más conocida y ampliamente estudiada como lo es la prevención de defectos del tubo neural mediante la administración de ácido fólico preconcepcional; finalmente, con el extraordinario desarrollo de la imagenología ultrasonográfica embrio-fetal, han sido muy importantes y trascendentes los avances en el diagnóstico intrauterino tanto de malformaciones como enfermedades capaces de afectar al feto. Los investigadores se han dado a la tarea de idear e implementar estrategias con el objetivo de tratar muchas de estas entidades por diversas vías (figura 1), pudiendo agruparse las mismas de manera didáctica como invasivas y no invasivas. Las primeras son clasificadas bajo el concepto de cirugía fetal mínimamente invasiva, que son tratadas en capítulo aparte.
El tratamiento no invasivo o médico del feto (farmacoterapia fetal) incluye aspectos de prevención y curación, y la vía fundamental la constituye la administración de medicamentos a la madre con el fin de que por vía transplacentaria logren el impacto deseado sobre el feto. La prevención primaria debe ser considerada el objetivo principal de toda acción de salud en este campo. Es necesario investigar factores de riesgo, sobre los que se pueda influir favorablemente. Estos, en nuestro medio, son: edad materna avanzada, madres adolescentes, embarazos no deseados, deficiente control prenatal, automedicación, alcohol, tabaco, drogadicción, dieta deficiente, factores ocupacionales, enfermedades infecciosas y enfermedades crónicas maternas(3). La prevención primaria de las alteraciones genéticas es muy complicada pero no imposible. Existen principalmente dos posibilidades: el consejo genético a familias de riesgo y las técnicas de reproducción asistida con diagnóstico pre-implantación. La terapéutica genética continúa siendo objeto de investigación.
En la prevención primaria de las enfermedades fetales conviene tener presente lo conveniente de evaluar la salud preconcepcional en ambos progenitores, planificar la gestación en edades de menor riesgo, recurrir a las inmunizaciones contra virus vinculados a malformaciones, emplear el acido fólico como medida preventiva antes del embarazo, realizar un control prenatal adecuado con realización de estudios de tamizaje, evitar el consumo de medicamentos o reducirlos al máximo y siempre por indicación facultativa, evitar el alcohol, tabaco y drogas, ejecutar un plan de vida sana con dieta balanceada y tranquilidad psíquica.
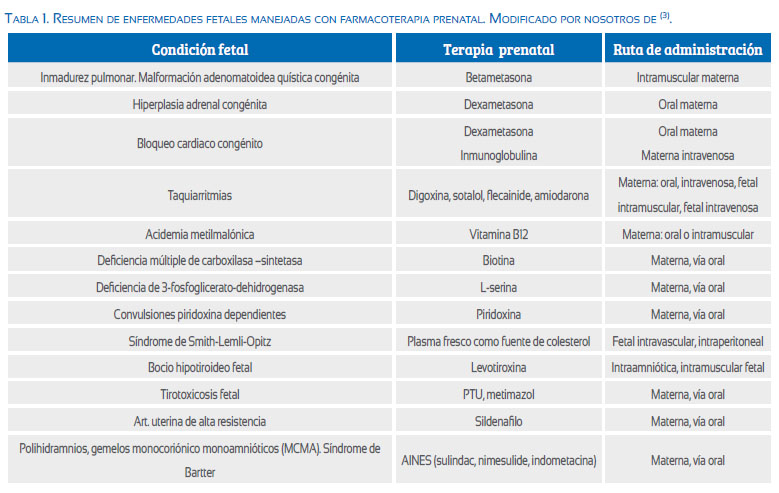
En la tabla 1, de Hui y Branchi(3) modificada por nosotros, se resume las acciones farmacológicas empleadas hasta el momento en diversas entidades capaces de afectar al feto. A continuación abordaremos las acciones terapéuticas de carácter preventivo y luego las de objetivo curativo.
I. Farmacoterapia fetal preventiva
Ácido fólico
El ácido fólico es una vitamina del grupo de la vitamina B12 necesaria para la división celular, porque cumple un rol fundamental en la síntesis de ácidos nucléicos y de algunos aminoácidos. En su forma natural de folato, se encuentra en algunos alimentos como el hígado de vaca, las verduras de hojas verdes, las naranjas y las legumbres. La forma sintética es el ácido fólico que se utiliza en suplementos vitamínicos y para fortificar alimentos. Diferentes estudios han demostrado que la ingesta materna de una suplementación diaria de ácido fólico reduce el riesgo que el niño tenga espina bífida y otros defectos del sistema nervioso central, así como cardiopatías congénitas, y posiblemente labio leporino, reducciones de extremidades, y otros defectos congénitos. De los múltiples estudios realizados hasta la fecha, los que indudablemente mostraron mayor evidencia del rol protector del ácido fólico en relación con los DCTN fueron los estudios de intervención citados por Cortez(4) y realizados por Smithells y col, MRC Vitamin Study Research Group y Czeizel y Dudas. Los dos primeros demostraron la disminución de la recurrencia de los DCTN entre 75 y 91% al utilizar ácido fólico en dosis de 4 mg diarios en mujeres que habían tenido un hijo previo con este tipo de defectos. El tercer estudio demostró que el uso de ácido fólico en forma preconcepcional permitía también disminuir el riesgo de ocurrencia, puesto que en el grupo suplementado no ocurrió ningún caso de DCTN, a diferencia del grupo control en el que se observó una ocurrencia cercana a 3 por 1 000, similar a la esperada para la población general. Es por ello que para prevenir estas malformaciones congénitas, la suplementación con ácido fólico debe comenzar un mes antes de la concepción y continuar durante el primer trimestre del embarazo. Pero, como la mayoría de ellos no son programados, se recomienda una ingesta diaria de 0,4 a 0,8 mg en todas las mujeres de edad reproductiva.
Las pacientes que presentan mayor riesgo de tener un bebé con malformaciones neurológicas por fallas en el cierre del tubo neural son quienes tienen antecedentes de un hijo con igual patología y las que toman drogas anticonvulsivantes como carbamazepina y valproato. En estos casos se recomienda dosis elevadas de ácido fólico (4 mg por día) para prevenir malformaciones en futuros embarazos.
En 1992, el Servicio de Salud Pública de los Estados Unidos a través del Center for Disease Control and Prevention (CDC) recomendó que todas las mujeres con posibilidades de embarazo ingirieran una dosis de ácido fólico de 0,4 mg al día(4). En la Argentina, el enriquecimiento de la harina de trigo fue establecido por la Ley No 25.630 sancionada en julio 2002. El Ministerio de Salud mediante la Encuesta Nacional de Nutrición y Salud (ENNyS) evaluó el impacto de esta intervención nutricional universal: entre los años 2004 y 2005 la disminución del riesgo de anencefalia alcanzó 56% y de espina bífida 45%. La fortificación de alimentos ofrece la ventaja de cubrir una gran población a un bajo costo, sin requerir cambios de la conducta alimentaria de la población. Los estudios de costo-efectividad han demostrado el beneficio económico de la fortificación de alimentos, especialmente con niveles altos de fortificación. En 1996, la FDA (Food and Drug Administration) en Estados Unidos determinó que todos los cereales deberían ser enriquecidos con ácido fólico y desde enero de 1998 es obliga toria la fortificación de la harina de panificación que se consume en Estados Unidos. El nivel de fortificación exigido es de 140 mcg de ácido fólico por cada 100 g de harina, aún cuando en la actualidad estas cifras están en discusión y se está planteando niveles de fortificación cercanos a 300 mcg de ácido fólico por cada 100 g de harina, puesto que con los niveles elegidos no se ha logrado una protección adecuada.
Inmadurez pulmonar
El comentario de la BSR(5) abarca tres revisiones Cochrane cuyos objetivos fueron: "evaluar los efectos de la administración de corticoesteroides a la madre antes del parto prematuro anticipado en cuanto a la morbimortalidad fetal y neonatal, la morbimortalidad materna y al niño en etapas posteriores de su vida", "evaluar la efectividad y seguridad de la repetición de dosis de corticoesteroides prenatales", y "evaluar los efectos de diferentes regímenes con corticoesteroides para mujeres con riesgo de parto prematuro". Esta revisión Cochrane se actualizó en 2006, con la inclusión de 21 estudios en los que participaron 3 885 mujeres y 4 269 neonatos. En la revisión se descubrió que la administración de determinados corticoesteroides a mujeres con riesgo de tener un parto prematuro reduce considerablemente los riesgos de complicaciones relacionadas con la prematurez como muerte fetal y neonatal combinada, síndrome de dificultad respiratoria, hemorragia cerebro-ventricular, enterocolitis necrosante, infecciones sistémicas y retraso en el desarrollo durante la niñez. Los beneficios estaban presentes cuando el tratamiento se iniciaba entre las 26 y las 35 semanas de gestación y en los niños que nacían entre 1 y 7 días después de haber comenzado el tratamiento. No se demostraron beneficios cuando el tratamiento comenzó antes de las 26 semanas de gestación, tampoco se observaron beneficios en los recién nacidos antes de las 26 semanas de gestación ni en los que nacieron después de siete días o más de la administración del tratamiento. Uno o más ciclos repetidos de corticoesteroides se asociaron con una reducción de la enfermedad pulmonar severa (riesgo relativo [RR]: 0,60, intervalo de confianza [IC] del 95%: 0,48 a 0,75); morbilidad neonatal severa (RR: 0,79, IC 95%: 0,67 a 0,93). Por otro lado, en un estudio clínico hubo una reducción en el puntaje z de peso al nacer (RR: -0,13, IC 95%: -0,26 a 0,00), y en dos estudios clínicos se registró un mayor riesgo de neonato pequeño para la edad gestacional (RR: 1,63, IC 95%: 1,12 a 2,37). La revisión reveló que la dexametasona, en comparación con la betametasona, redujo la incidencia de hemorragia interventricular (RR: 0,44, IC 95%: 0,21 a 0,92). No se justifica la realización de estudios clínicos adicionales sobre la eficacia del tratamiento prenatal con corticoesteroides. En cambio, la investigación debe concentrarse en métodos para lograr la implementación efectiva de la intervención en diversos ámbitos. También se requieren investigaciones futuras sobre los beneficios y riesgos de los ciclos repetidos de tratamiento con corticoesteroides y el fármaco, la dosis y la vía de administración óptimos.
Dieta
Ácidos grasos poliinsaturados
El estado nutricional materno es bien conocido por ser un factor determinante del crecimiento placentario y fetal. Entre los diferentes nutrientes, ácidos grasos poli insaturados de cadena larga (AGPICL) como el ácido docosahexaenoico (DHA) y ácido araquidónico (ARA) son vitales durante el embarazo para el feto, puesto que son componentes estructurales de los lípidos de la membrana del cerebro y del sistema nervioso central en desarrollo. El desarrollo del feto depende totalmente del suministro de ácido graso esencial proveniente del organismo materno, y una escasez de estos puede resultar en resultado adverso del embarazo; por ello resulta indispensable conocer la frecuencia de consumo de alimentos ricos en ácidos grasos omega-3.
La importancia de los ácidos grasos en el desarrollo infantil ha llevado a varios estudios examinar el estado del ácido graso en las mujeres durante el embarazo, la comparación de la situación de ácidos grasos en embarazadas frente a mujeres no embarazadas y estudios de estado posparto del ácido graso. El embarazo normal está asociado con una dislipidemia fisiológica, por un patrón predominante de hipertrigliceridemia, elevación del colesterol total, del colesterol no-HDL y del índice TG/cHDL. Estas alteraciones lipídicas se relacionan con el índice de masa corporal (IMC) pre-gestacional y con el desarrollo fetal.
Varios estudios(6-8) han reportado la composición de la fracción de fosfolípidos de ácidos grasos durante el embarazo. El porcentaje relativo y la concentración absoluta de DHA en los fosfolípidos del plasma aumentan durante el embarazo temprano. Más adelante, aunque el porcentaje relativo de DHA disminuye, la concentración de DHA permanece estable, o posiblemente aumenta enmascarado por la hemodilución. Hay una disminución rápida de la concentración en el posparto del porcentaje relativo y absoluto del fosfolípido DHA. Aunque los ácidos grasos fosfolípidos representan lípidos estructurales y son biomarcadores de ingesta dietética de ácidos grasos, esta fracción no puede ser el mejor indicador de la disponibilidad de ácidos grasos de transferencia placentaria.
La transferencia a través de la placenta se limita a ácidos grasos no esterificados, y la localización y actividad de la lipoproteína lipasa y triacilglicerol hidrolasa en la placenta ha llevado a sugerir que los triacilgliceroles son la principal fuente de ácidos grasos maternos, aunque también es posible la movilización de otras clases de lípidos circulantes.
En un estudio(6) se observaron en casos con recién nacidos de peso bajo al nacer niveles más bajos de ácidos de grasos omega-3 total eritrocítico materno. Sin embargo, por el contrario, una serie de metaanálisis(7) recientemente informa que suplementos de ácidos grasos omega-3 durante el embarazo no previenen el parto prematuro recurrente en embarazos simples asintomáticos con parto prematuro previo, restricción de crecimiento intrauterino-RCIU recurrente en embarazos simples asintomáticos con RCIU previo; y no reducen la incidencia de parto prematuro ni mejoran el resultado neonatal. Además, suplementos durante el embarazo de omega-3 no se asociaron con la prevención de prematuridad, diabetes gestacional, preeclampsia, restricción del crecimiento intrauterino, pequeño para edad gestacional, depresión posparto o mejor desarrollo de los niños(8).
Sin embargo, afirman que existe una asociación positiva de ácido docosahexaenoico (DHA) materno en el embarazo temprano con peso al nacer(7) y, por lo tanto, sugieren que la suplementación del DHA puede ser útil en la mejora de los resultados del embarazo, afirmando que su estudio demuestra el papel posible de LCPUFA en la etiología de los bebés de peso bajo al nacer desde el principio del embarazo.
Lo más sensato por lo tanto es una dieta con proporciones normales de DHA durante la gestación, la cual puede ser importante para el equilibrio de estado maternal de ácidos grasos.
Consumo de sal
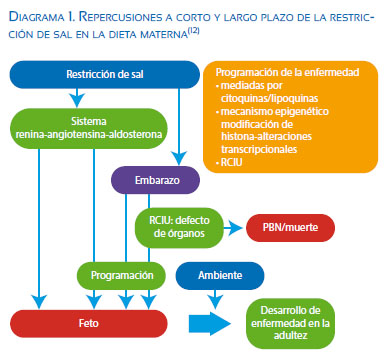
En los seres humanos, es limitada la evidencia directa de la asociación etiológica de la restricción de sal gestacional y retraso del crecimiento de los recién nacidos. Recientemente, sin embargo, ha habido un número creciente de estudios que apoyan la hipótesis(12). Originalmente, se informó que la hiperémesis gravídica suele estar asociada con peso bajo al nacer o parto prematuro y la pérdida de la sal resultante de vómitos se cree pueda ser responsable del peso bajo al nacer. Por otra parte, Shirazki y col., referido por Hiroe Sakuyama(12), encontraron que los recién nacidos con concentraciones de sodio bajo en la sangre resultante de la baja ingesta de sal de su madre durante el embarazo tienen más probabilidades de tener peso bajo al nacer y posiblemente se vinculen a enfermedades en el adulto (diagrama 1).
Errores innatos del metabolismo
La acidemia metilmalónica (MMA)
La existencia de un transporte facilitado materno fetal de casi todas las vitaminas ha estimulado la tentativa terapéutica intraútero con vitaminas (cianocobalamina, biotina, rivoflavina y piridoxina) a fetos con presunto trastorno metabólico dependiente de vitaminas (mutaciones de la aciduria metilmalónica, homocistinuria sensible a B6 y deficiencia múltiple de carboxilaxas). El inconveniente sería el enmascaramiento del diagnóstico neonatal, es decir, no aparecerían los signos bioquímicos que permitan confirmar el diagnóstico inmediatamente después del nacimiento. Las enfermedades relacionadas con los ácidos orgánicos (OAD, del inglés organic acid disorders) son un grupo de enfermedades hereditarias poco usuales(13). Se originan de ciertas enzimas que no funcionan correctamente. Se necesitan varias enzimas para procesar las proteínas de los alimentos que se ingieren para que el cuerpo las utilice. Los problemas con una o más de estas enzimas pueden causar una enfermedad relacionada con los ácidos orgánicos. Las personas que tienen este tipo de enfermedades no pueden descomponer las proteínas correctamente. Esto causa la acumulación de sustancias dañinas en la sangre y en la orina, que pueden afectar la salud, el crecimiento y el aprendizaje.
La acidemia metilmalónica (MMA) ocurre cuando una de estas enzimas especiales está ausente o no funciona correctamente. Sin esta enzima, ciertos aminoácidos y ácidos grasos no pueden utilizarse como es debido. Esto provoca que la glicina, el ácido metilmalónico y otras sustancias dañinas se acumulen en la sangre y en la orina y causen problemas de salud. Es una entidad autosómico recesiva con una incidencia de 1:20 000(13) y afecta a los niños y a las niñas por igual. Cuando ambos padres son portadores, en cada embarazo existe un 25% de probabilidades de que el niño tenga MMA. Existe un 50% de probabilidades de que el niño sea portador, como lo son sus padres. Y, por último, un 25% de probabilidades de que los dos genes desempeñen correctamente sus funciones.
Se han descrito varios tipos de MMA. Algunos pueden tratarse con inyecciones de vitamina B12. Estos tipos se llaman ‘sensibles a la vitamina B12’. Dos tipos de MMA que a menudo pueden tratarse con vitamina B12 son la deficiencia de cobalamina A (CblA) y la deficiencia de coba-lamina B (CblB). Existen otras clases de MMA que no pueden tratarse con vitamina B12. Se llaman ‘no sensibles a la vitamina B12’. Una de ellas es la llamada ‘Mut 0’, cuya causa es la ausencia de una enzima denominada metilmalonilCoA mutasa (MCM). Se promueve el tratamiento prenatal a partir del tercer mes con carnitina (50 mg/kg/d) y glicina (100 mg/kg/d) en madres con fetos en los que se sospecha una aciduria orgánica no sensible a vitaminoterapia (metilmalónica, isovalérica y priopiónica) y aquellos con trastornos de la oxidación de ácidos grasos. Contrariamente a lo que sucede con los trastornos dependientes de vitaminas, en este caso la administración de carnitina actúa como destoxificante y lejos de interferir, aumenta la excreción neonatal de derivados de acilcarnitinas, lo cual favorece el diagnóstico posnatal.
Fenilcetonuria
Es una enfermedad metabólica autosómico recesiva con una incidencia de 1:15 000, debida a un error en la fenilalanina hidrolasa en 98% de los casos y a un defecto metabólico de la biopterina en menos de 2%.
Son 4 las secuelas irreversibles asociadas a concentraciones elevadas de fenilalanina materna en el período preconcepcional y primer trimestre del embarazo(9-11,13): retraso mental, microcefalia, retraso del crecimiento intrauterino y anomalías congénitas fundamentalmente cardiovasculares. Otros defectos congénitos observados en menor cuantía son: atresia esofágica, catarata, sindactilia y dismorfia facial. Las cifras maternas superiores a 20 mg/dL suponen riesgo mayor de cardiopatías, pero niveles de 15 mg/ dL se asocian a retraso mental y microcefalia. La fenilcetonuria es una enfermedad heredita ria, lo cual significa que se transmite de padres a hijos. Ambos padres deben transmitir una copia defectuosa del gen para que el bebé padezca la enfermedad. Los bebés con fenilcetonuria carecen de una enzima denominada fenilalanina hidroxilasa, necesaria para descomponer el aminoácido esencial fenilalanina. La fenilalanina se encuentra en alimentos que contienen proteína. Sin la enzima, los niveles de fenilalanina se acumulan en el cuerpo. Esta acumulación puede dañar el sistema nervioso central y ocasiona daño cerebral. Es especialmente importante que las mujeres que presentan fenilcetonuria sigan la dieta antes de la concepción y durante todo el embarazo.
Hay grandes cantidades de fenilalanina en la leche, los huevos y otros alimentos comunes. El edulcorante artificial Nutrasweet (aspartamo) también contiene fenilalanina. Cualquier producto que contenga aspartamo se debe evitar(11).
Un análisis enzimático o una prueba genética pueden determinar si los padres son portadores del gen de la fenilcetonuria (FCU). Asimismo, se puede tomar una muestra de vellosidades coriónicas o amniocentesis durante el embarazo para examinar el feto en búsqueda de esta enfermedad. Es muy importante que las mujeres con fenilcetonuria sigan estrictamente una dieta baja en fenilalanina, tanto antes de quedar embarazadas como a través de todo el embarazo. La acumulación de la fenilalanina le causará daño al bebé en desarrollo, incluso si este no heredó el gen defectuoso.
Aunque la más efectiva medida preventiva es el adecuado control del riesgo reproductivo preconcepcional y el consentimiento informado de los riesgos que se corren, las mujeres fenilcetonúricas deben recibir como mínimo seis meses antes de la concepción y durante todo el embarazo una dieta restrictiva de fenilalanina y controles metabólicos seriados para mantener concentraciones plasmáticas entre 2 y 5 mg/100 mL, que equivale a una ingestión de 200 a 400 mg del aminoácido por día(11).
II. Farmacoterapia fetal curativa
Arritmias cardíacas
La detección y estratificación o tipificación cuidadosa de la frecuencia cardíaca fetal (FCF) es extremadamente importante en todos los embarazos. Los disturbios del ritmo cardíaco más letales ocurren durante embarazos aparentemente normales y con ritmos y frecuencias en apariencia normales, teniendo como punto de partida anormalidades en la polarización y des-polarización vinculadas a canalopatías iónicas de origen genético que no pueden ser detectadas por la ecocardiografía y pueden ser responsables de hasta un 10% de fallecimiento fetal inexplicable. Comúnmente se reconocen otras arritmias, como latidos prematuros, taquicardia y bradicardia. Los recursos utilizados en la práctica obstétrica para el diagnóstico de ritmo del corazón es hecho generalmente por modo M y ecocardiografía fetal Doppler pulsado, pero no todos los intervalos del ciclo cardiaco fetal pueden ser capturados o evaluados con estos métodos ecocardiográficos.
Las arritmias fetales son responsables de aproximadamente 10 a 20% de remisiones a cardiólogos fetales. La mayoría de estos ritmos se han resuelto en el momento de la evaluación, o consisten en latidos ectópicos atriales. La detección de una arritmia fetal por el especialista en obstetricia o ultrasonografista debe incitar la rápida derivación a un centro cardíaco fetal de excelencia para la evaluación adicional, especialmente si la arritmia se mantiene.
La mayoría de las arritmias fetales son benignas, y el 90% son extrasístoles auriculares. Estas deben ser observadas dos veces por semana para descartar extrasístoles supraventriculares sostenidas o aleteo auricular. En caso de extrasístoles ventriculares, se debe excluir el foramen oval redundante o aneurisma del FO, la isquemia y el infarto, y tumores (por ejemplo, los rabdomiomas).
Como requisitos previos antes de comenzar el tratamiento anti-arrítmico, incluir lo siguiente: la comprensión de la base electrofisiológica del ritmo anormal y su historia natural, buena comprensión de la farmacocinética del agente en la madre, el feto y la placenta, el consentimiento para el tratamiento materno, presencia de hidropesía fetal con una arritmia supraventricular sostenida, la gestación temprana con una arritmia sostenida en la que se percibe el riesgo para el desarrollo de hidropesía a ser alta. Las desventajas incluyen la mortalidad precoz y tardía en la madre y el feto.
Taquiarritmias
Las taquicardias supraventriculares (TSV) deben ser tratadas si son sostenidas y se asocian con hidropesía fetal o cuando haya pruebas de pre excitación de la aurícula izquierda y un pequeño agujero oval. El tratamiento de pacientes hospitalizados se inicia después de 12 a 24 horas de monitoreo cardíaco fetal y dependiendo de las condiciones fetales. El examen materno debe incluir ECG para excluir un síndrome materno Wolff-Parkinson-White y una determinación de electrolitos, nitrógeno de urea en sangre (BUN), creatinina y los niveles de digoxina antes de la carga.
La digoxina es el fármaco de primera línea. También se ha utilizado propranolol, procainamida, quinidina. Todos los medicamentos antiarrítmicos fetales están asociados con riesgos de pro-arritmia y mortalidad en la madre y el feto.
La identificación precisa del mecanismo subyacente a una taquiarritmia es importante, ya que el enfoque farmacológico puede ser muy diferente. Otro aspecto a considerar en el tratamiento fetal es que el medicamento ha de ser administrado a la madre, que desde luego comparte el riesgo potencial de comorbilidad con su no nacido. Se debe seleccionar cuidadosamente a los pacientes para el tratamiento y monitorizar los niveles del fármaco y la toxicidad. Defectos estructurales, como la anomalía de Ebstein y la insuficiencia mitral, deben ser excluidos.
Por lo tanto, cuando nos enfrentamos a la necesidad de instaurar tratamiento de un feto con arritmia, es de suma importancia, en primer lugar, establecer el mecanismo electrofisiológico en el momento del diagnóstico; en segundo lugar, dar el fármaco más eficaz en la dosis más baja posible; y en tercer lugar, evitar el riesgo de morbilidad materna y fetal.
Es de destacar que en el estudio de Fouron y col. (14), la necesidad de tratamiento posnatal fue infrecuente (8 de 18 fetos). Esto con toda probabilidad estaría relacionado con cambios en la maduración miocárdica, histológica y funcional, con repercusión en la electrofisiología del corazón fetal.
En el estudio multicéntrico retrospectivo(15), el primero en comparar la eficacia y seguridad de la digoxina transplacentaria, la más comúnmente usada para el tratamiento de la taquiarritmia fetal, en ausencia de hidropesía fetal, la mortalidad relacionada con la arritmia fue 0%, sugiriendo que la terapia antiarrítmica transplacentaria es segura y efectiva independientemente del fármaco elegido (digoxina, flecainide y sotalol). En presencia de hidropesía fetal, sin embargo, cuando el control rápido de la frecuencia cardíaca constituye una emergencia para mejorar las posibilidades de supervivencia, la tasa de mortalidad mediada por arritmias fue 17%. Flecainide y digoxina se asociaron con mayor probabilidad de conversión de la taquicardia supraventricular fetal a un ritmo normal. La mayor tasa de terminación del flutter atrial prenatal se observó con sotalol, aunque esto se logró en solo la mitad de los pacientes.
Bradiarritmias
El bloqueo AV completo congénito se asocia con la enfermedad cardíaca congénita importante en aproximadamente el 50% de los casos. Los diagnósticos han incluido isomerísmo de la aurícula izquierda, la transposición corregida de grandes vasos, defectos del canal auriculoventricular y defectos septales ventriculares. Este grupo tiene una alta incidencia de insuficiencia cardíaca congestiva o cianosis y requiere marcapasos permanentes posnatales. Los casos restantes (50%) están asociados con enfermedades autoinmunes maternos, por ejemplo, lupus eritematoso sistémico, enfermedad de Sjögren.
Esta bradiarritmia afecta a aproximadamente 2% de los fetos de madres con anticuerpos anti-Ro o anti-La, independientemente de los síntomas reumatológicos maternos. Los anticuerpos anti-Ro y anti-La son los anticuerpos antinucleares que se encuentran comúnmente en las enfermedades autoinmunes. El bloqueo auriculoventricular congénito se asocia con una relativa alta morbimortalidad fetal. Existe importante controversia en torno a la vigilancia de embarazos de anti Ro/La positivo y tratamiento de los fetos diagnosticados con CAVB. Estudios de dexametasona en el tratamiento de CAVB han producido resultados contradictorios. Se necesita estudios prospectivos más amplios para evaluar la eficacia de la inmunoglobulina intravenosa en el tratamiento de CAVB, de la inmunoglobulina intravenosa y la hidroxicloroquina en la prevención de CAVB en fetos de madres con riesgo. Los regímenes de vigilancia y el tratamiento deben determinarse sobre una base caso por caso, teniendo en cuenta el grado de CAVB, costos y efectos adversos del tratamiento(16). Los protocolos experimentales han utilizado inmunosupresores, betamiméticos e inotrópicos.
Infecciones maternas. Bacterias y virus
Un millón de recién nacidos muere cada año en países de ingresos bajos y medianos debido a sepsis neonatal; se responsabilizan, en parte, el estreptococo grupo B (GBS) y Escherichia coli entre las principales causas. En la actualidad, Streptococcus agalactiae (estreptococo del grupo B, EGB) y Escherichia coli son las principales causas de sepsis neonatal de aparición temprana en todo el mundo. Además, SGB y E. coli se asocian con parto prematuro, neonatos de peso muy bajo al nacer y sepsis puerperal, que causan considerable morbilidad y mortalidad en el África (subsahariana) y en países de ingresos bajos y medianos. Para evitar la sepsis neonatal de aparición temprana se han centrado esfuerzos preventivos principalmente en GBS países de ingreso alto y, basado en dos estrategias, a saber, el cribado y proyección o de riesgo y en la profilaxis antibiótica intraparto (IAP) y el desarrollo de vacunas.
La colonización vaginal por el Escherichia coli está relacionada con infecciones obstétricas y el consiguiente desarrollo de infecciones en los recién nacidos. Se ha observado un aumento a la resistencia a la ampicilina entre cepas de E. coli, que es la principal opción para el tratamiento empírico en muchas infecciones obstétricas y neonatales. Las cepas de E. coli vaginal son muy similares al Escherichia coli patógeno extraintestinal con respecto a los factores de virulencia y los pertenecientes a filogropo B2.
Se ha estudiado(17) la resistencia a los antimicrobianos y el perfil de virulencia genéticos de 82 aislados de E. coli procedentes de 638 muestras vaginales y 63 aisladas del endometrio aspirado, las muestras de líquido amnióticas y placentarias de mujeres embarazadas con infecciones obstétricas. La prevalencia de E. coli en las muestras vaginales fue 13%, significativo entre las mujeres con factores de riesgo asociados durante el embarazo, especialmente la rotura prematura de membranas (p < 0,0001). Sesenta y cinco por ciento de las cepas fueron resistentes a ampicilina. El E. coli aislado que causa infecciones obstétricas mostró niveles más altos de resistencia particularmente para gentamicina (p = 0,001). En las mujeres que presentan infecciones obstétricas, debe hacerse con cuidado la elección del tratamiento empírico más apropiado en el manejo clínico de las mujeres embarazadas y recién nacidos. Se tendrá en cuenta la susceptibilidad del huésped, la heterogeneidad de E. coli debida a la evolución en el tiempo y la zona geográfica, y la caracterización de E. coli(17).
Una reciente revisión(18) destacó que la administración de immunomoduladores/inmunodepresores durante el embarazo ha demostrado ser relativamente segura, pero los resultados no son concluyentes. Por otra parte, no es ético realizar ensayos clínicos controlados en el embarazo. Por lo tanto, el seguimiento del embarazo de estos pacientes es la herramienta que solo está disponible para evaluación de seguridad. De acuerdo con los autores citados, también esperamos que los registros internacionales de los potenciales efectos secundarios de medicamentos o de cualquier información útil relacionada con el embarazo y el resultado sobre el neonato se convierta en información común y de fácil acceso en los diferentes países. La administración de un cuestionario de cribado en el primer trimestre de la gestación ha demostrado ser una herramienta útil para identificar de antemano estos temas, para ser monitoreados cuidadosamente y, si es necesario, el tratamiento adecuado para proceder con éxito con el embarazo(18).
La Organización Panamericana de la Salud ha realizado un llamado para reducir la transmisión de madre a hijo del virus de inmunodeficiencia humana (VIH) y la incidencia de la sífilis en las Américas en 2015. La estrategia sería aumentar el acceso a las pruebas de detección y la atención adecuada de los casos portadores del VIH y la sífilis, apoyando el cumplimiento del tratamiento del VIH y de la sífilis en el periodo prenatal. La infección materna por VIH requiere de la administración materna de la zidovudina (AZT), iniciado alrededor de las 14 semanas de gestación, continuar durante todo el embarazo; administrado por vía intravenosa durante el parto, será seguido por el tratamiento del recién nacido durante las primeras 6 semanas. Se ha documentado que con ello se disminuye la tasa de la transmisión vertical de 8 a 25%(19). Para el tratamiento de la sífilis se recurre a la penicilina benzatínica (penicilina benzatínica 2 400 000 UI. En caso de que no sea posible clasificar el estadio de la enfermedad en la gestante, se recomienda aplicar tres dosis con intervalo semanal o en caso de alergia a la primera, usar estearato o etilsuccinato de eritromicina 500 mg cuatro veces al día por 15 días en sífilis temprana y por 30 días en sífilis tardía.
En cuanto a las infecciones bacterianas, una reducción de la colonización vaginal por el SGB podría lograrse promoviendo cambios de comportamiento, como la abstinencia de relaciones sexuales y evitar el lavado vaginal durante el embarazo tardío. Podría ser aconsejable explorar la presencia de ectopia cervical y establecer el riesgo de la invasión por C. albicans, GBS, E. coli e implementar profilaxis antibiótica(22).
La posibilidad de proteger a la mayoría de la población de gestantes con vacunas GBS II (una vacuna trivalente contra los serotipos Ia, Ib y III y una vacuna conjugada contra el serotipo III) no parece ser una estrategia viable, al menos en nuestro continente.
Insuficiencia de las arterias uterinas
Como es sabido, la invasión del trofoblasto extravellositario hacia los vasos uterinos, especialmente el tercio más distal de las arterias espiraladas o helicinas junto a la aparición de shunt entre los vasos encargados de perfundir el espacio intervelloso (EIV), conducen a un descenso de las resistencias en las arterias uterinas. Cuando fallan estos cambios fisiológicos unidos al parecer con niveles bajos de factores proangiogénicos, las arterias uterinas presentan una resistencia elevada, circunstancia que ha sido asociada a la preeclampsia, crecimiento fetal restringido y otros resultados adversos(20,21,24). La ausencia de los cambios fisiológicos en las arterias uterinas conlleva a una función placentaria subóptima. El factor de crecimiento placentario (PlGF) es un miembro de la familia del factor de crecimiento endotelial vascular (VEGF). Su efecto es particularmente pronunciado en las arterias uterinas durante el embarazo, lo que sugiere que el PlGF contribuye al remodelado vascular uterino durante la gestación. Los niveles maternos de PlGF son más bajos en los embarazos con inicio temprano de la preeclampsia o restricción del crecimiento fetal. Los niveles bajos de PlGF en ambas situaciones clínicas probablemente reflejan la fisiopatología subyacente por el que la invasión del trofoblasto defectuoso conduce a expresión alterada de los factores angiogénicos. Ante esta circunstancia, se ha venido emplean do el citrato de sildenafilo (SC) para mejorar los resultados perinatales en los embarazos complicados por la restricción del crecimiento fetal o preeclampsia. Su empleo puede ser una opción terapéutica potencial para mejorar la circulación uteroplacentaria en los embarazos complicados por la restricción severa del crecimiento fetal. Su eficacia en este sentido es actualmente evaluada en un estudio multicéntrico, internacional actualmente en curso en el Reino Unido, Australia y Nueva Zelanda. Las pruebas disponibles hasta ahora sugieren que el uso de SC a dosis de 20 a 240 mg/día en el segundo o tercer trimestre del embarazo no se asocia con significativos resultados adversos maternos o fetales.
Los resultados de esta investigación apoyarían el hecho de que la inhibición de la fosfodiesterasa usando el citrato de sildenafilo mejoraría la relajación mediada por el óxido nítrico de las arterias uterinas, probablemente por una disminución de la alta resistencia en los vasos útero-placentarios en pacientes con embarazos complicados por la preeclampsia o con arterias uterinas de elevada resistencia.
Según los hallazgos de esta investigación(20), y basado en la literatura revisada, el uso del SC dos veces al día (100 mg/día) por vía alcanzan las concentraciones plasmáticas que serían efectivas a nivel uterino in vivo sin producir inhibición de otras isoformas de la fosfodiesterasa. Otra consideración importante es la posibilidad que el sildenafilo atraviesa la barrera placentaria afectando la hemodinámica fetal. Los datos de esta investigación demuestran que en las 48 horas siguientes a la administración de 100 mg/día no produce modificaciones en los parámetros ecográficos de la arteria umbilical y cerebral media fetal. Como quiera que el sildenafilo pudiera atravesar la placenta, se conoce de una investigación en la que se trataron 35 preeclámpticas con dosis de hasta 240 mg/día, sin efectos neonatales importantes. En conclusión, el citrato de sildenafilo produce una disminución significativa sobre el flujo de las arterias uterinas sin afectar el flujo sanguíneo de las arterias umbilical y cerebral media fetal(20,21).
Hiperplasia suprarrenal congénita
El término de hiperplasia suprarrenal congénita (CAH) se aplica a una familia de trastornos hereditarios de la esteroidogénesis causados por una anomalía en uno de los cinco pasos enzimáticos necesarios en la conversión de colesterol a cortisol. Los defectos de la enzima se traducen como un rasgo autosómico recesivo, con la enzima deficiente la 21-hidroxilasa en más del 90% de los casos. En las formas clásicas, debido a la de ficiencia de 21 hidroxilasa (21-OHD), el exceso de andrógeno causa ambigüedad genital externa en mujeres recién nacidas y virilización posnatal progresiva en varones y mujeres. La 21-OHD no clásica (NC21OHD) se refiere a la condición en que las deficiencias parciales de 21-hidroxilación producen menos hiperandrogenemia extrema y síntomas más leves. Las mujeres no demuestran la ambigüedad genital en el nacimiento. El gen de la 21-hidroxilasa suprarrenal, CYP21, está situado en el cromosoma 6p en el área de los genes HLA.
El agrandamiento bilateral o asimétrico de las glándulas suprarrenales, con predominio de la izquierda, con pérdida de su apariencia normal triangular o en forma de Y, pueden simular masas suprarrenales hipoecoicas. El diagnóstico intrauterino de la hemorragia suprarrenal es poco frecuente, con evolución del hematoma conforme avanza el tiempo y es 3 a 4 veces más frecuente en la glándula suprarrenal derecha. Al angio Doppler la arteria suprarrenal se manifiesta más agrandada. Este hallazgo y la existencia de genitales ambiguos o pseudohermafroditismo permiten sospechar el diagnóstico, aunque de manera tardía.
Es importante establecer lo antes posible un diagnóstico fiable del sexo y CAH. La generalización de las biopsias de vellosidades coriónicas y los recientes avances en genética molecular, longitud de restricción del fragmento de reacción en cadena de polimorfismo y de la polimerasa (PCR), análisis directo del ADN durante el primer trimestre, en particular, la determinación de mutaciones puntuales mediante amplificación por PCR de los alelos específicos en el probando de uno de los padres, simplifica el procedimiento y también aumenta la fiabilidad del diagnóstico prenatal.
Este es un ejemplo de un error innato metabólico con tratado con éxito prenatalmente. Desde 1986, el diagnóstico prenatal y el tratamiento de la hiperplasia suprarrenal congénita por deficiencia de 21 hidroxilasa (21-OHD) se ha realizado en 403 embarazos, en el New York Hospital Cornell Medical Center(25). En 280, el diagnóstico fue hecho por amniocentesis, mientras que 123 fueron diagnosticados utilizando muestreo de vellosidades coriónicas. De los 403 embarazos evaluados, 84 bebés estuvieron afectados con la 21-OHD clásica. De estos, 52 eran mujeres, 36 de las cuales fueron tratados prenatalmente con dexametasona(25), la cual puede administrarse de manera eficiente al feto a través de la madre. No se observó efectos secundarios significativos o duraderos en las madres o los fetos, lo que indica que el tratamiento con dexametasona es seguro. Los recién nacidos tratados prenatalmente no difirieron en peso, longitud o circunferencia de la cabeza con los de los recién nacidos no tratados. Se sugiere una dosis de 20 a 25 microgramos/kg de peso corporal.
El adecuado diagnóstico y tratamiento prenatales de 21-OHD es eficaz en reducir o eliminar significativamente la virilización en las recién nacidas. Esto ahorra las consecuencias de ambigüedad genital, cirugía genital, mal asignación de sexo y la confusión de género.
Tirotoxicosis e hipotiroidismo fetal
La tirotoxicosis fetal es una enfermedad rara que ocurre en 1 de cada 70 embarazos con enfermedad de Graves o en 1 por cada 4 000 a 50 000 partos. La mortalidad es 12 a 20%, generalmente debida a la insuficiencia cardíaca o por otras complicaciones como la compresión traqueal, infecciones y trombocitopenia. Es el resultado de la transferencia de inmunoglobulinas estimulantes de la tiroides de la madre al feto a través de la placenta. Esta transferencia transplacentaria comienza alrededor de las 20 semanas de embarazo y alcanza su máximo por la semana 30. Estos autoanticuerpos se unen a la tiroides fetal y estimulan los receptores de la hormona TSH y aumentan la secreción de las hormonas tiroideas. Generalmente se observa en los recién nacidos de madres con enfermedad de Graves o tiroiditis autoinmune(26). El diagnóstico se realiza mediante cordocentesis. El tratamiento materno con propiltiouracilo (dosis 300 mg/d PO inicial, luego dosificar según efecto), metimazol o carbimazol (el paso de este a través de la placenta es mayor que el del PTU) se asocia con un buen resultado fetal. Si la madre se vuelve hipotiroidea debido al tratamiento, se agrega tiroxina aprovechando el hecho de que muy poco de la tiroxina se transfiere a través de la placenta. En estos casos el estudio fetal puede evidenciar muerte intrauterina, taquicardia, edema (ascitis) y el bocio fetal es un buen indicio cuando está presente. Además se ha descrito abortos a repetición, craneosinostosis y crecimiento fetal retardado. El propiltiouracilo se ha asociado con atresia de coanas y otras malformaciones(27).
El hipotiroidismo fetal está vinculado a hipertiroidismo materno, el uso de iodo radiactivo, las drogas y el consumo excesivo de iodo materno. El estado fetal se evalúa por ecografía y por cordocentesis directa. Se ha empleado la inyección intraamniótica de L-tiroxina (500 mcg cada 2 semanas, iniciando a las 34 semanas de gestación). Intervenciones como la inyección intraamniótica de L-T4 deben ser realizadas solamente por equipos multidisciplinarios especializados. Se ha demostrado que causa la regresión de bocio fetales y la normalización de los niveles hormonales.
Niveles de evidencia de algunas terapéuticas farmacológicas fetales (MBE)
-
La administración de corticoesteroides. Nivel de evidencia: Nivel I.
-
La administración de fármacos antiarrítmicos: digoxina, flecainide, sotalol, amiodarona, beta-simpaticomiméticos. Nivel de evidencia: Nivel II-3.
-
La administración intravenosa de inmunoglobulina (IVIG) fetal y neonatal trombocitopenia aloinmune (FNAIT). Nivel de evidencia: Nivel II-3.
-
La administración de fármacos antivirales o antiparasitarios. Nivel de evidencia: Nivel II-2.
-
La administración de tionamidas propiltiouracilo (PTU) en el hipertiroidismo fetal en mujeres embarazadas que tienen enfermedad de la tiroides (Graves o enfermedad de Hashimoto) y donde los anticuerpos maternos estimulante del tiroides (TSI) están afectando la glándula tiroides fetal. Nivel de evidencia: Nivel II-3.
-
La sustitución o dieta de restricción en las enfermedades hereditarias fetales metabólicas como acidemia metilmalónica (MMA) (tratados con vitamina B12), deficiencias de carboxilasa (tratado con biotina), 3-fosfoglicerato-deshidrogenasa (3-PGDH) (tratados con L-serina). Nivel de evidencia: nivel III.
Conflicto de interés: No existe conflicto de interés con el presente artículo.
Referencias Bibliográficas
1. Liley AW. Intrauterine transfusion of foetus in haemolytic disease. BMJ.1963;2:1107-9. [ Links ]
2. Liggins GC, Howie RN. A controlled trial of antepartum glucocorticoid treatment for prevention of the respiratory distress syndrome in premature infants. Pediatrics 1972;50: 515–25. [ Links ]
3. Hui L, Bianchi DW. Prenatal pharmacotherapy for fetal anomalies: a 2011 update. Prenat Diagn. 2011 Jul;31(7):735-43. doi: 10.1002/pd.2777. Epub 2011 Jun 3. [ Links ]
4. Cortés MF, Hirsch BS, de la Maza MP. Importancia del ácido fólico en la medicina actual. Rev méd Chile [Internet]. 2000 Feb [citado 2016 Mar 01; 128( 2 ):213-20[. Disponible en: http://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0034-98872000000200013&lng=es. http://dx.doi. org/10.4067/S0034-98872000000200013. [ Links ]
5. Hofmeyr GJ. Administración prenatal de corticoesteroides para mujeres con riesgo de parto prematuro: Comentario de la BSR (última revisión: 2 de febrero de 2009). La Biblioteca de Salud Reproductiva de la OMS; Ginebra: Organización Mundial de la Salud. [ Links ]
6. Meher A, Randhir K, Mehendale S, Wagh G, Joshi S. (2016). Maternal Fatty Acids and Their Association with Birth Outcome: A Prospective Study. PLoS ONE. 2016;11(1), e0147359. http://doi.org/10.1371/journal.pone.0147359. [ Links ]
7. Saccone G, Berghella V. Omega-3 supplementation to prevent recurrent preterm birth: a systematic review and metaanalysis of randomized controlled trials. Am J Obstet Gynecol. 2015;213: 135–40. doi: 10.1016/j.ajog.2015.03.013. [ Links ]
8. Saccone G, Saccone I, Berghella V. Omega-3 long-chain polyunsaturated fatty acids and fish oil supplementation during pregnancy: which evidence? J Matern Fetal Neonatal Med. 2015;18:1–9. doi: 10.3109/14767058.2015.1086742. [ Links ]
9. Vockley J, Andersson HC, Antshel KM, Braverman NE4, Burton BK5, Frazier DM6, et al; American College of Medical Genetics and Genomics Therapeutics Committee. Phenylalanine hydroxylase deficiency: diagnosis and management guideline. Genet Med. 2014;16(2):188-200. doi: 10.1038/gim.2013.157. [ Links ]
10. Welch T. Dietary management of mothers with PKU during pregnancy. J Pediatr. Feb 2004;144(2):1A. [ Links ]
11. Álvarez Fumero R. Enfermedades heredo metabólicas y embarazo Dirección Nacional Materno Infantil http://www.bvs. sld.cu/revistas/gin/vol29_2_03/gin01203.htm [ Links ]
12. Sakuyama H, Katoh M, Wakabayashi H, Zulli A, Kruzliak P, Uehara Y. Influence of gestational salt restriction in fetal growth and in development of diseases in adulthood. J Biomed Sci. 2016;23:12. doi: 10.1186/s12929-016-0233-8 [ Links ]
13. Raghuveer TS, Garg U, Graf WD. Inborn errors of metabolism in infancy and early childhood: an update. Am Fam Physician. 2006 Jun 1;73(11):1981-90. [ Links ]
14. Fouron J-C, Fournier A, Proulx F, Lamarche J, Brigas JL, Boutin C, et al. Management of fetal tachyarrhythmia based on superior vena cava/aorta Doppler flow recordings. Heart. 2003;89(10):1211-6. [ Links ]
15. Jaeggi ET, Carvalho JS, De Groot E, Api O, Clur SA, Rammeloo L, McCrindle BW, Ryan G, Manlhiot C, Blom NA. Comparison of transplacental treatment of fetal supraventricular tachyarrhythmias with digoxin, flecainide, and sotalol: results of a nonrandomized multicenter study. Circulation. 2011;124:1747–54. [ Links ]
16. DeNoble AE, Kuller JA, Rhee EJ. Controversies in the management of isolated congenital atrioventricular block. Obstet Gynecol Surv. 2015 Aug;70(8):518-23. doi: 10.1097/ OGX.0000000000000208. [ Links ]
17. Sáez-López, Guiral, Fernández-Orth, Villanueva S, Goncé A, López, Teixidó I, et al. Vaginal versus obstetric infection Escherichia coli isolates among pregnant women: antimicro bial resistance and genetic virulence profile. PLoS One. 2016 Jan 19;11(1):e0146531. doi: 10.1371/journal.pone.0146531. [ Links ]
18. Mazzucchelli I, Decembrino L, Garofoli F, Ruffinazzi G, Ramo-ni V, Romano M, Prisco E, Locatelli E, et al. Maternal and neonatal outcomes in pregnant women with autoimmune diseases in Pavia, Italy. BMC Pediatr. 2015;15: 217. doi: 10.1186/ s12887-015-0532-3 PMCID: PMC4683757. [ Links ]
19. Cerda R, Perez F, Domingues RM, Luz PM, Grinsztejn B, Veloso VG, et al. Prenatal transmission of syphilis and human immunodeficiency virus in Brazil: Achieving regional targets for elimination. Open Forum Infect Dis. 2015 May 22;2(2):ofv073. doi: 10.1093/ofid/ofv073. [ Links ]
20. Reyna-Villasmil E, Torres-Cepeda D, Peña-Paredes E, Mejía-Montill J, Reyna-Villasmil N, González-Rodríguez P. Efecto del citrato de sildenafil sobre el flujo sanguíneo de las arterias uterina, umbilical y cerebral media fetal en preeclámpticas. Rev Obstet Ginecol Venez. 2008;68(3):187-94. [ Links ]
21. Dunn L, Flenady V, Kumar S. Reducing the risk of fetal distress with sildenafil study (RIDSTRESS): a double-blind randomised control trial. J Transl Med. 2016;14:15. doi: 10.1186/ s12967-016-0769-0. PMCID: PMC4712615. [ Links ]
22. Cools P, Jespers V, Hardy L, Crucitti T, Delany-Moretlwe S, Mwaura M, Vaneechoutte M. (2016). A multi-country cross-sectional study of vaginal carriage of group B Streptococci (GBS) and Escherichia coli in resource-poor settings: prevalences and risk factors. PLoS ONE. 2016;11(1). e0148052. http://doi.org/10.1371/journal.pone.0148052. [ Links ]
23. Forest MG, David M. [Prevention of sexual ambiguity in children with 21-hydroxylase deficiency by treatment in utero]. Pediatrie. 1992;47(5):351-7.[Artículo en francés] [ Links ].
24. Velauthar L, Plana MN, Kalidindi M, Zamora J, Thilaganathan B, Illanes SE, Khan KS, Aquilina J, Thangaratinam S. First-trimester uterine artery Doppler and adverse pregnancy outcome: a meta-analysis involving 55,974 women. Ultrasound Obstet Gynecol. 2014 May;43(5):500-7. doi: 10.1002/uog.13275. [ Links ]
25. Carlson AD, Obeid JS, Kanellopoulou N, Wilson RC, New MI. Con-genital adrenal hyperplasia: update on prenatal diagnosis and treatment. J Steroid Biochem Mol Biol. 1999 Apr-Jun;69(1-6):19-29. [ Links ]
26. Batra CM. Fetal and neonatal thyrotoxicosis. Indian J Endocrinol Metab. 2013;17(Suppl1):S50–S54. http://doi. org/10.4103/2230-8210.119505. [ Links ]
27. Andersen SL, Olsen J, Wu CS, Laurberg P. Birth defects after early pregnancy use of antithyroid drugs: a Danish nationwide study. J Clin Endocrinol Metab. 2013 Nov;98(11):4373-81. doi: 10.1210/jc.2013-2831. Epub 2013 Oct 22. [ Links ]
Otras fuentes consultadas:
Pagina web. Errores del Metabolismo http://www.newbornscreening.info/spanish/parent/Organic_acid/MMA.html
Centers for Diseases Control and Prevention. Recommendations for the use of folic acid to reduce the number of cases of spina bifida and other neural tube defects. MMWR. 1992; 41:1-7.
Correspondencia: Dr, Alberto Sosa Olavarría ceusperinatal@yahoo.com