Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.62 no.2 Lima abr./jun. 2016
ARTÍCULO DE REVISIÓN
Streptococcus spp. en el embarazo, patología y avances en su detección temprana
Streptococcus spp. in pregnancy, pathology and advances in early detection
Ana Cristina Toro-Moreno1,a, Lina María Martínez-Sánchez1,b, Marcos Restrepo-Arango1,a, Laura Isabel Jaramillo-Jaramillo1,a
1 Facultad de Medicina, Universidad Pontificia Bolivariana, Sede Central Medellín, Circular 1 No. 70-01, Medellín, Colombia
a Estudiante b Docente
Resumen
El Streptococcus spp ha adquirido mucha importancia a nivel mundial debido a la gran patogenicidad de sus diferentes especies. Una de ellas es el Streptococcus del Grupo B que comúnmente se encuentra a nivel vaginal en mujeres embarazadas, lo que puede ocasionar una contaminación al recién nacido en el momento del parto. Solo un pequeño porcentaje de estos neonatos desarrollan la infección y pueden llegar a presentar sepsis, meningitis, neumonía neonatal, entre otras complicaciones, así como secuelas neurológicas permanentes, retraso en el crecimiento y muerte. Debido a esto, se han implementado estrategias preventivas, en las que se incluyen pruebas de tamizaje para su detección temprana y evitar el riesgo de infección. En las últimas décadas se ha incrementado el uso de técnicas moleculares para su diagnóstico precoz y tratamiento temprano, de manera de disminuir la morbimortalidad atribuida al Streptococcus del Grupo B.
Palabras clave: Enfermedades Vaginales; Complicaciones del Embarazo, Infecciones; Streptococcus agalactiae; Streptococcus Grupo B; Recién Nacido, Tamizaje Neonatal.
Abstract
Streptococcus spp has acquired great importance due to the high pathogenicity of its different species around the world. The Group B Streptococcus is commonly found in the vaginal area of pregnant women, which at delivery may lead to contamination of the newborn. Only some of these infants develop the infection and may present sepsis, meningitis, neonatal pneumonia, among other complications, including permanent neurological sequelae, delayed growth and death. Preventive strategies include screening and early detection to avoid the risk of infection. In recent decades the use of molecular techniques for early diagnosis and treatment has increased that would decrease morbidity and mortality attributed to Group B Streptococcus.
Keywords: Vaginal Diseases; Pregnancy Complications, Infections; Streptococcus agalactiae; Streptococcus Group B; Newborn; Neonatal Screening.
Generalidades sobre Streptococcus Spp
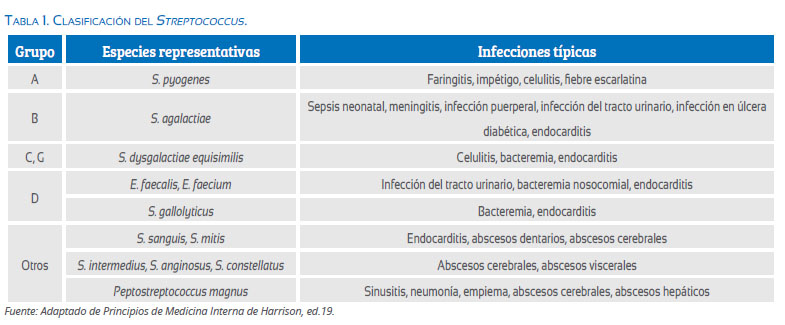
Existen más de 100 especies de Streptococcus, muchos de los cuales son comensales de la cavidad oral y nasofaringe; estos microorganismos son bacterias gram positivas y anaerobias facultativas o estrictas, con forma esférica u ovoide y que se organizan en cadenas(1,2). El género Streptococcus incluye algunos de los patógenos más importantes y puede dividirse en diferentes grupos(3).
Streptococcus grupo A
Los patógenos pertenecientes a este grupo son los principales responsables de infecciones del tracto respiratorio superior y de la piel. Se asocian comúnmente a gran variedad de afecciones supurativas; entre ellas, faringitis, tonsilitis o amigdalitis, impétigo, entre otras(2,4-6). La infección por estos microorganismos en ocasiones puede ir más allá de los episodios agudos y desencadenar síndromes postinfecciosos como fiebre reumática aguda y glomerulonefritis postestreptocóccica. Para evitar estas complicaciones es esencial un diagnóstico y tratamiento oportuno y adecuado(2,5).
La mayoría de los microorganismos pertenecientes a este grupo son comensales, algunos pocos patógenos y otros, como el Streptococcus pyogenes, microorganismo característico de este grupo, puede ser patógeno y comensal(7).
Streptococcus grupos C y G
Este grupo causa infecciones similares a los del anterior. Son bacterias β-hemolíticas generalmente miembros del grupo Streptococcus milleri (Streptococcus intermedius, Streptococcus anginosus)(2). Son anaerobios facultativos, coprofílicos y catalasa negativos(8). Estos microorganismos comúnmente causan infección en nasofaringe, garganta, piel y tracto genital. Así mismo, aunque son casos muy raros, en ocasiones pueden causar glomerulonefritis aguda, artritis séptica, osteomielitis, neumonitis y bacteriemia(8).
Streptococcus Grupo B
Es un grupo de microorganismos de presentación frecuente en mujeres embarazadas, se conoce que aproximadamente el 25% de estas se encuentran colonizadas por Streptococcus agalactiae en la mucosa rectal y/o vaginal, que a menudo han sido relacionada con parto pretérmino e infección neonatal, convirtiéndose así en una causa importante de morbimortalidad(9,10). Aunque no es tan común, también puede originar infecciones serias en adultas, que llegan a amenazar la vida(2).
Streptococcus grupo D
Las bacterias pertenecientes a este grupo se encuentran comúnmente en la microbiota intestinal. Sin embargo, también son causales de importantes infecciones. El principal microorganismo patógeno de este grupo es el Streptococcus bovis, que a su vez ha sido reclasificado en dos especies, Streptococcus gallolyticus gallolyticus y pasteurianus y Streptococcus infantarius infantarius y coli(2,3). Una de las principales características que cabe resaltar de este grupo de microorganismos es su asociación con neoplasias del tracto gastrointestinal, principalmente carcinoma colorrectal y otras lesiones intestinales de este tipo; sin embargo, no son las únicas ni más comunes condiciones derivadas de la presencia de un Streptococcus del grupo D. Las infecciones osteoarticulares, del tracto urinario, meningitis, peritonitis y bacteremia son más comunes en los pacientes infectados(3,11).
Viridans y otros Streptococcus
Los Streptococcus viridans son un grupo de microorganismos de gran importancia como agente etiológico de la endocarditis infecciosa. Algunas especies de viridans, como Streptococcus salivarius, Streptococcus mitis, Streptococcus sanguis y Streptococcus mutans, componen la flora normal de la cavidad oral y por tanto están en contacto estrecho con los dientes y la mucosa gingival, siendo así un microorganismo que puede ponerse fácilmente en contacto con la circulación sistémica(2,3).
Streptococcus grupo B
El Streptococcus B hemolítico del grupo B (SGB), también llamado Streptococcus agalactiae, es un coco gram positivo que coloniza tanto el tracto genitourinario como gastrointestinal de los seres humanos(12,13). Es conocido principalmente por la colonización vaginal previa al parto, entre 10 y 40% de las mujeres embarazadas, que por vía vertical trasmiten este microorganismo a los recién nacidos, radicando ahí su importancia como principal factor de riesgo para causar infecciones importantes en los neonatos durante el nacimiento(14). Del 10 al 30% de estas mujeres adquieren un estado portador vaginal transitorio(15).
Estas infecciones pueden ser de dos tipos:
-
De inicio temprano o que se desarrollan en los primeros seis días de vida, las cuales ocurren más en prematuros y neonatos con peso bajo al nacer, por su débil sistema inmune(16-18).
-
De inicio tardío o que se desarrollan después de la primer semana hasta los tres meses de vida, las cuales están principalmente asociadas a los factores de virulencia del SGB y que pueden llevar a secuelas neurológicas en 30% de los sobrevivientes(16-18).
El SGB ha adquirido gran importancia epidemiológica, ya que algunos estudios han demostrado que aproximadamente 30 a 70% de los neonatos son colonizados por este microorganismo durante el parto; de estos, 1 a 3% desarrollan una infección de inicio temprano que, en ausencia de intervención, alcanzan una tasa de mortalidad del 50%(19,20).
Otros factores de riesgo importantes para que el neonato adquiera la infección son la colonización intestinal materna por SGB, parto prematuro antes de completar 37 semanas de gestación, rotura prematura de membranas (RPM) mayor a 18 horas, fiebre intraparto con una temperatura > 38ºC, haber tenido más hijos con infecciones por SGB, nivel bajo de anticuerpos capsulares anti-GBS y bacteriuria de la madre durante el embarazo con un recuento de bacterias en orina > 100 000 UFC/mL por este microorganismo(13,21).
Reconocido entonces como causa líder de infecciones neonatales en países desarrollados, se empezaron a utilizar métodos de detección como el tamizaje, entre otros métodos diagnósticos, para determinar tempranamente el estado portador de las mujeres en embarazo y poder analizar sus factores de riesgo para una posible colonización y desarrollo de la infección(12).
Infecciones producidas por Streptococcus agalactiae
A nivel mundial, las infecciones son una de las tres principales causas de mortalidad en el neonato, y aproximadamente un cuarto de los recién nacidos muere en el primer mes(22). La infección por SGB comienza cuando la bacteria coloniza satisfactoriamente el epitelio vaginal de la mujer embarazada, donde luego de llegar allí varios factores pre y posparto adquieren importancia: su penetración a las membranas placentarias o la inhalación de fluidos contaminados por SGB que llegan a la orofaringe del neonato y la colonizan(23). La poca información que se tiene sobre los mecanismos de virulencia que promueven la infección de la cavidad amniótica es uno de los factores que limita las estrategias preventivas(24). Siendo un órgano multicelular, la placenta, que protege al feto de microorganismos que colonizan el trato genital de su madre, es invadido por ascenso del líquido amniótico contaminado por SGB a través del cérvix y las capas placentarias -decidua, corion, amnios y epitelio amniótico-, siendo esta última motivo de gran controversia para los investigadores, ya que estudios previos indican que aunque es una fuente importante de infección para el feto y el neonato, el SGB no la coloniza(24,25).
La severidad de estas infecciones difiere según el grupo étnico, los factores socioeconómicos de la mujer en embarazo y la distribución geográfica de los serotipos del SGB(21,26). El principal factor de virulencia de esta bacteria es su cápsula, la cual es capaz de disminuir la activación de la vía alterna del complemento y no permite que el hospedero se defienda(27-29). Para que haya una buena respuesta inmune contra el SGB es necesario que se active la vía clásica del complemento, de los neutrófilos, y la presencia de anticuerpos(27). Se entiende que la colonización materna por microorganismos estimula la inmunidad materna, permitiendo así transferir los anticuerpos creados contra este al recién nacido para su posible protección(30). Es probable que por defectos en la inmunidad o por inmadurez del sistema inmune se puedan llegar a presentar infecciones en los neonatos(30). Aunque la principal vía de adquisición de la infección es la transmisión vertical, otras formas como el origen nosocomial de la infección han cobrado gran importancia en los últimos años(31,32).
A causa de la bacteremia, la embarazada puede desarrollar infecciones urinarias, corioamnionitis, endocarditis, peritonitis, artritis séptica, endometritis e infecciones en la piel, las cuales pueden o no estar acompañadas de fiebre postparto. También pueden causar sepsis bacteriana, meningitis, otitis media, osteomielitis, celulitis y neumonía neonatal(17,33-35). La funisitis, producida cuando hay infiltración de microorganismos como el SGB al cordón umbilical, tiene peores resultados cuando se acompaña del daño de órganos(25,36). Las infecciones severas pueden resultar en la muerte o discapacidad permanente de los neonatos(25,36).
Manifestaciones clínicas
Las infecciones de inicio temprano por SGB pueden derivar en retraso en el desarrollo y crecimiento del neonato, discapacidad intelectual, pérdida de la visión y audición, enfermedades pulmonares crónicas y parálisis cerebral. El 80% de los que adquieren la infección presentan síntomas dentro de las primeras 24 horas después del nacimiento(24,31,37). La incidencia de estas infecciones de inicio temprano ha disminuido notablemente, pasando de 1,7 casos por 1 000 nacidos vivos en los años 1900 a 0,34-0,37 casos por 1 000 nacidos vivos en los últimos años(38). En ausencia de una intervención adecuada, la infección ocurre en 1 a 2 niños por 1 000 nacidos vivos del total de la población obstétrica(39).
Varios reportes de caso sugieren signos y síntomas de deterioro del neonato, como irritabilidad, palidez y falla respiratoria que requiere de ventilación mecánica(31). Otras manifestaciones de infección neonatal incluyen hipertermia, anorexia, vómito e ictericia. Sin embargo, los neonatos cuyas madres reciben profilaxis intraparto tienen menor probabilidad de desarrollar sintomatología clínica(38). La SBG es la causa más común de sepsis neonatal de inicio temprano; sin embargo, los síntomas continúan siendo poco específicos(38,40).
Algunas infecciones de inicio tardío generalmente son adquiridas de forma nosocomial y tienen un período de incubación corto. Pueden manifestarse como meningitis y suelen ser de mal pronóstico, ya que se presentan con una tasa de mortalidad del 10% y secuelas neurológicas permanentes en 25 a 35% de los sobrevivientes(31). En algunos estudios se ha demostrado que las mujeres embarazadas infectadas con VIH tienen mayores tasas de colonización por SGB que las que no. Esta situación podría explicarse por la alteración del sistema inmune que genera una deficiencia en la producción de anticuerpos secundaria a esta colonización, incrementando así el riesgo en los neonatos no infectados pero expuestos al VIH de presentar una infección severa o de inicio tardío por SGB(30).
En algunos reportes de caso se ha sugerido a la lactancia como factor de riesgo para la infección de comienzo tardío. Sin embargo, no se ha demostrado con certeza cómo funciona este me-canismo(17). Aunque suele ser raro, se presenta más en los casos donde la madre desarrolla mastitis o abscesos mamarios, los cuales tienen gran potencial de contaminar la leche materna de microorganismos patógenos(31,41).
Algunos estudios han descrito que entre 15 y 26% de las mujeres portadoras de SGB pueden llegar a tener RPM y parto prematuro, siendo esta primera, la complicación de 2 a 3% de los embarazos en EE UU y la causa de 20 a 30% de los partos prematuros, aumentando la morbilidad, mortalidad perinatal, y potenciando también infecciones nuevas(40).
Prevención y tratamiento
A finales del siglo XX, los Centros para el Control y Prevención de Enfermedades (CDC) y otras organizaciones implementaron estrategias preventivas en gestantes con factores de riesgo en los Estados Unidos, idea que se fortaleció en el 2002 y se ha empezado a reproducir en muchos países(12).
La primera estrategia preventiva fue la profilaxis antibiótica intraparto (PAI), la cual era suministrada a mujeres portadoras de SGB por medio de cultivos de detección realizados entre las 35 y 37 semanas de gestación y a las mujeres que desarrollaron parto prematuro o RPM(42). La segunda estrategia difiere de la primera en que la PAI era dada a las mujeres que en el momento de desarrollar parto prematuro o RPM presentaban uno o más factores de riesgo para infección por SGB, los cuales fueron mencionados en la primera parte de esta revisión(42). Actualmente, se recomienda los métodos de detección prenatal para SGB en todas las mujeres en embarazo entre las 35 y 37 semanas de gestación y la PAI, empleada en mujeres que resultan ser portadoras o aquellas que desarrollan uno o más factores de riesgo para desarrollar la infección(42).
Desde que se implementó la PAI y los métodos de detección temprana, se ha demostrado que ha habido una reducción en la incidencia de estas infecciones por SGB en un 80%(39), adoptándose por fin a gran escala en la mayoría de mujeres embarazadas de todo el mundo. Se cree que hasta 15% de estas no reciben un cuidado y control prenatal adecuado que incluya detección temprana para SGB(37,39). La PAI consiste en la administración antibiótica de penicilina o ampicilina 4 horas antes del parto a las mujeres embarazadas que son colonizadas por SGB. Para aquellas con hipersensibilidad o alergia a estos, se ha recomendado el uso de eritromicina, clindamicina y vancomicina. Sin embargo, en la actualidad se ha documentado incremento en la resistencia a estos antibióticos que anteriormente no se presentaba(20,43).
Aunque el tratamiento antibiótico perinatal ha disminuido la incidencia de infecciones de inicio temprano por SGB, aún se busca desarrollar una vacuna contra este microorganismo. Sin embargo, ha sido difícil debido a la gran diversidad de serotipos, el cambio constante en la prevalencia de estos, la reducción en la sensibilidad de los antimicrobianos al SGB, el intercambio capsular entre cepas, entre otros(44,45).
Para poder realizar una estrategia de detección y tratamiento óptimo y efectivo, primero se requiere realizar un adecuado diagnóstico acerca del estado de colonización en el que se encuentra la mujer en estado de embarazo(46).
Historia y actual protocolo de los Métodos diaGnósticos
En el año 1992, el American College of Obstetricians and Gynecologists (ACOG) y la American Academy of Pediatrics desarrollaron la primera guía en la cual se establecían las directrices para el tratamiento y tamizaje del SGB. Posteriormente, para 1996, una nueva guía con tres importantes estrategias fue planteada a partir del trabajo de Rouse y col. En esta se propuso un tratamiento con base en los factores de riesgo existentes, un tratamiento universal y la realización del tamizaje con cultivo en las semanas 35 a 37(10,47). Así mismo, con la finalidad de capacitar a las gestantes y brindarles la posibilidad de obtener tamizaje de manera gratuita, se creó el Group B Strep Support (GBSS) en el Reino Unido(48). El cultivo realizado en la semana 35 a 37 de gestación fue el primero en ser utilizado y el más recomendado de los métodos, apoyado por las guías del 2002 del CDC; método que se mantiene hasta la actualidad como el estándar de oro(49). El protocolo establece que el cultivo debe ser ano/vaginal, realizado en caldo suple-mentado Todd-Hewitt. Sin embargo, ya que el caldo no es suficiente para la completa identificación del SGB, se han planteado dos pruebas adicionales, la prueba CAMP y la aglutinación por látex(50).
Lo nuevo en diagnóstico molecular para la tamización del SGB
Como se mencionó anteriormente, aún no se han encontrado nuevos métodos que superen la utilidad del cultivo para el diagnóstico. Sin embargo, en los últimos años se han estudiado alternativas moleculares que probablemente en un futuro superarán al cultivo(51).
Xpert® SGB Assay:
Esta prueba fue diseñada con la finalidad de una obtención rápida de resultados intraparto, para conocer el estado de colonización por SGB en mujeres a término con riesgo bajo. El Xpert® SGB tiene una gran ventaja en cuanto a su realización, ya que no requiere de personal entrenado de laboratorio, sino que cualquier miembro del personal de salud está en la capacidad de realizarla(52). Su fundamento se basa en integración de la lisis de la muestra, purificación del ácido nucleico, amplificación y detección de la secuencia diana utilizando la reacción en cadena de polimerasa (PCR, por sus siglas en inglés) y transcripción reversa, logrando finalmente la identificación automatizada y precisa del SGB(53).
IDI-Strep B Assay:
Esta prueba fue aprobada recientemente por la FDA para la detección del SGB en mujeres embarazadas, utilizando el instrumento Cepheid Smart Cycler® que analiza muestras rectales y vaginales. Este detecta el ADN de la bacteria sin la realización de un cultivo previo, por lo cual es capaz de tener resultados en menos de una hora en comparación con los cultivos que pueden tardar entre 18 y 48 horas. Además, esta prueba es la primera que no utiliza cultivo y que cumple con todos los criterios de rendimiento que exige el CDC, lo que la convierte en un examen de laboratorio altamente recomendado, incluso con la posibilidad de reemplazar el cultivo(54).
BD GeneOhm StrepB:
Esta prueba es de tipo cualitativa in vitro y sirve para la detección rápida de ADN del SGB en mujeres embarazadas con muestras vaginal o rectales tomadas antes o durante el parto. El instrumento utilizado es un SmartCycler® que amplifica la secuencia del gen cfb de SGB y marca con fluorescencia, permitiendo la detección del ADN en la muestra(55). Esta prueba tiene la capacidad de proveer resultados en tiempos inferiores a una hora. Así mismo puede ser empleado para tamizaje preparto en la semana 35 a 37 de gestación o intraparto en caso de ausencia de control prenatal, estado y grado de colonización desconocido(56).
La alta morbimortalidad atribuida al SGB en neonatos es una de las principales razones por las cuales se realiza la tamización prenatal y se estudian nuevas alternativas que permitan una mayor disminución de estas tasas frente al cultivo. Couturier y col evaluaron el comportamiento de las tres pruebas de amplificación de ácidos nucleicos (NAAT) planteadas por la FDA -BD Max GBS, illumigene GBS y BD GeneOhm StrepB-, encontrando que superan en sensibilidad al cultivo y por tanto son tres opciones muy viables para reemplazar al estándar de oro actual. Sin embargo, se requiere más evidencias antes de que puedan ser incluidas oficialmente como alternativa superior(57).
El uso de la PCR y la hibridación fluorescente in situ (FISH) ha sido igualmente evaluado como una alternativa molecular para el tamizaje de SGB en mujeres embarazadas. La serotipificación capsular de SGB por aglutinación de látex ha sido el método de tipificación más utilizado. Pero, en algunos estudios se ha encontrado que la aglutinación por látex tiene un número inferior de muestras tipificadas frente a la genotipificación por PCR, planteándola como una opción no solo viable sino también precisa para la tipificación del SGB(32). Por otro lado, con la FISH se obtuvo una sensibilidad y especificidad del 100%, posicionándose como una alternativa útil cuando no esté disponible el cultivo(32,46).
Estas y otras pruebas moleculares han comenzado a posicionarse como importantes candidatos a futuro para nuevos estándar de oro en el diagnóstico de SGB, ofreciendo un nuevo espectro diagnóstico más rápido, preciso y probablemente con un mejor margen de costo efectividad. Es por esto que se han ejecutado numerosos estudios buscando dar respaldo y probar la utilidad que promete la biología molecular en este campo. Buchan y col llevaron a cabo un estudio clínico con Xpert® SGB Assay, con el cual se logró la identificación de un mayor número de muestras positivas que con el cultivo. De igual manera, en los estudios de Bourgeois-Nicolaos y col y Jost y col se evaluó el Xpert® SGB Assay en líquido amniótico y gástrico, respectivamente, obteniéndose en ambos casos superioridad de la prueba frente al cultivo. Estos resultados dan apoyo a que con la utilización de las pruebas moleculares podría lograrse una disminución de la prevalencia de infecciones de aparición aguda o tardía en el recién nacido. Así mismo, una mejor identificación de pacientes candidatas a profilaxis intraparto(37,58,59).
Conflictos de interés: Ninguno de los autores declara tener auspicios económicos relacionados con el trabajo presentado.
Referencias Bibliográficas
1. Nobbs AH, Jenkinson HF, Everett DB. Generic determinants of Streptococcus colonization and infection. Infect Genet Evol. 2015;33:361-70. doi: 10.1016/j.meegid.2014.09.018. [ Links ]
2. Wessels MR. Infecciones estreptocóccicas. En: Kasper D, Fauci A, Hauser S, Longo D, Jameson JL, Loscalzo J, editores. Principios de medicina interna de Harrison. 19. ed. New York: McGraw-Hill; 2015:963-71. [ Links ]
3. Janda WM. The Genus Streptococcus. Part II: New Species and Pathogens in the "Miscellaneous" Streptococci and "Viridans" Streptococci. Clin Microbiol Newsletter. 2014;36(20):157-66. doi:10.1016/j.clinmicnews.2014.10.002. [ Links ]
4. Malota M, Felbinger TW, Ruppert R, Nüssler NC. Group A Streptococci: A rare and often misdiagnosed cause of spontaneous bacterial peritonitis in adults. Int J Surg Case Rep. 2015;6:251-5. doi: 10.1016/j.ijscr.2014.10.060. [ Links ]
5. Plainvert C, Duquesne I, Touak G, Dmytruk N, Poyart C. In vitro evaluation and comparison of 5 rapid antigen detection tests for the diagnosis of beta-hemolytic group A streptococcal pharyngitis. Diagn Microbiol Infect Dis. 2015;83:105-11. doi: 10.1016/j.diagmicrobio.2015.06.012. [ Links ]
6. Bessen DE, McShan WM, Nguyen SV, Shetty A, Agrawal S, Tettelin H. Molecular epidemiology and genomics of group A Streptococcus. Infect Genet Evol. 2015; 33:393-418. doi: 10.1016/j.meegid.2014.10.011. [ Links ]
7. Wollein K, Raberg L. To harm or not to harm? On the evolution and expression of virulence in group A streptococci. Cell press. 2014;22(1):7-13. doi: 10.1016/j.tim.2013.10.006. [ Links ]
8. Chadnani HK, Jain R, Patamasucon P. Group C Streptococcus causing rheumatic heart disease in a child. J Emerg Med. 2015;49(1):12-4. doi: 10.1016/j.jemermed.2014.12.057. [ Links ]
9. Yeh CC, Tsui KH, Wang PH. Group B streptococci screening. J Chin Med Assoc. 2015;1-2. doi:10.1016/j.jcma.2015.08.008. [ Links ]
10. Ahmadzia HK, Heine RP. Diagnosis and management of group B Streptococcus in pregnancy. Obstet Gynecol Clin N Am. 2014;41(4):629-47. doi:10.1016/j.ogc.2014.08.009. [ Links ]
11. Corredoira J, Alonso MP, García-Garrote F, García-Pais MJ, Coira A, Rabuñal R, et al. Streptococcus bovis group and biliary tract infections: an analysis of 51 cases. Clin Microbiol Infect. [ Links ] 2014;20:405-9. doi: 10.1111/1469-0691.12333.
12. Ceballos CA, Loaiza N, Romero J, Ospina M, Vásquez EM. Caracterización de las gestantes tamizadas para Streptococcus. Clínica del Prado de Medellín (Colombia), año 2010. Infect. 2014;18(2):66-71. doi:10.1016/j.infect.2013.12.002.
13. Al-Kadri HM, Bamuhair SS, Al Johani SM, Al-Buriki NA, Tamim HM. Maternal and neonatal risk factors for early-onset group B streptococcal disease: a case control study. Int J Womens Health. 2013;5:729–35. doi: 10.2147/IJWH.S52206.
14. Brzychczy-Wloch M, Gosiewski T, Bulanda M. Multilocus sequence types of invasive and colonizing neonatal group B streptococci in Poland. Med Princ Pract. 2014;23:323-30. doi: 10.1159/000362368.
15. Lee WT, Lai MC. High prevalence of Streptococcus agalactiae from vaginas of women in Taiwan and its mechanisms of macrolide and quinolone resistance. J Microbiol Immunol Infect. 2015;48(5):510-6. doi: 10.1016/j.jmii.2014.03.002.
16. Al-Maani A, Streitenberger L, Clarke M, Yau YC, Kovach D, Wray R, et al. Nosocomial transmission of group B Streptococci proven by positive environmental culture. Oman Med J. 2014;29(5):376-9. doi: 10.5001/omj.2014.100.
17. Berardi A, Rossi C, Creti R, China M, Gherardi G, Venturelli C, et al. Group B streptococcal colonization in 160 mother-baby pairs: a prospective cohort study. J Pediatr. 2013;163(4):1099-104. doi: 10.1016/j.jpeds.2013.05.064.
18. Crespo-Ortiz MdelP, Castañeda-Ramirez CR, Recalde-Bolaños M, Vélez-Londoño JD. Emerging trends in invasive and noninvasive isolates of Streptococcus agalactiae in a Latin American hospital: a 17-year study. BMC Infect Dis. 2014;14:428. doi: 10.1186/1471-2334-14-428.
19. Scasso S, Laufer J, Rodriguez G, Alonso JG, Sosa CG. Vaginal group B streptococcus status during intrapartum antibiotic prophylaxis. Int J Gynaecol Obstet. 2015;129(1):9-12. doi: 10.1016/j.ijgo.2014.10.018.
20. Perugini Biasi-Garbin R, Saori Otaguiri E, Morey AT, Fernandes da Silva M, Belotto Morguette AE, Armando Contreras et al. Effect of Eugenol against Streptococcus agalactiae and synergistic interaction with biologically produced silver nanoparticles. Evid Based Complement Alternat Med.2015;2015:861497. doi: 10.1155/2015/861497.
21. Tamariz-Ortiz JH, Obregon-Calero M, Jara-Aguirre JC, Díaz-Herrea J, Jefferson-Cortez L, Guerra-Allison H. Colonización vaginal y anorectal por Streptococcus agalactiae en gestantes de los Hospitales Nacionales Cayetano Heredia y Arzobispo Loayza. Rev Med Hered. 2004;15 (3):144-50.
22. Chan GJ, Lee AC, Baqui AH, Tan J, Black RE. Prevalence of early-onset neonatal Infection among newborns of mothers with bacterial infection or colonization: a systematic review and meta-analysis. BMC Infect Dis. 2015;15:118. doi: 10.1186/s12879-015-0813-3.
23. Stoner TD, Weston TA, Trejo J, Doran KS. Group B streptococcal infection and activation of human astrocytes. PLoS One. 2015;10(6):e0128431. doi: 10.1371/journal.pone.0128431.
24. Whidbey C, Harrell MI, Burnside K, Ngo L, Becraft AK, Iyer LM, et al. A hemolytic pigment of Group B Streptococcus allows bacterial penetration of human placenta. J Exp Med. 2013;210(6):1265-81. doi: 10.1084/jem.20122753.
25. Seliga-Siwecka JP, Kornacka MK. Neonatal outcome of preterm infants born to mothers with abnormal genital tract colonisation and chorioamnionitis: a cohort study. Early Hum Dev. 2013;89(5):271-5. doi: 10.1016/j.earlhumdev.2012.10.003.
26. Namavar Jahromi B, Poorarian S, Poorbarfehee S. The prevalence and adverse effects of group B streptococcal colonization during pregnancy. Arch Iran Med. 2008;11(6):654-7.
27. Six A, Joubrel C, Tazi A, Poyart C. Infections materno-fœtales à Streptococcus agalactiae. Presse Med. 2014;43(6):706-14. doi:10.1016/j.lpm.2014.04.008.
28. Cruz M, Doren A, Tapia JL, Abrazúa F. Sepsis neonatal por Streptococcus Grupo B. Rev Chil Pediatr. 2008;79(5):462-70. http://dx.doi.org/10.4067/S0370-41062008000500003.
29. Wang X, Buhimschi CS, Temoin S, Bhandari V, Han YW, Buhimschi IA. Comparative microbial analysis of paired amniotic fluid and cord blood from pregnancies complicated by preterm birth and early-onset neonatal sepsis. PLoS One. 2013;8(2):e56131. doi: 10.1371/journal.pone.0056131.
30. Le Doare K, Allen L, Kampmann B, Heath PT, Taylor S, Hesseling AC, et al. Anti-group B Streptococcus antibody in infants born to mothers with human immunodeficiency virus (HIV) infection. Vaccine. 2015;33(5):621-7. doi: 10.1016/j.vaccine.2014.12.025.
31. Elling R, Hufnagel M, de Zoysa A, Lander F, Zumstein K, Krueger M, et al. Synchronous recurrence of group B streptococcal late-onset sepsis in twins. Pediatrics. 2014;133(5):e1388-91. doi: 10.1542/peds.2013-0426.
32. Brigtsen AK, Dedi L, Melby KK, Holberg-Petersen M, Radtke A, Lyng RV, et al. Comparison of PCR and serotyping of Group B Streptococcus in pregnant women: the Oslo GBSstudy. J Microbiol Methods. 2015;108:31-5. doi: 10.1016/j. mimet.2014.11.001.
33. Di Bartolomeo S, Gentile M, Priore G, Valle S, Di Bella A. Streptococcus agalactiae en embarazadas. Prevalencia en el Hospital Nacional Alejandro Posadas. Rev Argent Microbiol. 2005;37(3):142-4.
34. de Melo SC, Gavena AA, Silva FT, Moreira RC, de Lima Scodro RB, Cardoso RF, et al. Performance of Hitchens-Pike-Todd-Hewitt medium for group B streptococcus screening in pregnant women. PLoS One. 2015;10(4):e0123988. doi: 10.1371/journal.pone.0123988.
35. Chung MY, Ko DJ, Chen CC, Huang CB, Chung CH, Chen FS, et al. Neonatal group B streptococcal infection: a 7-year experience. Chang Gung Med J. 2004;27(7):501-8.
36. Wang P, Ma Z, Tong J, Zhao R, Shi W, Yu S, et al. Serotype distribution, antimicrobial resistance, and molecular characterization of invasive group B Streptococcus isolates recovered from Chinese neonates. Int J Infect Dis. 2015;37:115-8. doi: 10.1016/j.ijid.2015.06.019.
37. Buchan BW, Faron ML, Fuller D, Davis TE, Mayne D, Ledeboer NA. Multicenter clinical evaluation of the Xpert GBS LB assay for detection of group B Streptococcus in prenatal screening specimens. J Clin Microbiol. 2015;53(2):443-8. doi: 10.1128/ JCM.02598-14.
38. Kojima K, Tanaka R, Nakajima K, Kurihara N, Oba MS, Yamashita Y, et al. Predicting outcomes of neonates born to GBS-positive women who received inadequate intrapartum antimicrobial prophylaxis. Turk J Pediatr. 2014;56(3):238-42.
39. Edwards RK, Tang Y, Raglan GB, Szychowski JM, Schulkin J, Schrag SJ. Survey of American obstetricians regarding group B streptococcus: opinions and practice patterns. Am J Obstet Gynecol. 2015;213(2):229.e1-7. doi: 10.1016/j. ajog.2015.03.047.
40. Ganor-Paz Y, Kailer D, Shechter-Maor G, Regev R, Fejgin MD, Biron-Shental T. Obstetric and neonatal outcomes after preterm premature rupture of membranes among women carrying group B streptococcus. Int J Gynaecol Obstet. 2015;129(1):13-6. doi: 10.1016/j.ijgo.2014.10.024.
41. Arias-Camison JM. Late onset group B streptococcal infection from maternal expressed breast milk in a very low birth weight infant. J Perinatol. 2003;23(8):691-2.
42. Wang P, Tong JJ, Ma XH, Song FL, Fan L, Guo CM, et al. Serotypes, antibiotic susceptibilities, and multi-locus sequence type profiles of Streptococcus agalactiae isolates circulating in Beijing, China. PLoS One. 2015;10(3):e0120035. doi: 10.1371/journal.pone.0120035.
43. Yook JH, Kim MY, Kim EJ, Yang JH, Ryu HM, Oh KY, et al. Risk factors associated with group B streptococcus resistant to clindamycin and erythromycin in pregnant korean women. Infect Chemother. 2013;45(3):299-307. doi: 10.3947/ ic.2013.45.3.299.
44. Usein CR, Militaru M, Cristea V, Străuţ M. Genetic diversity and antimicrobial resistance in Streptococcus agalactiae strains recovered from female carriers in the Bucharest area. Mem Inst Oswaldo Cruz. 2014;109(2):189-96. DOI: 10.1590/0074-0276140431.
45. Kwatra G, Adrian PV, Shiri T, Buchmann EJ, Cutland CL, Madhi SA. Serotype-specific acquisition and loss of group B streptococcus recto-vaginal colonization in late pregnancy. PLoS One. 2014;9(6):e98778. doi: 10.1371/journal.pone.0098778.
46. Tajbakhsh S, Norouzi Esfahani M, Emaneini M, Motamed N, Rahmani E, Gharibi S. Identification of Streptococcus agalactiae by fluorescent in situ hybridization compared to culturing and the determination of prevalence of Streptococcus agalactiae colonization among pregnant women in Bushehr, Iran. BMC Infect Dis. 2013;13:420. doi: 10.1186/1471-233413-420.
47. Larsen JW, Sever JL. Group B Streptococcus and pregnancy: a review. Am J Obstet Gynecol. 2008;198(4):440-8. doi: 10.1016/j.ajog.2007.11.030.
48. Steer PJ, Plumb J. Myth: group B streptococcal infection in pregnancy: comprehended and conquered. Semin Fetal Neonatal Med. 2011;16(5):254-8. doi: 10.1016/j. siny.2011.03.005.
49. Schrag S, Gorwitz R, Fultz-Butts K, Schuchat A. Prevention of perinatal Group B Streptococcal disease. Atlanta, GA: CDC, Division of Bacterial and Mycotic Diseases, National Center for Infectious Diseases; 2002.
50. Joubrel C, Gendron N, Dmytruk N, Touak G, Verlaguet M, Poyart C, et al. Comparative evaluation of 5 different selective media for Group B Streptococcus screening in pregnant women. Diagn Microbiol Infect Dis. 2014;80(4):282-4. doi: 10.1016/j.diagmicrobio.2014.08.005.
51. Verani JR, McGee L, Schrag SJ. Prevention of perinatal group B streptococcal disease––revised guidelines from CDC, 2010. Division of Bacterial Diseases, National Center for Immunization and Respiratory Diseases, Centers for Disease Control and Prevention (CDC). MMWR Recomm Rep. 2010;59 (RR– 10):1–36.
52. Cepheid. Xpert® GBS LB & Xpert® GBS. California: Cepheid; 2015.
53. Cepheid. Xpert GBS -GXGBS-100N-10 GXGBS-100N-10 [Internet]. California: Cepheid; 2015 [acceso 10 de diciembre de 2015]. Disponible en: http://www.diagnostictechnology.com. au/persistent/catalogue_files/products/xpertgbspi.pdf
54. FDA. Fdagov [Internet]. Silver Spring, MD: FDA; 2015 [acceso 10 de diciembre de 2015]. Disponible en: http://www. fda.gov/MedicalDevices/ProductsandMedicalProcedures/ DeviceApprovalsandClearances/Recently-ApprovedDevices/ ucm083015.htm
55. BD Diagnostic. BD GeneOhm™ StrepB [Internet]. Quebec: BD Diagnostic; 2015 [acceso 10 de diciembre de 2015].Disponible en: https://www.bd.com/ds/technicalCenter/inserts/ P0001(02) SC StrepB IVD PI.pdf.
56. BD Diagnostic. BD GeneOhm™ StrepB [Internet]. San diego, California: BD Diagnostic; 2006 [acceso 10 de diciembre de 2015].Disponible en: http://www.bd.com/resource.aspx?IDX=18877.
57. Couturier BA, Weight T, Elmer H, Schlaberg R. Antepartum screening for group B Streptococcus by three FDA-cleared molecular tests and effect of shortened enrichment culture on molecular detection rates. J Clin Microbiol. 2014 Sep;52(9):3429-32. doi: 10.1128/JCM.01081-14.
58. Bourgeois-Nicolaos N, Cordier AG, Guillet-Caruba C, Casanova F, Benachi A, Doucet-Populaire F. Evaluation of the Cepheid Xpert GBS assay for rapid detection of group B Streptococci in amniotic fluids from pregnant women with premature rupture of membranes. J Clin Microbiol. 2013;51(4):1305-6. doi: 10.1128/JCM.03356-12.
59. Jost C, Bercot B, Jacquier H, Raskine L, Barranger E, Mouchnino G, Cambau E. Xpert GBS assay for rapid detection of group B streptococcus in gastric fluid samples from newborns. J Clin Microbiol. 2014;52(2):657-9. doi: 10.1128/ JCM.02532-13.
Correspondencia: Ana Cristina Toro Moreno, Universidad Pontificia Bolivariana, Sede Central Medellín, Circular 1 No. 70-01, Medellín, Colombia. Grupo Biología de Sistemas, Escuela de Ciencias de la Salud, Facultad de Medicina. Teléfono: +57(4) 4936300 Fax: +57(4) 2572428 ana.toromo@upb.edu.co
Artículo recibido el 12 de febrero de 2016 y aceptado para publicación 10 de marzo de 2016.