Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.62 no.3 Lima jul./set. 2016
CONTROVERSIAS EN GINECOLOGÍA Y OBSTETRICIA
Diagnóstico prenatal de anomalías cromosómicas. Biopsia de vellosidades coriales y amniocentesis para cariotipo fetal
Prenatal diagnosis of chromosomal abnormalities Chorionic villous sampling and amniocentesis for fetal karyotyping
Moisés Huamán G.1, María Isabel Quiroga de Michelena2, Brad St. Martin3, Moisés Huamán J.1
1 Instituto Latinoamericano de Salud Reproductiva (ILSAR), Lima, Perú.
2 Instituto de Medicina Genética: Lima- Perú.
3 Universidad de Kentucky, Kentucky, EE UU.
Resumen
Introducción: El diagnóstico prenatal temprano de anomalías cromosómicas requiere de técnicas invasivas, como la biopsia de vellosidades coriales (BVC) y la amniocentesis (AMC), con el fin de obtener células fetales, cultivarlas y obtener el cariotipo en los fetos con riesgo alto para estas anomalías, identificadas mediante marcadores ecográficos y bioquímicos desde las 11 semanas. Reportamos nuestra experiencia hasta junio del año 2016. Diseño: Estudio descriptivo longitudinal. Institución: Instituto Latinoamericano de Salud Reproductiva (ILSAR), Lima, Perú. Participantes: Fetos de primer y segundo trimestres del embarazo. Intervenciones: Se analizó los resultados del estudio de 400 fetos que cursaban el primer y segundo trimestre y que tenían riesgo alto para anomalías cromosómicas (mayor de 1/270 inicialmente y 1/100 desde el año 2012), resultado cuantificado utilizando la base de datos del Fetal Test de España más el resultado de los marcadores bioquímicos (riesgo combinado). El análisis del cariotipo fetal se realizó en muestras obtenidas por medio de 338 amniocentesis genéticas y 62 biopsias de vellosidades coriales realizadas durante el período comprendido de enero 2003 a junio 2016 en nuestro centro ILSAR. Principales medidas de resultados: Presencia de arcadores ecográficos y normalidad de los cariotipos. Resultados: Los marcadores ecográficos encontrados con mayor frecuencia fueron: higroma quístico (35,8%), translucencia nucal aumentada (13%), ductus venoso con onda de velocidad de flujo anormal (8,5%), dos o más marcadores asociados a anomalías fetales (13,7%). De 400 muestras estudiadas, 141 (35%) fueron cariotipos anormales: 64 (45%) T21, 35 (25%) T18, 21 (15%) 45X, 7 (5%) T13, 14 (10%) otras anomalías. No hubo complicación importante alguna atribuida al procedimiento invasivo. Conclusiones: En los fetos con riesgo alto para anomalías cromosómicas estudiados, el 35% tuvo cariotipo anormal, siendo las más frecuentes las trisomías de los cromosomas 21 y 18, seguidas de la monosomía del cromosoma X. El higroma quístico, la translucencia nucal aumentada y la presencia de 2 o más marcadores asociados a anomalías fetales fueron los hallazgos más frecuentes en la determinación del riesgo ecográfico. El higroma quístico mostró el mayor valor predictivo para anomalías cromosómicas.
Palabras clave: Diagnóstico Prenatal; Amniocentesis Genética; Biopsia de Vellosidades Coriales; Anomalía Cromosómica.
Abstract
Introduction: Early prenatal diagnosis of chromosomal abnormalities requires invasive techniques, including chorionic villous sampling (CVS) and amniocentesis (AMC) in order to acquire, culture and kayotype cells from fetuses at high risk for these abnormalities based on sonographic and biochemical markers present after week 11. We report our experience through June 2016.Design: Descriptive, longitudinal study. Setting: Instituto Latinoamericano de Salud Reproductiva (ILSAR), Lima, Peru. Participants: First and second trimester of pregnancy fetuses. Interventions: Results of the study of 400 first and second trimester fetuses at high risk for chromosomal abnormalities (greater than 1/270 initially or 1/100 starting in 2012) based on Spain Fetal Test database and the results of biochemical markers (combined risk). Fetal karyotype analysis was performed on samples obtained from 338 genetic AMC and 62 CVS from January 2003 to June 2016. Main outcomes measures: Presence of ultrasound markers and normality of karyotypes. Results: The sonographic markers of complications identified most frequently were the following: cystic hygroma (35.8%), increased nuchal translucency (13%), abnormal ductus venosus waveforms (8.5%), two or more markers associated with fetal anomalies (13.7%). Out of the 400 samples studied, 141 (35%) had abnormal karyotypes: 64 (45%) trisomy 21, 35 (25%) trisomy 18, 21 (15%) monosomy X, 7 (5%) trisomy 13, and 14 (10%) other abnormalities. No major complications were attributed to the invasive procedure. Conclusions: Among these fetuses at high risk for chromosomal abnormalities, 35% had an abnormal karyotype. The most frequent chromosomal abnormalities were trisomies 21 and 18, followed by monosomy X. Cystic hygroma, increased nuchal translucency, and the presence of 2 or more markers associated with fetal anomalies were the most common findings in determining the sonographic risk of abnormalities. Cystic hygroma showed the highest predictive value for chromosomal abnormalities.
Keywords: Prenatal Diagnosis; Genetic Amniocentesis; Chorionic Villous Sampling; Chromosomal Abnormalities.
Introducción
Las anomalías cromosómicas son la primera causa de pérdidas embrionarias y fetales del primer trimestre. En los abortos espontáneos se han encontrado múltiples anomalías, siendo las más frecuentes las trisomías, poliploidías, monosomías, entre otras, espectro que aumenta con los estudios de microdelecciones(1).
El diagnóstico prenatal temprano de anomalías cromosómicas es una necesidad en el control prenatal actual. Es posible identificar con seguridad los fetos con riego elevado para esta patología utilizando los marcadores ecográficos del primer trimestre, entre las 11 y 13 semanas y 6 días: higroma quístico, translucencia nucal aumentada, ausencia de huesos nasales, onda de velocidad de flujo (OVF) anormal del ductus venoso, flujo retrógrado en la válvula trícuspídea, OVF invertida en la arteria umbilical, anomalías del feto y/o de los anexos. Se adicionan los factores epidemiológicos, como la edad materna, antecedente de anomalías cromosómicas y los marcadores bioquímicos del primer trimestre: subunidad beta libre de la gonadotropinas coriónicas (GTC) y la proteína A de la gestación (PAP-A), cuyos valores integrados en una base de datos proporcionan un riesgo. Si es mayor de 1/100, nos permite aconsejar la prueba diagnóstica que es el cariotipo de la muestra celular fetal, obtenida por medio de la biopsia de vellosidades coriales (BVC) que se realiza entre las 11 y 14 semanas de gestación, obteniendo los resultados en 2 semanas promedio(2-9).
Resumimos las indicaciones para el estudio prenatal de anomalías cromosómicas:
-
Un padre portador de reordenamiento cromosómico balanceado.
-
Hijo previo con síndrome de Down u otras anomalías cromosómicas.
-
Aborto espontáneo aneuploide en gestación previa.
-
Historia familiar de malformaciones congénitas y otras alteraciones de etiología cromosómica.
-
Hallazgos ultrasonográficos de malformaciones fetales asociadas con anomalías cromosómi
-
Riesgo alto para anomalías cromosómicas calculado en la base de datos utilizando los marcadores ecográficos y bioquímicos.
-
Riesgo alto por ADN fetal libre en sangre materna.
El riesgo para trisomías aumenta con la edad materna. Si se incluye a gestantes de 35 años a más y se les realiza una prueba diagnóstica (amniocentesis o BVC), se detectaría el 50% de T21 para una tasa de falsos positivos de 5%, debiendo realizar procedimientos invasivos innecesarios con la pérdida de fetos sanos como complicación del procedimiento. El riesgo de síndrome de Turner y triploidías no cambia con la edad materna(2-4).
La translucencia nucal (TN), que corresponde al acúmulo subcutáneo de líquido detrás del cuello fetal en el primer trimestre de gestación, tiene una incidencia de anomalías cromosómicas relacionada a un grosor mayor a 2,5 mm, o por encima del percentil 95 para la longitud corona-nalga. Dicha medida debe realizarse entre las 11 y 13 semanas 6 días y/o con una longitud corona-nalga de 45 a 84 mm. El tamizaje mediante la TN puede identificar a más de 75% de los fetos con trisomía 21, para una tasa de falsos positivos de 5%(4-8).
El examen de los huesos nasales realizado correctamente puede evidenciar ausencia o hipoplasia de estos, lo que ocurre en los fetos cromosómicamente normales en 1% en la población caucásica y alrededor de 10% en los afro-caribeños. El hueso nasal está ausente en 60 a 70% de los fetos con trisomía 21, en alrededor de 50% de los fetos con trisomía 18 y en 30% de los fetos con trisomía 13(8-11).
El ductus venoso anormal (onda A llega a la línea de base o está invertida, o el IP está por encima del percentil 95) entre las 11 y 13 semanas 6 días se observa en 5% de los fetos cromosómicamente normales y en aproximadamente 80% de los fetos con trisomía 21(8,12).
La regurgitación tricuspídea (RT) es otro marcador importante en relación a riesgo de anomalías cromosómicas y cardiovasculares. Si se asocia con aumento de translucencia nucal, la prevalencia de aneuploidías puede llegar al 65% de trisomía 21 y en 8,5% de fetos euploides, con un cociente de probabilidad de 8,4 para cardiopatías congénitas. En una publicación más reciente, la frecuencia encontrada de regurgitación tricuspídea fue de 55% en fetos con trisomía 21, de 30% en trisomías 18 y 13, y apenas 1% en fetos cromosómicamente normales. Hay que destacar, sin embargo, que los datos publicados han sido obtenidos en poblaciones de riesgo alto, por lo que se requiere mayor investigación para evaluar el verdadero valor predictivo de este marcador(8,13).
El ángulo facial abierto (por encima del percentil 95, la longitud corona-nalga) también se ha descrito como marcador de riesgo para T21(8,14).
Con relación a los marcadores bioquímicos en suero materno, en embarazos con trisomía 21 a las 11 a 13 semanas 6 días, la concentración sérica materna de B-hCG libre es mayor y la de PAPP-A (proteína plasmática A asociada al embarazo) es menor que en los fetos euploides. En las trisomías 18 y 13, los niveles de B-hCG libre y PAPP-A están disminuidos. El tamizaje mediante la combinación de la ecografía con la TN, ausencia del hueso nasal, la B-hCG libre y PAPP-A en suero materno, puede identificar al 95% de los fetos con trisomía 21, para una tasa de falsos positivos de 5% entre las 11 y 13 semanas 6 días(3,8,9,15,16).
En las anomalías cromosómicas sexuales, la B-hCG libre es normal y la PAPP-A está disminuida. En la triploidía de origen paterno, la B-hCG libre está muy aumentada mientras que la PAPP-A está ligeramente disminuida. La triploidia de origen materno se asocia a niveles muy bajos de B-hCG libre y PAPP-A(3,8,9).
Los hallazgos ecográficos, bioquímicos y epidemiológicos son ingresados en una base de datos (utilizamos el Fetal Test de España), obteniendo el riesgo cuantificado para ese feto, de acuerdo al cual se hará la consejería.
Actualmente no se recomienda la amniocentesis temprana (antes de las 14 semanas), debido al aumento de la pérdida de embarazos (7,6% versus 5,9%; RR 1,29; IC95% 1,03 a 1,61)(2) y a una mayor incidencia de pie bot en comparación con la BVC (1,8% versus 0,2%; RR 6,43; IC95% 1,68 a 24,64). Comparada con la amniocentesis en el segundo trimestre, la BVC transcervical conlleva un riesgo significativamente mayor de pérdida de embarazo (14,5% versus 11%; RR 1,40; IC95% 1,09 a 1,81) y aborto espontáneo (12,9% versus 9,4%; RR 1,50; IC95% 1,07 a 2,11); estas cifras estadísticas son referidas a pérdida de embarazo en general(17,18).
La evidencia actual muestra que la amniocentesis en el segundo trimestre es más segura que la BVC por vía transcervical y la amniocentesis temprana; si se requiere un diagnóstico temprano, la BVC transabdominal es preferible a la amniocentesis temprana o la BVC transcervical(17,18).
En conclusión, la amniocentesis no debería de realizarse antes de las 14 semanas ni la BVC transabdominal antes de las 11 semanas de gestación; la BVC transcervical está contraindicada. Se aconseja que las técnicas invasivas debieran ser realizadas por profesionales entrenados.
Los marcadores ecográficos asociados con anomalías cromosómicas en el segundo trimestre no son patognomónicos para determinada anomalía cromosómica, y tienen diferente valor predictivo: la trisomía 21 se asocia a agenesia o hipoplasia de los huesos nasales, aumento del grosor del pliegue nucal, anomalías cardíacas, atresia duodenal, intestino hiperecogénico, pielectasia bilateral leve, acortamiento del fémur y aún más del húmero, signo de la sandalia (sandal gap), clinodactilia, hipoplasia de la falange media del quinto dedo, entre otros(19,20).
La trisomía 18 se asocia con el cráneo en forma de fresa, quistes de plexos coroideos, agenesia del cuerpo calloso, aumento de la cisterna magna, hendidura facial, micrognatia, edema nucal, anomalías cardíacas, hernia diafragmática, atresia esofágica, onfalocele, arteria umbilical única, anomalías renales, intestino hiperecogénico, mielomeningocele, restricción del crecimiento y acortamiento de las extremidades, aplasia radial, dedos superpuestos y pie en mecedora(19,20).
La trisomía 13 se asocia con holoprosencefalia, microcefalia, anomalías faciales, anomalías cardíacas, riñones grandes e hiperecogénicos, onfalocele y polidactilia post axial, entre otras(19,20).
La triploidia de origen paterno se asocia con una placenta molar y el embarazo rara vez persiste más allá de las 20 semanas. En la triploidía de origen materno, el embarazo puede persistir hasta el tercer trimestre, la placenta es de con asistencia normal aunque fina y el feto muestra una severa restricción del crecimiento de tipo asimétrico; frecuentemente existe una ventriculomegalia leve, micrognatia, anomalías cardíacas, mielomeningocele y sindactilia(19,20).
El síndrome de Turner se asocia con higroma quístico nucal, edema generalizado, hidropesía, anomalías cardíacas, riñón en herradura, entre otros.(19,20)
La sistemática desarrollada para el estudio de los marcadores ecográficos de riesgo para anomalías cromosómicas debe ser parte del estudio morfológico feto placentario del segundo trimestre.
En los últimos años está a disposición la prueba no invasiva de tamizaje utilizando el ADN libre fetal en sangre materna (NIPT), el que procede de la apoptosis de células trofoblásticas y que puede ser separado del ADN libre materno por procesos de secuenciamiento realizados en laboratorios especializados (la muestra de sangre materna es enviada a otro país). Es posible detectar anomalías de los cromosomas 13, 18, 21, X, Y, algunas micro deleciones y otras anomalías no identificadas con el cariotipo habitual. Se realiza desde las 10 semanas de gestación y el valor predictivo es mayor que las pruebas habituales utilizando la ecografía y los marcadores bioquímicos. Sin embargo, el costo y otras limitaciones actuales limitan la aplicación más amplia de esta prueba que muestra un futuro importante, y que de acuerdo a las actuales investigaciones tienen como punto de partida las pruebas combinadas ofrecidas habitualmente para el tamizaje del riesgo de anomalías cromosómicas(21-24).
Métodos
Se realizó un estudio clínico, descriptivo longitudinal, analizando los resultados de 400 muestras obtenidas: 338 por amniocentesis y realizadas entre las 14 y 22 semanas de gestación, y 62 biopsias de vellosidades coriales (BVC) realizadas entre las 11 y 13 semanas, en embarazos con riesgo alto para anomalías cromosómicas. Para el cálculo se utilizó la base de datos del Fetal Test de España, entre el año 2003 y junio del 2016. Inicialmente se consideró riesgo alto combinado cuando era > a 270 y a partir del 2012 cuando era > a 100. Los procedimientos invasivos se realizaron en el Instituto Latinoamericano de Salud Reproductiva-ILSAR y los análisis citogenéticos en el Instituto de Medicina Genética. Todas las gestantes y sus esposos firmaron el documento de consentimiento informado.
La técnica utilizada en la BVC fue: elección por ecografía de un punto adecuado para la punción, asepsia, punción con aguja número 20, de 12 cm de longitud, introducción de la aguja bajo guía ecográfica hasta la zona del corion, en donde con movimiento de vaivén vertical y bajo presión negativa se aspiró la muestra hacia una jeringa que contiene el medio de cultivo.
La amniocentesis se realizó con los mismos pasos, utilizando aguja 22, obteniendo 15 mL de líquido amniótico.
El estudio cromosómico se hizo con las técnicas habituales; en todos los casos los cultivos se sembraron por duplicado. Se analizó no menos de 15 células por muestra y se imprimió dos o más cariotipos para cada paciente. Nueve muestras no cultivaron; en ellas, se repitió el procedimiento invasivo.
Se estudiaron los casos que resultaron positivos para anomalía cromosómica, la frecuencia de las indicaciones para los procedimientos invasivos y su relación con anomalía cromosómica, los tipos de anomalía cromosómica, la relación existente entre anomalía cromosómica y el marcador ecográfico, analizando el valor predictivo de los principales marcadores.
Resultados
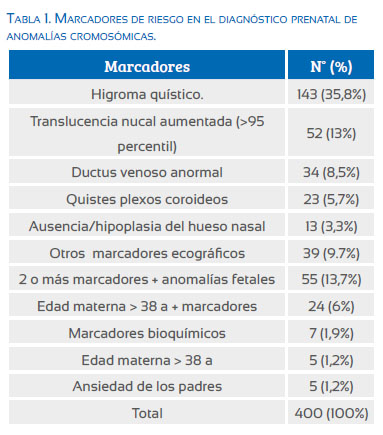
Los marcadores ecográficos de riesgo para anomalías cromosómicas encontrados con mayor frecuencia en el grupo estudiado fueron: higroma quístico (35,8%), translucencia nucal aumentada (13%), ductus venoso con onda de velocidad de flujo (OVF) anormal (4%), quistes de plexos coroideos (5,7%), ausencia o hipoplasia de los huesos nasales (3,3%), otros marcadores (9,7%), dos o más marcadores y anomalías fetales (13,7%), edad materna mayor a 38 años más algún marcador ecográfico (6%), riesgo alto por marcadores bioquímicos (1,9%), solo edad materna > 38 años (1,2%), ansiedad de los padres (1,2%) (Tabla 1).
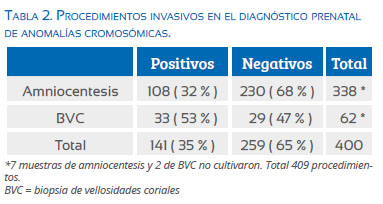
La amniocentesis entre las 14 y 22 semanas fue el procedimiento invasivo más frecuente para la obtención de la muestra (84,5%), mientras que la BVC se hizo en 15,5%.
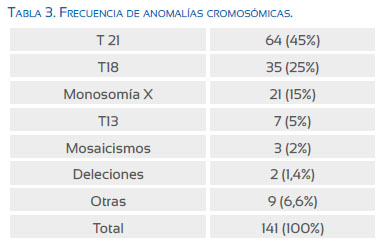
De 400 muestras estudiadas, 141 (35%) fueron cariotipos anormales; entre ellas, las obtenidas a través de la BVC fueron con mayor frecuencia anormales (53 versus 32%) (Tabla 2). Nueve muestras no cultivaron, por lo que se repitió el procedimiento.
Las trisomías 21 y 18, fueron las anomalías más frecuentes (45 y 25%, respectivamente), seguidas de la monosomía del cromosoma X (15%), trisomía 13 (5%), con menor frecuencia los mosaisismos, deleciones, polimorfismo, inversiones, otros (Tabla 3).
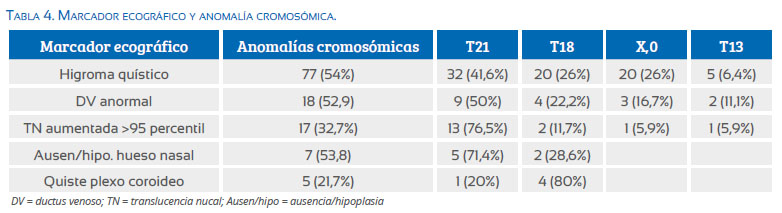
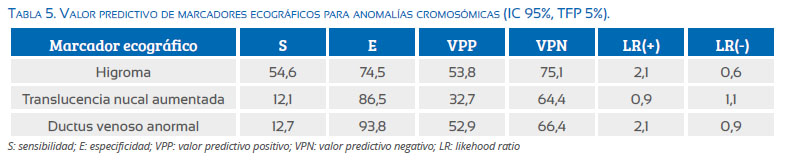
El higroma quístico fue el marcador observado con mayor frecuencia y que tuvo el mayor valor predictivo para detectar anomalías cromosómicas (S: 54,6%, VPP: 53,8%), encontrándose en estos casos con mayor frecuencia T21 (41,6%), T18 (26%), X,0 (26%). El ductus venoso con OVF anormal mostró baja sensibilidad (12,7%), aunque el VPP fue similar al higroma (52,9%). La translucencia nucal aumentada fue el marcador que mostró menor valor predictivo en la identificación del riesgo (tablas 4 y 5).
No se presentaron complicaciones mayores. Hubo un caso de hipotensión materna con bradicardia fetal pasajera, un caso de pérdida de líquido amniótico que sucedió al siguiente día del procedimiento con evolución satisfactoria, contracciones uterinas sin repercusión clínica. En dos casos se observó sangrado intraamniótico sin consecuencias.
Discusión
El estudio prenatal de anomalías cromosómicas debe ser parte del control prenatal en casos de fetos con riesgo alto cuantificado con los marcadores epidemiológicos, ecográficos y bioquímicos habituales o por el tamizaje con ADN fetal libre en sangre materna. Cuando los padres con una adecuada información deciden por la prueba diagnóstica que es el cariotipo fetal. Actualmente se considera riesgo alto cuando es mayor de 1/100 obtenido en una base de dato y/o por ADN fetal libre en sangre materna. La obtención de la muestra de células fetales implica un riesgo de pérdida fetal de 0,5 a 1% para la amniocentesis y BVC, aunque los reportes actuales de series mayores minimizan el riesgo(25-29).
El marcador ecográfico encontrado con mayor frecuencia desde el primer trimestre fue el higroma quístico, el que habitualmente es confundido e informado como translucencia nucal aumentada, sin considerar la diferencia etiopatogénica y la relación con el tipo y frecuencia de anomalías cromosómicas asociadas, como lo hemos demostrado en una publicación anterior. Este marcador se asocia en más de la mitad de casos con diferentes anomalías cromosómicas, a diferencia de la menor asociación de la translucencia nucal aumentada (32,7%)(30).
El flujo anormal en el ductus venoso y la ausencia o hipoplasia de los huesos nasales mostraron importante valor predictivo en el tamizaje de anomalías cromosómicas.
Otros marcadores ecográficos aislados se observaron con menor frecuencia. Sin embargo, la asociación de dos o más marcadores y la presencia de anomalías estructurales en el feto o anexos, entre ellas anomalías cardiovasculares, fueron importantes. Es así que, de 18 casos de hipoplasia de corazón izquierdo diagnosticados entre el primer y segundo trimestre en ese período, el 44% tenía alguna anomalía cromosómica.
La amniocentesis genética fue el procedimiento invasivo más utilizado, aunque en los últimos años los padres y los propios médicos tratantes aceptan la BVC como procedimiento de elección, por la ventaja de tener los resultados con mayor anticipación(31).
De las 141 anomalías cromosómicas diagnosticadas, cerca de la mitad (45%) fue T21; hubo un alto porcentaje (30%) de anomalías letales entre T18 y T13, siguiendo en frecuencia la monosomía del cromosoma X. Estos hallazgos tienen relación con el/los marcadores que cuantificaron el riesgo, lo cual, a pesar de las barreras importantes que limitan a los padres la decisión por la prueba diagnóstica (costos, marco legal restrictivo para el aborto, creencias religiosas, desinformación por parte de los padres y los profesionales involucrados, otros).
El higroma quístico fue el marcador con mayor sensibilidad (S: 54,6%) y valor predictivo positivo (VPP: 53,8%). Valores muy similares mostró el ductus venoso anormal, aunque los casos fueron reducidos. Estos resultados evidencian que en el primer trimestre el higroma quístico y el DV anormal por sí solos son recomendación para la prueba diagnóstica.
El tamizaje utilizando el ADN fetal libre en sangre materna se está extendiendo. De acuerdo a las evidencias actuales, su recomendación esta ría en base a los resultados de la cuantificación del riesgo utilizando los marcadores ecográficos y bioquímicos en una base de datos combinada. Un resultado de riesgo alto es indicación para una prueba diagnóstica(21-24).
En nuestro país, las anomalías cromosómicas letales o de mal pronóstico pueden ser consideradas como causal de interrupción del embarazo, por riesgo en la salud física y mental materna(32).
A la luz de las evidencias actuales, se van superando aspectos controversiales que surgieron al inicio, como era el valor predictivo de la edad materna, la translucencia nucal u otros marca dores ecográficos y los marcadores bioquímicos para la identificación de los fetos con riesgo alto para anomalías cromosómicos. Está claro que debe integrarse todos los parámetros, en lo posible utilizando una base de datos que cuantifique el riesgo, y que en base a ese resultado y con una adecuada información a los padres se pueda aconsejar o no una prueba diagnóstica, y serán ellos los que tomarán la decisión.
La controversia actual está en el lugar de la prueba no invasiva con el ADN libre fetal en sangre materna (NIPT), si esta reemplaza a las otras pruebas habituales de tamizaje. Opinamos que los marcadores ecográficos integrados dentro del examen morfológico y funcional de feto en el primer trimestre no perderá su lugar y mas bien se ampliará con el avance tecnológico de la ultra sonografía; y que a medida que bajen los costos del NIPT y sigan extendiéndose sus aplicaciones, su uso aumentará en fetos con riesgo identificado por el test combinado habitual.
Concluyendo, en la población estudiada el 35% tuvo cariotipo anormal, siendo lo más frecuente las trisomías de los cromosomas 21 y 18, seguidas de la monosomía del cromosoma X. El higroma quístico, la translucencia nucal aumentada y la presencia de 2 o más marcadores asociados a anomalías fetales fueron los hallazgos más frecuentes. El higroma quístico mostró el mayor valor predictivo para anomalías cromosómicas. No hubo complicaciones atribuidas al procedimiento invasivo.
Referencias bibliográficas
1. Mora AP, Paredes D, Rodríguez O, Quispe E, Chavesta F, Klein de Zihelboim E, De Michelena M. Anomalías cromosómicas en abortos espontáneos. Rev Per Ginecol Obstet. 2016;62(2):141-51. [ Links ] http://ww.spog.org.pe/web/revista/index.php/RPGO/article/view/1897/pdf_370
2. Ferguson-Smith MA, Yates JRW. Maternal age-specific rates for chromosomes aberrations and factors influencing them: report of a collaborative European study on 52 965 amniocenteses. Prenal Diagn. 1984 Spring;4 Spec N°.5:44. http://onlinelibrary.wiley.com/doi/10.1002/pd.1970040704/full [ Links ]
3. Hecht CA, Hook EB. The imprecision in rates of Down syndrome by 1-year maternal age intervals: a critical analysis of rates used in biochemical screening. Prenat Diagn. 1994; 14: 729-38. [ Links ] http://onlinelibrary.wiley.com/doi/10.1002/pd.1970140814/full
4. Pandya PP, Snijders RJM, Johnson SJ, Brizot M, Nicolaides KH. Screening for fetal trisomies by maternal age and fetal nuchal translucency thickness at 10 to 14 weeks of gestation. BJMO. 1995;102:957-62. [ Links ] http://onlinelibrary.wiley.com/doi/10.1111/j.1471-0528.1995.tb10902.x/full
5. Snijders RJM, Nicolaides KH. Sequential screening. En: Ultrasound Markers for Fetal Chromosomal Defects. Carnforth, UK: Pathernon Publishing,1996:109-13. [ Links ]
6. Snijders RJM, Noble P, Sebire N, Souka A, Nicolaides KM. UK multicentre project on assessment of risk of trisomy 21 by maternal age and fetal nuchal translucency thickness at 10-14 weeks of gestation. Lancet. 1998;351:343-6. [ Links ] http://www.thelancet.com/pdfs/journals/lancet/PIIS0140- 6736(97)11280-6.pdf
7. Snijders RJM, Sundberg K, Holzgreve W, Henry G, Nicolaides KM. Maternal age and gestation-specific risk for trisomy 21. Ultrasound Obstet Gynecol. 1999 Mar;13(3):167-70. [ Links ] http://onlinelibrary.wiley.com/ doi/10.1046/j.1469-0705.1999.13030167.x/epdf
8. Kypros H. Nicolaides. La ecografía de las 11-13+6 semanas. Fetal Medicine Foundation, Londres, 2004. http://www.fetalmedicine. com/synced/fmf/FMF-spanish.pdf [ Links ]
9. Spencer K, Spencer CE, Power M, Dawson C, Nicolaides KH. Screening for chromosomal abnormalities in the first trimester using ultrasound and maternal serum biochemistry in a one stop clinic: A review of three years prospective experience. BJOG. 2003b;110:281-6. [ Links ] http://onlinelibrary.wiley.com/ doi/10.1046/j.1471-0528.2003.02246.x/epdf
10. Cicero S, Curcio P, Papageorghiou A, Sonek J, Nicolaides KH. Absence of nasal bone in fetuses with trisomy 21 at 11-14 weeks of gestation: an observational study. Lancet. 2001;358:1665-7. [ Links ]
11. Cicero S, Rembouskos G, Vandecruys H, Hogg M. Likelihood ratio for trisomy 21 in fetuses with absent nasal bone at the 11-14 weeks scan. Ultrasound Obstet Gynecol. 2004;23:218- 23. [ Links ] http://www.sciencedirect.com/science/article/pii/ S0140673601067095
12. Matias A, Gomes C, Flack N, Montenegro N. Screening for chromosomal abnormalities at 11-14 weeks: the role of ductus venosus blood flow. Ultrasound Obstet Gynecol. 1998;2:380-4. [ Links ] http://onlinelibrary.wiley.com/doi/10.1046/ j.1469-0705.1998.12060380.x/epdf
13. Kagan KO, Valencia C, Livanos P, Wright D, Nicolaides KH. Tricuspid regurgitation in screening for trisomies 21, 18 and 13 and Turner syndrome at 11+0 to 13+6 weeks of gestation. Ultrasound Obstet Gynecol. 2009;33:18-22. [ Links ] http://onlinelibrary.wiley.com/doi/10.1002/uog.6264/full
14. Farkas LG, Katic MJ, Forrest CR, Litsas L. Surface anatomy of the face in Down syndrome: linear and angular measurement in the craniofacial regions. J Craniofac Surg. 2001;12:373-9. [ Links ] http://journals.lww.com/jcraniofacialsurgery/Abstract/2001/07000/Surface_Anatomy_of_the_Face_ in_Down_s_Syndrome_.11.aspx
15. Huang T, Dennis A, Meschino WS, Rashid S, Mak-Tam E, Cuckle H. First trimester screening for Down syndrome using nuchal translucency, maternal serum pregnancy-associated plasma protein A, free-β human chorionic gonadotrophin, placental growth factor, and α-fetoprotein. Prenatal diagnosis. 2015;35(7):709-16. http://onlinelibrary.wiley.com/ doi/10.1002/pd.4597/full
16. Wiechec M, Knafel A, Nocun A, Matyszkiewicz A, Wiercinska E, Latała E. How effective is ultrasound-based screening for trisomy 18 without the addition of biochemistry at the time of late first trimester? J Perinatal Med.2016;44(2):149- 59. http://www.degruyter.com/view/j/jpme.2016.44.issue-2/jpm-2014-0384/jpm-2014-0384.xml
17. Philip J, Silver RK, Wilson RD. Diagnóstico prenatal invasivo al final del primer trimestre: Resultados de un Ensayo Internacional Randomizado. Rev Chil Obst Ginecol. 2004;69(3):263- 5. [ Links ]
18. Alfirevic Z, Sundberg K, Brigham S. Amniocentesis y toma de muestra de vellosidades coriónicas para el diagnóstico prenatal (Revisión Cochrane). Biblioteca Cochrane Plus, número 2, 2007. http://www.cochrane.org/es/CD003252/amniocentesis-y-toma-de-muestra-de-vellosidades-corionicas-para- el-diagnostico-prenatal [ Links ]
19. Gallo M, Espinosa A, Palermo M. Marcadores ecográficos de la semana 18-22. Rev Colomb Salud Libre. Julio - Diciembre 2007;2(2). [ Links ]
20. Nodarse Rodríguez A, Llanusa Ruiz C, Castillo Sánchez Y, Sánchez Lombana R, Carrillo Bermúdez L, Peña Abreu R. Marcadores ecográficos del segundo trimestre como indicadores de riesgo de cromosomopatías. Rev Cubana Obstet Ginecol. 2009;35(4):85-98. [ Links ] http://scielo.sld.cu/scielo.php?script=sci_ arttext&pid=S0138-600X2009000400010
21. Verweij EJ, van den Oever JM, de Boer MA, Boon EM, Oepkes D.. Diagnostic accuracy of noninvasive detection of fetal trisomy 21 in maternal blood: a systematic review. Fetal Diagn Ther. 2012;31(2):81–6. doi: 10.1159/000333060. [ Links ]
22. Norton ME, Wapner RJ. Cell-free DNA analysis for noninvasive examination of trisomy. N Engl J Med. 2015 Dec 24;37(26):2572. doi: 10.1056/NEJMc1509344. [ Links ]
23. Gil MM, Revello R, Poon LC, Akolekar R, Nicolaides KH. Clinical implementation of routine screening for fetal trisomies in the UK NHS: cell-free DNA test contingent on results from first-trimester combined test. Ultrasound Obstet Gynecol. 2016 Jan;47(1):45-52. doi: 10.1002/uog.15783. [ Links ]
24. Reimers RM, Dobson L, Hanmer K, Pilliod RA, Little SE, Reiff E,Wilkins-Haug L. Pregnancy outcomes for trisomy 21 following NIPT, CVS, and amniocentesis. Am J Obstet Gynecol. 2016;598:214(1):S320. http://www.ajog.org/article/S0002- 9378(15)01948-1/pdf [ Links ]
25. Akolekar R, Beta J, Picciarelli G, Ogilvie C, d’Antonio F. Procedure- related risk of miscarriage following amniocentesis and chorionic villus sampling: a systematic review and meta- analysis. Ultrasound Obstet Gynecol. 2015 Jan;45(1):16- 26. doi: 10.1002/uog.14636. [ Links ]
26. Wah YM, Leung TY, Cheng YK, Sahota DS. Procedure-related fetal loss following chorionic villus sampling after first-trimester aneuploidy screening. Fetal Diagn Ther. 2016 Jul 12 (Publicación electrónica previa a impresión). http://www. karger.com/Article/Abstract/447538 [ Links ]
27. Cowan L, Norton M, Goldman S, Flessel M, Jelliffe-Pawlowski L,Towner D, Currier R. Amniocentesis does not increase the risk of miscarriage in patients with positive prenatal screening. Am J Obstet Gynecol. 2015;350:212(1),S184. [ Links ] http:// www.ajog.org/article/S0002-9378(14)01451-3/pdf
28. Theodora M, Antsaklis A, Antsaklis P, Blanas K, Daskalakis G, Sindos M, Papantoniou N. Fetal loss following second trimester amniocentesis. Who is at greater risk? How to counsel pregnant women? J Matern Fetal Neonatal Med. 2016;29(4):590-5. doi: 10.3109/14767058.2015.1012061. [ Links ]
29. Huamán GM, Quiroga M, Arias J, Huamán JM. Diagnóstico prenatal de anomalías cromosómicas. Ultrasonografía Embrio- Fetal. 2006;2:22-8. http://www.redalyc.org/articulo. oa?id=323428185008 [ Links ]
30. Huamán GM, Sosa AO, Campanero M. Higroma quístico y translucencia nucal aumentada como marcadores de anomalías cromosómicas. Rev Per Ginecol Obstet. 2012;58:267-71. [ Links ] http://www.scielo.org.pe/scielo.php?pid=S2304-51322012000400005&script=sci_arttext
31. Huaman GM. Procedimientos invasivos en el diagnóstico prenatal. Rev Per Ginecol Obstet. 2010;56:258-62. [ Links ] http:// www.redalyc.org/articulo.oa?id=323428198003
32. Guevara RE. Interrupción terapéutica del embarazo en el Instituto Nacional Materno Perinatal, Perú, 2009-2013. Rev Per Ginecol Obstet. 2016;62:19-30. [ Links ] http://www.scielo.org.pe/scielo.php?pid=S2304-1322016000100003&script=sci_arttext
Conflicto de interés: Los autores declaran que no existe conflicto de interés en la presente publicación.
Artículo recibido el 30 de julio de 2016 y aceptado para publicación el 9 de agosto de 2016.
Correspondencia: Dr. Moisés Huamán Guerrero