Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.62 no.3 Lima jul./set. 2016
CASO CLÍNICO
Primer embarazo con transferencia de embriones seleccionados por morfocinética en el Perú
First pregnancy with transfer of morphokinetics-selected embryos in Peru
Jimmy Portella1,a, Denisse Nuñez1,a, Eva Obregón2,b, Nathaly Chávez1,a, Luis Noriega-Hoces1,2,3,b, Luis Guzmán1,c
1 PRANOR. Grupo de Reproducción Asistida. San Isidro, Lima, Perú
2 Clínica Monterrico, Surco, Lima, Perú
3 Clínica Concebir, San Isidro, Lima, Perú
a Embriólogo b Ginecólogo c Embriólogo, PhD.
Resumen
La selección embrionaria usando características morfológicas observadas por pocos segundos bajo el microscopio, ha sido la principal herramienta de selección en las técnicas de reproducción asistida. Sin embargo, el desarrollo embrionario es un proceso dinámico que con la introducción de incubadoras con microcámaras integradas, conocidas como incubadoras con sistema Time Lapse, ha permitido registrar eventos morfológicos y cinéticos del desarrollo embrionario que pueden ser útiles como marcadores de selección, denominándolos parámetros ‘morfocinéticos’. En este reporte de caso damos a conocer el primer embarazo en el Perú mediante la transferencia de embriones seleccionados por parámetros morfocinéticos en una incubadora con sistema Time Lapse.
Palabras clave: Embrión, Técnicas de Cultivo; Embrión Desarrollo Preimplantación; Incubadoras; Transferencia Embrionaria.
Abstract
Embryo selection by using morphological characteristics has been the main tool to select the best embryo to transfer in assisted reproduction technology (ART). However, embryo development is a dynamic process that cannot be monitored with conventional microscopes. The introduction of incubators with an integrated micro-camera system, denominated time-lapse incubators, has allowed to register morphological and kinetic events in human embryos, be coming useful markers for embryo selection. In this report, we present the first pregnancy in Peru using morphokinetic parameters in a time lapse incubator.
Keywords: Embryo culture techniques; Preimplantation Embryonic Development; Incubators; Embryo Transfer.
Introducción
En las técnicas de reproducción asistida (TRA) los embriones seleccionados para la transferencia se realizan bajo criterios morfológicos basados en la observación de unos pocos segundos bajo el microscopio. Sin embargo, el desarrollo embrionario es altamente dinámico y en tiempos cortos pueden ocurrir cambios que no son percibidos durante la evaluación convencional, limitando las diferencias para embriones en el mismo estado celular(1). Además, bajo el sistema de evaluación convencional, las placas de cultivo son trasladadas desde la incubadora hasta la estación del microscopio alterando parámetros como temperatura, oxígeno, pH, exposición a luz y condiciones ambientales que podrían comprometer el desarrollo y viabilidad embrionaria(2).
Actualmente, existen incubadoras que incorporan microcámaras de fotos que permiten monitorear el desarrollo de embriones mediante la toma de imágenes en alta resolución cada 5 a 10 minutos y en 5 a 7 planos focales que son compiladas para generar un vídeo (incubadoras con sistema Time Lapse (TL)). El registro visual obtenido nos permite la evaluación de eventos morfológicos y cinéticos del desarrollo embrionario, término que denominaremos parámetros ‘morfocinéticos’. Estos incluyen desde la expulsión del segundo cuerpo polar, singamia y las sucesivas divisiones de las blastómeras. Los marcadores morfocinéticos han permitido la creación de algoritmos para seleccionar los embriones con mayores probabilidades de implantar(3).
En la selección embrionaria convencional las características que se evalúan son el número de células, fragmentación, simetría y multinucleación; para embriones en estadio de blastocisto se considera el grado de expansión, calidad de la masa celular interna y el trofoectodermo.
El objetivo de este reporte de caso es dar a conocer el primer embarazo en el Perú mediante la transferencia de embriones seleccionados por parámetros morfocinéticos en una incubadora con sistema TL.
Reporte de caso
Paciente de 34 años de edad que fue referida a un procedimiento de fecundación in vitro (FIV) por in-fertilidad secundaria de 4 años. Tenía diagnóstico de endometriosis y dos cirugías previas, así como, antecedente de tratamientos de baja complejidad de 3 inseminaciones intrauterinas en otras clínicas de fertilidad. La paciente tuvo valores basales de FSH 6,1 mIU/mL, LH 4,18 mIU/mL, prolactina 18 ng/ mL, TSH 2,0 mU/L. La calidad seminal se encontraba por encima de los límites de referencia según el quinto Manual de la OMS 2010(4).
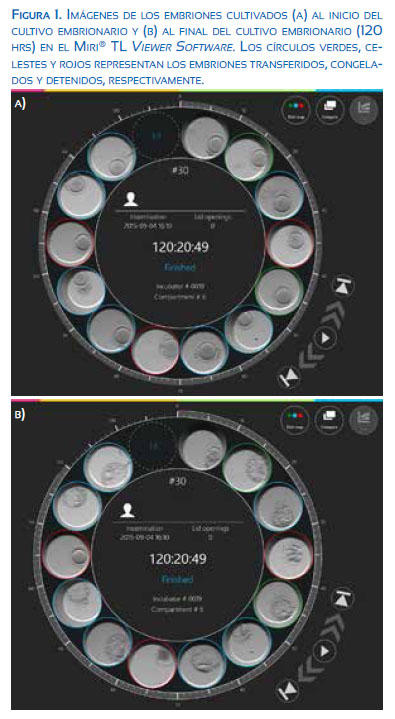
La paciente tuvo estimulación con gonadotrofinas con dosis de 300 UI diarias por 8 días consecutivos. A partir del día 8 de estimulación, recibió el antagonista de la GnRH (Cetrotide 0,25 mg). La maduración final ovocitaria fue gatillada con 250 µg de rhCG (Ovidrel, Merck Serono), cuando se observaron al menos 2 folículos de 17 mm de diámetro. La aspiración folicular se realizó a las 36,5 horas posteriores a la administración del rhCG. Se obtuvieron 15 complejos cúmulo-corona-ovocito y fueron incubados en medio Global® Total for Fertilization (Lifeglobal, Canadá) bajo aceite LiteOil (Lifeglobal, Canadá) a 37 °C, CO2 7%, N2 88% y O2 5%, en incubadoras MINC (Cook, Australia). Luego de tres horas, los ovocitos fueron decumulados y se microinyectaron 13 ovocitos metafase II. A partir de este momento fueron cultivados en medio Global® Total bajo aceite en la placa de cultivo CultureCoin® a 37 °C, CO2 7%, N2 88% y O2 5% en las incubadoras con sistema TL, la incubadora Miri® TL (ESCO, Dinamarca). La incubadora Miri® TL que posee la cámara de fotos integrada fue configurada a través del Miri® TL Viewer Software para la toma de fotografías cada 5 minutos en 7 planos focales (Figura 1a).
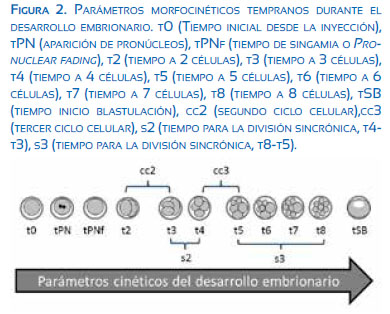
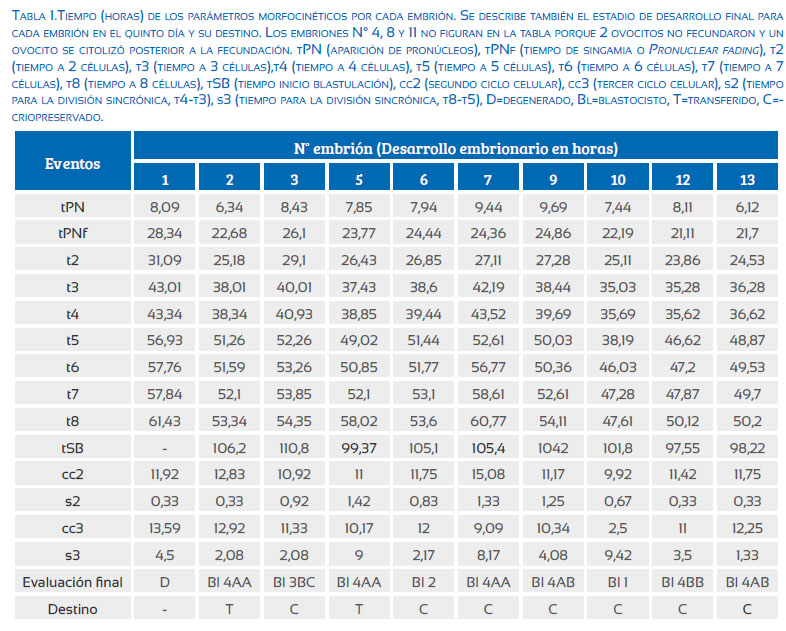
Los siguientes marcadores cinéticos tempranos (Figura 2) fueron evaluados a partir del tiempo de inyección (t0): observación de pronúcleos (tPN), tiempo de singamia o pronuclear fading (tPNf), tiempo a 2 células (c) (t2), 3c (t3), 4c (4t), 5c (t5), 6c (t6), 7c (t7), 8c (t8). Adicionalmente se calculó la duración del segundo ciclo celular (cc2; t3-t2), duración del tercer ciclo celular (cc3; t5-t4), el tiempo de una división sincrónica completa de 2c a 4c (s2; t4-t3) y de 4c a 8c (s3; t8-t5). El tiempo de inicio de blastulación (tSB) fue registrado, pero no se usó como marcador de selección. En el estadio de blastocisto los embriones fueron clasificados de acuerdo al criterio de Gardner y colaboradores(5); el grado de expansión de la cavidad blastocélica tiene una valoración numérica de 1 a 6, donde 1=inicial, 2=medio, 3=completo, 4=expandido, 5=eclosionando, 6=eclosionado; la masa celular interna y trofoectodermo se clasifican A=bueno, B=regular, C=malo.
La presencia de 2 pronúcleos y dos cuerpos polares se observó en 10 ovocitos; 2 ovocitos no fecundaron y 1 ovocito resultó citolizado. El seguimiento del desarrollo se realizó en los 10 cigotos, como se muestra en la Tabla 1. Todos los embriones fueron cultivados hasta el quinto día post-inyección (120 horas), se transfirieron 2 y se vitrificaron 7 (Figura 1b). La selección de los embriones a transferir se basaron en el trabajo de Meseguer y colaboradores (2011), donde los embriones que implantaron presentaron los siguientes tiempos para cada evento: t2 = 25,6±2,2, t3 = 34,4±2,8, t4 = 38,2±3,0, t5 = 52,3±4,2, cc2 = 11,8±1,2, s2 = 0,78±0,73. En nuestro caso, 5 embriones se encontraron dentro de los rangos de tiempo para cada evento (embriones N°: 2, 5, 6, 9 y 13). Por lo tanto, el segundo criterio de decisión se basó en características morfológicas de los blastocistos, transfiriendo los de mejor calidad (embriones N°: 2 y 5).
La transferencia se realizó con el catéter Frydman Ultrasoft (CCD, Francia). El soporte de la fase lútea fue con progesterona micronizada vaginal, en una dosis de 600 mg/día desde el día de la aspiración folicular hasta el segundo mes de embarazo.
El embarazo fue evaluado por la cuantificación sérica de la subunidad beta de la hCG con un valor de 198 mUI/mL, la segunda hCG fue 7 días después con un valor de 1 356 mUI/mL. Luego, se confirmó el embarazo por ecografía transvaginal con la presencia de un saco gestacional y latido cardíaco. Actualmente, el embarazo cursa el tercer trimestre.
Discusión
El presente trabajo describe el primer embarazo tras realizar una transferencia de embriones seleccionados por parámetros morfocinéticos con el uso de la incubadora con sistema TL para el cultivo de embriones.
La calidad embrionaria es el factor más importante dentro de un procedimiento de reproducción asistida por lo cual seleccionar al mejor embrión para transferir es el paso más crítico. La calidad del embrión se ha basado en los criterios de morfología, los cuales han permitido seleccionar embriones asociando el correcto desarrollo embrionario con la apariencia. Se ha demostrado que evaluar la morfología en el estadio de blastocisto permite predecir las tasas de embarazo(6); sin embargo, algunos embriones clasificados de buena calidad no implantan(7). La principal desventaja de utilizar únicamente la morfología como criterio de selección es que se evalúa en intervalos específicos del desarrollo, limitando la información de otros acontecimientos importantes. Por ello, es necesaria la utilización de otros criterios de selección embrionaria que brinden mayor información sobre el potencial implantatorio del embrión.
El desarrollo embrionario es un proceso dinámico en el cual la morfología del embrión puede sufrir notables cambios en unos pocos minutos. Existe evidencia que resalta la importancia de los tiempos de las divisiones celulares en el desarrollo del embrión, ya que pueden predecir el potencial implantatorio. Por lo cual, muchas clínicas especializadas han introducido programas de reproducción asistida con el uso de incubadoras con microcámaras integradas conocidas como incubadoras con sistema Time Lapse. Esta nueva tecnología nos brinda información sobre los acontecimientos importantes del desarrollo embrionario como aparición de los pronúcleos, singamia, sincronía de divisiones celulares, intervalo de ciclos celulares e iniciación de blastulación, los cuales se consideran indicadores del potencial implantatorio del embrión.
A diferencia de la evaluación morfológica convencional, donde podemos obtener 5 imágenes en 120 horas de cultivo (1 cada 24 horas), con la Miri® TL podemos obtener 1 440 imágenes en un solo plano focal y 10 080 imágenes en total (7 planos focales); información importante para la adecuada selección embrionaria.
En general, los beneficios de las incubadoras con sistema TL frente al cultivo convencional son principalmente dos: (i) las condiciones estables de temperatura y gases desde la fecundación hasta el quinto o sexto día de cultivo, sin remover los embriones de la incubadora; y (ii) la observación continua del desarrollo embrionario que nos permite conocer los tiempos y sincronía de división celular (morfocinética).
En el presente reporte de caso con el empleo de la incubadora con sistema TL, permitió ponderar la calidad de los embriones al quinto día de cultivo embrionario(8,9) junto con parámetros morfocinéticos (t2, t3, t4, t5, cc2 y s2) publicados por Meseguer y colaboradores(10), los cuales mostraron una mejor tasa de implantación. Por tanto, para la selección embrionaria se utilizó como primer criterio el t5, luego el s2 y por último el cc2; con lo cual, los embriones potencialmente transferibles eran los embriones 2, 5, 6, 9 y 13. Al adicionar las características morfológicas, los embriones seleccionados para transferir fueron el embrión N° 2 y 5. Los otros embrionarios su pernumerarios fueron vitrificados.
En conclusión, este primer reporte muestra resultados óptimos de la utilización de las incubadoras con sistema TL para los procedimientos de reproducción asistida. Futuros casos nos permitirán establecer algoritmos para la selección y predicción de embarazos.
Referencias bibliográficas
1. Desai N, Ploskonka S, Goodman LR, Austin C, Goldberg J, Falcone T. Analysis of embryo morphokinetics, multinucleation and cleavage anomalies using continuous time-lapse monitoring in blastocyst transfer cycles. Reprod Biology Endocrinol. 2014;12:54. doi: 10.1186/1477-7827-12-54. [ Links ]
2. Wale PL, Gardner DK. The effects of chemical and physical factors on mammalian embryo culture and their importance for the practice of assisted human reproduction. Hum Reprod Update. 2016;22(1):2-22. doi: 10.1093/humupd/ dmv034. [ Links ]
3. Basile N, Vime P, Florensa M, Aparicio Ruiz B, Garcia Velasco JA, Remohi J, et al. The use of morphokinetics as a predictor of implantation: a multicentric study to define and validate an algorithm for embryo selection. Hum Reprod. 2015;30(2):276-83. doi: 10.1093/humrep/deu331. [ Links ]
4. World Health Organization. WHO laboratory manual for the examination and processing of human semen. 5th ed. Geneva: World Health Organization; 2010;xiv:271 p. [ Links ]
5. Gardner DK, Lane M, Stevens J, Schlenker T, Schoolcraft WB. Blastocyst score affects implantation and pregnancy outcome: towards a single blastocyst transfer. Fertil Steril. 2000;73(6):1155-8. [ Links ]
6. Alpha Scientists in Reproductive Medicine and ESHRE Special Interest Group of Embryology. The Istanbul consensus workshop on embryo assessment: proceedings of an expert meeting. Hum Reprod. 2011;26(6):1270-83. doi: 10.1093/ humrep/der037. [ Links ]
7. Yang Z, Zhang J, Salem SA, Liu X, Kuang Y, Salem RD, et al. Selection of competent blastocysts for transfer by combining time-lapse monitoring and array CGH testing for patients undergoing preimplantation genetic screening: a prospective study with sibling oocytes. BMC Medl Genomics. 2014;7:38. doi: 10.1186/1755-8794-7-38. [ Links ]
8. Van den Abbeel E, Balaban B, Ziebe S, Lundin K, Cuesta MJ, Klein BM, et al. Association between blastocyst morphology and outcome of single-blastocyst transfer. Reprod Biomed Online. 2013;27(4):353-61. doi: 10.1016/j.rbmo.2013.07.006. [ Links ]
9. Hill MJ, Richter KS, Heitmann RJ, Graham JR, Tucker MJ, De- Cherney AH, et al. Trophectoderm grade predicts outcomes of single-blastocyst transfers. Fertil Steril. 2013;99(5):1283-9 e1. doi: 10.1016/j.fertnstert.2012.12.003 [ Links ]
10. Meseguer M, Herrero J, Tejera A, Hilligsoe KM, Ramsing NB, Remohi J. The use of morphokinetics as a predictor of embryo implantation. Hum Reprod. 2011;26(10):2658-71. doi: 10.1016/j.fertnstert.2011.06.059. [ Links ]
Conflicto de interés: Los autores que no existe conflicto de interés con el presente artículo.
Artículo recibido el 5 de mayo de 2016 y aceptado para publicación el 12 de junio de 2016.
Correspondencia: Jimmy Portella Grupo PRANOR Calle los Olivos 364. San Isidro. Lima, Perú.
Telefono: +511-4225246