Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.62 no.4 Lima oct. 2016
ARTÍCULO ORIGINAL
Propuesta de un puntaje de riesgo para detectar gestantes preeclámpticas
Proposal of a risk score for preeclampsia in pregnant women
John Apaza Valencia1,a, Mónica Sotelo Hancco1,b, María Tejada Zúñiga1,b
1 Departamento de Ginecología y Obstetricia, Hospital III Honorio Delgado de Arequipa, Perú.
a Médico Asistente b Médico Cirujano
Resumen
Objetivo: Determinar la utilidad de un puntaje para la valoración del riesgo y detección de gestantes con y sin preeclampsia. Diseño: Estudio transversal, analítico, de casos y controles. Institución: Departamento de Ginecología y Obstetricia, Hospital III Honorio Delgado de Arequipa, Perú. Participantes: Gestantes con y sin preeclampsia que tuvieron parto eutócico o distócico en el Servicio de Obstetricia durante los meses de junio de 2015 a junio de 2016. Metodología: Se evaluó la historia clínica del alta hospitalaria. Se elaboró una tabla con factores de riesgo de preeclampsia (PE) y se calificó mediante un puntaje. Principales medidas de resultados: Análisis bivariado de factores de riesgo del grupo preeclampsia y control. Determinación de un punto de corte del puntaje. Resultados: Se evaluó 253 pacientes; 132 pacientes pertenecieron al grupo control y 121 casos al grupo PE. Los factores de riesgo estudiados tuvieron un odds ratio (OR) mayor de 2, siendo mayor para el factor de riesgo presión arterial media con OR de 8,80 y siendo menor para el factor de riesgo hemoglobina (Hb) con OR de 2,749. Con un punto de corte ≥ 4 se valoró el alto riesgo de PE con una sensibilidad de 94,21%, especificidad de 87,88% y razón de verosimilitud de 7,77. Conclusiones: El puntaje de riesgo de preeclampsia propuesto parece ser útil para la valoración del riesgo y detección de preeclampsia, tomando como punto de corte un puntaje mayor e igual a 4, y puede ser utilizado en centros de nivel de atención I a III.
Palabras clave: Preeclampsia, Factores de Riesgo; Puntaje de Riesgo.
Abstract
Objectives: To determine a score for risk assessment and screening of pregnant women with and without preeclampsia. Design: Cross-sectional, analytical, case-control study. Institution: Department of Gynecology and Obstetrics, Hospital III Honorio Delgado de Arequipa, Peru. Participants: Pregnant women with and without preeclampsia (PE) who had normal or dystocic vaginal delivery in our Department between June 2015 and June 2016. Main outcome measures: Bivariate analysis of risk factors for preeclampsia. Determination of a cutoff point of risk for preeclampsia. Results: 253 patients were evaluated, 132 patients belonged to the control group and 121 cases to the PE group. The risk factors studied had an odds ratio (OR) greater than 2, being higher for the risk factor mean arterial pressure (OR: 8.80) and smaller for hemoglobin - Hb (OR: 2.749). A cutoff point ≥ 4 appreciated the high risk of PE with a sensitivity of 94.21%, specificity of 87.88% and likelihood ratio of 7.77. Conclusions: The score proposed seems to be useful for the risk assessment and screen ing of preeclampsia taking a cutoff point of ≥ 4 and can be used in I to III level care centers.
Keywords: Preeclampsia; Preeclampsia Risk Factor; Risk Score.
Introducción
La preeclampsia (PE) es una enfermedad del embarazo que afecta a la madre y al feto, siendo responsable de una proporción considerable de muertes maternas y perinatales. Complica de 3 a 22% de los embarazos y es la segunda causa de muerte materna en el Perú, con 32%, y la primera causa de muerte materna en el Instituto Nacional Materno Perinatal con 43%(1).
La evidencia actual nos muestra que para identificar pacientes con alto riesgo de desarrollar PE se requiere de la combinación de características maternas (factores pre e intraconcepcionales), marcadores séricos y el Doppler de arterias uterinas. Sin embargo, hasta la fecha no hay una prueba que sola o combinada pueda predecir la enfermedad con exactitud.
La PE es una entidad que compromete fundamentalmente el sistema cardiovascular, donde la base fisiopatológica de la misma corresponde a la disfunción endotelial. Los cambios fisiológicos cardiovasculares y hematológicos en la gestante permiten el desarrollo normal de la gestación. Por lo tanto, identificar signos de inadecuada adaptación cardiovascular y hematológica en la gestante, como presión arterial media (PAM) elevada y hemoglobina (Hb) elevada podrían orientar a la detección de gestantes en riesgo de desarrollar la enfermedad en una etapa temprana, como en el segundo trimestre de la gestación.
En nuestro medio, no contamos con los marcadores séricos (como el factor de crecimiento placentario) y el Doppler de arterias uterinas tiene un uso limitado. Por lo tanto, existe la necesidad de adoptar algún instrumento que nos permita la valoración y detección del riesgo de PE. En este estudio tenemos el objetivo de determinar la utilidad de un puntaje para la valoración del riesgo y detección de PE.
Métodos
El presente es un estudio de corte transversal, analítico, de casos y controles. Se desarrolló en el Departamento de Ginecología y Obstetricia del Hospital III Regional Honorio Delgado Espinoza de Arequipa. Se evaluó la historia clínica del alta hospitalaria y el carnet de control prenatal de las pacientes atendidas que tuvieron parto eutócico o distócico en el Servicio de Obstetricia durante los meses de junio de 2015 a junio de 2016. Se incluyó gestantes que fueron atendidas por PE de acuerdo con los criterios publicados por la ACOG(2), los cuales fueron denominados como casos de preeclampsia. Los controles fueron gestantes sin hipertensión y se les denominó grupo control. Se excluyó gestantes con embarazo gemelar, fetos malformados, historias clínicas incompletas, gestantes con niveles de hemoglobina por debajo de 11 mg/% y que radicaran fuera de la ciudad de Arequipa.
Desde un punto de vista fisiopatológico(3-5), los factores de riesgo seleccionados fueron los siguientes: 1) Edad materna menor de 19 años y mayor e igual a 35 años; 2) Historia materna de PE en una gestación anterior; antecedente materno de hipertensión, diabetes o enfermedadautoinmune; 3) Índice de masa corporal (IMC) pregestacional mayor de 24,9; 4) Edema pretibial que dejaba fóvea; 5) Ganancia de peso anormal, definido como aquella ganancia de peso mensual por encima de lo recomendado por el IOM según el IMC pregestacional de la gestante; 6) Hb mayor al punto de corte por trimestre de gestación; para el II trimestre el punto de corte fue 13,3 g% y para el III trimestre el punto de corte fue 13,0 g% (estos puntos de corte fueron establecidos por un estudio previo no publicado); 7) Presión arterial media (PAM) mayor al punto de corte por trimestre de gestación; para el II trimestre, el punto de corte fue 83 mmHg y para el III trimestre 95 mmHg (estos puntos de corte fueron establecidos por un estudio previo no publicado); 8) La proteinuria se consideró positiva si fue (+) tomada con tira reactiva o cuantificada mayor o igual a 300 mg en orina de 24 horas.
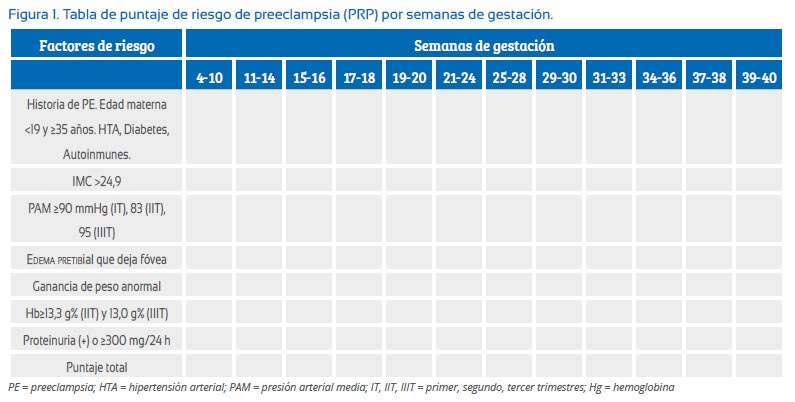
Con estos factores de riesgo se confeccionó la siguiente tabla de puntuación para valorar el riesgo y detectar los casos de preeclampsia (Figura 1).
En esta tabla, la edad materna y antecedentes fueron agrupados en una categoría, por ser factores de riesgo no modificables. Para realizar el puntaje simplemente se anotó en la columna de semanas de gestación con un uno (número 1) si estuvo presente el factor de riesgo o un cero (número 0) si estuvo ausente el factor de riesgo; luego se sumó los factores de riesgo que estuvieron presentes para obtener el puntaje total. Esta evaluación se realizó de acuerdo a la semana de gestación en que se encontró a la gestante.
Los datos obtenidos fueron procesados y analizados por el paquete estadístico SPSS versión 21. Se utilizó la prueba de t de student y U de Mann Whitney para comparar las medias y tablas de contingencia y chi cuadrado para variables categóricas. Se realizó el análisis ROC para determinar el umbral de discriminación.
Resultados
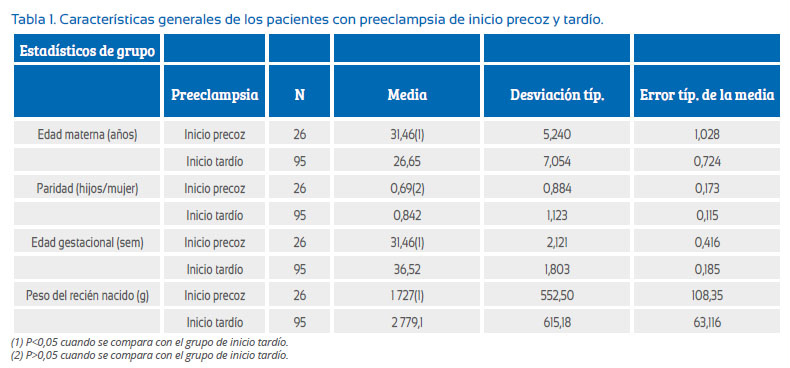
Se evaluó 253 pacientes, 132 pacientes pertenecieron al grupo control y 121 al grupo PE. Las pacientes con PE fueron clasificadas en PE de inicio precoz con 26 casos (21,5%) y PE de inicio tardío con 95 casos (78,5%). La media y desviación típica para la edad, paridad, edad gestacional (EG) y peso del recién nacido se muestran en la Tabla 1, no habiéndose encontrado diferencia significativa en la edad y paridad cuando se compararon el grupo PE con los controles. Sin embargo, cuando se comparó la nuliparidad entre los grupos, si existió diferencia significativa (X2= 4,057, p=0,044, p<0,05) (tabla no mostrada). Con la edad gestacional y el peso del recién nacido (RN), se encontró diferencia significativa, siendo la edad gestacional media 35,4 y 38,8 semanas para los grupos PE y control, respectivamente; la media del peso del RN fue de 2 552 g para el grupo PE y 3 373 g para el grupo control (tabla no mostrada).
Se dividió los casos de PE en PE de inicio precoz con 26 casos y PE de inicio tardío con 95 casos; las medias de las pacientes PE se muestran en la Tabla 1. Allí se encuentra que las gestantes con PE de inicio precoz tuvieron mayor edad materna, menor edad gestacional y menor peso del RN cuando comparadas con las gestantes con PE de inicio tardío, habiendo diferencia significativa. Respecto a la variable paridad, no hubo diferencia significativa (Tabla 1). Tampoco hubo diferencia significativa cuando se analizó la variable nuliparidad (X2= 0,090 p=0,764, p>0,05) (tabla no mostrada).
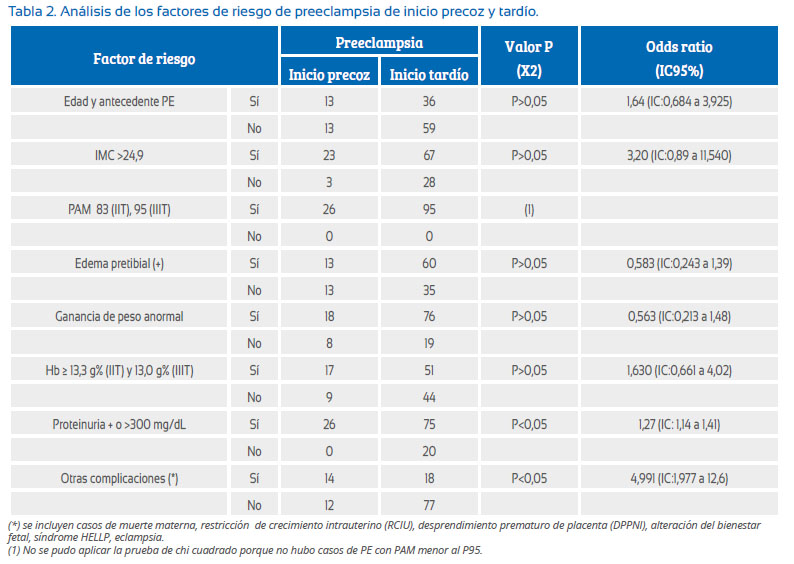
En la Tabla 2 se muestra al análisis de los factores de riesgo de PE de inicio precoz y tardío, donde se encuentra diferencia significativa para la variable proteinuria y otras complicaciones y no se encuentra diferencia significativa entre estos grupos para la presencia de factores de riesgo edad y antecedente de hipertensión, IMC mayor de 24,9, edema pretibial, ganancia de peso anormal, Hb (≥13,0 g%). Es importante destacar que ninguna paciente con PE tuvo PAM menor al punto de corte para el trimestre de gestación, por lo cual no fue posible realizar la prueba de chi cuadrado.
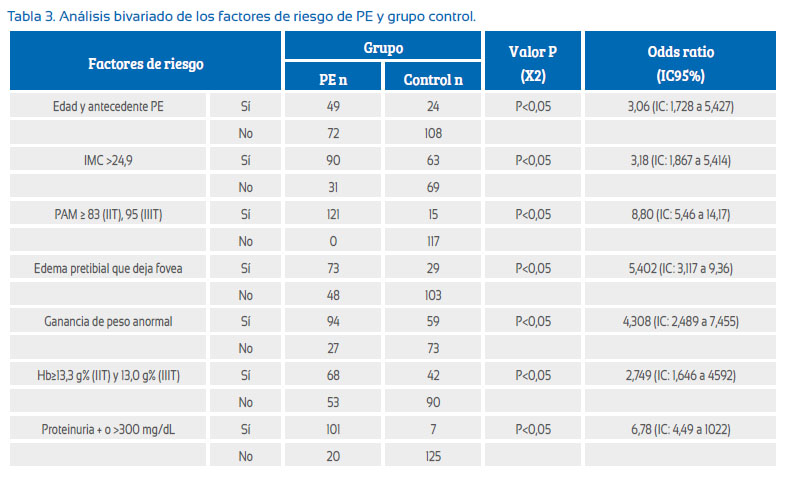
El análisis bivariado de los factores de riesgo de PE y grupo control de la Tabla 3 nos muestra que todos los factores de riesgo estudiados tuvieron odds ratio (OR) mayor de 2, siendo mayor para el factor de riesgo PAM con OR 8,80 y menor para el factor de riesgo Hb con OR 2,749.
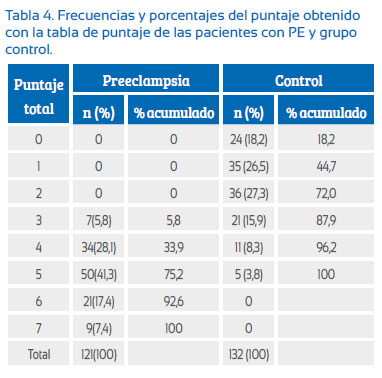
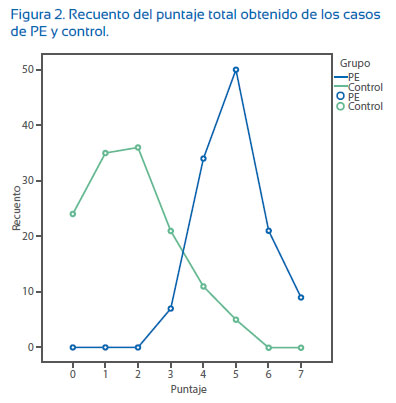
Luego de calificar con 1 punto la presencia de cada factor de riesgo para una determinada edad gestacional y obtener la sumatoria de cada puntaje para obtener el puntaje total (Tabla 4 y Figura 2), encontramos una relación inversa entre el grupo de PE que tiene PRP mayores de 3 (5,8%) y el grupo control con PRP menores de 5. Por lo tanto, a mayor PRP mayor número de casos de PE y a menor PRP mayor número de casos controles sin PE.
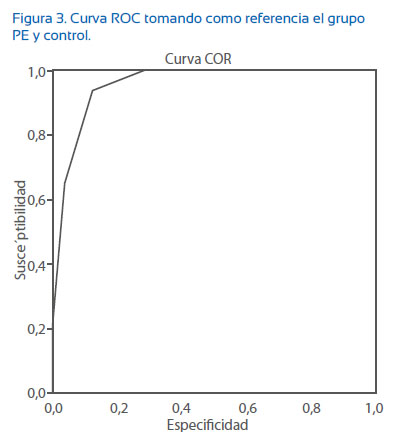
En la Figura 3 se muestra el análisis de la curva ROC del PRP de las pacientes con PE y control tomando como referencia el grupo PE. El área bajo la curva fue de 0,958 y error típico de 0,011, con un intervalo de confianza de 0,936 a 0,981. Este análisis de la curva ROC también nos ha permitido establecer un punto de corte ≥ 4 y así determinar el mejor punto de discriminación como prueba diagnóstica de PE, con una sensibilidad de 94,21% (IC95%: 89,64 a 98,79), especificidad de 87,88% (IC95%: 81,93 a 93,83 ), valor predictivo positivo de 87,69% (IC95%: 81,66 a 93,72), valor predictivo negativo de 94,31% (IC95%: 89,81 a 98,81) y razón de verosimilitud de 7,77 (IC95%: 4,9 a 12,33).
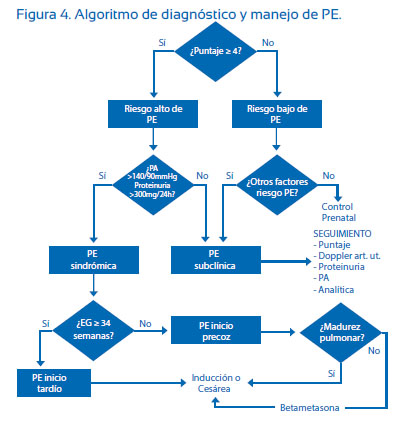
Este puntaje también nos ha permitido proponer un algoritmo de diagnóstico y manejo de PE (Figura 4). Si las gestantes con sospecha de PE tuvieran un puntaje ≥ 4, se las califica con un riesgo alto de PE y en ellas se determinará si tienen hipertensión o proteinuria > 300 mg/24 h para catalogarlas como subclínica (PE en evolución) o PE sindrómica. La PE subclínica debe tener un seguimiento en la búsqueda de nuevos factores de riesgo y calificación con el PRP y, de encontrar alguno, debe ingresar al algoritmo. El manejo de la PE sindrómica seguirá de acuerdo a las guías o protocolos de cada centro.
Discusión
Cobra fuerza la hipótesis de que la PE de inicio precoz y tardío sean dos enfermedades distintas por las importantes diferencias genéticas, epidemiológicas y placentarias. Sin embargo, recientes estudios nos muestran la posibilidad de una continuidad clínico temporal entre ambos fenotipos(6).
Las diferencias encontradas en la Tabla 1 en relación con la edad gestacional y peso del RN es una muestra de que la PE de inicio precoz implica una fisiopatología de mayor severidad desarrollada en una etapa temprana de la gestación, donde la PE sería inducida por factores placentarios intrínsecos, a diferencia de la etapa tardía donde la PE sería inducida por factores extrínsecos y maternos(7). La paridad no es un factor que hace diferencia en ambos grupos. Por lo tanto, en nuestra población probablemente no representa un riesgo de padecer la enfermedad, a diferencia de lo reportado en la literatura donde la multiparidad es característica de la PE de inicio tardío(6).
De los factores de riesgo de la Tabla 2, podemos deducir que la proteinuria es un signo de gravedad y la presencia de otras complicaciones (síndrome HELLP, eclampsia, RCIU y otros) son más frecuente en la PE de inicio precoz, lo cual es concordante con otro estudio de Piura(8). Los factores de riesgo (Tabla 2) como antecedente de PE, mayor ganancia de peso, sobrepeso u obesidad no hacen diferencia de la PE de inicio precoz y tardío, a diferencia de la reportado por la literatura, donde el antecedente de PE es más frecuente en PE de inicio precoz, y la edad mayor de 40, mayor ganancia de peso y la obesidad son más frecuentes en PE de inicio tardío(6,9). Lisonkova y Joseph(10) presentan resultados donde la edad materna más joven, nuliparidad y diabetes estuvieron fuertemente asociados con la enfermedad de inicio tardío. Por lo tanto, esta información nos muestra que la PE de inicio temprano o tardío comparten y son diferentes con los factores de riesgo, los cuales dependerán probablemente del tipo de población que se estudia y de su entorno. Esta observación puede sugerir que las manifestaciones clínicas heterogéneas de PE pueden ser precedidas por diferentes mecanismos patológicos(11).
Del análisis bivariado de los factores de riesgo de PE entre el grupo de PE y control (Tabla 3) revaloramos dos antiguos parámetros relacionados con PE, PAM y Hb. La PAM es un mejor predictor de PE que la presión sistólica, diastólica o un incremento de la presión sanguínea(12), los cuales tienen relación con la disminución fisiológica de la PAM en el II trimestre de gestación como consecuencia de la vasodilatación y remodelación vascular que ocurre en el embarazo(13), y con la hemodilución materna e incremento del volumen plasmático en respuesta a un sistema vascular de bajo nivel de llenado, como resultado de la vasodilatación sistémica y aumento de la capacitancia vascular. Los glóbulos rojos también incrementan pero en menor proporción que el volumen plasmático, dando como resultado una disminución de los niveles de Hb(14). Altos niveles de Hb en ausencia de hemodilución deben ser considerados como indicadores de gestación de alto riesgo(15). Hipotéticamente, la elevación de la hemoglobina libre y el daño a la célula endotelial producen una disminución de la vasodilatación mediada por la inhibición del factor relajante derivado del endotelio(16).
Frecuentemente evaluamos la ganancia de peso total en el embarazo como factor de riesgo. Sin embargo, hemos observado que aquellas pacientes que ganan peso mensual mayor a lo recomendado en cada trimestre tienen riesgo aumentado de desarrollar PE con OR 4,3 (Tabla 3). La excesiva ingesta de alimentos expone al sistema cardiovascular a una hiperlipidemia posprandial prolongada; así, el metabolismo de los hidratos de carbono y lípidos posprandiales produce múltiples productos proaterogénicos. Incluso un aumento transitorio de estos factores puede empeorar la función vascular e inducir alteración en la vasodilatación dependiente del endotelio, un predictor de la aterosclerosis y los eventos cardiovasculares futuros(17).
Si el riesgo es la probabilidad de enfermar o morir y los factores de riesgo son las variables asociadas a la mayor frecuencia de daño o problema de salud, entonces lógicamente cuantos más factores de riesgo presente la paciente mayor será la probabilidad de enfermar. Esta proposición es compatible con PE. Los factores de riesgo que fueron demostrados en nuestra población nos han permitido determinar qué gestantes tienen más factores de riesgo y probabilidad de PE, para así poder validar la tabla PRP de puntaje para establecer el riesgo y detectar clínicamente PE. Una de las fortalezas del PRP es que se puede utilizar desde el primer nivel de atención hasta el tercer nivel de atención y puede formar parte de un algoritmo de diagnóstico y manejo de PE (Figura 4).
La utilidad del PRP en el I y II nivel de atención es poder establecer el riesgo alto o bajo de desarrollar PE (según el punto de corte ≥4) en las primeras semanas de gestación y adoptar una conducta con enfoque de riesgo y así poder intervenir no solo con controles prenatales habituales sino con determinadas medidas generales, aún cuando no haya evidencia científica demostrada. Estas medidas en conjunto deben incluir alimentación e hidratación adecuada, ganancia de peso controlada, evitar el estrés, evaluación nutricional, psicológica, cardiológica y endocrinológica; cuando sean necesarios, administración de multivitamínicos, calcio, ácido linoleico, magnesio, zinc, aspirina; controlar la actividad física, proteinuria, riesgo coronario y referencia oportuna a un nivel de mayor complejidad(18-25). Estas medidas hipotéticamente nos deberían conducir a limitar la severidad de la PE, llevar la gestación lo más cercano a término, lograr un peso del recién nacido adecuado para la edad gestacional y en el mejor de los casos prevenir PE. Hipótesis que debería ser demostrada mediante estudios prospectivos a futuro. En algunos casos probablemente no lograremos ningún efecto debido a factores que aún desconocemos y determinan una inadecuada invasión trofoblástica y remodelación vascular.
En el tercer nivel de atención la determinación del PRP debe ser una prueba discriminante de aquellas gestantes con sospecha de riesgo alto o bajo de PE como se ha propuesto en el algoritmo de diagnóstico y manejo de PE (Figura 4) y de esta manera ser un complemento de la evaluación de la suficiencia placentaria mediante ecografía Doppler de las arterias uterinas, evaluación del crecimiento y bienestar fetal. Cuando estamos frente a un cuadro de PE sindrómica (hipertensión, proteinuria y edema), la enfermedad está ya definida; entonces la conducta estará orientada a determinar la severidad del cuadro, limitar las complicaciones y terminar la gestación. En este escenario, el PRP no tendría mayor utilidad, porque la PE ya no es sospecha diagnóstica sino un diagnóstico definido.
Una de las limitaciones del puntaje es que los puntos de corte para Hb pueden variar, ya que a mayor altitud las gestantes tienen mayores niveles de Hb. Sin embargo, alternativamente valorar la tendencia de hemoconcentración de un trimestre a otro puede salvar esta limitación, así como la tendencia ascendente de la PAM de un trimestre a otro puede ser la alternativa en la valoración cuando no se disponga de los puntos de corte para PAM. Otra limitación del puntaje es que no se ha evaluado el riesgo de PE con Hb menor de 11 g%.
Si bien este puntaje se aplicó en su mayoría a gestantes con PE de inicio tardío, entonces en PE de inicio precoz donde la severidad del cuadro es mayor, probablemente sea conveniente bajar el punto de corte a 3 con el propósito de detectar el mayor número de casos, mejorar la sensibilidad a costa de disminuir la especificidad, con el propósito de intervenir tempranamente en el control prenatal. Esto deberá ser demostrado en otro estudio de PE de inicio precoz.
Referencias Bibliográficas
1. Guevara E, Meza L. Manejo de la preeclampsia/eclampsia en el Perú. Rev peru ginecol obstet. 2014;60(4):385-93. [ Links ]
2. American College of Obstetricians and Gynecologists. Task Force on Hypertension in Pregnancy. Hypertension in Pregnancy. Practice Guideline. WQ 244. Disponible en: https:// www.acog.org/~/media/Task%20Force%20and%20 Work%20Group%20Reports/public/HypertensioninPregnancy. pdf. Obtenido el 10 de mayo del 2015. [ Links ]
3. English F, Kenny L, McCarthy F, Risk factors and effective management of preeclampsia. Integr Blood Press Control. 2015;8:7–12. doi: 10.2147/IBPC.S50641. [ Links ]
4. Salviz M, Cordero L, Saona P. Pre-eclampsia: Factores de riesgo. Estudio en el Hospital Nacional Cayetano Heredia. Rev Med Hered. 1996;7:24-31. [ Links ]
5. Bartsch E, Medcalf K, Park A, Ray J. Clinical risk factors for pre-eclampsia determined in early pregnancy: systematic review and meta-analysis of large cohort studies. BMJ. 2016;353:i1753. doi: 10.1136/bmj.i1753. [ Links ]
6. Lacunza R, Pacheco J. Preeclampsia de inicio temprano y tardío: una antigua enfermedad, nuevas ideas. Rev peru ginecol obstet. 2014;60(4):351-61. [ Links ]
7. Huppertz B. Placental origins of preeclampsia: challenging the current hypothesis. Hypertension. 2008 Apr;51(4):970-5. doi: 10.1161/HYPERTENSIONAHA.107.107607. [ Links ]
8. Correa D. Severidad de preeclampsia de inicio precoz comparada con preeclampsia de inicio tardío en gestantes atendidas en el Hospital Santa Rosa de Piura (Tesis bachiller). Piura20- Perú: Universidad Privada Antenor Orrego. 2014:42pp. Disponible en: http://repositorio.upao.edu.pe/bitstream/ upaorep/416/1/CORREA_DANYRO_ PREECLAMPSIA_PRECOZ_ GESTANTES.pdf Ultima revisión 10-08-2016. [ Links ]
9. Ornaghi S, Tyurmorezova A, Algeri P, Giardini V, Ceruti P, Vertemati E, Vergani P. Influencing factors for late-onset preeclampsia. J Matern Fetal Neonatal Med. 2013 Sep;26(13):1299-302. doi: 10.3109/14767058.2013.783807. [ Links ]
10. Lisonkova S, Joseph KS. Incidence of preeclampsia: risk factors and outcomes associated with early- versus late-onset disease. Am J Obstet Gynecol. 2013 Dec;209(6):544.e1-544. e12. doi: 10.1016/j.ajog.2013.08.019. [ Links ]
11. Odegård RA, Vatten LJ, Nilsen ST, Salvesen KA, Austgulen R. Risk factors and clinical manifestations of pre-eclampsia. BJOG. 2000 Nov;107(11):1410-6. [ Links ]
12. Cnossen J, Vollebregt K, de Vrieze N, Riet G, Mol B, Franx A, Khan K, Van der Post J. Accuracy of mean arterial pressure and blood pressure measurements in predicting pre-eclampsia: systematic review and meta-analysis. BMJ. 2008;336:1117. doi: http://dx.doi.org/10.1136/bmj.39540.522049.BE. [ Links ]
13. Osol G, Mandala M. Maternal uterine vascular remodeling during pregnancy. Physiology (Bethesda). 2009 Feb;24:58- 71. doi: 10.1152/physiol.00033.2008. [ Links ]
14. Chandra S, Tripathi AK, Mishra S, Amzarul M, Vaish AK. Physiological changes in hematological parameters during pregnancy. Indian J Hematol Blood Transfus. 2012 Sep;28(3):144– 6 doi: 10.1007/s12288-012-0175-6. [ Links ]
15. Maghsoudlou S, Cnattingius S, Stephansson O, Aarabi M, Semnani S, Montgomery S, Bahmanyar S. Maternal haemoglobin concentrations before and during pregnancy and stillbirth risk: a population-based case-control study. BMC Pregnancy Childbirth. 2016;16:135. doi: 10.1186/s12884- 016-0924-x. [ Links ]
16. Sarrel PM, Lindsay DC, Poole-Wilson PA, Collins P. Hypothesis: inhibition of endothelium-derived relaxing factor by haemoglobin in the pathogenesis of pre-eclampsia. Lancet. 1990 Oct 27;336(8722):1030-2. [ Links ]
17. Ansar S, Koska J, Reaven P. Postprandial hyperlipidemia, endothelial dysfunction and cardiovascular risk: focus on incretins. Cardiovascular Diabetology. 2011;10:61. DOI: 10.1186/1475-2840-10-61. [ Links ]
18. Santangelo C, Zicari A, Mandosi E, Scazzocchio B, Mari E, Morano S, Masella R. Could gestational diabetes mellitus be managed through dietary bioactive compounds? Current knowledge and future perspectives. Br J Nutr. 2016 Apr 14;115(7):1129-44. doi: 10.1017/S0007114516000222. [ Links ]
19. Zonana A, Baldenebro R, Ruiz M. Efecto de la ganancia de peso gestacional en la madre y el neonato. Salud pública Méx. 2010;52(3):220-5. http://dx.doi.org/10.1590/S0036- 36342010000300006. [ Links ]
20. Lowensohn RI, Stadler DD, Naze C. Current concepts of maternal nutrition. Obstet Gynecol Surv. 2016 Aug;71(7):413-26. doi: 10.1097/ OGX.0000000000000329. [ Links ]
21. Gupta A, Kant S, Pandav CS, Gupta SK, Rai SK, Misra P. Dietary calcium intake, serum calcium level, and their association with preeclampsia in rural North India. Indian J Community Med. 2016 Jul-Sep;41(3):223-7. doi: 10.4103/0970-0218.183591. [ Links ]
22. Alzate A, Herrera R, Pineda L. Preeclampsia prevention a case- control study nested in a cohort. Colomb Med (Cali). 2015 Oct-Dec;46(4):156–61. [ Links ]
23. Ghesquière L, Clouqueur E, Garabedian C, Tsatsaris V, Houfflin- Debarge V. Can we prevent preeclampsia? Presse Med. 2016 Apr;45(4 Pt 1):403-13. doi: 10.1016/j.lpm.2016.02.007. [ Links ]
24. Dalton LM, Ní Fhloinn DM, Gaydadzhieva GT, Mazurkiewicz OM, Leeson H, Wright CP. Magnesium in pregnancy. Nutr Rev. 2016 Jul 21. pii: nuw018. [ Links ]
25. Roberge S, Odibo AO, Bujold E. Aspirin for the prevention of preeclampsia and intrauterine growth restriction. Clin Lab Med. 2016 Jun;36(2):319-29. doi: 10.1016/j.cll.2016.01.013. [ Links ]
Conflicto de interés: ninguno
Apoyo: Departamento de Ginecología y Obstetricia del Hospital III Honorio Delgado de Arequipa
Trabajo presentado como Tema Libre al XXI Congreso Peruano de Obstetricia y Ginecología, Lima, octubre de 2016
Correspondencia: Dr. John Apaza Valencia Dirección: Urb. Quinta El Sol B-11 Cerro Colorado, Arequipa, Perú. @ john_apaza@hotmail.com