Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Ginecología y Obstetricia
On-line version ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.62 no.4 Lima Oct. 2016
CASO CLÍNICO
Maduración in vitro de ovocitos con cultivo extendido hasta estadio de blastocisto -Primer nacimiento reportado en el Perú
In vitro oocyte maturation combined with extended blastocyst embryo culture - Report of the first baby born in Peru
Luis Guzmán, PhD1, Milthon Mestanza, MD1; Naomi Inoue, BSc1; Denisse Nuñez, BSc1; Jimmy Portella, MSc1; Luis Noriega-Hoces, MD1,2
1 PRANOR. Grupo de Reproducción Asistida. San Isidro, Lima, Perú.
2 Clínica Concebir. San Isidro, Lima, Perú.
Resumen
La maduración in vitro de ovocitos (MIV) es una técnica de reproducción asistida muy poco difundida entre los centros de reproducción asistida, debido al bajo éxito en obtener embarazos. Sin embargo, en los últimos años, diferentes estrategias empleadas han demostrado tasas de embarazo similares a las técnicas convencionales de fecundación in vitro (FIV). En el presente reporte, describimos el caso clínico del primer nacido vivo usando MIV en combinación del cultivo extendido hasta estadio de blastocisto.
Palabras clave: Maduración In Vitro de Ovocitos; Fecundación In Vitro; Cultivo de Blastocisto.
Abstract
In vitro oocyte maturation is not yet considered a well-established technique in in vitro fertilization (IVF) laboratories. This is due to a lower pregnancy rates. However in the last few years, reports have shown similar pregnancy rates compared to the conventional IVF techniques. The current report describes the first baby born after an IVM treatment in combination with extended blastocyst culture in Peru.
Keywords: In vitro Oocyte Maturation; In vitro Fertilization; Blastocyst, Culture.
Introducción
La maduración in vitro de ovocitos (MIV) es una técnica de reproducción asistida prometedora, la cual consiste en cultivar en el laboratorio los ovocitos obtenidos a partir de folículos entre 2 y 10 mm(1); estos ovocitos se encuentran en estadio de vesícula germinal (ovocito inmaduro) y, tras el proceso de maduración nuclear, alcanzarán el estadio de metafase II (ovocito maduro)(2).
Aunque parece nueva la estrategia clínica, fue en 1991 cuando Cha(3) reportó el primer embarazo con MIV en humanos. Sin embargo, han pasado más de 25 años y solo se han reportado alrededor de 3 000 nacidos vivos(4,5) a diferencia de los más de 5 millones de nacidos vivos con técnicas convencionales de reproducción asistida(6). La poca utilización de la técnica de MIV se puede explicar debido a los resultados contradictorios en la literatura y a las reducidas tasas de embarazo de la MIV respecto a ciclos de fecundación in vitro clásica.
El grupo de pacientes que más se beneficiaría al realizar el tratamiento de MIV son mujeres con síndrome de ovario poliquístico, porque elimina la probabilidad de desarrollar el síndrome de hiperestimulación ovárica (SHO). El segundo grupo objetivo son los pacientes oncológicos que opten por preservar su fertilidad. Este grupo de pacientes podrían ser tratados en la fase folicular o fase lútea del ciclo menstrual sin la necesidad de postergar el inicio del tratamiento oncológico. Adicionalmente, al no requerir el uso de gonadotropinas exógena, los niveles hormonales, tales como estrógenos, no se verían afectados.
Por muchos años los resultados clínicos de la MIV han sido muy variables entre los distintos centros de fertilidad, mostrando tasas de embarazo que iban desde 0%(7) hasta 42%(8). Esta variabilidad en los resultados clínicos puede ser explicada por la falta de estandarización de un protocolo de estimulación ovárica para MIV(9), el pobre desarrollo en medios de cultivo de MIV(10) y las discrepancias respecto a la transferencia en fresco o diferida(11).
El presente reporte describe el primer nacido vivo en el Perú después de un procedimiento de MIV seguido de un cultivo extendido hasta el estadio de blastocisto.
Reporte del caso
Paciente de 39 años de edad, con un tiempo acumulado de siete años de infertilidad, con anovulación y resistente al clomifeno. El diagnóstico de la paciente era síndrome de ovario poliquístico. La paciente tuvo antes de realizarse la MIV dos tratamientos de FIV convencionales, con dos transferencias embrionarias que terminaron en abortos espontáneos.
Protocolo de mínima estimulación ovárica para MIV
La paciente recibió a partir del tercer día del ciclo tres dosis consecutivas de 150 UI de hp-HMG (Menopur, Ferring). La aspiración fue programada luego de 42 horas posterior a la última dosis de gonadotropinas. Se obtuvieron 18 ovocitos en estadio de vesícula germinal (VG); los ovocitos fueron cultivados por 30 horas en medio de cultivo suplementado con 75 mUI de FSH y 75 mUI de hCG.
Posterior al cultivo de MIV, los ovocitos fueron denudados con hialuronidasa (Lifeglobal 80 UI/ mL), obteniéndose 8 (44%) ovocitos maduros, 3 (17%) en estadio de metafase I y 6 (33%) en estadio de vesícula germinal y 1 ovocito atrésico (6%).
La muestra seminal del esposo fue obtenida por masturbación; los espermatozoides fueron seleccionados por la técnica de gradiente de densidad. La técnica de inseminación elegida fue PICSI, la cual consiste en usar una matriz de ácido hialurónico para seleccionar espermatozoides con mayor capacidad fecundante y menor fragmentación de ADN(12).
Los ovocitos inyectados fueron cultivados en medio Global Total for Fertilization (Lifeglobal) por 18 horas, donde se evaluó fecundación. De los ovocitos inyectados, 6 (75%) fueron fecundados y cultivados en medio Global Total (Lifeglobal) hasta el día 5/6. Finalmente, 1 (17%) embrión alcanzó el estadio de blastocisto que fue vitrificado con la técnica de Cryotech(13).
Preparación endometrial y transferencia embrionaria
A la paciente se le administró una inyección intramuscular de acetato de leuprolida de 3,75 mg al día 21 del ciclo. Inició la menstruación 10 días después. Luego, se inició el siguiente protocolo con valerato de estradiol (Progynova, Bayer®) de 2 mg. Del día 1 al 8 del ciclo se le indicó una tableta de valerato de estradiol vía oral en las mañanas (8 am); del día 9 al 11 del ciclo se le señaló tomar una tableta cada 12 horas de valerato de estradiol (8 am y 8 pm). Del día 12 del ciclo hasta el tercer trimestre del embarazo se le comunicó tomar una tableta de valerato de estradiol cada 8 horas (6 am, 2 pm y 10 pm). El día 18 del ciclo se le indicó usar progesterona micronizada de 200 mg vía vaginal (Geslutin®) y colocarse 2 óvulos cada 12 horas. Respecto a la utilización de óvulos, inició su uso el día 18 del ciclo en la noche y los días posteriores los usó cada 12 horas, hasta el primer trimestre del embarazo.
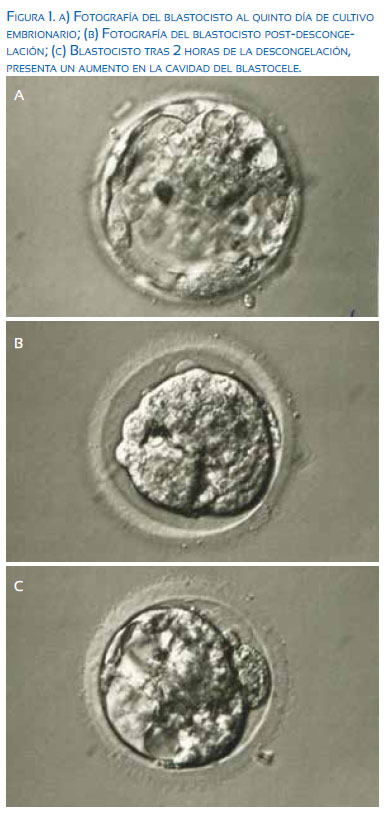
El día 23 del ciclo se realizó la transferencia embrionaria única (Figura 1). Dos semanas después, se realizó una prueba de embarazo en sangre, cuyo resultado fue positivo; luego de otras dos semanas, una ecografía transvaginal evidenció embarazo único, con adecuado latido cardíaco fetal. El niño de sexo masculino nació por cesárea a las 36 semanas, con un peso de 2 500 gramos.
Discusión
La MIV es una técnica de reproducción asistida que consiste en obtener ovocitos inmaduros y que logran reiniciar meiosis luego que son removidos del folículo. La meiosis es reiniciada debido a que se eliminan los diversos factores que mantienen arrestado al ovocito en estadio de VG y son expuestos in vitro a las gonadotropinas que gatillan la maduración ovocitaria(2,14).
El realizar FIV con los protocolos de estimulación convencionales a los pacientes con síndrome de ovario poliquístico conlleva el riesgo de desarrollar el SHO. Sin embargo, con MIV no se han reportado casos de este síndrome(15). A pesar de esta ventaja comparativa, la MIV no ha logrado ser aplicada en la rutina de los centros de fertilidad. Una de las razones son los diferentes protocolos de mínima estimulación usados en MIV. Algunos han reportado el uso de hCG para gatillar maduración in vivo, obteniendo ovocitos maduros y otros inmaduros para madurarlos in vitro(16,17). No obstante, este procedimiento no podría llamarse una verdadera MIV. Por otro lado, otros prefieren no usar gonadotropinas y/o solo estimular con dosis mínimas de FSH, sin el uso de hCG(18,19), con lo que se obtiene una cohorte homogénea de ovocitos inmaduros en estadio de VG (verdadera MIV). Para este caso reporte, nosotros usamos el procedimiento de MIV verdadero sin el uso de hCG.
La MIV en ovocitos humanos es una técnica amigable para el paciente, pudiendo convertirse en una alternativa de tratamiento en pacientes correctamente seleccionados antes de iniciado el tratamiento(20). Pero el reto es obtener resultados clínicos comparables al FIV convencional. Para lograrlo se necesitan estrategias que mejoren los resultados clínicos. Una de ellas, ya ha sido ampliamente demostrada y consiste en el cultivo extendido a blastocisto(21); esto permite una mejor selección embrionaria. Sin embargo, a pesar de la existencia de diferentes criterios de inclusión, no existe un claro consenso de cuáles son los que se debería tomar en cuenta para realizar una transferencia en estadio de blastocisto.
Hasta el momento, los reportes de MIV han realizado la transferencia embrionaria en estadio de clivaje, preferentemente en día 3(22-24). Un grupo australiano(8,18) ha practicado una serie de ciclos de MIV con tasas comparables entre FIV y MIV. Introdujeron dos modificaciones sustanciales al protocolo del laboratorio en MIV: (i) disminuir el tiempo de cultivo ovocitario de 48 o 40 horas a 28 horas; y, (ii) cultivo extendido hasta el estadio de blastocisto, permitiendo una mejor selección embrionaria.
En el Perú, se ha reportado una serie de casos con MIV, teniendo como tiempo de cultivo para la MIV de ovocitos de 36 horas y realizando transferencia al día 3 (estadio de clivaje embrionario), con resultados prometedores. Sin embargo, la tasa global reportada fue aún subóptima cuando se compara con lo descrito en los ciclos de FIV convencional de los centros de fertilidad adscritos a la Red Latinoamericana de Reproducción Asistida en el Perú(25,26).
En el presente informe, reportamos el primer nacimiento de un niño de 2 500 g a las 36 semanas en el Perú, tras realizar un procedimiento de MIV de 30 horas de cultivo ovocitario con un cultivo extendido hasta estadio de blastocisto. Estas modificaciones al protocolo de MIV brindarían buenas expectativas para ser desarrollada en el Perú.
Referencias bibliográficas
1. Smitz JE, Thompson JG, Gilchrist RB. The promise of in vitro maturation in assisted reproduction and fertility preservation. Semin Reprod Med. 2011;29(1):24-37. DOI 10.1055/s- 0030-1268701. [ Links ]
2. Edwards RG. Maturation in vitro of human ovarian oocytes. Lancet. 1965;2(7419):926-9. [ Links ]
3. Cha KY, Koo JJ, Ko JJ, Choi DH, Han SY, Yoon TK. Pregnancy after in vitro fertilization of human follicular oocytes collected from nonstimulated cycles, their culture in vitro and their transfer in a donor oocyte program. Fertil Steril. 1991;55(1):109-13. [ Links ]
4. Chian RC, Huang JY, Gilbert L, Son WY, Holzer H, Cui SJ, et al. Obstetric outcomes following vitrification of in vitro and in vivo matured oocytes. Fertil Steril. 2009;91(6):2391-8. doi. 10.1016/j.fertnstert.2008.04.014. [ Links ]
5. Chian RC, Xu CL, Huang JY, Ata B. Obstetric outcomes and congenital abnormalities in infants conceived with oocytes matured in vitro. Facts, views & vision in ObGyn. 2014;6(1):15-8. [ Links ]
6. Van Steirteghem A. Celebrating ICSI's twentieth anniversary and the birth of more than 2.5 million children--the 'how, why, when and where'. Hum Reprod. 2012;27(1):1-2. DOI 10.1093/humrep/der447. [ Links ]
7. Mikkelsen AL, Lindenberg S. Benefit of FSH priming of women with PCOS to the in vitro maturation procedure and the outcome: a randomized prospective study. Reproduction. 2001;122(4):587-92. [ Links ]
8. Junk SM, Yeap D. Improved implantation and ongoing pregnancy rates after single-embryo transfer with an optimized protocol for in vitro oocyte maturation in women with polycystic ovaries and polycystic ovary syndrome. Fertil Steril. 2012;98(4):888-92. DOI 10.1016/j.fertnstert.2012.06.055. [ Links ]
9. Fadini R, Dal Canto MB, Mignini Renzini M, Brambillasca F, Comi R, Fumagalli D, et al. Effect of different gonadotrophin priming on IVM of oocytes from women with normal ovaries: a prospective randomized study. Reprod Biomed Online. 2009;19(3):343-51. [ Links ]
10. Son WY, Tan SL. Laboratory and embryological aspects of hCG-primed in vitro maturation cycles for patients with polycystic ovaries. Hum Reprod Update. 2010;16(6):675-89. DOI 10.1093/humupd/dmq014. [ Links ]
11. Ortega-Hrepich C, Stoop D, Guzman L, Van Landuyt L, Tournaye H, Smitz J, et al. A "freeze-all" embryo strategy after in vitro maturation: a novel approach in women with polycystic ovary syndrome? Fertil Steril. 2013. DOI 10.1016/j.fertnstert. 2013.06.018. [ Links ]
12. Parmegiani L, Cognigni GE, Bernardi S, Troilo E, Ciampaglia W, Filicori M. "Physiologic ICSI": hyaluronic acid (HA) favors selection of spermatozoa without DNA fragmentation and with normal nucleus, resulting in improvement of embryo quality. Fertil Steril. 2010;93(2):598-604. DOI 10.1016/j.fertnstert. 2009.03.033. [ Links ]
13. Gutnisky C, Alvarez GM, Cetica PD, Dalvit GC. Evaluation of the Cryotech Vitrification Kit for bovine embryos. Cryobiology. 2013;67(3):391-3. DOI 10.1016/j.cryobiol.2013.08.006. [ Links ]
14. Edwards RG. Maturation in vitro of mouse, sheep, cow, pig, rhesus monkey and human ovarian oocytes. Nature. 1965;208(5008):349-51. [ Links ]
15. Das M, Son WY, Buckett W, Tulandi T, Holzer H. In-vitro maturation versus IVF with GnRH antagonist for women with polycystic ovary syndrome: treatment outcome and rates of ovarian hyperstimulation syndrome. Reprod Biomed Online. 2014;29(5):545-51. DOI 10.1016/j.rbmo.2014.07.019. [ Links ]
16. Son WY, Chung JT, Dahan M, Reinblatt S, Tan SL, Holzer H. Comparison of fertilization and embryonic development in sibling in vivo matured oocytes retrieved from different sizes follicles from in vitro maturation cycles. J Assist Reprod Genet. 2011;28(6):539-44. DOI 10.1007/s10815-010-9527-z. [ Links ]
17. Shalom-Paz E, Holzer H, Young Son W, Levin I, Tan SL, Almog B. PCOS patients can benefit from in vitro maturation (IVM) of oocytes. Eur J Obstet Gynecol Reprod Biol. 2012;165(1):53- 6. DOI 10.1016/j.ejogrb.2012.07.001. [ Links ]
18. Walls M, Junk S, Ryan JP, Hart R. IVF versus ICSI for the fertilization of in-vitro matured human oocytes. Reprod Biomed Online. 2012;25(6):603-7. DOI 10.1016/j.rbmo.2012.08.001. [ Links ]
19. De Vos M, Ortega-Hrepich C, Albuz FK, Guzman L, Polyzos NP, Smitz J, et al. Clinical outcome of non-hCG-primed oocyte in vitro maturation treatment in patients with polycystic ovaries and polycystic ovary syndrome. Fertil Steril. 2011;96(4):860- 4. DOI 10.1016/j.fertnstert.2011.07.1108. [ Links ]
20. Guzman L, Ortega-Hrepich C, Polyzos NP, Anckaert E, Verheyen G, Coucke W, et al. A prediction model to select PCOS patients suitable for IVM treatment based on anti-Mullerian hormone and antral follicle count. Hum Reprod. 2013;28(5):1261-6. DOI 10.1093/humrep/det034. [ Links ]
21. Gardner DK, Schoolcraft WB, Wagley L, Schlenker T, Stevens J, Hesla J. A prospective randomized trial of blastocyst culture and transfer in in-vitro fertilization. Hum Reprod. 1998;13(12):3434-40. [ Links ]
22. Guzman L, Ortega-Hrepich C, Albuz FK, Verheyen G, Devroey P, Smitz J, et al. Developmental capacity of in vitro- matured human oocytes retrieved from polycystic ovary syndrome ovaries containing no follicles larger than 6 mm. Fertil Steril. 2012;98(2):503-7 e2. DOI. 10.1016/j.fertnstert. 2012.01.114. [ Links ]
23. Nogueira D, Sadeu JC, Montagut J. In vitro oocyte maturation: current status. Semin Reprod Med. 2012;30(3):199-213. DOI 10.1055/s-0032-1311522. [ Links ]
24. Coticchio G, Dal-Canto M, Guglielmo MC, Mignini-Renzini M, Fadini R. Human oocyte maturation in vitro. Int J Dev Biol. 2012;56(10-12):909-18. DOI 10.1387/ijdb.120135gv. [ Links ]
25. Tominaga LA, Caceres RE, Lechuga JA, Duran LS, Vargas MS. In vitro maturation of oocytes in high altitude women with polycystic ovaries. Jornal brasileiro de reproducao assistida. 2015;19(2):83-6. DOI 10.5935/1518-0557.20150018. [ Links ]
26. Zegers-Hochschild F, Schwarze JE, Crosby JA, Musri C, Urbina MT. Assisted reproductive techniques in Latin America: the Latin American Registry, 2013. Reprod Biomed Online. 2016. DOI 10.1016/j.rbmo.2016.02.012. [ Links ]
Conflicto de interés: Los autores niegan que exista algún conflicto de interés.
Financiamiento: Propio de los autores.
Artículo recibido el 29 de junio de 2016 y aceptado para publicación el 24 de agosto de 2016
Correspondencia
Luis Guzmán, PhD. Grupo PRANOR. Calle los Olivos 364. San Isidro Teléfono +511-4225266