Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.63 no.1 Lima ene./mar. 2017
ARTÍCULO DE REVISIÓN
Women affected by breast cancer—follow up recommendations
Mujeres afectadas por cáncer de mama—Recomendaciones para el seguimiento
Pedro A. Poma1
1 Professor, Department of Obstetrics and Gynecology, University of Illinois, Chicago, USA
Abstract
Breast cancer incidence has increased, while its mortality has decreased; almost nine out of ten women survive five years after the diagnosis. With a clinical history and physical exam, survivors are evaluated for recurrences, new malignancies, and late effects of its treatment. Asymptomatic survivors do not need to be evaluated for recurrences, but education about healthy lifestyles is necessary.
Keywords: Breast cancer, Survivors, Treatment Complications, Follow-up.
Resumen
La incidencia de cáncer de mama continúa aumentando, pero su mortalidad ha disminuido; casi nueve de cada diez mujeres sobreviven cinco años después del diagnóstico. Mediante la historia clínica y el examen físico las sobrevivientes son evaluadas por recurrencias, nuevos cánceres y efectos tardíos del tratamiento. Las sobrevivientes sin síntomas y examen físico normal no necesitan ser evaluadas por recurrencias, pero deben ser educadas acerca de un estilo de vida saludable.
Palabras clave. Cáncer de Mama; Sobrevivientes; Complicaciones del Tratamiento; Seguimiento.
In Peru, breast cancer, the second most common malignancy after cervical cancer, is the third leading cancer-related mortality cause in women, after stomach and cervical cancer. It has an estimated incidence of 26.6 / 100 000 per year (3 952 cases) occur with a mortality of 8.1 / 100 000 per year (1 715 cases)1. In the United States, the incidence of breast cancer in 1985 was 124.25 / 100 000 women and in 2013 increased to 132.18 / 100 000; while mortality has declined from 32.9 in 1985 to 20.7 in 2013 2.
Women who live decades after their experience with cancer suffer the common problems of their age 3 , often aggravated by residual cancer effects of cancer and its treatment. This article presents recommendations for the care of breast cancer survivors.
I. Recommendations for follow-up
Survivors are people who have gone through the diagnostic process, completed treatment, and still need clinical attention to reduce recurrences or manage chronic problems. These are the clinical recommendations after the treatment.
a. Clinical evaluation. Medical history and physical examination are recommended every three to six months during the first 3 years, every six to twelve months during the next two years, and then annually after the first five years4.
b. Annual mammography after lumpectomy or unilateral mastectomy4. Magnetic resonance imaging (MRI) is indicated only in persons at high risk of cancer (relatives with breast, ovarian, tubal or peritoneal cancer)5. Asymptomatic women with a normal exam do not need routine complete blood counts (CBCs), biochemical profiles, bone scans, lung X-rays, liver or pelvic ultrasound, computed tomography or positron emission tomography, magnetic resonance imaging, or tumor markers (carcinoembryonic antigen, CA 15- 3, CA 27.29)4,6,7.
c. Evaluation of recurrences. Survivors must know symptoms of recurrence (new masses, bone pain, chest pain, dyspnea, abdominal pain, persistent headaches). Recurrences may occur up to ≥ 15 years after treatment6. Recurrences may be local (breast, thoracic wall, and scar) or distant (metastases in axillary or supraclavicular ganglia, bones, liver, lungs, and brain). Most recurrences occur within the first 2 years after treatment (annual recurrence 4.3%), and decrease from the second to the twelfth year8. Patients with >3 positive lymph nodes suffer more recurrences than patients with negative lymph nodes. After 5 years the risk of recurrence in the next 5 years is 11% and in the next 10 years 19%8.
After surgery, a delay of over 6 weeks to begin radiation therapy is associated with more local recurrences (HR 1.19), so, especially in older women, radiation should be started soon9. Survivors under 35 years old have a higher risk of recurrence than women over 50 years old (HR 2.80), as well as women with conservative surger y compared to mastectomy (HR 1.82); chemotherapy decreases risk (HR 0.63)10. Recurrence increases the risk of metastases (HR 3.64)11.
Mammography detects 40% of recurrences while clinical examination only identifies 15%12. Compared with women who did not have this test, a mammogram decreases the chance of dying of breast cancer in the first 2 years (OR 0.80)13; mortality declines by 13% for each mammogram (OR 0.77)14. The risk of a second breast cancer is greater in women who were younger than 40 years of age when diagnosed with their primary cancer (OR 3.41), in women with dense breasts (OR 2.55), and in those treated with conservative surgery without radiation (OR 2.67)15.
Magnetic resonance imaging is no more sensitive or more specific in detecting breast cancer than mammography16. Because of scar tissue after treatment, the diagnosis of recurrence may be more difficult. MRI has a sensitivity of 75%-100% and a specificity of 67%-100%; both characteristics improve with a longer interval of observation. MRI is recommended in women with a family history of cancer or with BRCA mutations16.
d. Genetic evaluation. Genetic evaluation is recommended for survivors with relatives with breast, colon, or endometrial cancer (especially with cancer before age 60), relatives with triple negative breast cancer, Jewish women (Ashkenazi-ancestral origin in eastern and central Europe) with ovarian cancer or first or second degree relatives with ovarian cancer, or with first-degree relatives under 50 years old with breast cancer or with ≥2 relatives of first or second degree with breast cancer at any age, or with bilateral breast cancer or with a relative with bilateral cancer or with a male relative with breast cancer (First-degree relatives are parents, siblings, and children; second-degree relatives are grandparents, grandchildren, uncles, nephews, half-brothers)5-7,17.
e. Antiestrogenic treatment. The use of antiestrogens (aromatase inhibitors, or agonist-antagonist estrogens, or estrogen receptor modulators) is recommended to decrease the chance of relapses. Aromatase inhibitors (Anastrozole-Arimidex 1 mg, letrozole-Femara 2.5 mg, exemestane-Aromasin 25 mg); agonist-antagonists (tamoxifen (agonist/antagonist 10-30 mg/day) and estrogen receptor modulators (raloxifene-Evista 60 mg/day) have also been shown to be effective in preventing the development of breast cancer in high-risk women18,19.
f. Evaluation for other primary cancers. Evaluation for other cancers is recommended depending on the age of the patient. Cervical cancer (21 to 65 years old), cancer of the large intestine and rectum (≥ 50 years), endometrial cancer (menopause), lung cancer (55 to 74 years old in good health, who have smoked in the past 15 years or who currently smoke), thyroid, ovary, skin, mouth and lymph nodes (over 20 years old) cancer20. Females receiving tamoxifen are at risk of endometrial hyperplasia (8%) and endometrial cancer (4.7%), and should be evaluated for abnormal vaginal bleeding21.
g. Secondary cancers. Survivors are more likely to have secondary cancers22. Compared with the general population, non-mammary cancers are more common (SIR 1.22)22. In patients under 50 years old, radiotherapy is associated with an increased risk of lung cancer (HR 2.31), and chemotherapy is associated with decreased risk of lung and colon cancer (HR 0.78). In patients over 50 years old, radiotherapy is associated with an increased risk of cancer (HR 3.43); chemotherapy increases the risk of melanoma, uterine cancer, and leukemia. Meanwhile hormonal therapy is associated with an increase in uterine cancer (HR 1.78)22.
In the United States, secondary cancers account for 18% of all neoplasms and are more common than primary neoplasms (breast, lung, prostate)23,24; primary cancer risk factors (tobacco, excess alcohol, obesity), primary cancer therapy, genetic predisposition, environment, and a combination of these factors affect their incidence24,25. Leukemias associated with chemotherapy (alkylating agents, topoisomerase inhibitors, and platinum) occur 2 to 5 years after treatment. Alkylating agents also increase the risk of tumors of the lung, gastrointestinal, bladder, breast and sarcomas, this risk that decreases after 10 years23,25.
Radiation-induced tumors generally have a latency period of 5 to 10 years, are associated with the dose, treatment field, and age of treatment 23 . Comparing patients who received radiotherapy with those who did not receive radiation therapy, an increased risk of lung cancer (RR 1.62 at 10-14 years and RR 1.49 at ≥15 years), myeloid leukemia (RR 2.99 for 1-5 years), second breast cancer (RR 1.34 for 5-10 years) and esophageal cancer (RR 2.19 to ≥15 years) is observed26. Irradiation of the supraclavicular and internal mammary areas affects the esophagus; the risk of esophageal cancer is low but increases with dose (≥35 Gy OR 8.3)27.
Survivors treated with doxorubicin + cyclophosphamide are at increased risk for acute myeloid leukemia (AML) and myelodysplastic syndrome (MDS)28. Those receiving radiation therapy have more AML/MDS than those who did not receive it (RR 2.38)28. In a prospective study, AML developed 13-36 months (mean 16) after the onset of chemotherapy, with poor prognosis. Patients receiving G-CSF (granulocyte colony stimulating factor, Neupogen, Filgrastim) had a higher risk (RR 6.3)29, as well as patients under 65 years old with incidence of MDS (RR 10.88) and AML (RR 5.32)30,31.
II. Effects of cancer treatment
a. Body image. Radical mastectomy has more serious effects than simple mastectomy. As the woman reacts to these physical changes, her emotions, other circumstances in her life and well-being in general affect her adaptation. We must identify the patients’ concerns and, if appropriate, offer prosthesis, wigs or reconstructive surgery32.
b. Premature menopause. Breast cancer occurs in 25% to 30% of women under 50 years old; the physiological changes of the menopause happen during a decade which facilitates adaptation of them. In survivors these changes occur immediately after treatment without a period of adaptation. Young women are more affected by early menopause and their physical and psychological effects33. Treatment, especially chemotherapy, causes changes that affect emotional relationships and sexual function. These problems should be anticipated in patient communications, in addition to treating hot flashes, vaginal dryness and dyspareunia34,35. Young survivors have concerns about their fertility, even though they have regular menstrual periods (80% of survivors compared to 25% of controls)35. Most (70%) tamoxifen patients suffer from hot flashes36. Lifestyle changes are recommended, including exercises, yoga, a proper diet, cessation of smoking, vaginal humectants, bisphosphonates, vitamin D, calcium, antidepressants, selective serotonin-norepinephrine reuptake inhibitors, serotonin reuptake inhibitors (gabapentin), and in cases of more severe hot flashes stellate ganglion block37. Compared with placebo, paroxetine (Paxil), Venlafaxine (Effexor), fluoxetine (Prozac), sertraline (Zoloft) and gabapentin (Neurontin) reduce hot flashes38.
It is recommended to treat hot flashes of women receiving tamoxifen with venlafaxine, citalopram, clonidine, gabapentin or pregabalin. Paroxetine and fluoxetine are not recommended because they may reduce the effectiveness of tamoxifen. Survivors who do not use tamoxifen can receive venlafaxine, paroxetine, citalopram, clonidine, gabapentin and pregabalin; fluoxetine is not used because there is insufficient evidence of benefit39. Survivors with irregular cycles suffer from bone mineral loss. One study reports that after 10 years of follow-up, survivors with regular menstrual periods present a lumbar spine bone loss of -5.4%, those with irregular menstruations -15.3% and those with amenorrhea, -13.2%40. Aromatase inhibitors (IA) can cause bone mineral loss because they block the production of estrogen. Compared with controls, women in AI had greater bone loss (8.7% vs 7.1%, RR 1.3) and more fractures (13.5% vs 10.3%, RR 1.46)41.
c. Infertility. Compared with controls, menstrual survivors who menstruate after chemotherapy have fewer follicles (6.0 versus controls 9.5) and lower levels of anti-Müllerian hormone. Those who receive tamoxifen have fewer follicles, lower levels of anti-Müllerian hormone and inhibin, inhibin B, but higher levels of estradiol than those who do not receive tamoxifen42,43.
There are alternatives to protect fertility. A randomized study compared the addition of leuprolide acetate to chemotherapy. After one year, normal levels of FSH and E2 were restored, especially in the combined group, where the periods returned in 9.2 months (median), while amenorrhea persisted in the other group44. Depending on the moment in the menstrual cycle, ovarian stimulation may delay treatment for 2 to 6 weeks. But initiating stimulation in any part of the cycle is as effective as at the beginning of the cycle and only postpones the treatment of cancer for two weeks45.
d. Pregnancy. More women tend to postpone their pregnancies, so more will be diagnosed with breast cancer before they have completed their family. Compared with women who did not become pregnant, women with pregnancies after their diagnosis had less chance of death (-41%)46,47, even in cases of estrogen receptor positive tumors48. However, pregnancies of survivors are more often associated with preterm births49. Compared with women with no history of cancer, the possibility of live birth in survivors is lower using autologous oocytes, but similar when donated oocytes are used. Survivors who are pregnant have the same chance of having a live birth as women without cancer (autologous 85.8% and 86.7%, donors 85.3% and 86.9%)50. In another study of survivors, half with hormone-positive tumors, most had term pregnancies (77% spontaneous pregnancies and 76% via assisted reproduction); pregnancies did not affect maternal health for 5 years of follow-up51.
e. Irregular menstruations. Amenorrhea is common (31.6%) among survivors; age over 30 years old and nulliparity increase the risk of amenorrhea. In most women (90%), menstruation returns within the first two years. Menses return later in older survivors and in those who have received chemotherapy or radiation. Older age is associated with irregular menses52. Hormonal therapy is associated with increased risk and death of breast cancer53,54. In a 4-year follow-up study, compared with controls, more survivors receiving hormonal therapy had a new breast cancer (HR 2.4)55.
In order to control irregular bleeding, after an endometrial evaluation (transvaginal ultrasound) bleeding-reducing medications such as non-steroidal anti-inflammatory drugs (Motrin) or mefenamic acid (Ponstel), or oral antifibrinolytics such as tranexamic acid (Lysteda) may be used56. The intrauterine device with levonorgestrel (Mirena) regulates menses and is not associated with recurrences57,58, except in patients who used the device prior to diagnosis and continued to use it after treatment58.
III. Other late effects
At the end of treatment, survivors generally feel relieved but have to make physical, emotional, social, and spiritual adjustments59. Common changes include pain, fatigue, insomnia, anxiety, depression, concentration and memory problems, fear of cancer coming back, effects on family relationships, friends, intimacy, sexuality, economic concerns, experience of cancer in the context of religion, hope, and uncertainty about future health. After 5 years the majority of survivors report a quality of life similar to those who have not suffered from cancer59.
a. Brachial plexopathy. This peripheral neuropathy occurs in 1.8% of survivors after supraclavicular irradiation; especially with axillary doses over 50 Gy, most (80%) are completely resolved60.
b. Lymphedema. This is a chronic, progressive and debilitating condition. It results from the imbalance between microvascular filtration in the capillaries and venules and the lymphatic drainage system61. The incidence of lymphedema varies with the type of cancer treatment, 6.3% in patients with sentinel node biopsy and 22.3% (range 11% to 57%) in those with axillary node dissection62. This incidence increases until 5 years after treatment63. Radiation therapy also increases the risk of lymphedema, although it is difficult to separate its effect from the effect of surgery. An incidence of 14.5% is estimated in patients with breast and chest wall radiation, 31.5% in patients with radiation that also includes the supraclavicular area, and 41.4% with additional irradiation of the posterior axilla64. The incidence also varies with the method used for the diagnosis: symptoms (weight gain, edema), estimation of the difference in arm volume using a tape measure (Figure 1, a 2 cm circumference change), using water displacement or other techniques. 45% of the cases where volume is increased by 10% present with symptoms65.
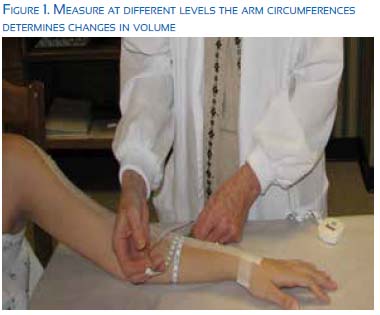
Early treatment includes manual lymphatic drainage and compression dressings66,67, although there is no complete agreement on their benefit. Resistance exercises do not increase the risk of lymphedema 68,69 . Excision and liposuction have been used with varying results, as well as lymphatic reconstruction (creation of anastomosis between lymphatics and veins)70.
c. Cardiac toxicity. Irradiation, chemotherapy, and even aromatase inhibitors are associated with increased cardiovascular risk. It is important to evaluate symptoms (fatigue, dyspnea) and blood lipids, and to stress the value of healthy lifestyles. Irradiation of the heart increases ischemic heart disease in proportion to the dose received; the effect begins 5 years later and remains for the next 20 years. In women with heart problems prior to exposure their risk is greater than in healthy people71. Chemotherapy is also associated with cardiovascular toxicity; anthracyclines affect cardiac function; some of these effects are irreversible72,73. Elderly patients are at increased risk of heart failure or cardiomyopathy, especially related to high doses of doxorubicin (6% between 65-74 years old and 11% over 75 years old) compared to 1- 2% in young women73.
Cardiovascular disease risk factors are more common in survivors than in the general population: tobacco (5.1%), obesity-overweight (62%), physical inactivity (18.1%), hypercholesterolemia, hypertension (55%) and diabetes (20.7%). However, a third of survivors with ≥1 risk factors report that their physicians do not assess these risks74.
d. Cognitive impairment. 75% of patients report problems of concentration, executive function and memory during treatment and 35% of them report the same issues after therapy36. Other concers include memory, attention, concentration, processing speed, language and executive functioning disorders75.
e. Evaluate fatigue and insomnia. We must evaluate the patiient’s concerns, fear of pain, recurrence, death; sexual problems, body image, social relations, and economic issues. Depression and anxiety occur in 11.6% and 17.9% of survivors 76. It may be necessary to evaluate anemia, thyroid problems, insomnia, pain, and depression.
f. Bone health. Compared with the physiological changes, therapy causes greater bone loss 77 . DEXA (dual-energy x-ray absorptiometry) is recommended in postmenopausal women, in those using aromatase inhibitors, those using tamoxifen or GnRH agonists, and in women with chemotherapy-induced menopause. Compared with healthy controls, survivors have lower bone mineral density78, and a higher incidence of vertebral fractures (OR 4.7)77. It is recommended to increase physical activity and resistance exercises (weights), to avoid tobacco, to limit alcohol intake, and to consider taking calcium and vitamin D supplements (1 200 mg with 800 IU daily). Fracture of hip decreases 6% for every 3 metabolic equivalents/week (equivalent to walking 1 hour/week at average rate). Compared with sedentary women, active women decrease the risk of hip fractures by 55% (24 MET-h/week vs <3 MET-h week). Walking 4 h/week decreases the risk of hip fractures by 41%79.
g. Muscle health. Some suffer limitations of mobility of the shoulder (1.5% to 50%), muscle or bone pain (12% to 51%), arm weakness (18% to 23%), and numbness (29% to 81%). Half of survivors receiving aromatase inhibitors report joint and muscle pain80. Duloxetine is recommended for peripheral neuropathy induced by chemotherapy81,82. Chronic pain affects 25% to 60%83; age 18 to 39 years old (OR 3.62) and having received radiotherapy (OR 1.50) are associated with pain84.
h. Decreased sexual desire. Sexual problems are common: problems of desire, libido (23% to 64%), excitement or lubrication (20% to 48%), orgasm (16% to 36%), and dyspareunia (38%). A functional MRI compares responses to stimuli, including erotic stimuli, in two groups of women with loss of sexual desire treated with chemotherapy (some without stress and others with stress from loss of desire). Stressed women show diminished responses to erotic stimulation in the anterior cingulate and dorsolateral prefrontal cortex (brain reward system)85. Signs and symptoms of sexual problems or intimacy should be assessed, an attemp to correct factors contributing to these problems shoud be made; water soluble lubricants can be recommended, and patients can be referred to consultants86.
i. Other effects. Depression in patients undergoing chemotherapy may improve with selective serotonin reuptake inhibitors, but have no effect on fatigue. Radiation dermatitis is treated with steroid creams; pneumonitis with prednisone and pentoxifylline (Tentral); esophagitis with diet, proton pump inhibitors, prokinetic agents, and viscous lidocaine87.
j. Obesity. About 62% of survivors are overweight (≥BMI 25) or obese (30% ≥BMI 30). Increased weight is related to an increase in mortality, especially obesity (BMI>30.0 RR 1.41), with an RR of 1.75 before and RR 1.34 after menopause88. It is recommended to maintain an ideal weight and limit high-calorie foods, to increase physical activity (150 minutes of moderate activity or 75 minutes of vigorous activity/week), and to perform muscle endurance exercises twice a week (especially in women treated with chemotherapy or hormone therapy)89.90. Diet should be high in vegetables, fruits, whole grains, legumes, low in saturated fats. This diet reduces the risk of death (14% to 43%)91-93.
Replacing 30 minutes of sedentary time with light activity is associated with a 14% reduction in mortality and if replaced with vigorous activity, it is associated with a 50% reduction in mortality94.
k. Alcohol. Survivors should not take more than 3 to 4 drinks per week. Compared with abstinence, 6 g/day of alcohol is associated with increased recurrence, especially in postmenopause, and with death, especially in overweight and obese women95-97.
l. Tobacco. It is recommended to avoid using cigarettes and to refer to counseling for cessation. Almost 12% of survivors smoke at an increased risk of mortality98.
IV. Positive effects
Many survivors report positive effects of their cancer experience, greater satisfaction for being alive, better relationships with family and friends, a better understanding of the meaning of life, and better tolerance to difficult situations59,99. Compared to early cancer or a benign process, advanced cancer can facilitate, perhaps without a linear relationship with prognosis, personal development. Youth, spirituality, optimism, marriage, social support (family, friends and health professionals) favor personal development during advanced illness99.
V. Conclusions
Many people associate the diagnosis of cancer with certain death. These patients suffer from body image problems, fear of recurrences, problems with their partner, economic problems, sexual problems, infertility, premature menopause, osteoporosis, cognitive dysfunction, depression and secondary cancers. Before treatment, women of reproductive age should be informed of alternatives to preserve fertility. The use of aromatase inhibitors reduces the risk of recurrences. Besides appropriately evaluating the patient in the context of her age, clinical examinations and mammograms, we recommend to assess early common complications associated with treatment (leukemias, secondary cancers), as well as to discuss with the patient what aspects of her lifestyle can be improved (physical activity, weight gain control, appropriate diet) should be suggested.
En el Perú, el cáncer de mama -el segundo cáncer más común después de cáncer de cuello uterino- es la tercera causa de mortalidad relacionada con cáncer en mujeres, después de los cánceres de estómago y cuello uterino. Se estima que ocurren 26,6/100 000/año (3 952 casos), con una mortalidad de 8,1/100 000/año (1 715 casos)1. En EE UU, la incidencia de cáncer de mama en 1985 era 124,25/100 000 mujeres y en 2013 aumentó a 132,18/100 000, mientras que la mortalidad ha disminuido de 32,9 en 1985 a 20,7 in 2013 2. Las mujeres que viven décadas después de su experiencia con cáncer sufren los problemas comunes de su edad3, a menudo agravados por efectos residuales del cáncer y su tratamiento. Este artículo presenta recomendaciones para la atención de sobrevivientes del cáncer de mama.
I. Recomendaciones para el seguimiento
Las sobrevivientes son personas que han pasado por el proceso diagnóstico, concluido el tratamiento, y aún necesitan atención clínica para reducir recurrencias o manejar problemas crónicos. Estas son las recomendaciones clínicas para despues del tratamiento.
a. Evaluación clínica. Se recomienda evaluar la historia clínica y realizar examen físico cada tres a seis meses en los primeros 3 años, luego cada seis a doce meses en los próximos dos años y anualmente después de los primeros cinco años4.
b. Mamografía anual después de tumorectomía o mastectomía unilateral4. Se ordena RMN (resonancia magnética nuclear) solo en personas con riesgo alto de cáncer (familiares con cáncer de mama, ovario, trompa o peritoneo)5. En mujeres asintomáticas con examen clínico normal, no es necesario realizar de rutina hemograma, perfil bioquímico, gammagrafía ósea, radiografía de pulmones, ecografía del hígado o pélvica, tomografía computada o de emisión de positrón, resonancia magnética, marcadores tumorales (antígeno carcinoembriónico, CA 15-3, CA 27,29)4,6,7.
c. Evaluación de las recurrencias. Las sobrevivientes deben conocer los síntomas de una recurrencia (nuevas tumoraciones, dolor de huesos, dolor de pecho, disnea, dolor abdominal, cefalalgias persistentes). Las recurrencias pueden ocurrir hasta ≥ 15 años después del tratamiento6, y pueden ser locales (en la mama, pared torácica, cicatriz) o distantes (metástasis en ganglios axilares o supraclaviculares, huesos, hígado, pulmones, cerebro). La mayoría de las recurrencias ocurre en los 2 primeros años despues del tratamiento (recurrencia anual 4,3%), proporción que disminuye del segundo al decimosegundo año8. Las pacientes con >3 ganglios positivos sufren más recurrencias que las mujeres con ganglios negativos. Después de 5 años, el riesgo de recurrencia en los siguientes 5 años es 11% y en los próximos 10 años, 19%8.
Después de la operación, una demora de más de 6 semanas para comenzar la radiación se asocia con más recurrencias locales (HR 1,19), por lo que, especialmente en mujeres mayores, se debe iniciar pronto la radiación9. Las sobrevivientes <35 años tienen mayor riesgo de recurrencia que las mujeres >50 años (HR 2,80), así como las mujeres con cirugía conservadora comparadas con las que tuvieron mastectomía (HR 1,82); mientras tanto, la quimioterapia disminuye el riesgo (HR 0,63)10. La recurrencia aumenta el riesgo de metástasis (HR 3,64)11.
La mamografía detecta 40% de las recurrencias, mientras que el examen clínico solo 15%12. Comparadas con las mujeres que no tuvieron este examen, una mamografía disminuye la posibilidad de morir de cáncer de mama en los primeros 2 años (OR 0,80)13. Por cada mamografía se reduce la mortalidad 13% (OR 0,77)14. El riesgo de otro cáncer de mama es mayor en las mujeres que eran menores de 40 años cuando fueron diagnosticadas con su cáncer primario (OR 3,41), en mujeres con mamas densas (OR 2,55) y en aquellas tratadas con cirugía conservadora sin radiación (OR 2,67)15.
La resonancia magnética no es más sensitiva ni más específica en la detección de cáncer de la mama que la mamografía16. Debido al tejido cicatricial después del tratamiento, el diagnóstico de recurrencia puede ser más difícil. La RMN tiene una sensibilidad de 75% a 100% y especificidad de 67% a 100%; ambas características mejoran con un intervalo más prolongado de observación. Se recomienda la RMN en las mujeres con antecedentes familiares de cáncer o con mutaciones BRCA16.
d. Evaluación genética5-7,17. Se recomienda evaluación genética a las sobrevivientes con familiares con cáncer de mama, colon o endometrio (especialmente con cáncer antes de los 60 años), en familiares con cáncer de mama triple negativo, en mujeres judías (Askenazi—origen ancestral en la parte este y central de Europa) con cáncer de ovario o con parientes de primer o segundo grado con cáncer de ovario, o en caso de familiares de primer grado <50 años con cáncer de mama o con ≥2 familiares de primer o segundo grado con cáncer de mama a cualquier edad, o con cáncer de mama bilateral, pariente con cáncer bilateral o pariente masculino con cáncer de mama. (Los parientes de primer grado son los padres, hermanos, e hijos; parientes de segundo grado son los abuelos, nietos, tíos, sobrinos, medio-hermanos).
e. Tratamiento antiestrogénico. Se recomienda el uso de antiestrógenos (inhibidores de la aromatasa, o estrógenos agonista-antagonista, o moduladores del receptor de estrógeno) para disminuir la posibilidad de recidivas. Los inhibidores de la aromatasa (anastrozole—Arimidex 1 mg, letrozole—Femara 2,5 mg, exemestane—Aromasin 25 mg), los agonistas-antagonistas de estrógenos (tamoxifeno (agonista/antagonista 10 a 30 mg/día) y los moduladores del receptor de estrógeno (raloxifeno—Evista 60 mg/día) también han demostrado su eficacia previniendo el desarrollo de cáncer de mama en mujeres con riesgo alto18,19.
f. Evaluación por otros cánceres primarios. Se recomienda evaluación de otros cánceres dependiendo de la edad de la paciente: cáncer de cuello uterino (21 a 65 años), del intestino grueso y recto (≥ 50 años), endometrial (menopausia), del pulmón (55 a 74 años con buena salud, con historia de 30 paquetes-años, que ha fumado en los últimos 15 años o que aún fuma), cáncer de tiroides, ovarios, ganglios linfáticos, piel, boca (≥20 años)20. Las mujeres que reciben tamoxifeno tienen riesgo de hiperplasia endometrial (8%) y cáncer endometrial (4,7%), por lo que deben ser evaluadas si presentan sangrado vaginal anormal21.
g. Cánceres secundarios. Las sobrevivientes tienen mayor posibilidad de cánceres secundarios22. Comparadas con la población en general, los cánceres no mamarios son más frecuentes (SIR [proporción de incidencia estandarizada] 1,22)22. En las pacientes <50 años, la radioterapia se asocia con un aumento del riesgo de cáncer del pulmón (HR 2,31) y la quimioterapia con disminución del riesgo de cáncer de pulmón y colon (HR 0,78). En pacientes ≥50 años, la radioterapia se asocia con un aumento del riesgo de cáncer (HR 3,43), y la quimioterapia aumenta el riesgo de melanoma, cáncer uterino y leucemia. Mientras que la terapia hormonal se asocia con un aumento del cáncer uterino (HR 1,78)22.
En EE UU, los cánceres secundarios representan 18% de todas las neoplasias y son más comunes que las neoplasias primarias (mama, pulmón, próstata)23,24; los factores de riesgo de cáncer primario (tabaco, exceso de alcohol, obesidad), terapia del cáncer primario, predisposición genética, medio ambiente, y una combinación de estos factores afectan su incidencia24,25. Las leucemias asociadas con la quimioterapia (agentes alquilantes, inhibidores de la topoisomerasa y platino) ocurren 2 a 5 años después del tratamiento. Los agentes alquilantes también aumentan el riesgo de tumores del pulmón, gastrointestinal, vejiga, mama y sarcomas; este riesgo disminuye después de 10 años 23,25 . Los tumores inducidos por radiación tienen generalmente un periodo de latencia de 5 a 10 años, están asociados con la dosis, el campo de tratamiento y la edad de la mujer cuando fue tratada23. Comparando las pacientes que recibieron radioterapia con las que no la recibieron, se observa un aumento del riesgo de cáncer del pulmón (RR 1,62 a los 10 a 14 años y RR 1,49 a ≥15 años), leucemia mieloide (RR 2,99 entre 1 y 5 años), segundo cáncer de mama (RR 1,34 entre 5 y 10 años) y de cáncer del esófago (RR 2,19 ≥15 años)26. La irradiación del área supraclavicular y mamaria interna afectan al esófago; el riesgo de cáncer del esófago es bajo, pero aumenta con la dosis (≥35 Gy OR 8,3)27.
Las sobrevivientes tratadas con doxorubicina + ciclofosfamida tienen mayor riesgo de leucemia mieloide aguda (LMA) y síndrome mielodisplásico (SMD) 28. Las que recibieron radioterapia presentan más LMA/SMD que aquellas que no la recibieron (RR 2,38) 28. En un estudio prospectivo, la LMA se desarrolla 13 a 36 meses (media 16) después del comienzo de la quimioterapia, con un pronóstico pobre. Las pacientes que recibieron G-CSF (factor estimulante de la colonia de granulocitos; Neupogen, Filgrastim) tienen un riesgo mayor (RR 6,3)29, así como las pacientes <65 años: incidencia de SMD (RR 10,88) y LMA (RR 5,32)30,31.
II – Efectos del tratamiento del cáncer
a. Imagen corporal. La mastectomía radical tiene efectos más serios que la simple. Como la mujer reacciona a estos cambios físicos, sus emociones, otras circunstancias en su vida y el bienestar en general afectan su adaptación. Se averigua lo que le preocupa a la paciente y si es apropiado se ofrece prótesis, pelucas o cirugía reconstructiva.32
b. Menopausia prematura. El cáncer de mama ocurre en 25% a 30% de mujeres menores de 50 años; los cambios fisiológicos de la menopausia ocurren durante una década, lo que facilita su adaptación. En las sobrevivientes estos cambios ocurren inmediatamente después del tratamiento, sin un periodo de adaptación. Las jóvenes son más afectadas por la menopausia temprana, con sus efectos físicos y psicológicos33. El tratamiento, especialmente la quimioterapia, causa cambios que afectan las relaciones emocionales y la función sexual. Estos problemas deben anticiparse en las comunicaciones con la paciente, además de tratar los bochornos, sequedad vaginal y dispareunia34,35. Las sobrevivientes jóvenes se preocupan acerca de su fertilidad, aun cuando tienen menstruaciones regulares (80% de sobrevivientes comparadas con 25% de las controles)35. La mayoría (70%) de pacientes en tamoxifeno sufren bochornos 36 . Se recomienda modificar el estilo de vida, ejercicios, yoga, dieta adecuada, dejar de fumar, humectantes vaginales, bisfosfonatos, vitamina D, calcio, antidepresores, inhibidores de la recaptación selectiva de serotonina-norepinefrina, inhibidores de la recaptación de serotonina (gabapentina) y, en casos de bochornos más severos, bloqueo del ganglio estrellado37. Comparados con placebo, la paroxetina (Paxil), venlafaxina (Efexor), fluoxetina (Prozac), sertralina (Zoloft) y gabapentina (Neurontin) disminuyen los bochornos38. Se recomienda tratar los bochornos de mujeres que reciben tamoxifeno con venlafaxina, citalopram, clonidina, gabapentina o pregabalina. No se recomienda paroxetina y fluoxetina, porque pueden reducir la eficacia del tamoxifeno.
Las sobrevivientes que no usan tamoxifeno pueden recibir venlafaxina, paroxetina, citalopram, clonidina, gabapentina y pregabalina; no se usa fluoxetina, porque no hay suficiente evidencia de beneficio 39 .
Las sobrevivientes con menstruaciones irregulares sufren pérdida mineral ósea. Un estudio reporta que después de 10 años de seguimiento, las sobrevivientes con menstruaciones regulares sufren una pérdida ósea de columna lumbar de -5,4%, con menstruaciones irregulares -15,3% y con amenorrea -13,2%40. Los inhibidores de la aromatasa (IA) pueden causar pérdida mineral ósea porque bloquean la producción de estrógeno. Comparadas con las controles, las mujeres que reciben IA tienen mayor pérdida ósea (8,7% vs. 7,1%; RR 1,3) y más fracturas (13,5% vs. 10,3%; RR 1,46)41.
c. Infertilidad. Comparadas con las controles, las sobrevivientes con menstruaciones después de la quimoterapia tienen menos folículos (6,0 vs. controles 9,5) y niveles más bajos de la hormona antimuleriana. Las que reciben tamoxifeno tienen menos folículos, niveles más bajos de hormona antimuleriana, inhibina B, pero niveles más altos de estradiol que las que no reciben tamoxifeno43,44. Existen alternativas para proteger la fertilidad. Un estudio aleatorizado compara la adición de acetato de leuprolida a la quimioterapia. Después de un año se restablecieron los niveles normales de FSH y E2, especialmente en el grupo combinado, y las menstruaciones volvieron en 9,2 meses (media), mientras que persistió la amenorrea en el otro grupo44. Dependiendo de la parte del ciclo menstrual, la estimulación de los ovarios podría demorar el tratamiento de 2 a 6 semanas. Pero iniciar la estimulación en cualquier parte del ciclo es tan efectivo como al inicio del ciclo y solo posterga el tratamiento del cáncer por dos semanas45.
d. Embarazo. Más mujeres tienden a postergar sus embarazos, por lo que se diagnosticará cáncer de mama en más mujeres antes de haber completado su familia. Comparadas con las mujeres que no gestan, las mujeres con embarazos después de su diagnóstico presentan menos posibilidad de muerte (-41%)46,47, aun en casos de tumores con receptores estrogénicos positivos48. Sin embargo, los embarazos de sobrevivientes se asocian más a menudo con partos prematuros49. Comparadas con las mujeres sin historia de cáncer, la posibilidad de un nacimiento vivo en las sobrevivientes es menor usando ovocitos autólogos, pero similar cuando se usa ovocitos donados. Las sobrevivientes que salieron embarazadas tienen la misma posibilidad de tener un parto vivo que las mujeres sin cáncer (autólogos: 85,8% y 86,7%; de donantes 85,3% y 86,9%)50. En otro estudio de sobrevivientes, la mitad con tumores hormonales positivos, la mayoría tuvo embarazos a término (77% embarazos espontáneos y 76% de reproducción asistida); los embarazos no afectaron la salud materna durante 5 años de seguimiento51.
e. Menstruaciones irregulares. La amenorrea es común (31,6%) en las mujeres sobrevivientes; la edad >30 años y la nuliparidad aumentan el riesgo de amenorrea. Las menstruaciones retornan en la mayoría de los casos (90%) en los dos primeros años. Las menstruaciones demoran más en las sobrevivientes de mayor edad, las que han recibido quimioterapia o radiación. La mayoría de edad se asocia con menstruaciones irregulares52. La terapia hormonal está asociada con un aumento del riesgo y muerte por cáncer de mama53,54. En un estudio con 4 años de seguimiento, comparadas con controles, más sobrevivientes que recibían hormonas tuvieron un nuevo cáncer de mama (HR 2,4)55.
Para controlar el sangrado irregular, después de una evaluación del endometrio (ecografía transvaginal) se usan medicaciones que disminuyen el sangrado, como las drogas antiinflamatorias no esteroideas (Motrin) o ácido mefenámico (Ponstel), o antifribinolíticos orales como el ácido tranexámico (Lysteda).56 El dispositivo intrauterino con levonorgestrel (Mirena) regula las menstruaciones y no se asocia con recurrencias 57,58 , excepto en las pacientes que usaban el dispositivo antes del diagnóstico y continuaron usándolo después del tratamiento58.
III. Otros efectos tardíos
Cuando concluye el tratamiento, las sobrevivientes generalmente sienten alivio, pero tienen que hacer reajustes físicos, emocionales, sociales y espirituales59. Son comunes el dolor, fatiga, insomnio, ansiedad, depresión, problemas de concentración y memoria, temor de que el cáncer vuelva, efectos en las relaciones con la familia, amigos, intimidad, sexualidad, preocupaciones económicas, experiencia del cáncer en el contexto de religión, esperanza, incertidumbre de la salud futura. Después de 5 años, la mayoría de las sobrevivientes reportan calidad de vida similar a aquellas que no han sufrido de cáncer59.
a. La plexopatía braquial, neuropatía periférica, ocurre en 1,8% de sobrevivientes después de irradiación supraclavicular, especialmente con dosis axilares >50 Gy; en la mayoría (80%) se resuelve completamente60.
b. Linfedema. Esta es una condición crónica, progresiva y debilitante. Resulta del desequilibrio entre la filtración microvascular en los capilares y vénulas y las del sistema de drenaje linfático61. La incidencia de linfedema varía con el tipo de tratamiento, 6,3% en pacientes con biopsia de ganglio centinela y 22,3% (rango 11% a 57%) con disección de los ganglios de la axila62. Esta incidencia aumenta hasta 5 años después del tratamiento 63 . La radiación también aumenta el riesgo de linfedema, aunque es difícil separar su efecto del efecto de la cirugía. Se estima una incidencia de 14,5% en pacientes con radiación de la mama y la pared torácica, 31,5% en pacientes con radiación que además incluye el área supraclavicular, y 41,4% con irradiación adicional de la axila posterior64. La incidencia varía también con el método utilizado para el diagnóstico: síntomas (aumento de peso, edema), estimación de la diferencia de volumen del brazo usando un centímetro (figura 1; un cambio de circunferencia de 2 cm), agua u otras técnicas. Con un aumento del 10% del volumen se encuentran síntomas en 45% de los casos65.
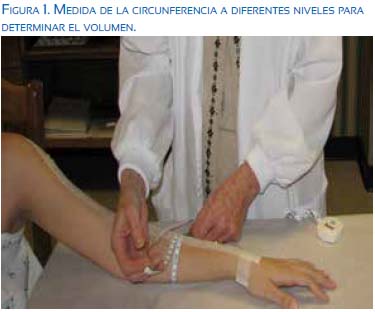
El tratamiento temprano incluye el drenaje linfático manual y vendajes de compresión66,67, aunque no hay un acuerdo sobre su beneficio. Los ejercicios de resistencia no aumentan el riesgo de linfedema68,69. Se ha usado la escisión y liposucción con resultados variables, y la reconstrucción de linfáticos (creación de anastomosis entre linfáticos y venas)70.
c. Toxicidad cardiaca. La irradiación, quimioterapia y aun los inhibidores de la aromatasa han sido asociados con un aumento del riesgo cardiovascular. Se debe evaluar los síntomas (fatiga, disnea), determinar lípidos sanguíneos, y enfatizar estilos de vida saludables. La irradiación del corazón aumenta la enfermedad cardiaca isquémica en proporción a la dosis recibida; su efecto comienza 5 años después y continúa por los próximos 20 años. En las mujeres con problemas cardiacos antes de la exposición, su riesgo es mayor que en personas saludables71. La quimioterapia también está asociada con toxicidad cardiovascular; las antraciclinas afectan la función cardiaca; algunos de estos efectos son irreversibles72,73. Aquellas con mayor edad tienen más riesgo de insuficiencia cardiaca o cardiomiopatía, especialmente relacionada con las dosis altas de doxorubicina (6% entre 65 y 74 años y 11% en ≥75 años) comparada con 1 a 2% en mujeres jóvenes73. Los factores de riesgo de enfermedad cardiovascular son más comunes en las sobrevivientes que en la población en general: tabaco (5,1%), obesidad-sobrepeso (62%), inactividad física (18,1%), hipercolesterolemia, hipertensión arterial (55%) y diabetes (20,7%). Sin embargo, la tercera parte de sobrevivientes con ≥1 factores de riesgo reportan que sus médicos no evalúan estos riesgos74.
d. Deterioro cognitivo. Durante el tratamiento, 75% y después 35% reportan problemas de concentración, función ejecutiva y memoria36: problemas de memoria, atención, concentración, velocidad de procesamiento, lenguaje y funcionamiento ejecutivo75.
e. Evaluar fatiga e insomnio. La evaluación incluye preocupaciones, miedo al dolor, a recurrencias, a la muerte; problemas sexuales, de imagen corporal, relaciones sociales y económicos. Ocurre depresión y ansiedad en 11,6% y 17,9% de los sobrevivientes 76 . Puede ser necesario evaluar anemia, problemas de la tiroides, insomnio, dolor y depresión.
f. Salud ósea. Comparado con lo fisiológico, la terapia causa mayor pérdida ósea77. Se recomienda DEXA (absorsiometría de rayos X de energía dual) en mujeres posmenopáusicas, en las que usan inhibidores de la aromatasa, en las que reciben tamoxifeno o agonistas del GnRH y en mujeres con menopausia inducida por la quimioterapia. Comparadas con las controles (sanas), las sobrevivientes tienen menos densidad mineral ósea78 y mayor incidencia de fracturas vertebrales (OR 4,7)77. Se recomienda aumentar la actividad física, ejercicios de resistencia (pesas), evitar tabaco, limitar ingesta de alcohol, considerar calcio y vitamina D (1 200 mg con 800 UI diariamente). La fractura de cadera disminuye 6% por cada 3 equivalentes metabólicos/ semana (equivale a caminar 1 hora/semana a ritmo promedio). Comparadas con las mujeres sedentarias, las activas disminuyen las fracturas de la cadera en 55% (24 MET-h/ semana vs. <3 MET-h semana). Caminar 4 h/ semana disminuye las fracturas de cadera en 41%79.
g. Salud muscular. Se reporta limitaciones de movilidad del hombro (1,5% a 50%), dolor de los músculos o huesos (12% a 51%), debilidad del brazo (18% a 23%), adormecimiento (29% a 81%). La mitad de sobrevivientes que reciben inhibidores de la aromatasa reportan dolores de las articulaciones y músculos80. Se recomienda Duloxetina para la neuropatía periférica inducida por la quimioterapia81.82. El dolor crónico afecta de 25% a 60% de las pacientes 83 , la edad de 18 a 39 años (OR 3,62) y la radioterapia (OR 1,50)84.
h. Disminución del deseo sexual. Los problemas sexuales son comunes. Hay problemas de deseo, libido (23% a 64%), excitación o lubricación (20% a 48%), orgasmo (16% a 36%) y dispareunia (38%). Un estudio de resonancia magnética funcional compara la respuesta a los estímulos, incluyendo estímulos eróticos, en dos grupos de mujeres con pérdida del deseo sexual tratadas con quimioterapia (unas sin estrés y otras con estrés por la pérdida del deseo). Las mujeres estresadas muestran respuestas disminuidas al estímulo erótico en el cingulado anterior y corteza prefrontal dorsolateral (sistema de recompensa del cerebro)85. Se debe evaluar signos y síntomas de problemas sexuales o intimidad, intentar corregir los factores que contribuyen a estos problemas, ofrecer lubricantes (solubles en agua) y referir a la consulta especializada86.
i. Otros efectos. La depresión en pacientes en quimioterapia puede mejorar con los inhibidores selectivos de la recaptación de serotonina, pero no tienen efecto en la fatiga. La dermatitis causada por la radiación es tratada con cremas con esteroides, la neumonitis con prednisona y pentoxifilina (Tentral), la esofagitis con dieta, inhibidores de la bomba de protones, agentes proquinéticos y lidocaína viscosa87.
j. Obesidad. Cerca de 62% de las sobrevivientes tiene exceso de peso (≥BMI 25) o son obesas (30% ≥BMI 30). La obesidad está relacionada con un aumento de la mortalidad, especialmente las obesas (IMC >30,0 RR 1,41), RR 1,75 antes y RR 1,34 después de la menopausia88. Se recomienda mantener el peso ideal y limitar las comidas de alto contenido calórico, aumentar la actividad física (150 minutos de actividad moderada o 75 minutos de actividad vigorosa/semana), ejercicios de resistencia muscular dos veces por semana (especialmente en mujeres tratadas con quimioterapia o terapia hormonal)89.90. La dieta debe ser alta en vegetales, frutas, granos enteros, legumbres, y baja en grasas saturadas. Esta dieta reduce del riesgo de muerte (14% a 43%)91-93. Reemplazando 30 minutos de tiempo sedentario por actividad ligera se asocia con una reducción de 14% de mortalidad, y si se reemplaza con una actividad vigorosa se asocia con una reducción del 50% de mortalidad94.
k. Alcohol. La sobrevivientes no deben tomar más de 3 a 4 tragos por semana. Comparado con la abstinencia, la ingesta de 6 g/día de alcohol se asocia con un aumento de recurrencia, especialmente en la posmenopausia, y muerte, especialmente en mujeres con sobrepeso y obesas95-97.
l. Tabaco. Se recomienda evitar el uso de cigarrillos y referir a consejería para su cesación. Casi 12% de las sobrevivientes fuman, con un riesgo mayor de mortalidad98.
IV. Efectos positivos
Muchas sobrevientes reportan efectos positivos de su experiencia con cáncer, una mayor satisfacción de estar vivas, una mejor relación con la familia y amigos, un mejor entendimiento del significado de la vida y mejor tolerancia a las situaciones difíciles59.99. Comparado con el cáncer temprano o un proceso benigno, el cáncer avanzado puede facilitar, quizás sin una relación linear con el pronóstico, el desarrollo personal. La juventud, espiritualidad, optimismo, matrimonio, apoyo social (familia, amigos y profesionales de salud) favorecen el desarrollo personal durante la enfermedad avanzada99.
V. Conclusiones
Muchas personas asocian el diagnóstico de cáncer con muerte segura. Estas pacientes sufren problemas de imagen corporal, temor de recurrencias, problemas con su pareja, problemas económicos, problemas sexuales, infertilidad, menopausia prematura, osteoporosis, disfunción cognitiva, depresión, cánceres secundarios. Antes del tratamiento, se debe informar a mujeres de edad reproductiva de las alternativas para preservar la fertilidad. El uso de inhibidores de la aromatasa reduce el riesgo de recurrencias. Además de la evaluación apropiada para la edad de la paciente, se recomienda exámenes clínicos y mamografías, evaluación temprana de las complicaciones comunes asociadas con el tratamiento (leucemias, cánceres secundarios), mejorar el estilo de vida (actividad física, control del aumento de peso, dieta adecuada).
References
1. WHO. Cancer Peru. Country profile. http://www.who.int/cancer/country-profiles/en/ [ Links ]
2. Surveillance, Epidemiology, and End Results. SEER Cancer Statistics Review. 1975-2013. Breast/Table 4.9. seer.cancer.gov [ Links ]
3. Yancik R, Wesley MN, Ries LA, Havlik RJ, Edwards BK, Yates JW. Effect of age and comorbidity in postmenopausal breast cancer patients aged 55 years and older. JAMA. 2001;285(7):885-92. [ Links ]
4. Runowicz CD, Leach CR, Henry NL, Henry KS, Mackey HT, Cowens-Alvarado RL, et al. American Cancer Society/American Society of Clinical Oncology Breast Cancer Survivorship Care Guideline. CA Cancer J Clin. 2016;66(1):43-73. doi: 10.3322/caac.21319. [ Links ]
5. Moyer VA. Risk assessment, genetic counseling, and genetic testing for BRCA-related cancer in women: US Preventive Services Task Force recommendation statement. Ann Intern Med. 2014;160(4):271-81. DOI: 10.7326/M13-2747 [ Links ]
6. Khatcheressian JL, Hurley P, Bantug E, Esserman LJ, Grunfeld E, Halberg F, et al; American Society of Clinical Oncology. Breast cancer follow-up and management after primary treatment: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2013;31(7):961-5. doi: 10.1200/JCO.2012.45.9859. [ Links ]
7. Henry LN, Hayes DF, Ramsey SD, Hortobagyi GN, Barlow WE, Gralow JR. Promoting quality and evidence-based care in early-stage breast cancer follow-up. J Natl Cancer Inst. 2014;106(4):dju034. doi: 10.1093/jnci/dju034. [ Links ]
8. Brewster AM, Hortobagyi GN, Broglio KR, Kau SW, Santa-Maria CA, Arun B, et al. Residual risk of breast cancer recurrence 5 years after adjuvant therapy. J Natl Cancer Inst. 2008;100(16):1179-83. doi: 10.1093/jnci/djn233. [ Links ]
9. Punglia RS, Saito AM, Neville BA, Earle CC, Weeks JC. Impact of interval from breast conserving surgery to radiotherapy on local recurrence in older women with breast cancer: retrospective cohort analysis. BMJ. 2010;340:c845. doi: 10.1136/bmj.c845. [ Links ]
10. de Bock GH, van der Hage JA, Putter H, Bonnema J, Bartelink H, van de Velde CJ. Isolated loco-regional recurrence of breast cancer is more common in young patients and following breast conserving therapy: long-term results of European Organisation for Research and Treatment of Cancer studies. Eur J Cancer. 2006;42(3):351-6. DOI: 10.1016/j.ejca.2005.10.006 [ Links ]
11. de Bock GH, Putter H, Bonnema J, van der Hage JA, Bartelink H, van de Velde CJ. The impact of loco-regional recurrences on metastatic progression in early-stage breast cancer: a multistate model. Breast Cancer Res Treat. 2009;117(2):401-8. doi: 10.1007/s10549-008-0300-2. [ Links ]
12. Montgomery DA, Krupa K, Cooke TG. Follow-up in breast cancer: does routine clinical examination improve outcome? A systematic review of the literature. Br J Cancer. 2007;97(12):1632-41. DOI: 10.1038/sj.bjc.6604065 [ Links ]
13. Schootman M, Jeffe DB, Lian M, Aft R, Gillanders WE. Surveillance mammography and the risk of death among elderly breast cancer patients. Breast Cancer Res Treat. 2008;111(3):489-96. DOI: 10.1007/s10549-007-9795-1 [ Links ]
14. Lash TL, Fox MP, Silliman RA. Reduced mortality rate associated with annual mammograms after breast cancer therapy. Breast J. 2006;12(1):2-6. DOI: 10.1111/j.1075-122X.2006.00177.x [ Links ]
15. Houssami N, Abraham LA, Kerlikowske K, Buist DS, Irwig L, Lee J, et al. Risk factors for second screen-detected or interval breast cancers in women with a personal history of breast cancer participating in mammography screening. Cancer Epidemiol Biomarkers Prev. 2013;22(5):946-61. doi: 10.1158/1055-9965. EPI-12-1208-T. [ Links ]
16. Quinn EM, Coveney AP, Redmond HP. Use of magnetic resonance imaging in detection of breast cancer recurrence: a systematic review. Ann Surg Oncol. 2012;19(9):3035-41. doi: 10.1245/s10434-012-2341-3. [ Links ]
17. U.S. Preventive Services Task Force. Risk Assessment, Genetic Counseling, and Genetic Testing for BRCA-Related Cancer in Women: Clinical Summary of USPSTF Recommendation. AHRQ Publication No. 12-05164- EF-3. December 2013. http://www.uspreventiveservicestaskforce.org/uspstf12/brcatest/brcatestsumm.htm] [ Links ]
18. Goss PE, Ingle JN, Alés-Martínez JE, Cheung AM, Chle- bowski RT, Wactawski-Wende J, et al. for Exemestane breast-cancer prevention in postmenopausal women. N Engl J Med. 2011;364(25):2381-91. doi: 10.1056/NEJMoa1103507. [ Links ]
19. Cuzick J, Sestak I, Forbes JF, Dowsett M, Knox J, Cawthorn S, et al. Anastrozole for prevention of breast cancer in high-risk postmenopausal women (IBIS-II): an international, double-blind, randomised placebo-controlled trial. Lancet. 2014;383(9922):1041-8. doi: 10.1016/S0140-6736(13)62292-8. [ Links ]
20. Smith RA, Manassaram-Baptiste D, Brooks D, Doroshenk M, Fedewa S, Saslow D, et al. Cancer screening in the United States, 2015: a review of current American Cancer Society guidelines and current issues in cancer screening. CA Cancer J Clin. 2015;65(1):30-54. doi: 10.3322/caac.21261. [ Links ]
21. Deligdisch L, Kalir T, Cohen CJ, de Latour M, Le Bouedec G, Penault-Llorca F. Endometrial histopathology in 700 patients treated with tamoxifen for breast cancer. Gynecol Oncol. 2000;78(2):181-6. DOI: 10.1006/gyno.2000.5859 [ Links ]
22. Schaapveld M, Visser O, Louwman MJ, de Vries EG, Willemse PH, Otter R, et al. Risk of new primary nonbreast cancers after breast cancer treatment: a Dutch population-based study. J Clin Oncol. 2008;26(8):1239-46. doi: 10.1200/JCO.2007.11.9081. [ Links ]
23. Wood ME, Vogel V, Ng A, Foxhall L, Goodwin P, Travis LB. Second malignant neoplasms: assessment and strategies for risk reduction. J Clin Oncol. 2012; 30(30):3734-45. doi: 10.1200/JCO.2012.41.8681. [ Links ]
24. Travis LB, Demark Wahnefried W, Allan JM, Wood ME, Ng AK. Aetiology, genetics and prevention of secondary neoplasms in adult cancer survivors. Nat Rev Clin Oncol. 2013;10(5):289-301. doi: 10.1038/nrclinonc.2013.41. [ Links ]
25. Klabunde CN, Han PK, Earle CC, Smith T, Ayanian JZ, Lee R, et al. Physician roles in the cancer-related follow-up care of cancer survivors. Fam Med. 2013;45(7):463-74. [ Links ]
26. Roychoudhuri R, Evans H, Robinson D, Møller H. Radiation-induced malignancies following radiotherapy for breast cancer. Br J Cancer. 2004;91(5):868-72. DOI: 10.1038/sj.bjc.6602084 [ Links ]
27. Morton LM, Gilbert ES, Hall P, Andersson M, Joensuu H, Vaalavirta L, et al. Risk of treatment-related esophageal cancer among breast cancer survivors. Ann Oncol. 2012;23(12):3081-91. doi: 10.1093/annonc/mds144. [ Links ]
28. Smith RE, Bryant J, DeCillis A, Anderson S; National Surgical Adjuvant Breast and Bowel Project Experience. Acute myeloid leukemia and myelodysplastic syndrome after doxorubicin-cyclophosphamide adjuvant therapy for operable breast cancer: the National Surgical Adjuvant Breast and Bowel Project Experience. J Clin Oncol. 2003;21(7):1195-204. [ Links ]
29. Le Deley MC, Suzan F, Cutuli B, Delaloge S, Shamsaldin A, Linassier C, et al. Anthracyclines, mitoxantrone, radiotherapy, and granulocyte colony-stimulating factor: risk factors for leukemia and myelodysplastic syndrome after breast cancer. J Clin Oncol. 2007;25(3):292-300. DOI: 10.1200/JCO.2006.05.9048 [ Links ]
30. Kaplan HG, Malmgren JA, Atwood MK. Increased incidence of myelodysplastic syndrome and acute myeloid leukemia following breast cancer treatment with radiation alone or combined with chemotherapy: a registry cohort analysis 1990-2005. BMC Cancer. 2011;11:260. doi: 10.1186/1471-2407-11-260. [ Links ]
31. Malmgren JA, Calip GS, Pyott SM, Atwood MK, Kaplan HG. Therapy-related myelodysplastic syndrome following primary breast cancer. Leuk Res. 2016;47:178-84. doi: 10.1016/j.leukres.2016.06.005. [ Links ]
32. Falk Dahl CA, Reinertsen KV, Nesvold IL, Fossa SD, Dahl AA. A study of body image in long-term breast cancer survivors. Cancer.2010;116(15):3549-57. doi: 10.1002/cncr.25251. [ Links ]
33. Partridge AH. Cancer survivorship and the young breast cancer patient: addressing the important issues. Oncologist. 2013;18(8):e19-e20. doi: 10.1634/ theoncologist.2013-0300. [ Links ]
34. Fobair P, Spiegel D. Concerns about sexuality after breast cancer. Cancer J. 2009;15(1):19-26. doi: 10.1097/PPO.0b013e31819587bb. [ Links ]
35. Ruddy KJ, Gelber S, Ginsburg ES, Schapira L, Abusief ME, Meyer ME, et al. Menopausal symptoms and fertility concerns in premenopausal breast cancer survivors: a comparison to age- and gravidity-matched controls. Menopause. 2011;18(1):105-8. [ Links ]
36. Stan D, Loprinzi CL, Ruddy KJ. Breast cancer survivorship issues. Hematol Oncol Clin North Am. 2013;27(4):805-27, ix. doi: 10.1016/j.hoc.2013.05.005. [ Links ]
37. Murthy V, Chamberlain RS. Menopausal symptoms in young survivors of breast cancer: a growing problem without an ideal solution. Cancer Control. 2012;19(4):317-29. [ Links ]
38. Loprinzi CL, Sloan J, Stearns V, Slack R, Iyengar M, Diekmann B, et al. Newer antidepressants and gabapentin for hot flashes: an individual patient pooled analysis. J Clin Oncol. 2009;27(17):2831-7. doi: 10.1200/JCO.2008.19.6253. [ Links ]
39. L’Espérance S, Frenette S, Dionne A, Dionne JY; Comité de l’évolution des pratiques en oncologie (CEPO). Pharmacological and non-hormonal treatment of hot flashes in breast cancer survivors: CEPO review and recommendations. Support Care Cancer. 2013;21(5):1461-74. doi: 10.1007/s00520-013-1732-8. [ Links ]
40. Vehmanen LK, Elomaa I, Blomqvist CP, Saarto T. The effect of ovarian dysfunction on bone mineral density in breast cancer patients 10 years after adjuvant chemotherapy. Acta Oncol. 2014;53(1):75-9. doi: 10.3109/0284186X.2013.792992. [ Links ]
41. Mincey BA, Duh MS, Thomas SK, Moyneur E, Marynchencko M, Boyce SP, et al. Risk of cancer treatment-associated bone loss and fractures among women with breast cancer receiving aromatase inhibitors. Clin Breast Cancer. 2006;7(2):127-32. DOI: 10.3816/ CBC.2006.n.021 [ Links ]
42. Partridge AH, Ruddy KJ, Gelber S, Schapira L, Abusief M, Meyer M, et al. Ovarian reserve in women who remain premenopausal after chemotherapy for early stage breast cancer. Fertil Steril. 2010;94(2):638-44. doi: 10.1016/j.fertnstert.2009.03.045. [ Links ]
43. Ruddy KJ, Gelber S, Ginsburg ES, Schapira L, Abusief M, Meyer M, Partridge AH. Menopausal symptoms and fertility concerns in premenopausal breast cancer survivors: a comparison to age- and gravidity-matched controls. Menopause. 2011;18(1):105-8. [ Links ]
44. Song G, Gao H, Yuan Z. Effect of leuprolide acetate on ovarian function after cyclophosphamide-doxorubicin-based chemotherapy in premenopausal patients with breast cancer: results from a phase II randomized trial. Med Oncol. 2013;30(3):667. doi: 10.1007/s12032-013-0667-8. [ Links ]
45. Cakmak H, Katz A, Cedars MI, Rosen MP. Effective method for emergency fertility preservation: random-start controlled ovarian stimulation. Fertil Steril. 2013;100(6):1673-80. doi: 10.1016/j.fertnstert.2013.07.1992. [ Links ]
46. Azim HA Jr, Santoro L, Pavlidis N, Gelber S, Kroman N, Azim H, Peccatori FA. Safety of pregnancy following breast cancer diagnosis: a meta-analysis of 14 studies. Eur J Cancer. 2011;47(1):74-83. doi: 10.1016/j.ejca.2010.09.007. [ Links ]
47. Valachis A, Tsali L, Pesce LL, Polyzos NP, Dimitriadis C, Tsalis K, et al. Safety of pregnancy after primary breast carcinoma in young women: a meta-analysis to overcome bias of healthy mother effect studies. Obstet Gynecol Surv. 2010;65(12):786-93. doi: 10.1097/OGX .0b013e31821285bf. [ Links ]
48. Azim HA Jr, Kroman N, Paesmans M, Gelber S, Rotmensz N, Ameye L, et al. Prognostic impact of pregnancy after breast cancer according to estrogen receptor status: a multicenter retrospective study. J Clin Oncol. 2013;31(1):73-9. doi: 10.1200/JCO.2012.44.2285. [ Links ]
49. Landa A, Kuller J, Rhee E. Perinatal Considerations in Women With Previous Diagnosis of Cancer. Obstet Gynecol Surv. 2015;70(12):765-72. doi: 10.1097/OGX.0000000000000255 [ Links ]
50. Luke B, Brown MB, Missmer SA, Spector LG, Leach RE, Williams M, et al. Assisted reproductive technology use and outcomes among women with a history of cancer. Hum Reprod. 2016;31(1):183-9. doi: 10.1093/humrep/dev288. [ Links ]
51. Goldrat O, Kroman N, Peccatori FA, Cordoba O, Pistilli B, Lidegaard O, et al. Pregnancy following breast cancer using assisted reproduction and its effect on longterm outcome. Eur J Cancer. 2015;51(12):1490-6. doi: 10.1016/j.ejca.2015.05.007. [ Links ]
52. Jacobson MH, Mertens AC, Spencer JB, Manatunga AK, Howards PP. Menses resumption after cancer treatment-induced amenorrhea occurs early or not at all. Fertil Steril. 2016;105(3):765-72.e4. doi: 10.1016/j. fertnstert.2015.11.020. [ Links ]
53. Beral V; Million Women Study Collaborators. Breast cancer and hormone-replacement therapy in the Million Women Study. Lancet. 2003;362(9382):419-27. [ Links ]
54. Col NF, Kim JA, Chlebowski RT. Menopausal hormone therapy after breast cancer: a meta-analysis and critical appraisal of the evidence. Breast Cancer Res. 2005;7(4):R535-40. DOI: 10.1186/bcr1035 [ Links ]
55. Holmberg L, Iversen OE, Rudenstam CM, Hammar M, Kumpulainen E, Jaskiewicz J, et al; HABITS Study Group. Increased risk of recurrence after hormone replacement therapy in breast cancer survivors. J Natl Cancer Inst. 2008;100(7):475-82. doi: 10.1093/jnci/djn058. [ Links ]
56. Maybin JA, Critchley HO. Medical management of heavy menstrual bleeding. Womens Health (Lond). 2016;12(1):27-34. doi: 10.2217/whe.15.100. [ Links ]
57. Eralil GJ. The effectiveness of levonorgestrel-releasing intrauterine system in the treatment of heavy menstrual bleeding. J Obstet Gynaecol India. 2016;66(Suppl 1):505-12. doi: 10.1007/s13224-016-0865-3. [ Links ]
58. Trinh XB, Tjalma WA, Makar AP, Buytaert G, Weyler J, van Dam PA. Use of the levonorgestrel-releasing intrauterine system in breast cancer patients. Fertil Steril. 2008;90(1):17-22. DOI: 10.1016/j.fertnstert.2007.05.033 [ Links ]
59. Ganz PA, Earle CC, Goodwin PJ. Journal of Clinical Oncology update on progress in cancer survivorship care and research. J Clin Oncol. 2012; 30(30):3655-6. DOI: 10.1200/JCO.2012.45.3886 [ Links ]
60. Delanian S, Lefaix JL, Pradat PF. Radiation-induced neuropathy in cancer survivors. Radioth- er Oncol. 2012;105(3):273-82. doi: 10.1016/j.radonc.2012.10.012. [ Links ]
61. Mortimer PS. The pathophysiology of lymphedema. Cancer. 1998;83(12 Suppl American):2798–802. [ Links ]
62. Norman SA, Localio AR, Potashnik SL, Simoes Torpey HA, Kallan MJ, Weber AL, et al. Lymphedema in breast cancer survivors: incidence, degree, time course, treatment, and symptoms. J Clin Oncol. 2009;27(3):390–7. doi: 10.1200/JCO.2008.17.9291. [ Links ]
63. DiSipio T, Rye S, Newman B, Hayes S. Incidence of unilateral arm lymphoedema after breast cancer: a systematic review and meta-analysis. Lancet Oncol. 2013;14(14):500–15. doi: 10.1016/S1470-2045(13)70076-7. [ Links ]
64. Shaitelman SF, Cromwell KD, Rasmussen JC, Stout NL, Armer JM, Lasinski BB, Cormier JN. Recent Progress in Cancer-Related Lymphedema Treatment and Prevention. CA Cancer J Clin. 2015;65(1): 55–81. doi: 10.3322/caac.21253. [ Links ]
65. Armer JM, Stewart BR. Post-breast cancer lymphedema: incidence increases from 12 to 30 to 60 months. Lymphology.2010;43(3):118-27. [ Links ]
66. Lasinski BB, McKillip Thrift K, Squire D, Austin MK, Smith KM, et al. A systematic review of the evidence for complete decongestive therapy in the treatment of lymphedema from 2004 to 2011. PM R. 2012;4(8):580–601. doi: 10.1016/j.pmrj.2012.05.003 [ Links ]
67. Huang TW, Tseng SH, Lin CC, Bai CH, Chen CS, Hung CS, et al. Effects of manual lymphatic drainage on breast cancer-related lymphedema: a systematic review and meta-analysis of randomized controlled trials. World J Surg Oncol. 2013;11:15. doi: 10.1186/1477-7819-11-15. [ Links ]
68. Kwan ML, Cohn JC, Armer JM, Stewart BR, Cormier JN. Exercise in patients with lymphedema: a systematic review of the contemporary literature. J Cancer Surviv. 2011;5(4):320-36. doi: 10.1007/s11764-011-0203-9. [ Links ]
69. Schmitz KH, Ahmed RL, Troxel AB, Cheville A, Lewis-Grant L, Smith R, Bryan CJ, et al. Weight lifting for women at risk for breast cancer-related lymphedema: a randomized trial. JAMA. 2010;304(24):2699-705. doi: 10.1001/jama.2010.1837. [ Links ]
70. Cormier JN, Rourke L, Crosby M, Chang D, Armer J. The surgical treatment of lymphedema: a systematic review of the contemporary literature (2004-2010). Ann Surg Oncol. 2012;19(2):642-51. doi: 10.1245/s10434-011-2017-4. [ Links ]
71. Darby SC, Ewertz M, McGale P, Bennet AM, Blom-Goldman U, Brønnum D, et al. Risk of ischemic heart disease in women after radiotherapy for breast cancer. N Engl J Med.2013;368(11):987-98. doi: 10.1056/NEJMoa1209825. [ Links ]
72. Curigliano G, Cardinale D, Suter T, Plataniotis G, de Azambuja E, Sandri MT, et al. Cardiovascular toxicity induced by chemotherapy, targeted agents and radiotherapy: ESMO Clinical Practice Guidelines. Ann Oncol. 2012 Oct;23 Suppl 7:vii155-66. [ Links ]
73. Bowles EJ, Wellman R, Feigelson HS, Onitilo AA, Freedman AN, Delate T, et al. Risk of heart failure in breast cancer patients after anthracycline and trastuzumab treatment: a retrospective cohort study. J Natl Cancer Inst. 2012;104(17):1293-305. doi: 10.1093/jnci/djs317. [ Links ]
74. Weaver KE, Foraker RE, Alfano CM, Rowland JH, Arora NK, Bellizzi KM, et al. Cardiovascular risk factors among long-term survivors of breast, prostate, colorectal, and gynecologic cancers: a gap in survivorship care? J Cancer Surviv. 2013;7(2):253-61. doi: 10.1007/ s11764-013-0267-9. [ Links ]
75. Janelsins MC, Kohli S, Mohile SG, Usuki K, Ahles TA, Morrow GR. An update on cancer- and chemotherapy-related cognitive dysfunction: current status. Semin Oncol. 2011;38(3):431-8. doi: 10.1053/j.seminoncol.2011.03.014. [ Links ]
76. Mitchell AJ, Ferguson DW, Gill J, Paul J, Symonds P. Depression and anxiety in long-term cancer survivors compared with spouses and healthy controls: a systematic review and meta-analysis. Lancet Oncol. 2013;14(8):721-32. doi: 10.1016/S1470-2045(13)70244-4. [ Links ]
77. Kanis JA, McCloskey EV, Powles T, Paterson AH, Ashley S, Spector T. A high incidence of vertebral fracture in women with breast cancer. Br J Cancer. 1999;79(7-8):1179-81. DOI: 10.1038/sj.bjc.6690188 [ Links ]
78. Chen Z, Maricic M, Pettinger M, Ritenbaugh C, Lopez AM, Barad DH, et al. Osteoporosis and rate of bone loss among postmenopausal survivors of breast cancer. Cancer. 2005;104(7):1520-30. DOI: 10.1002/cncr.21335 [ Links ]
79. Feskanich D, Willett W, Colditz G. Walking and leisure-time activity and risk of hip fracture in postmenopausal women. JAMA.2002;288(18):2300-6. [ Links ]
80. Crew KD, Greenlee H, Capodice J, Raptis G, Brafman L, Fuentes D, et al. Prevalence of joint symptoms in postmenopausal women taking aromatase inhibitors for early-stage breast cancer. J Clin Oncol. 2007;25(25):3877-83. DOI: 10.1200/JCO.2007.10.7573 [ Links ]
81. Hershman DL, Lacchetti C, Dworkin RH, Lavoie Smith EM, Bleeker J, Cavaletti G, et al; American Society of Clinical Oncology. Prevention and management of chemotherapy-induced peripheral neuropathy in survivors of adult cancers: American Society of Clinical Oncology clinical practice guideline. J Clin Oncol. 2014;32(18):1941-67. doi: 10.1200/JCO.2013.54.0914. [ Links ]
82. Smith EM, Pang H, Cirrincione C, Fleishman S, Paskett ED, Ahles T, et al; Alliance for Clinical Trials in Oncology. Effect of duloxetine on pain, function, and quality of life among patients with chemotherapy-induced painful peripheral neuropathy: a randomized clinical trial. JAMA. 2013;309(13):1359-67. doi: 10.1001/ jama.2013.2813. [ Links ]
83. Andersen KG, Kehlet H. Persistent pain after breast cancer treatment: a critical review of risk factors and strategies for prevention. J Pain. 2011;12(7):725-46. doi: 10.1016/j.jpain.2010.12.005. [ Links ]
84. Gartner R, Jensen MB, Nielsen J, Ewertz M, Kroman N, Kehlet H. Prevalence of and factors associated with persistent pain following breast cancer surgery. JAMA. 2009;302(18):1985-92. doi: 10.1001/ jama.2009.1568. [ Links ]
85. Versace F, Engelmann JM, Jackson EF, Slapin A, Cortese KM, Bevers TB, et al. Brain responses to erotic and other emotional stimuli in breast cancer survivors with and without distress about low sexual desire: a preliminary fMRI study. Brain Imaging Behav. 2013;7(4):533-42. DOI: 10.1007/s11682-013-9252-1 [ Links ]
86. Fobair P, Spiegel D. Concerns about sexuality after breast cancer. Cancer J. 2009;15(1):19-26. doi: 10.1097/PPO.0b013e31819587bb. [ Links ]
87. Berkey FJ. Managing the adverse effects of radiation therapy. Am Fam Physician. 2010;82(4):381-8, 394. [ Links ]
88. Chan DS, Vieira AR, Aune D, Bandera EV, Greenwood DC, McTiernan A, et al. Body mass index and survival in women with breast cancer-systematic literature review and meta-analysis of 82 follow-up studies. Ann Oncol. 2014;25(10):1901-14. doi: 10.1093/annonc/mdu042. [ Links ]
89. Rock CL, Doyle C, Demark-Wahnefried W, Meyerhardt J, Courneya KS, Schwartz AL, et al. Nutrition and physical activity guidelines for cancer survivors. CA Cancer J Clin.2012;62(4):243-74. doi: 10.3322/caac.21142. [ Links ]
90. Demark-Wahnefried W, Rogers LQ, Alfano CM, Thomson CA, Courneya KS, Meyerhardt JA, et al. Practical clinical interventions for diet, physical activity, and weight control in cancer survivors. CA Cancer J Clin. 2015;65(3):167-89. doi: 10.3322/caac.21265. [ Links ]
91. Kroenke CH, Fung TT, Hu FB, Holmes MD. Dietary patterns and survival after breast cancer diagnosis. J Clin Oncol.2005;23(36):9295-303. DOI: 10.1200/JCO.2005.02.0198 [ Links ]
92. Kwan ML, Weltzien E, Kushi LH, Castillo A, Slattery ML, Caan BJ. Dietary patterns and breast cancer recurrence and survival among women with early-stage breast cancer. J Clin Oncol. 2009;27(6):919-26.doi: 10.1200/JCO.2008.19.4035. [ Links ]
93. Vrieling A, Buck K, Seibold P, Heinz J, Obi N, Flesch-Janys D, Chang-Claude J. Dietary patterns and survival in German postmenopausal breast cancer survivors. Br J Cancer.2013;108(1):188-92. doi: 10.1038/bjc.2012.521. [ Links ]
94. Schmid D, Ricci C, Baumeister SE, Leitzmann MF. Replacing Sedentary Time with Physical Activity in Relation to Mortality. Med Sci Sports Exerc. 2016;48(7):1312-9. doi: 10.1249/MSS.0000000000000913. [ Links ]
95. Kwan ML, Kushi LH, Weltzien E, Tam EK, Castillo A, Sweeney C, Caan BJ Alcohol consumption and breast cancer recurrence and survival among women with early-stage breast cancer: the life after cancer epidemiology study. J Clin Oncol. 2010 Oct 10;28(29):4410-6. doi: 10.1200/JCO.2010.29.2730. [ Links ]
96. Nelson DE, Jarman DW, Rehm J, Greenfield TK, Rey G, Kerr WC, et al. Alcohol-attributable cancer deaths and years of potential life lost in the United States. Am J Public Health. 2013;103(4):641-8. doi: 10.2105/AJPH.2012.301199. [ Links ]
97. Scoccianti C, Lauby-Secretan B, Bello PY, Chajes V, Romieu I. Female breast cancer and alcohol consumption: a review of the literature. Am J Prev Med. 2014;46(3 suppl 1):S16-S25. doi: 10.1016/j.amepre.2013.10.031. [ Links ]
98. Zhao G, Li C, Okoro CA, Li J, Wen XJ, White A, Balluz LS. Trends in modifiable lifestyle-related risk factors following diagnosis in breast cancer survivors. J Cancer Surviv. 2013;7(4):563-9. doi: 10.1007/s11764-013-0295-5. [ Links ]
99. Moreno PI, Stanton AL. Personal growth during the experience of advanced cancer: a systematic review. Cancer J. 2013;19(5):421-30. DOI: 10.1097/PPO.0b013e3182a5bbe7 [ Links ]
Financing: The author certifies he has not received financial support for the publication of this review.
Conflict of interest: The author declares no conflict of interest.
Correspondence:
Received: 4 August 2016
Reviewed: 20 December 2016
Accepted: 27 December 2016













