Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.63 no.2 Lima abr./jun. 2017
SIMPOSIO PREECLAMPSIA: ACTUALIZACIÓN
Células progenitoras endoteliales en el embarazo normal y la preeclampsia
Endothelial progenitor cells in normal pregnancy and preeclampsia
Eduardo Reyna-Villasmil1,a; Gabriel Mayner-Tresol2,b; Pedro Herrera-Moya3,b; Carlos Briceño Pérez4,a
1 Hospital Central "Dr. Urquinaona". Maracaibo. Venezuela.
2 Universidad Católica de Santiago de Guayaquil. Guayaquil. Ecuador.
3 Universidad Nacional Estatal de Milagro. Milagro. Ecuador.
4 La Universidad del Zulia. Maracaibo. Venezuela.
a Médico especialista, Doctor en Ciencias Médicas
b Médico especialista y Docente
RESUMEN
El embarazo es un reto para el sistema cardiovascular materno, necesitando de adaptación sistémica y marcados cambios locales en el útero. La adaptación cardiovascular materna al embarazo involucra una respuesta fisiológica compleja a la presencia de un feto en crecimiento, incluyendo alteraciones de las células endoteliales vasculares que contribuyen a la marcada disminución de la resistencia vascular sistémica. El descubrimiento de las células progenitoras endoteliales ha generado un considerable interés en el campo de la biología vascular. Estas células pueden ser movilizadas hacia la circulación por factores de crecimiento y pueden apoyar la salud del endotelio vascular por varios mecanismos. Estas células se originan de una población de células mononucleares circulantes y tienen la capacidad de formar nuevos vasos y contribuyen a la reparación vascular. Patologías del embarazo, como la preeclampsia, incrementan el riesgo de complicaciones y están asociadas con disfunción endotelial.
Palabras clave. Células Endoteliales Progenitoras; Embarazo; Preeclampsia.
ABSTRACT
Pregnancy is a challenge to the maternal vascular system, requiring systemic adaptation and pronounced local changes in the uterus. The maternal cardiovascular adaptation to pregnancy involves a complex physiologic response to the presence of the growing fetus, including alterations in maternal vascular endothelial cells that contribute to a profound fall in total systemic vascular resistance. The discovery of endothelial progenitor cells has generated considerable interest in the field of vascular biology. These cells can be mobilized into the circulation by growth factors and can then support the health of the vascular endothelium by several mechanisms. These cells arise from a population of circulating mononuclear cells and have the capacity to form new blood vessels and contribute to vascular repair. Diseases of pregnancy, such as preeclampsia, increase the risk of complications and are associated with endothelial dysfunction.
Keywords: Endothelial Progenitor Cells; Pregnancy; Preeclampsia.
INTRODUCCIÓN
La reparación del endotelio es mediada por angiogénesis, Se pensaba que la formación de los vasos de novo ocurría solo en el feto, Existen nuevos conceptos de vasculogénesis en el cual las 'células progenitoras endoteliales' (EPC) migran para formar nuevo endotelio, Estas poseen características de las células endoteliales expresando C034 y receptor 2 de crecimiento vascular endotelial (VEGFR-2), La sintasa de óxido nítrico (ON) responde al factor de crecimiento vascular endotelial (VEGF)(1,2), Se ha demostrado que las EPC son movilizadas para colonizar la superficie endotelial'", Este artículo revisa el papel de las EPC en el embarazo y la preeclampsia.
METODOLOGÍA DE LA BÚSQUEDA DE LA INFORMACIÓN
Entre noviembre de 2016 y febrero 2017 se examinaron bases de datos electrónicas (PubMed y EMBASE) en busca de estudios elegibles de EPC en el embarazo normal, embarazo complicado e hipertensión inducida por el embarazo en los últimos 10 años (2006 a 2016), Los términos de búsqueda fueron: células endoteliales progenitoras, embarazo, preeclampsia, hipertensión, diabetes, vasculogénesis y angiogénesis, Se incluyeron todos los artículos realizados en cultivos celulares, modelos animales experimentales y humanos, escritos en inglés y español.
SUBTIPOS DE CÉLULAS PROGENITORAS ENDOTELIALES
El C034 permite la adhesión célula-célula, El CO-133 es una glicoproteína de superficie de las células madres hematopoyéticas y desaparece durante la diferenciación(4). Los marcadores no específicos de las EPC (CD34, CD133 y VEGFR-2) son compartidos por otras células hematopoyéticas que pueden movilizarse durante la vasculogénesis(5). Existen dos tipos de EPC: 'crecimiento temprano' y de 'crecimiento tardío', que desempeñan un papel en la formación y reparación de los vasos (figura 1)(5,6),
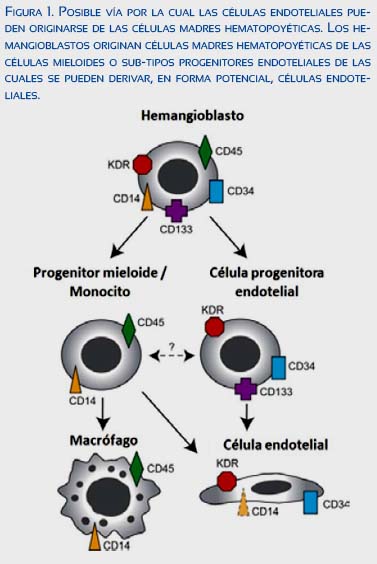
Los subtipos de crecimiento temprano son células endoteliales - unidades formadoras de colonias (CFU-EC) o células angiogénicas circulantes (CACs) (figura 2), El aislamiento de células mononucleares favorece la formación de colonias, conocidas como CFU-EC(7,8), Estas son catalogadas

como CAC debido a que promueven la neovascularización(7). Las CFU-EC y CACs poseen funciones y expresión antigénica similares; tienen capacidad limitada de proliferación y diferenciación, pero segregan mayor cantidad de factores de crecimiento(7-9). El subtipo de crecimiento tardío son células formadoras de colonias endoteliales (ECFCs)(10), Tienen una forma indistinguible de las células endoteliales maduras, poseen capacidad de formar túbulos y contribuyen a la formación de vasos, Se distinguen por ser CD45 y CD14- negativas y coexpresan CD31, CD146 y caderina-VE(8-11). En resumen, las ECFCs forman vasos sanguíneos mientras que las CACs promueven la supervivencia / función de otras células al suministrar factores angiogénicos(9,11-13).
Las EPCs residen inertes dentro del nicho estromal osteoblástico, hasta que pasan a la circulación(14,15), Existe un pequeño porcentaje de células endoteliales de la vena umbilical humana y aorta que contienen ambos tipos celulares que forman colonias secundarias y terciarias(16). Células similares han sido aisladas en bazo, hígado, tejido adiposo y placenta(17,18).
FUNCIONES DE LAS CÉLULAS PROGENITORAS ENDOTELlALES
La función de las EPCs es resultado de la interacción de varias moléculas(15,19,20), Se ha descrito que la isquemia tisular moviliza las EPC(21), El factor 1 inducible por hipoxia (HIF-1) aumenta las concentraciones del factor 1 derivado de quimiocinas estromales (SDF-1)(20,22), La activación de la sintasa de ON se produce en respuesta al VEGF, factor de crecimiento placentario (PIGF) y estrógenos(20,23,24).
El ligando Kit (KitL) mantiene las EPCs unidas al nicho estromal, El SDF-1 y el ON activan la proteólisis desde la membrana celular y la forma soluble del KitL es liberada, Esta liberación mejora la movilidad hacia la circulación periférica (figura 3)(25). El receptor de membrana para el KitL (C-kit) está presente en varios tipos celulares, Una forma soluble del receptor e-kit, se-kit, se une al KitL con alta afinidad(26) y puede movilizar las EPCs al destruir la adhesión al estroma(27,28).
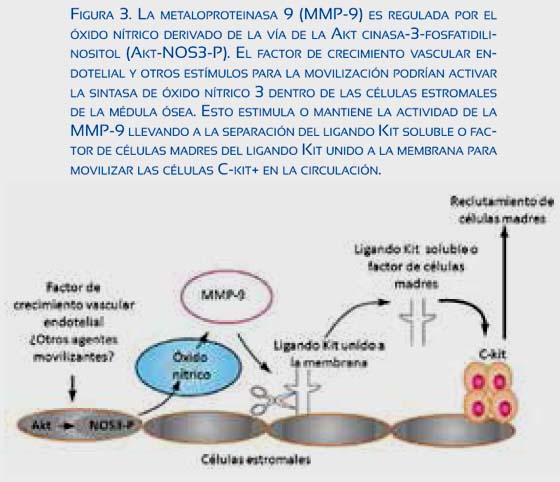
La actividad de la eNOS dentro de las EPCs es clave para su supervivencia y actividad angiogénica(23,24), Diferentes estudios demuestran que las CACs son cardioprotectoras con rápida liberación de VEGF y NO endoteliales a las zonas de lesión isquernia-reperfusión(29).
CÉLULAS PROGENITORAS ENDOTELIALES y EMBARAZO
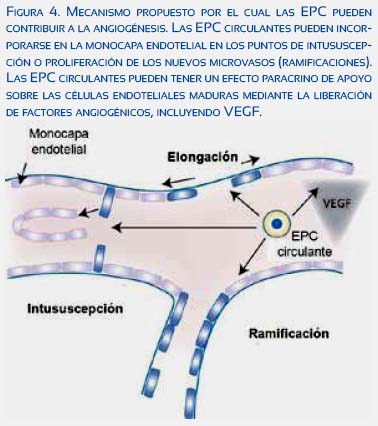
La angiogénesis ocurre por elongación e intuspección de los pequeños vasos(30) (figura 4), La vasculatura uterina sufre remodelaciones durante el embarazo, mediada por la invasión intersticial y endovascular(30-33). El endotelio de las arterias espirales es transformado por células endoteliales y EPCS(34), La angiogénesis contribuye a estos cambios adaptativos(35-38).
Diferentes estudios han demostrado que las CFU-ECs aumentan durante la segunda mitad del embarazo(38). Estudios de EPCs en embarazos sin complicaciones han demostrado que las células C0133+/VEGFR-2+ aumentan durante el segundo trimestre, mientras que las células C034+/VEGFR-2+ aumentan durante el tercer trimestre(40). Buemi y cols(39) reportaron incremento en las EPCs circulantes mientras avanzaba el embarazo, En contraste, se ha descrito que el número de EPC disminuía en forma gradual(41). Se ha reportado que las células circulantes en sangre materna son similares a las endoteliales de crecimiento tardío en embarazadas normales comparado con controles no ernbarazados(42,43).
Las células fetales entran en la circulación materna durante el embarazo temprano y persisten por décadas(44). Las células endoteliales progenitoras fetales CD34+/VEGFR-2+ recolectadas de lesiones inflamatorias son capaces de formar vasos sangulneos(45). Las células CD34+/CD31+/ CD133/c-kit no trofoblásticas son de origen fetal, pero no existe antígeno que distinga si son ECFCs o células endoteliales maduras circulantes(46).
Los hemangioblastos fetales sufren modificaciones, aquellos periféricos se transforman en EPC y los centrales generan precursores hematopoyéticos(47,48). Los angioblastos fetales son idénticos a las ECFCs y expresan el VEGFR y caderina en ausencia de C045, Mientras que los progenitores hematopoyéticos expresan C045 y c-Kit. El punto divergente en el desarrollo es el estadio VEGFR+/VE-caderina-/C04-(49,50). Se desconocen las señales que permiten la inducción de angioblastos o hernangioblastos(51). El factor de crecimiento de fibroblastos es un modulador de diferenciación hemato-endotelial yvasculogénesis temprana, El VEGF - neurofilina-1 inhiben la apoptosis(52,53), El HIF-1 induce crecimiento devasos sanguíneos en sitios de hipoxia(54,55), El factor de necrosis tumoral alfa (TNF-alfa) actúa como quimio-atrayente(56).
CÉLULAS PROGENITORAS ENDOTELlALES y PREECLAMPSIA
La preeclampsia es un síndrome específico del embarazo caracterizado por hipertensión y proteinuria luego de las 20 semanas(57). Las CFUECs en las preeclámpticas son cuatro veces más bajas(43), Se han reportado bajas cantidades de células circulantes CD34+/VEGFR-2+ y CD133+/VEGFR-2+ en sangre materna de las preeclámpticas(58). Las células CD133+/VEGFR-2+ son más comunes en hipertensas gestacionales sin proteinuria(39). Sin embargo, no se ha encontrado diferencias en las células triple positivas (CD133+/CD34+/VEGFR-2+) en las preeclámpticas(32). Las EPCs son afectadas por cambios en la movilización, almacenamiento, incorporación a estructuras vasculares y diferenciación(59,60). Es importante determinar si los cambios preceden a la aparición de la preeclampsia.
La disfunción de las EPC fetales puede ser secundaria a la alteraciones intrauterinas(61). Existe evidencia que las CACs de cordón umbilical están disminuidas en la preeclarnpsia. Se ha demostrado que las células CD133+/CD34+/VEGFR-2+ en el cordón umbilical también están disminuidas y que las CACs son senescentes(62). Las muestras de sangre de cordón umbilical presentan escasas CAC y menor concentración de VEGF libre(63,64). Estas anomalías podrían alterar el desarrollo vascular feto-placentario y afectar en forma negativa el endotelio(65), Se desconoce si estas alteraciones se extienden a las ECFCs,
La respuesta del endotelio basada en el ON está alterada en las preeclárnpticas, Aun no está claro qué sucede, ya que existe evidencia contradictoria(66,67). La producción puede estar normal, pero no alcanza los blancos biológicos(68). La nitrotirosina está elevada en las vellosidades placentarias(69). También las concentraciones plasmáticas de S-nitroalbúmina están aumentadas, lo cual demuestra la incapacidad de utilizar esta forma de almacenamiento de ON(70). La deficiencia de ON puede producir cambios en la EPCs y en la reparación endotelial.
CONCLUSIÓN
Las EPC desempeñan un papel en el mantenimiento del endotelio, La identidad exacta y su función siguen siendo desconocidas, Se ha propuesto que podrían actuar en la adaptación vascular normal del embarazo y sus deficiencias pueden conducir a complicaciones como la preeclampsia. Existen pruebas de la posible asociación con el estrés oxidativo y el desequilibrio de factores angiogénicos que limitan su movilización,
REFERENCIAS BIBLIOGRÁFICAS
1. Asahara T, Murohara T, Sullivan A, Silver M, van der Zee R, Li T, et al. Isolation of putative progenitor endothelial cells for angiogenesls. Science, 1997;275(5302):964-7. [ Links ]
2. Asahara T, Isner JM. Endothelial progenitor cells for vascular regeneration. JJ Hematother Stem Cell Res. 2002;11(2):171-8. [ Links ]
3. Schmeisser A, Garlichs CD, Zhang H, Eskafi S, Graffy C, Ludwig J, et al. Monocytes coexpress endothelial and macrophagocytic lineage markers and form cord-like structures in Matrigel under angiogenic conditions. Cardiovasc Res. 2001;49(3):671-80. [ Links ]
4. Lardon J, Corbeil D, Huttner WB, Ling Z, Bouwens L. Stem cell marker prominin-1/AC133 is expressed in duct cells of the adult human pancreas. Pancreas. 2008;36(1):e1-6. doi: 10.1097/mpa.Ob013e318149f2dc. [ Links ]
5. Bajek A, Olkowska J, Gurtowska N, Kloskowski T, Walentowicz-Sadlecka M, Sadlecki P, et al. Human amniotic-fluid-derived stem cells: a unique source for regenerative medicine. Expert Opin Biol Ther. 2014;14(6):831-9. doi: 1 0.1517/14712598.2014.898749. [ Links ]
6. Pearson JD. Endothelial progenitor cells--an evolving story. Microvasc Res. 2010;79(3):162-8. doi: 10.1 016/j.mvr.2009.12.004. [ Links ]
7. Asahara T, Kawamoto A, Masuda H. Concise review: Circulating endothelial progenitor cells for vascular medicine. Stem Cells. 2011;29(11):1650-5. doi: 10.1002/stem.745. [ Links ]
8. Sirker AA, Astroulakis ZM, Hill JM. Vascular progenitor cells and translational research: the role of endothelial and smooth muscle progenitor cells in endogenous arterial remodelling in the adult. Clin Sci (Lond). 2009;116(4):283-99. doi: 10.1042/CS20080001. [ Links ]
9. Sieveking DP, Buckle A, Celermajer DS, Ng MK. Strikingly different angiogenic properties of endothelial progenitor cell subpopulations: insights from a novel human angiogenesis assay. J Am ColI Cardiol. 2008;51 (6):660-8. doi: 10.1 016/j.jacc.2007.09.059. [ Links ]
10. Ingram DA ML, Tanaka H, Meade V, Fenoglio A, Mortell K, et al. Identification of a novel hierarchy of endothelial progenitor cells using human peripheral and umbilical cord blood. Blood. 2004 Nov 1;104(9):2752-60. [ Links ]
11. Kwon SM, Suzuki T, Kawamoto A, Ii M, Eguchi M, Akimaru H, et al. Pivotal role of Ink adaptor protein in endothelial progenitor cell biology for vascular regeneration. Circ Res. 2009;104(8):969-77. doi: 10.1161/CIRCRESAHA.108.192856. [ Links ]
12. Diller GP, van Eijl S, Okonko DO, Howard LS, Ali O, Thum T, et al. Circulating endothelial progenitor cells in patients with Eisenmenger syndrome and idiopathic pulmonary arterial hypertension. Circulation. 2008;117(23):3020-30. doi: 10.1161/CIRCULATIONAHA.1 08.769646. [ Links ]
13. Egan CG, Caporali F, Garcia-Gonzalez E, Galeazzi M, Sorrentino V. Endothelial progenitor cells and colony-forming units in rheumatoid arthritis: association with clinical characteristics. Rheumatology (Oxford). 2008;47(10):1484-8. doi: 10.1093/rheumatology/ken299. [ Links ]
14. Povsic TJ, Zavodni KL, Vainorius E, Kherani JF, Goldschmidt-Clermont PJ, Peterson ED. Common endothelial progenitor cell assays identify discrete endothelial progenitor cell populations. Am Heart J. 2009;157(2):33544. doi: 10.1 016/j.ahj.2008.10.010. [ Links ]
15. Tilling L, Chowienczyk P, Clapp B. Progenitors in motion: mechanisms of mobilization of endothelial progenitor cells. Br J Clin Pharmacol. 2009;68(4):484-92. doi: 10.1111/j.1365-2125.2009.03486.x. [ Links ]
16. Ingram DA, Mead LE, Moore DB, Woodard W, Fenoglio A, Yoder Me. Vessel wall-derived endothelial cells rapidly proliferate beca use they contain a complete hierarchy of endothelial progenitor ce lis. Blood. 2005;105(7):2783-6. [ Links ]
17. Pitchford Se. Rankin SM. Combinatorial stem cell mobilization in animal models. Methods Mol Biol. 2012;904:139-54. doi: 10.1007/978-1-61779-943-3_12. [ Links ]
18. Bárcena A, Muench MO, Kapidzic M, Fisher SJ. A new role for the human placenta as a hematopoietic site throughout gestation. Reprod Sci. 2009;16(2):178-87. doi: 10.1177/1933719108327621. [ Links ]
19. Aicher A, Heeschen C. Dimmeler S. The role of NOS3 in stem cell mobilization. Trends Mol Med. 2004;10(9):421-5. [ Links ]
20. Heeschen C. Aicher A, Lehmann R, Fichtlscherer S, Vasa M, Urbich C. et al. Erythropoietin is a potent physiologic stimulus for endothelial progenitor cell mobilization. Blood. 2003;102(4):1340-6. [ Links ]
21. Ruifrok WP, de Boer RA, Iwakura A, Silver M, Kusano K, Tio RA, et al. Estradiol-induced, endothelial progenitor cell-mediated neovascularization in male mice with hind-limb ischemia. Vasc Med. 2009;14(1):29-36. doi: 10.1177/1358863X08096666. [ Links ]
22. Thorell D, Borjesson M, Larsson P, Ulfhammer E, Karlsson L, DuttaRoy S. Strenuous exercise increases late outgrowth endothelial cells in healthy subjects. Eur J Appl Physiol. 2009;107(4):481-8. doi: 10.1007/s00421009-1144-0. [ Links ]
23. Tepper OM, Sealove BA, Murayama T, Asahara T. Newly emerging concepts in blood vessel growth: recent discovery of endothelial progenitor cells and their function in tissue regeneration. J Investig Med. 2003;51 (6):353-9. doi: 10.1136/jim-51-06-31. [ Links ]
24. Dimmeler S, Aicher A, Vasa M, Mildner-Rihm C. Adler K, Tiemann M, et al. HMG-CoA reductase inhibitors (statins) increase endothelial progenitor cells via the PI 3-kinase/Akt pathway. J Clin Invest. 2001;108(3):391-7. [ Links ]
25. Rafii S, Avecilla S, Shmelkov S, Shido K, Tejada R, Moore MA, et al. Angiogenic factors reconstitute hematopoiesis by recruiting stem cells from bone marrow microenvironment. Ann N Y Acad Sci. 2003;996:49-60. [ Links ]
26. Pedersen M, Rónnstrand L, Sun J. The c-Kit/D816V mutation eliminates the differences in signal transduction and biological responses between two isoforms of c-Kit. Cell Signal. 2009 Mar;21 (3):413-8. doi: 10.1 016/j.cellsig.2008.11.008. [ Links ]
27. Nakamura Y, Tajima F, Ishiga K, Yamazaki H, Oshimura M, Shiota G, et al. Soluble c-kit receptor mobilizes hematopoietic stem ce lis to peripheral blood in mice. Exp Hematol. 2004;32(4):390-6. [ Links ]
28. Westerweel PE, Visseren FL, Hajer GR, Olijhoek JK, Hoefer lE, de Bree P, et al. Endothelial progenitor cell levels in obese men with the metabolic syndrome and the effect of simvastatin monotherapy vs. simvastatin/ezetimibe combination therapy. Eur Heart J. 2008;29(22):2808-17. doi: 10.1093/eurheartj/ehn431. [ Links ]
29. Ii M, Nishimura H, Iwakura A, Wecker A, Eaton E, Asahara T, et al. Endothelial progenitor cells are rapidly recruited to myocardium and mediate protective effect of ischemic preconditioning via "imported" nitric oxide synthase activity. Circulation. 2005;111(9):1114-20. [ Links ]
30. Reynolds LP, Borowicz PP, Vonnahme KA, Johnson ML, Grazul-Bilska AT, Wallace JM, et al. Animal models of placental angiogenesis. Placenta. 2005;26(10):689708. [ Links ]
31. Asahara T, Masuda H, Takahashi T, Kalka C, Pastore C, Silver M, et al. Bone marrow origin of endothelial progenitor cells responsible for postnatal vasculogenesis in physiological and pathological neovascularization. Circ Res. 1999;85(3):221-8. [ Links ]
32. Matsubara K, Abe E, Matsubara Y, Kameda K, Ito M. Circulating endothelial progenitor cells during normal pregnancy and pre-eclampsia. Am J Reprod Immunol. 2006;56(2):79-85. [ Links ]
33. Espinoza J, Romero R, Mee Kim Y, Kusanovic JP, Hassan S, Erez O, et al. Normal and abnormal transformation of the spiral arteries during pregnancy. J Perinat Med. 2006;34(6):447-58. [ Links ]
34. Pijnenborg R, Vercruysse L, Hanssens M. The uterine spiral arteries in human pregnancy: facts and controversies. Placenta. 2006;27(9-10):939-58. [ Links ]
35. Clapp JF 3rd, Capeless E. Cardiovascular function before, during, and after the first and subsequent pregnancies. Am J Cardiol. 1997;80:1469-73. [ Links ]
36. Orshal JM, Khalil RA. Interleukin-6 impairs endothelium-dependent NO-cGMP-mediated relaxation and enhances contraction in systemic vessels of pregnant rats. Am J Physiol Regul Integr Comp Physiol. 2004;286(6):R1013-23. [ Links ]
37. Palik E, Baranyi E, Melczer t. Audikovszky M, Szócs A, Winkler G, et al. Elevated serum acylated (biologically active) ghrelin and resistin levels associate with pregnancy-induced weight gain and insulin resistance. Diabetes Res Clin Pract. 2007;76(3):351-7. [ Links ]
38. Sattar N, Greer IA. Pregnancy complications and maternal cardiovascular risk: opportunities for intervention and screening? BMJ. 2002;325(7356):157-60. [ Links ]
39. Buemi M, Allegra A, D'Anna R, Coppolino G, Crasci E, Giordano D, et al. Concentration of circulating endothelial progenitor cells (EPC) in normal pregnancy and in pregnant women with diabetes and hypertension. Am J Obstet Gynecol. 2007;196(1):68.e1-6. [ Links ]
40. Sugawara J, Mitsui-Saito M, Hayashi C. Hoshiai T, Senoo M, Chisaka H, et al. Decrease and senescence of endothelial progenitor cells in patients with preeclampsia. J Clin Endocrinol Metab. 2005;90(9):5329-32. [ Links ]
41. Sawidou MD, Xiao Q, Kaihura e. Anderson JM, Nicolaides KH. Maternal circulating endothelial progenitor cells in normal singleton and twin pregnancy. Am J Obstet Gynecol. 2008;198(4):414.e1-5. doi: 10.1016/j.ajog.2007.10.800. [ Links ]
42. Gussin HA, Bischoff FZ, Hoffman R, Elias S. Endothelial precursor cells in the peripheral blood of pregnant women. J Soc Gynecol Investig. 2002;9(6):357-61. [ Links ]
43. Lin C. Rajakumar A, Plymire DA, Verma V, Markovic N, Hubel CA. Maternal endothelial progenitor colony-forming units with macrophage characteristics are reduced in preeclampsia. Am J Hypertens. 2009;22(9):10149. doi: 10.1038/ajh.2009.101. [ Links ]
44. Boyon C. Vinatier D. Fetal microchimerism: self and non-self, finally who are we? J Gynecol Obstet Biol Reprod (Paris). 2011 ;40(5):387-98. doi: 10.1016/j.jgyn.2011.01.013. [ Links ]
45. Nassar D, Droitcourt e. Mathieu-d'Argent E, Kim MJ, Khosrotehrani K, Aractingi S. Fetal progenitor cells naturally transferred through pregnancy participate in inflammation and angiogenesis during wound healing. FASEB J. 2012;26(1):149-57. doi: 10.1096/fj.11-180695. [ Links ]
46. Parant O, Dubernard G, Challier JC. Oster M, Uzan S, Aractingi S, et al. CD34+ cells in maternal placental blood are mainly fetal in origin and express endothelial markers. Lab Invest. 2009;89(8):915-23. doi: 10.1038/labinvest.2009.55. [ Links ]
47. Lacaud G, Robertson S, Palis J, Kennedy M, Keller G. Regulation of hemangioblast development. Ann N Y Acad Sci. 2001;938:96-107. [ Links ]
48. Lancrin C, Sroczynska P, Stephenson C. Allen T, Kouskoff V, Lacaud G. The haemangioblast generates haematopoietic cells through a haemogenic endothelium stage. Nature. 2009;457(7231):892-5. doi: 10.1038/nature07679. [ Links ]
49. Fraser ST, Ogawa M, Yu RT, Nishikawa S, Yoder MC, Nishikawa S. Definitive hematopoietic commitment within the embryonic vascular endothelial-cadherin(+) population. Exp Hematol. 2002;30(9):1070-8. [ Links ]
50. Drake CJ, Fleming PA. Vasculogenesis in the day 6.5 to 9.5 mouse embryo. Blood. 2000;95(5):1671-9. [ Links ]
51. Vokes SA, Yatskievych TA, Heimark RL, McMahon J, McMahon AP, Antin PB, et al. Hedgehog signaling is essential for endothelial tube formation during vasculogenesis. Development. 2004;131(17):4371-80. [ Links ]
52. Liang D, Chang JR, Chin AJ, Smith A, Kelly C, Weinberg ES, et al. The role of vascular endothelial growth factor (VEGF) in vasculogenesis, angiogenesis, and hematopoiesis in zebrafish development. Mech Dev. 2001;108(1-2):29-43. [ Links ]
53. Takashima S, Kitakaze M, Asakura M, Asanuma H, Sanada S, Tashiro F, et al. Targeting of both mouse neuropilin-1 and neuropilin-2 genes severely impairs developmental yolk sac and embryonic angiogenesis. Proc Natl Acad Sci U S A. 2002;99(6):3657-62. 2002. [ Links ]
54. Yamakawa M, Liu LX, Date T, Belanger AJ, Vincent KA, Akita GY, et al. Hypoxia-inducible factor-1 mediates activation of cultured vascular endothelial cells by inducing multiple angiogenic factors. Circ Res. 2003;93(7):664-73. [ Links ]
55. van der Zwaag B, Burbach JP, Brunner HG, van Bokhoven H, Padberg GW. Nucleotide variation analysis does not support a causal role for plexin-A1 in hereditary congenital facial paresis. Brain Res Dev Brain Res. 2005;158(1-2):66-71. [ Links ]
56. Peppel K, Zhang L, Orman ES, Hagen PO, Amalfitano A, Brian L, et al. Activation of vascular smooth muscle cells by TNF and PDGF: overlapping and complementary signal transduction mechanisms. Cardiovasc Res. 2005;65(3):674-82. [ Links ]
57. Sankaralingam S, Arenas IA, Lalu MM, Davidge ST. Preeclampsia: current understanding of the molecular basis of vascular dysfunction. Expert Rev Mol Med. 2006;8(3):1-20. [ Links ]
58. Luppi P, Powers RW, Verma V, Edmunds L, Plymire D, Hubel CA. Maternal circulating CD34+VEGFR-2+ and CD133+VEGFR-2+ progenitor cells increase during normal pregnancy but are reduced in women with preeclampsia. Reprod Sci. 2010;17(7):643-52. doi: 10.1177/1933719110366164. [ Links ]
59. Reyna E, Mejia J, Reyna N, Torres D, Santos J, Perozo J. Células endoteliales maduras y progenitoras en preeclámpticas. Clin Invest Gin Obstet. 2010;37(3):186-91. [ Links ]
60. Javed MJ, Mead LE, Prater D, Bessler WK, Foster D, Case J. et al. Endothelial colony forming cells and mesenchymal stem cells are enriched at different gestational ages in human umbilical cord blood. Pediatr Res. 2008;64(1):68-73. doi: 10.1203/PDR.0b013e31817445e9. [ Links ]
61. Sipos PI, Crocker IP, Hubel CA, Baker PN. Endothelial progenitor cells: their potential in the placental vasculature and related complications. Placenta. 2010;31(1):1-10. doi: 10.1016/j.placenta.2009.10.006. [ Links ]
62. Hwang HS, Maeng YS, Park YW, Koos BJ, Kwon YG, Kim YH. Increased senescence and reduced functional ability of fetal endothelial progenitor cells in pregnancies complicated by preeclampsia without intrauterine growth restriction. Am J Obstet Gynecol. 2008;199(3):259.e1-7. doi: 10.1016/j.ajog.2008.06.060. [ Links ]
63. Kwon JY, Maeng YS, Kwon YG, Kim YH, Kang MH, Park YW. Decreased endothelial progenitor cells in umbilical cord blood in severe preeclampsia. Gynecol Obstet Invest. 2007;64(2):103-8. [ Links ]
64. Wang Y, Gu Y, Granger DN, Roberts JM, Alexander JS. Endothelial junctional protein redistribution and increased monolayer permeability in human umbilical vein endothelial cells isolated during preeclampsia. Am J Obstet Gynecol. 2002;186(2):214-20. [ Links ]
65. Demir R, Yaba A, Huppertz B. Vasculogenesis and angiogenesis in the endometrium during menstrual cycle and implantation. Acta Histochem. 2010;112(3):20314. doi: 10.1016/j.acthis.2009.04.004. [ Links ]
66. Tiboni GM, Ponzano A. Nitric oxide and teratogenesis: an update. Curr Pharm Des. 2014;20(34):5443-7. [ Links ]
67. Reyna-Villasmil E, Prieto-Franchi M, Torres-Montilla M, Reyna-Villasmil N, Mejia-Montilla J. Metabolitos del óxido nítrico plasmático y niveles de peróxidos lipídicos en pacientes preeclámpticas antes y después del parto. Rev Obstet Ginecol Venez. 2002;62(2):89-92. [ Links ]
68. Steed MM, Tyagi N, Sen U, Schuschke DA, Joshua IG, Tyagi SC. Functional consequences of the collagen/elastin switch in vascular remodeling in hyperhomocysteinemic wild-type, eNOS-/-, and iNOS-/- mice. Am J Physiol Lung Cell Mol Physiol. 2010;299(3):L301-11. doi: 10.1152/ajplung.00065.2010. [ Links ]
69. Jones ML, Mark PJ, Lewis JL, Mori TA, Keelan JA, Waddell BJ. Antioxidant defenses in the rat placenta in late gestation: increased labyrinthine expression of superoxide dismutases, glutathione peroxidase 3, and uncoupling protein 2. Biol Reprod. 2010;83(2):254-60. doi: 10.1095/biolreprod.110.083907. [ Links ]
70. Gandley RE, Tyurin VA, Huang W, Arroyo A, Daftary A, Harger G, et al. S-nitrosoalbumin-mediated relaxation is enhanced by ascorbate and copper: effects in pregnancy and preeclampsia plasma. Hypertension. 2005;45(1):21-7. [ Links ]
DECLARACIÓN DE ASPECTOS ÉTICOS
Reconocimiento de autoría: Todos los autores declaran que han realizado aportes a la idea, diseño del estudio, recolección de datos, análisis e interpretación de datos, revisión crítica del contenido intelectual y aprobación final del manuscrito que estamos enviando.
Financiamiento: Los autores certifican que no han recibido apoyos financieros, equipos, en personal de trabajo o en especie de personas, instituciones públicas y/o privadas para la realización del estudio,
Conflicto de intereses: Los autores declaran no tener ningún conflicto de intereses.
Correspondencia:
Dr. Eduardo Reyna-Villasmil.
Hospital Central "Dr. Urquinaona"
Final Av. El Milagro, Maracaibo, Estado Zulia, Venezuela
58162605233
sippenbauch@gmail.com
Recibido: 28 marzo 2107
Aceptado: 18 abril 2017













