Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.63 no.2 Lima abr./jun. 2017
SIMPOSIO PREECLAMPSIA: ACTUALIZACIÓN
Marcadores clínicos, biofísicos y bioquímicos para la predicción de preeclampsia
Clinical, biophysical and biochemical markers for preeclampsia prediction
Eduardo Reyna-Villasmil1,a; Gabriel Mayner-Tresol2,b; Pedro Herrera-Moya3,b; Carlos Briceño Pérez4,a
1 Hospital Central "Dr. Urquinaona". Maracaibo. Venezuela.
2 Universidad Católica de Santiago de Guayaquil. Guayaquil. Ecuador.
3 Universidad Nacional Estatal de Milagro. Milagro. Ecuador.
4 La Universidad del Zulia. Maracaibo. Venezuela.
a Médico especialista, Doctor en Ciencias Médicas
b Médico especialista y Docente
RESUMEN
La preeclampsia es una causa importante de morbilidad y mortalidad materna alrededor del mundo. La incidencia de preeclampsia ha aumentado en la última década, lo cual ha sido atribuido a varios factores. A pesar de las décadas de investigación de esta condición, la capacidad de los clínicos para predecir antes de la aparición de los síntomas no ha mejorado en forma significativa. Ninguna prueba de predicción en solitario ha logrado la aceptación generalizada en la práctica clínica. Las combinaciones de marcadores bioquímicos y ecográficos mejoran la predicción temprana de la preeclampsia. La pesquisa con una combinación de factores de riesgo maternos, Doppler de las arterias uterinas, presión arterial media, concentraciones plasmáticas de proteína A relacionada al embarazo y factor de crecimiento placentario, puede identificar cerca de195% de los casos de preeclampsia de aparición temprana. En forma interesante, la creciente investigación ha revelado los nombres de algunas bio-moléculas importantes que pueden tener un papel importante en la vasculogénesis de la placentación temprana. Existen preguntas si un único grupo de parámetros puede diagnosticar un síndrome que es complejo. En esta revisión, se examina la fisiopatología subyacente de la preeclampsia y se analiza los potenciales marcadores clínicos, biofísicos y bioquímicos para la predicción temprana.
Palabras clave. Preeclampsia; Marcadores; Riesgo, Predicción.
ABSTRACT
Preeclampsia is a major cause of maternal morbidity and mortality worldwide. The incidence of preeclampsia has increased in the past decade, which has been attributed to various predisposing factors. Despite decades of research into the condition, the ability of clinicians to predict it prior to the onset of symptoms has not improved significantly. No single screening test has gained widespread acceptance into clinical practice. Combinations of biochemical and ultrasonographic markers improve the performance of early prediction of preeclampsia. Screening with a combination of maternal risk factors, uterine artery Doppler, mean arterial pressure, maternal serum pregnancy associated plasma protein-A, and placental growth factor can identify about 95% of cases of early onset preeclampsia. Interestingly, intense research has unveiled the names of some important biomolecules which play an influential role in the vasculogenesis of the early placenta. Question remains whether a single set of parameters can diagnose such a complex syndrome. In this review, we will examine the pathophysiology underlying preeclampsia and examine potential clinical, biological and biophysical markers for early prediction.
Keywords: Preeclampsia; Markers; Risk; Prediction.
INTRODUCCIÓN
La preeclampsia (PE) complica 7% a 10% de los embarazos. Los hallazgos clínicos son hipertensión y proteinuria, que aparecen a las 20 semanas de embarazo en pacientes sin antecedentes de hipertensión. El 10 a 15% de los casos ocurren antes de las 34 semanas(1,2).
La predicción de la PE es difícil. Los clínicos han confiado en factores clínicos para determinar los casos con riesgo. El problema de estos marcadores es que muchas mujeres tienen estos factores de riesgo y no desarrollan PE. En esta revisión se examina el papel de los diferentes marcadores que son usados en la predicción del síndrome.
METODOLOGÍA DE LA BÚSQUEDA DE LA INFORMACIÓN
Entre noviembre de 2016 y febrero 2017 se examinaron bases de datos electrónicas para investigar los artículos elegibles en los últimos 10 años (2006 a 2016). Los términos de búsqueda para todas las bases de datos fueron: preeclampsia, marcadores, predicción inflamación, angiogénesis, placentación, Doppler y embarazo. Se incluyeron todos los artículos en inglés y en español realizados en cultivos celulares, en modelos animales experimentales y en humanos.
PATOGÉNESIS DE LA PREECLAMPSIA
La invasión trofoblástica tiene dos etapas: 1) invasión de los segmentos deciduales de las arterias espirales; y, 2) invasión de los segmentos miometriales(3). En la PE, la invasión de los segmentos miometriales está alterada y estas conservan la sensibilidad a sustancias vasopresoras. La isquemia placentaria es resultado de la placentación normal(4,5).
La PE temprana (antes de las 34 semanas) se asocia con anormalidades en el Doppler de la arteria uterina (AU), lesiones isquémicas placentarias y complicaciones materno-fetales. La PE tardía (después de las 34 semanas) se asocia a la resistencia normal o aumentada de la AU con baja afectación fetal y pronóstico materno-fetal más favorable(6.7)
MARCADORES CLÍNICOS
Se han propuestos guías de evaluación de riesgo de PE basado en los antecedentes personales (tabla 1). La mayoría de los estudios ha propuesto que estos factores no modifican el riesgo total(8). Sin embargo, las características maternas son útiles en la predicción de la PE(9-11).
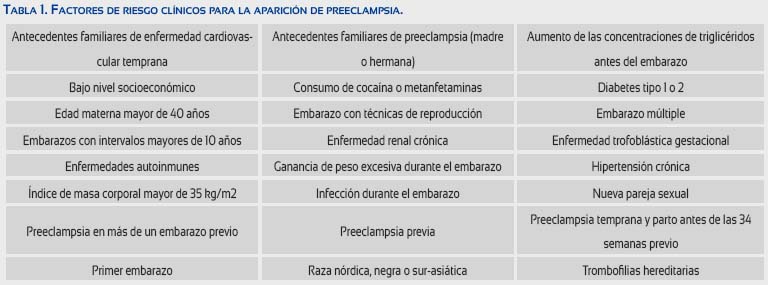
En la PE, la hipertensión es secundara a la alteración de la capacidad vascular(12). El error del observador en la medición es la mayor limitación del método auscultatorio y el uso del método digital es la causa más común de determinaciones subóptimas(13). Existe evidencia que demuestra que el incremento en la presión arterial en la PE aparece en el primer y segundo trimestre(14). Se ha demostrado que la presión arterial media es significativamente mejor que la presión arterial sistólica/diastólica para la predicción(15).
MARCADORES BIOFÍSICOS
El Doppler de las arterias uterinas (AU) es una de las pruebas prometedoras en la predicción de PE. Los hallazgos de la alteración placentaria son compatibles con la hipótesis de la alteración de la placentación(16). Los múltiplos de la media del índice de pulsatilidad (IP) están aumentados a las 11 a 13 semanas en mujeres con PE(11).
MARCADORES BIOQUÍMICOS
El factor de crecimiento vascular endotelial (VEGF) y de crecimiento placentario (PIGF) contribuyen a la placentación normal(17) y esta alteración es fundamental en la PE. Las concentraciones de ARN mensajero del VEGF son menores en las preeclámpticas(18). Las concentraciones de PIGF disminuyen en el segundo trimestre en mujeres con PE(19).
El FIt-1 soluble (receptor 1 soluble de VEGF o sFlt1) neutraliza el VEGF y PIGF(20), Sus concentraciones están elevadas en la PE(21), Las concentraciones también están elevadas en nuliparas(22). Existe evidencia que el ARN mensajero del sFlt-1 está aumentado en las preeclámpticas(23). El sFlt1 recombinante produce hipertensión, proteinuria y endoteliosis glomerular(24). Las mediciones de sFlt-1 plasmática tienen una sensibilidad del 89% y especificidad del 90% en el diagnóstico de PE temprana, La relación sFlt-1/PIGF es un mejor predictor de PE que cuando se miden solas(25).
La endoglina (sEng) está aumentada en las embarazadas con PE(20), En las pacientes que desarrollan PE temprana, las concentraciones están elevadas tan temprano como en la semana 17 a 20(25).
La proteína placentaria 13 (PP-13) tiene bajas concentraciones a las 11 a 13 semanas en mujeres con PE(26), La combinación de PP-13 con el Doppler de la AU en el embarazo temprano mejora la capacidad de predicción de PE severa(27). Por lo tanto, la PP-13, sola o en combinación con Doppler, parece ser un marcador prometedor.
La proteína plasmática A asociada al embarazo (PAPP-A) fue el primer marcador en demostrar alteración en las preeclámpticas(28). Las concentraciones bajas están asociadas con la PE, Aunque la PAPP-A sola no es un buen predictor de la PE, parece que su sensibilidad puede mejorar con la combinación de Doppler de la AU(29,30).
Las concentraciones de globulina fijadora de hormonas sexuales en el primer trimestre estaban disminuidas en embarazadas que desarrollaron PE(31), Otro estudio que evaluó las concentraciones a las 10 a 14 semanas de embarazo y no encontró diferencias significativas(32).
Se ha descrito que las concentraciones maternas de visfastina están disminuidas en forma significativa en las preeclámpticas(33). Sin embargo, otro estudio indicó que las concentraciones séricas de visfastina son más altas en las preeclámpticas(34). De igual forma, se ha demostrado que las concentraciones bajas de adiponectina están asociadas con aumentos del riesgo del desarrollo de la PE, Se ha reportado que las concentraciones en el primer y tercer trimestre de adiponectina es más alta en las preeclámpticas(35-37).
Las preeclámpticas presentan elevación de las concentraciones de lipoproteínas ricas en triglicéridos(38). El gen de la ApoE tiene alelos que codifican 3 isoformas plasmáticas, Se ha propuesto que la ApoE y sus polimorfismos genéticos están asociados con incremento del riesgo de PE(39).
Las concentraciones de inhibina A y activina A han sido usadas como predictor de PE, Las concentraciones aumentan más de 10 veces del valor normal en preeclámpticas severas(40). Se ha encontrado concentraciones elevadas de inhibina en embarazadas que desarrollan PE(41-44), Estas aportan información pronóstica en pacientes con alteraciones del flujo Doppler de la AU(45), Se ha demostrado concentraciones elevadas de activina A en mujeres que desarrollaron PE(46,47).
En la PE existe aumento de la sensibilidad a la angiotensina II(48-50), Se ha descrito aumento en las concentraciones de anticuerpos agonistas contra el receptor tipo 1 de angiotensina II (AT1) en la PE(51,52). La estimulación del receptor AT1 produce elevación de las concentraciones de sFlt-1 in vitro(53,54). Una forma de angiotensinógeno oxidado también ha sido descrita en la PE(55).
Se ha reportado aumento en las concentraciones de cistatina C en la PE y también se han descrito aumento de las concentraciones en el primer trimestre en embarazadas que desarrollan PE(56-58).
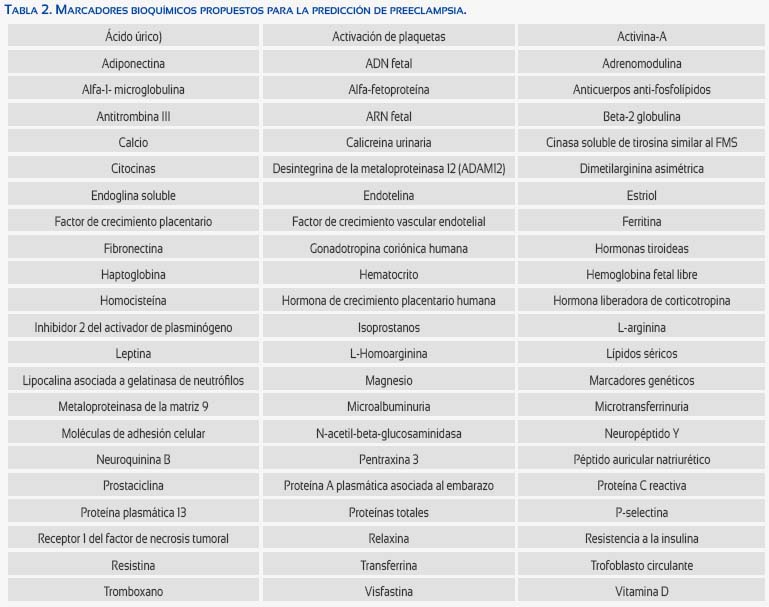
Varios estudios han demostrado que la PE está asociada con lesiones placentarias que facilitan el paso de células fetales y ADN fetal libre(59). Un estudio reveló que la capacidad predictiva de las células fetales no es satisfactoria para la predicción de PE(60). Se ha demostrado diferencias significativas en el ADN fetal libre en pacientes que desarrollan PE(61-62), Estudios de determinación de genes placentarios y fetales han mostrado resultados prometedores(63).
Diferentes investigadores han sugerido que las alteraciones de la neuroquinina B y antígeno de histocompatibilidad C son efectivos en la predicción de PE(64), Se ha encontrado que el miR-210 puede ayudar a identificar las mujeres en riesgo(65). El otro biomarcador es el miR-34a(66).
COMBINACIÓN DE MARCADORES BIOQUÍMICOS y DOPPLER DE LAS ARTERIAS UTERINAS
Existe evidencia que sugiere que la combinación de marcadores bioquímicos y Doppler es útil en la predicción de PE. Al agregar las características maternas, la predicción podría mejorar su capacidad predictiva, Solo 6 estudios incluyen marcadores bioquímicos y ecográficos combinados(9,27,67-69), Las combinaciones utilizadas reflejan la complejidad y heterogeneidad de la PE que limitan los análisis comparativos, Entre las combinaciones durante el segundo trimestre, varias parecen tener características predictivas, En embarazadas con alto riesgo en el primer trimestre, la PP-13 más IP de la AU aumenta la sensibilidad(27,70). No se conocen estudios de esta combinación en poblaciones de bajo riesgo,
Se ha descrito que la combinación de PAPP-A, inhibina A y activina A en el primer y segundo trimestre junto al Doppler de la AU pueden aportar información predictiva. Estos datos indican que estos marcadores bioquímicos predicen más del 42% de casos de PE temprana y sube a 89% al combinarlo con características maternas e IP de la AU en poblaciones de bajo riesgo(10). Se ha reportado que la disminución de PAPP-Ay PIGF durante el primer trimestre tiene un valor predictivo positivo de 94% en PE temprana(69).
CONCLUSIÓN
El posible uso de pruebas predictivas debe continuar investigándose, Estos marcadores son útiles en la prevención del síndrome en grupos
de alto riesgo. Las alteraciones de la placentación pueden explicar el aumento temprano de algunos marcadores. Existe creciente evidencia que los modelos multi-parámetros mejoran la tasa de predicción de PE y otras complicaciones obstétricas. Los factores angiogénicos y antiangiogénicos pueden suministrar información sobre el síndrome.
REFERENCIAS BIBLIOGRÁFICAS
1. Nissaisorakarn P, Sharif S, Jim B. Hypertension in pregnancy: defining blood pressure goals and the value of biomarkers for preeclampsia. Curr Cardiol Rep. 2016 Dec;18(12):131. [ Links ]
2. Oyola S, Kirley K. Another good reason to recommend low-dose aspirin. J Fam Pract. 2015;64(5):301-3. [ Links ]
3. Barnea ER, Vialard F, Moindjie H, Ornaghi S, Dieudonne MN, Paidas MJ. Prelmplantation Factor (PIF*) endogenously prevents preeclampsia: Promotes trophoblast invasion and reduces oxidative stress. J Reprod Immunol. 2016;114:58-64. doi: 10.1016/j.jri.2015.06.002. [ Links ]
4. Reyna-Villasmil E, Briceño-Pérez C, Santos-Bolívar J. Alteración de la placentación profunda en la preeclampsia. Rev Obstet Ginecol Venez. 2012;72(4):269-76. [ Links ]
5. Lee ES, Oh MJ, Jung JW, Lim JE, Seol HJ, Lee KJ, et al. The levels of circulating vascular endothelial growth factor and soluble Flt-1 in pregnancies complicated by preeclampsia. J Korean Med Sci. 2007;22(1):94-8. [ Links ]
6. Mol BW, Roberts CT, Thangaratinam S, Magee LA, de Groot CJ, Hofmeyr GJ. Pre-eclampsia. Lancet. 2016;387(10022):999-1011. doi: 10.1016/501406736(15)00070-7. [ Links ]
7. Moldenhauer JS, Stanek J, Warshak C, Khoury J, Sibai B. The frequency and severity of placental findings in women with preeclampsia are gestational age dependent. Am J Obstet Gynecol. 2003;189(4):1173-7. [ Links ]
8. Roberts JM MD, Ness RB, Poston L; Global Pregnancy Collaboration. Collaboration to understand complex diseases: preeclampsia and adverse pregnancy outcomes. Hypertension. 2016 Apr;67(4):681-7. doi: 10.1161/HYPERTENSIONAHA.115.06133. [ Links ]
9. Poon LC, Kametas NA, Chelemen T, Leal A, Nicolaides KH. Maternal risk factors for hypertensive disorders in pregnancy: a multivariate approach. J Hum Hypertens. 2010;24(2):104-10. doi: 10.1038/jhh.2009.45. [ Links ]
10. Akolekar R, Syngelaki A, Poon L, Wright D, Nicolaides KH. Competing risks model in early screening for preeclampsia by biophysical and biochemical markers. Fetal Diagn Ther. 2013;33(1):8-15. doi: 10.1159/000341264. [ Links ]
11. Wright D, Akolekar R, Syngelaki A, Poon Le, Nicolaides KH. A competing risks model in early screening for preeclampsia. Fetal Diagn Ther. 2012;32(3):171-8. doi: 10.1159/000338470. [ Links ]
12. LaMarca B, Amaral LM, Harmon AC, Cornelius DC, Faulkner JL, Cunningham MW Jr. Placental ischemia and resultant phenotype in animal models of preeclampsia. Curr Hypertens Rep. 2016;18(5):38. doi: 10.1007/s11906-016-0633-x. [ Links ]
13. Gravlee GP, Brockschmidt JK. Accuracy of four indirect methods of blood pressure measurement, with hemodynamic correlations. J Clin Monit. 1990;6(4):28498. [ Links ]
14. Piazze J, Gioia S, Cerekja A, Larciprete G, Argento T, Pizzulo S, et al. Doppler velocimetry alterations related to platelet changes in third trimester pregnancies. Platelets.2007;18(1):11-5. [ Links ]
15. Cnossen JS, Vollebregt KC, de Vrieze N, ter Riet G, Mol BW, Franx A, et al. Accuracy of mean arterial pressure and blood pressure measurements in predicting pre-eclampsia: systematic review and meta-analysis. BMJ. 2008;336(7653):1117-20. doi: 10.1136/bmj.39540.522049.BE. [ Links ]
16. Plasencia W MN, Poon L, Yu C, Nicolaides KH. Uterine artery Doppler at 11 + 0 to 13 + 6 weeks and 21 + 0 to 24 + 6 weeks in the prediction of pre-eclampsia. Ultrasound Obstet Gynecol. 2008 Aug;32(2):138-46. doi: 10.1002/uog.5402. [ Links ]
17. Reyna-Villasmil E, Briceño-Perez e, Torres-Cepeda D. Vasculogénesis y angiogénesis durante el embarazo normal y en la preeclampsia. Rev Obstet Ginecol Venez. 2010;70(4):265-79. [ Links ]
18. Ranheim T, Staff AC, Henriksen T. VEGF mRNA is unaltered in decidual and placental tissues in preeclampsia at delivery. Acta Obstet Gynecol Scand. 2001 ;80(2):93 8. [ Links ]
19. Lim JH, Kim SY, Park SY, Yang JH, Kim MY, Ryu HM. Effective prediction of preeclampsia by a combined ratio of angiogenesis-related factors. Obstet Gynecol. 2008;111(6):1403-9. doi: 10.1097/AOG.0b013e3181719b7a. [ Links ]
20. Venkatesha S, Toporsian M, Lam C, Hanai J, Mammoto T, Kim YM, et al. Soluble endoglin contributes to the pathogenesis of preeclampsia. Nat Med. 2006;12(6):6429. [ Links ]
21. Salahuddin S, Lee Y, Vadnais M, Sachs BP, Karumanchi SA, Lim KH. Diagnostic utility of soluble fms-like tyrosine kinase 1 and soluble endoglin in hypertensive diseases of pregnancy. Am J Obstet Gynecol. 2007;197(1):28.e1-6. [ Links ]
22. Wolf M, Shah A, Lam e, Martinez A, Smirnakis KV, Epstein FH, et al. Circulating levels of the antiangiogenic marker sFLT-1 are increased in first versus second pregnancies. Am J Obstet Gynecol. 2005;193(1):16-22. [ Links ]
23. Maynard SE, Min JY, Merchan J, Lim KH, Li J, Mondal S, et al. Excess placental soluble fms-like tyrosine kinase 1 (sFlt1) may contribute to endothelial dysfunction, hypertension, and proteinuria in preeclampsia. J Clin Invest. 2003;111(5):649-58. [ Links ]
24. Staff AC, Braekke K, Harsem NK, Lyberg T, Holthe MR. Circulating concentrations of sFlt1 (soluble fms-like tyrosine kinase 1) in fetal and maternal serum during pre-eclampsia. Eur J Obstet Gynecol Reprod Biol. 2005;122(1):33-9. [ Links ]
25. Noori M, Donald AE, Angelakopoulou A, Hingorani AD, Williams DJ. Prospective study of placental angiogenic factors and maternal vascular function before and after preeclampsia and gestational hypertension. Circulation. 2010;122(5):478-87. doi: 10.1161 /CIRCULATIONAHA.109.895458. [ Links ]
26. Chafetz I, Kuhnreich I, Sammar M, Tal Y, Gibor Y, Meiri H, et al. First-trimester placental protein 13 screening for preeclampsia and intrauterine growth restriction. Am J Obstet Gynecol. 2007;197(1):35.e1-7. [ Links ]
27. Nicolaides KH, Bindra R, Turan OM, Chefetz I, Sammar M, Meiri H, et al. A novel approach to first-trimester screening for early pre-eclampsia combining serum PP-13 and Doppler ultrasound. Ultrasound Obstet Gynecol. 2006;27(1):13-7. [ Links ]
28. Hughes G, Bischof P, Wilson G, Klopper A. Assay of a placental protein to determine fetal risk. Br Med J. 1980;280(6215):671-3. [ Links ]
29. Dugoff L, Hobbins JC, Malone FD, Porter TF, Luthy D, Comstock CH, et al. First-trimester maternal serum PAPP-A and free-beta subunit human chorionic gonadotropin concentrations and nuchal translucency are associated with obstetric complications: a population-based screening study (the FASTER Trial). Am J Obstet Gynecol. 2004;191(4):1446-51. [ Links ]
30. Canini S, Prefumo F, Pastorino D, Crocetti L, Afflitto CG, Venturini PL, et al. Association between birth weight and first-trimester free beta-human chorionic gonadotropin and pregnancy-associated plasma protein A. Fertil Steril. 2008;89(1):174-8. [ Links ]
31. Thadhani R, Ecker JL, Mutter WP, Wolf M, Smirnakis KV, Sukhatme VP, et al. Insulin resistance and alterations in angiogenesis: additive insults that may lead to preeclampsia. Hypertension. 2004;43(5):988-92. [ Links ]
32. Spencer K, Cowans NJ, Nicolaides KH. Low levels of maternal serum PAPP-A in the first trimester and the risk of pre-eclampsia. Prenat Diagn. 2008;28(1):7-10. [ Links ]
33. Hu W, Wang Z, Wang H, Huang H, Dong M. Serum visfatin levels in late pregnancy and pre-eclampsia. Acta Obstet Gynecol Scand. 2008;87(4):413-8. doi: 10.1080/00016340801976012. [ Links ]
34. Zulfikaroglu E, Isman F, Payasli A, Kilic S, Kucur M, Danisman N. Plasma visfatin levels in preeclamptic and normal pregnancies. Arch Gynecol Obstet. 2010;281 (6):995-8. doi: 10.1007/s00404-009-1192-z. [ Links ]
35. D'Anna R, Baviera G, Corrado F, Giordano D, De Vivo A, Nicocia G, et al. Adiponectin and insulin resistance in early- and late-onset pre-eclampsia. BJOG. 2006;113(11):1264-9. [ Links ]
36. Naruse K, Yamasaki M, Umekage H, Sado T, Sakamoto Y, Morikawa H. Peripheral blood concentrations of adiponectin, an adipocyte-specific plasma protein, in normal pregnancy and preeclampsia. J Reprod Immunol. 2005;65(1 ):65-75. [ Links ]
37. Reyna-Villasmil E, Mejia-MmontillaJ, Reyna-Villasmil N, Torres-Cepeda D, Peña-Paredes E. Adiponectina plasmática en preeclampsia y eclampsia. Rev Chil Obstet Ginecol. 2008;73(4):381-8. [ Links ]
38. Reyna-Villasmil E, Torres-Cepeda D, Peña-Paredes E, Mejia-MontillaJ, Reyna-Villasmil N, González-Rodríguez P. Concentraciones de homocisteína y perfil lipídico en preeclámpticas. Gac Med Caracas. 2008;116(3):235-40. [ Links ]
39. Ahmadi R, Rahimi Z, Vaisi-Raygani A, Kiani A, jalillan N, Rahimi Z. Apolipoprotein E genotypes, lipid peroxidation, and antioxidant status among mi Id and severe preeclamptic women from western Iran: protective role of apolipoprotein E2 allele in severe preeclampsia. Hypertens Pregnancy. 2012;31(4):405-18. doi: 10.3109/10641955.2012.690055. [ Links ]
40. Laivuori H, Kaaja R, Turpeinen U, Stenman UH, Ylikorkala O. Serum activin A and inhibin A elevated in pre-eclampsia: no relation to insulin sensitivity. Br J Obstet Gynaecol. 1999;106(12):1298-303. [ Links ]
41. Aquilina J BA, Thompson O, Harrington K. 1999. [ Links ]
42. Kim SY, Ryu HM, Yang JH, Kim MY, Ahn HK, ShinJS, et al. Maternal serum and amniotic fluid inhibin A levels in women who subsequently develop severe preeclampsia. J Korean Med Sci. 2006;21(3):452-6. [ Links ]
43. Zeeman GG, Alexander JM, McIntire DD, Byrd W, Levena KJ. Inhibin-A levels and severity of hyperten sive disorders due to pregnancy. Obstet Gynecol. 2002;100(1 ):140-4. [ Links ]
44. Muttukrishna S, Hyett J, Paine M, Moodley J, Groome N, Rodeck C. Uterine vein and maternal urinary levels of activin A and inhibin A in pre-eclampsia patients. Clin Endocrinol (Oxf). 2006;64(4):469-73. [ Links ]
45. Florio P, Reis FM, Pezzani I, Luisi S, Severi FM, Petraglia F. The addition of activin A and inhibin A measurement to uterine artery Doppler velocimetry to improve the early prediction of pre-eclampsia. Ultrasound Obstet Gynecol. 2003;21 (2):165-9. [ Links ]
46. D'Anna R, Baviera G, Corrado F, Leonardi I, Buemi M, jasonní VM. Is mid-trimester maternal serum inhibin-A a marker of preeclampsia or intrauterine growth restriction? Acta Obstet Gynecol Scand. 2002;81(6):540-3. [ Links ]
47. Davidson EJ, Riley Se, Roberts SAo Shearing CH, Groome NP, Martin Cw. Maternal serum activin, inhibin, human chorionic gonadotrophin and alpha-fetopro tein as second trimester predictors of pre-eclampsia. BJOG. 2003;110(1):46-52. [ Links ]
48. Fujimoto Y, Sasaki T, Tsuchida A, Chayama K. Angiotensin II type 1 receptor expression in human pancreatic cancer and growth inhibition by angiotensin II type 1 receptor antagonist. FEBS Lett. 2001;495(3):197-200. [ Links ]
49. De Mello Wc. Local renin angiotensin aldosterone systems and cardiovascular diseases. Med Clin North Am. 2017;101(1):117-127. doi: 10.1016/j. mcna.2016.08.017. [ Links ]
50. Quitterer U, Lother H, Abdalla S. AT1 receptor heterodimers and angiotensin II responsiveness in preec1ampsia. Semin Nephrol. 2004;24(2):115-9. [ Links ]
51. Xia Y, Wen H, Bobst S, Day Me, Kellems RE. Maternal autoantibodies from preeclamptic patients activate angiotensin receptors on human trophoblast cells. J Soc Gynecol Investig. 2003;10(2):82-93. [ Links ]
52. Hubel CA, Wallukat G, Wolf M, Herse F, Rajakumar A, Roberts JM, et al. Agonistic angiotensin II type 1 receptor autoantibodies in postpartum women with a history of preeclampsia. Hypertension. 2007;49(3):612-7. [ Links ]
53. Siddiqui AH, Irani RA, Zhang Y, Dai Y, Blackwell Se, Ramin SM, et al. Recombinant vascular endothelial growth factor 121 attenuates autoantibody-induced features of pre-eclampsia in pregnant mice. Am J Hypertens. 2011 ;24(5):606-12. doi: 10.1 038/ajh.201 0.247. [ Links ]
54. Irani RA, Zhang Y, Blackwell Se, Zhou Ce, Ramin SM, Kellems RE, et al. The detrimental role of angiotensin receptor agonistic autoantibodies in intrauterine growth restriction seen in preeclampsia. J Exp Med. 2009;206(12):2809-22. doi: 10.1 084/jem.20090872. [ Links ]
55. Zhou A, Carrell RW, Murphy MP, Wei Z, Van V, Stanley PL, et al. A redox switch in angiotensinogen modulates angiotensin release. Nature. 2010;468(7320):108-11. doi: 10.1 038/nature09505. [ Links ]
56. Thilaganathan B, Wormald B, Zanardini C, Sheldon J, Ralph E, Papageorghiou AT. Early-pregnancy multiple serum markers and second-trimester uterine artery Doppler in predicting preeclampsia. Obstet Gynecol. 2010;115(6):1233-8. doi: 10.1097/AOG.0b013e3181dd5137. [ Links ]
57. Kristensen K, Larsson I, Hansson SR. Increased cystatin C expression in the pre-eclamptic placenta. Mol Hum Reprod. 2007;13(3):189-95. [ Links ]
58. Thilaganathan B, Ralph E, Papageorghiou AT, Melchiorre K, Sheldon J. Raised maternal serum cystatin C: an early pregnancy marker for preeclampsia. Reprod Sci. 2009;16(8):788-93. doi: 10.1177/1933719109336618. [ Links ]
59. Hahn S, Huppertz B, Holzgreve W. Fetal cells and cell free fetal nucleic acids in maternal blood: new tools to study abnormal placentation? Placenta. 2005;26(7):515-26. [ Links ]
60. Bauer M, Hutterer G, Eder M, Majer S, Leshane E, Johnson KL, et al. A prospective analysis of cell-free fetal DNA concentration in maternal plasma as an indicator for adverse pregnancy outcome. Prenat Diagn. 2006;26(9):831-6. [ Links ]
61. Sifakis S, Zaravinos A, Maiz N, Spandidos DA, Nicolaides KH. First-trimester maternal plasma cell-free fetal DNA and preeclampsia. Am J Obstet Gynecol. 2009;201 (5):472.e1-7. doi: 10.1016/j.ajog.2009.05.025. [ Links ]
62. Alberry MS, Maddocks DG, Hadi MA, Metawi H, Hunt LP, Abdel-Fattah SA, et al. Quantification of cell free fetal DNA in maternal plasma in normal pregnancies and in pregnancies with placental dysfunction. Am J Obstet Gynecol. 2009;200(1):98.e1-6. doi: 10.1016/j. ajog.2008.07.063. [ Links ]
63. Reddy A, Zhong XV, Rusterholz e, Hahn S, Holzgreve W, Redman CW, et al. The effect of labour and placental separation on the shedding of syncytiotrophoblast microparticles, cell-free DNA and mRNA in normal pregnancy and pre-eclampsia. Placenta. 2008;29(11):942-9. doi: 10.1016/j.placenta.2008.08.018. [ Links ]
64. Kar M. Role of biomarkers in early detection of preec1ampsia. J Clin Diagn Res. 2014;8(4):BE01-4. doi: 10.7860/JCDR/201417969.4261. [ Links ]
65. Li Q, Pan Z, Wang X, Gao Z, Ren e, Vang W. miR-125b1-3p inhibits trophoblast cell invasion by targeting sphingosine-1-phosphate receptor 1 in preeclampsia. Biochem Biophys Res Commun. 2014;453(1):57-63. doi: 10.1016/j.bbrc.2014.09.059. [ Links ]
66. Doridot L, Houry D, Gaillard H, Chelbi ST, Barbaux S, Vaiman D. miR-34a expression, epigenetic regulation, and function in human placental diseases. Epigenetics. 2014;9(1):142-51. doi: 10.4161/epi.26196. [ Links ]
67. Akolekar R, Minekawa R, Veduta A, Romero xc. Nicolaides KH. Maternal plasma inhibin A at 11-13 weeks of gestation in hypertensive disorders of pregnancy. Prenat Diagn. 2009;29(8):753-60. doi: 10.1 002/pd.2279. [ Links ]
68. Leal AM, Poon LC, Frisova V, Veduta A, Nicolaides KH. First-trimester maternal serum tumor necrosis factor receptor-1 and pre-eclampsia. Ultrasound Obstet Gynecol. 2009;33(2):135-41. doi: 10.1 002/uog.6275. [ Links ]
69. Poon Le, Kametas NA, Maiz N, Akolekar R, Nicolaides KH. First-trimester prediction of hypertensive disorders in pregnancy. Hypertension. 2009;53(5):812-8. doi: 10.1161/HVPERTENSIONAHA.108.127977. [ Links ]
70. Romero R, Kusanovic JP, Than NG, Erez O, Gotsch F, Espinoza J, et al. First-trimester maternal serum PP13 in the risk assessment for preeclampsia. Am J Obstet Gynecol. 2008;199(2):122.e1-122.e11. doi: 10.1 016/j. ajog.2008.01.013. [ Links ]
DECLARACIÓN DE ASPECTOS ÉTICOS
Reconocimiento de autoría: Todos los autores declaran que han realizado aportes a la idea, diseño del estudio, recolección de datos, análisis e interpretación de datos, revisión crítica del contenido intelectual y aprobación final del manuscrito que estamos enviando.
Financiamiento: Los autores certifican que no han recibido apoyos financieros, equipos, en personal de trabajo o en especie de personas, instituciones públicas y/o privadas para la realización del estudio,
Conflicto de intereses: Los autores declaran no tener ningún conflicto de intereses.
Correspondencia:
Dr. Eduardo Reyna-Villasmil.
Hospital Central "Dr. Urquinaona"
Final Av. El Milagro, Maracaibo, Estado Zulia, Venezuela
58162605233
sippenbauch@gmail.com
Recibido: 28 marzo 2107
Aceptado: 18 abril 2017













