Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.63 no.4 Lima oct./dic. 2017
SIMPOSIO: OBESIDAD EN LA MUJER
Impacto de la obesidad en la salud reproductiva de la mujer adulta
Impact of obesity in the adult woman's reproductive health
Helard Manrique1
1. Médico Endocrinólogo, Hospital Nacional Arzobispo Loayza; Clínica Delgado, Lima, Perú
RESUMEN
La obesidad es una epidemia multifactorial que involucra factores genéticos, ambientales y sociales. Revisaremos el efecto de la obesidad en la reproducción femenina. El tejido adiposo está involucrado en la producción de diversas hormonas relacionadas al metabolismo, la homeostasis del individuo y a su vez también en la reproducción, tanto en la mujer como en el varón. Revisaremos los diversos cambios que producen el sobrepeso y la obesidad de la mujer y las alteraciones hormonales que influyen en la salud reproductiva de la mujer.
Palabras clave. Obesidad, reproducción femenina, fertilidad, ovario poliquistico, embarazo
ABSTRACT
Obesity is a multifactorial epidemic that involves genetic, environmental and social factors. We will review the effect of obesity on female reproduction. Adipose tissue is involved in the production of various hormones related to metabolism, the homeostasis of the individual and also in reproduction in both women and men. We will review the various changes produced by overweight and obesity in women and the hormonal changes that influence women's reproductive health.
Keywords: Obesity, Female reproduction, Fertility, Polycystic ovary, Pregnancy.
Introducción
La prevalencia de obesidad en las mujeres en edad fértil (MEF) de 20 a 49 años aumentó en el mundo a partir de 1980. Destacan las regiones de las Américas y el Caribe y Oceanía, por presentar las prevalencias más altas; al 2008, ambas regiones tuvieron prevalencias de obesidad superiores a 20%(1). La serie de estudios NHANES realizados en Estados Unidos de Norteamérica desde 1960 en adelante, demostraron que en mujeres de 20 a 39 años, la prevalencia de la obesidad se mantuvo relativamente estable durante 2 décadas (1960 a 1980); sin embargo, aumentó significativamente entre 1976-80 y 1988-94 (de 12,3% a 20,6%) y entre 1988-94 y 1999-2000 (de 20,6% a 28,4%)(2-4).
La población del Perú es relativamente joven: 29,6% tiene menos de 15 años, el 61,9% se encuentra entre los 15 y 64 años y 8,5% cuenta con 65 y más años de edad. El nivel educativo de las mujeres de 15 a 49 años de edad ha mejorado en el año 2016 respecto al año 2012. El 62,6% tiene educación secundaria completa o superior(5).
El 17,8% de personas de 15 y más años de edad tiene un IMC superior a 30, es decir, sufre de obesidad; 22,4% son mujeres y 13,3% hombres. Por área de residencia, hay una diferencia de 12,1 puntos porcentuales entre la población urbana (21,9%) y rural (9,8%) que es obesa(4,5).
Además se observó que 69,2% tenía exceso de peso al inicio del embarazo (sobrepeso u obesidad). También, la prevalencia de peso bajo, sobrepeso y obesidad en la zona urbana no fue diferente significativamente que las del área rural, a pesar de que la obesidad fue 10 puntos porcentuales más alta en el área urbana (24,4% vs. 14,0%, respectivamente)(4-6).
La obesidad es uno de los problemas de salud más comunes en mujeres, pero las implicaciones relativas a la reproducción y el embarazo no se reconoce, se pasa por alto o se ignora debido a la falta de tratamiento específico basado en la evidencia. Existe una relación de complicaciones del embarazo asociadas a la obesidad y que afectan a la madre, el feto, y neonato. La programación fetal puede ocurrir y pueden impactar en las generaciones siguientes.
Las complicaciones durante la edad reproductiva son cáncer, diabetes y enfermedades cardiometabólicas(6). Además se asocia con la anovulación y la probabilidad de volverse infértiles tres veces mayor para las mujeres obesas en edad fértil que para las mujeres de peso normal. También hay relación con complicaciones durante el embarazo, que incluyen parto prematuro, peso elevado al nacer, diabetes gestacional, preeclampsia, aumento del riesgo de aborto espontáneo, parto por cesárea intraparto, inducción fallida, complicaciones operatorias, distocia de hombro, depresión posparto, hemorragia, infecciones de heridas y endometritis. Los riesgos fetales incluyen un mayor riesgo de anomalías congénitas, macrosomía, crecimiento fetal y muerte fetal. Datos recientes de una revisión y metaanálisis también indicó que las mujeres obesas embarazadas son más propensas a experimentar aumento prenatal y depresión posparto que las mujeres de peso normal(7-10).
Factores de riesgo y obesidad en mujeres en edad fértil
La obesidad no es una enfermedad exclusiva del estrato socioeconómico más elevado, lo cual ha cambiado en los últimos años, ya que investigaciones recientes han determinado una relación inversa entre el nivel socioeconómico de las mujeres y su desarrollo.
La relación inversa entre la condición socioeconómica (CSE) y la obesidad en la mujer podría estar mediada por cuatro factores. El primero destaca que las mujeres de CSE alta de sociedades desarrolladas poseen el hábito de hacer dieta y restringir el consumo de alimentos, lo cual no es frecuente en la CSE baja(11).
En segundo lugar, existe una mayor práctica de actividad física en mujeres de CSE alta, producto de mayor disponibilidad de tiempo y mayores oportunidades de hacer ejercicio con fines recreativos. El último factor asocia la CSE con el aspecto hereditario, lo cual prevalece al parecer en muchas familias de baja CSE. Por otro lado, hay la idea de que adoptar una dieta saludable implica una mayor inversión de recursos económicos, justificando así el incumplimiento(11).
Riesgos de la obesidad en edad reproductiva
La obesidad femenina se asocia a cáncer de endometrio, ovario, mama, diabetes y enfermedades cardiometabólicas. Además, se asocia con la anovulación, menstruación irregular, síndrome de ovario poliquístico e implantación de óvulos fallida; la probabilidad de volverse infértil es tres veces mayor para las mujeres obesas en edad fértil que para las mujeres con peso normal(12).
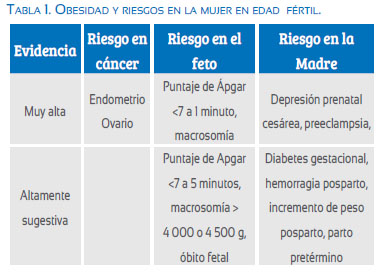
La tasa de aborto involuntario es mayor en mujeres que se someten a fecundación in vitro (FIV), con macrosomía fetal, puntaje bajo de Ápgar (a los cinco minutos), muerte fetal, diabetes gestacional, parto instrumental, hemorragia posparto y nacimiento prematuro, así como la asociación con las tasas de pequeños para la edad gestacional(10)(tabla 1).
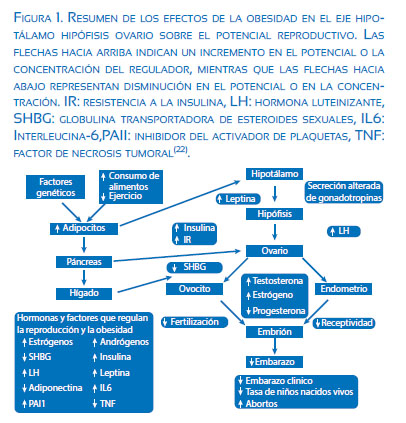
Las mujeres obesas pueden también desarrollar resistencia a la insulina e hiperinsulinemia y experimentar cambios en la secreción de liberación de gonadotropina, que puede aumentar la secreción de la hormona luteinizante por la glándula pituitaria y reducir el nivel de hormona foliculoestimulante (FSH). Además, los niveles de andrógenos (testosterona, dehidroepiandrosterona (DHEA) y androstenediona y estrógeno) se incrementan en las mujeres obesas, porque la concentración de la globulina transportadora de hormonas sexuales (SHBG) disminuye. Como resultado, la capacidad de fertilización es menor, e incluso cuando se logra el embarazo hay es una tasa de aborto mucho más alta y una tasa de natalidad más baja de lo normal entre los recién nacidos de mujeres obesas(13,14,16)(figura 1).
Por lo tanto, la obesidad en la mujer en edad fértil (MEF) es de importancia por sus problemas a la salud tanto en el mediano como en largo plazo.
Obesidad e Infertilidad
La relación entre obesidad e infertilidad es complejo y al parecer multifactorial. Hay una serie de factores descritos en la literatura relacionados al incremento de la adiposidad, tales como la hiperinsulinemia, la resistencia a la insulina, el exceso de andrógenos, el aumento en la aromatización de andrógenos a estrógenos, alteración en la secreción de gonadotropinas, disminución en la globulina transportadora de hormonas sexuales (SHBG), disminución de la hormona del crecimiento (GH), aumento de la leptina, entre otros(18-21).
La hormona folículo estimulante (FSH) y la hormona luteinizante (LH) pertenecen a un grupo de hormonas glicoproteicas producidas en la adenohipófisis y son las encargadas de regular la función ovárica. A su vez, estimulan la maduración de las células foliculares (granulosas) que rodean al ovocito. Las células de la granulosa junto con las células dela teca actúan en conjunto y producen estrógenos que:
1. Estimulan a que el endometrio uterino entre en fase proliferativa o folicular;
2. Generan moco cervical para permitir el paso de los espermatozoides, y
3. Estimulan a la hipófisis a que secrete LH.
A mitad del ciclo menstrual hay un pico de secreción de LH que eleva las concentraciones del factor promotor de la maduración, que lleva al ovocito a completar la meiosis I e iniciar la meiosis II; estimula la producción de progesterona por las células del estroma folicular (luteinización) y provoca la rotura folicular y la ovulación(21-23). La hipersecreción de LH y/o el aumento en la proporción de LH/ FSH durante la fase folicular ha sido asociada con un decremento en la función ovárica, con procesos de infertilidad, abortos y con el desarrollo de tumores ováricos. Estas condiciones se encuentran con frecuencia en el síndrome de ovarios poliquísticos y en mujeres obesas infértiles(19,23).
Se está acumulando evidencia de que la obesidad está asociada con la supresión de los niveles de gonadotropina sérica, independientemente de la resistencia a la insulina, al menos en parte. Se ha informado asociaciones inversas entre el índice de masa corporal (IMC). Una serie de estudios ha mostrado consistentemente niveles de LH en fase folicular disminuidos y una supresión de la amplitud del pico del pulso de LH y supresión sutil de FSH en mujeres eumenorreicas con obesidad mórbida que son clínicamente normoandrógenas. Estas gonadotropinas disminuidas tuvieron un efecto sutil pero importante en la función folicular y disminuyen significativamente en el momento del pico ovulatorio a mitad del ciclo, después de lo cual se produce insuficiencia del cuerpo lúteo. Estos estudios sugirieron además que el exceso de citocinas inflamatorias relacionado con la obesidad media la supresión de la liberación de gonadotropina hipofisaria y que ambos se mejoran mediante la administración transdérmica de estradiol para aumentar ligeramente los niveles de estradiol(19,23).
El más importante cambio endocrino de la obesidad es la elevación del nivel basal de insulina y la resistencia periférica a la insulina. En respuesta a la resistencia a la insulina hay un incremento en la secreción de insulina. El metabolismo alterado de insulina reduce las concentraciones de SHBG, promueve el hiperandrogenismo e incrementa la posibilidad de alteraciones en los ciclos menstruales y ovulatorios. Inclusive, en mujeres obesas con pérdida de peso significativa y cuyos ciclos se regularizan, se observa una reducción de la resistencia a la insulina.
Los niveles circulantes de insulina son proporcionales al volumen de grasa corporal. La insulina disminuye el metabolismo hepático de SHBG; de esta manera se aumentan las fracciones libres de andrógenos y estrógenos.
Al parecer, la insulina tiene mayor poder que los esteroides sexuales sobre la regulación de la producción de SHBG. El aumento de los niveles de insulina también disminuye la producción hepática de la globulina ligadura del factor del crecimiento similar a la insulina tipo 1 (IGFBP-1); así, hay mayor cantidad del factor de crecimiento similar a la insulina tipo 1 (IGF-1) disponible para actuar en su propio receptor, el cual se encuentra en las células de la teca del ovario. Al actuar sobre su receptor, el IGF-1 potencia la acción que tiene la LH sobre la producción de andrógenos ováricos(16).
El ovario, como muchos órganos, es un órgano importante para la insulina. Actúa mediante la interacción con los receptores de insulina y receptores de factores de crecimiento similares a insulina (IGF) que se encuentran tanto en las células de la granulosa, de la teca y en el estroma ovárico en humanos. La insulina estimula la esteroidogénesis en las células de la teca y en las de la granulosa, aumenta el efecto estimulatorio de la LH mediante el aumento de la expresión de receptores para LH(19,22).
La insulina también actúa a nivel de la hipófisis aumentando la sensibilidad de los gonadotropos a la hormona liberadora de gonadotropinas (GnRH) y por lo tanto incrementa la esteroidogénesis ovárica. A su vez, la insulina modula la biodisponibilidad de esteroides sexuales mediante la inhibición de la síntesis hepática de la globulina transportadora de esteroides sexuales (SHBG).
Con respecto a la leptina, su producción aumenta posprandialmente y disminuye en el ayuno. Induce una reducción del apetito a nivel hipotalámico, tiene un papel en el metabolismo de lípidos y es una señal de almacenamiento de energía; tiene un efecto estimulador de la foliculogénesis cuando se encuentra dentro de los valores de referencia y puede ser inhibitoria de la foliculogénesis cuando sus concentraciones están elevadas. Los niveles séricos de leptina varían sutilmente a lo largo del ciclo menstrual, con una concentración máxima cercana al medio ciclo. También se han
encontrado receptores para leptina en el hipotálamo y en la hipófisis, por lo que se la ha implicado en la regulación de la secreción de gonadotropinas. La leptina regula directa o indirectamente la foliculogénesis mediante el control de la secreción de la LH y la FSH(19,23).
Ovario poliquístico (sop): fertilidad y obesidad
Se estima que el SOP afecta entre el 12% y el 21% de las mujeres en edad reproductiva, y la mayoría de estas mujeres permanece sin diagnosticar. Es la endocrinopatía más común en las mujeres(24). Típicamente (pero no exclusivamente), las pacientes que presentan SOP tienen sobrepeso y presentan irregularidades menstruales concomitantes. Adicionalmente, la obesidad puede promover el desarrollo del fenotipo SOP en mujeres susceptibles, ya que los efectos adversos de SOP son más frecuentes en mujeres obesas(25,26). El diagnóstico de SOP debe ser considerado un diagnóstico de exclusión. Se utilizan los criterios de Rotterdam, que requieren dos de las tres características clave de oligo o anovulación, manifestaciones clínicas y/o bioquímicas de hiperandrogenismo y ovarios poliquísticos en el ultrasonido, muchas veces acompañado de acné e hirsutismo. Es de importancia crucial inicialmente excluir trastornos de la tiroides, hiperprolactinemia, hiperplasia suprarrenal congénita, secreción de andrógenos tumores y síndrome de Cushing. La tríada que comprende la obesidad, la infertilidad y el SOP están vinculadas, y la prevalencia de esta tríada está en aumento. Si bien es el deber de los especialistas en fertilidad abordar las preocupaciones de infertilidad de las pacientes con SOP(26,27).
Se ha notificado que la grasa visceral contribuye más a la resistencia a la insulina del SOP que la grasa abdominal y parece causar resistencia a la insulina hepática por la lipotoxicidad del exceso de ácidos grasos libres liberados en la circulación portal(24,27).
En el SOP, el IMC también está inversamente relacionado con los niveles medios de LH basales. La caída en los niveles de LH con la obesidad es atribuible a una caída en la amplitud del pulso de LH. Aunque la respuesta temprana de LH a GnRH es significativamente elevada en SOP, es significativamente más baja en el obeso que en el no obeso(27-29).
El debilitamiento de las pulsaciones de LH en el SOP en mujeres obesas se debe al menos en parte al metabolismo acelerado de LH. La eliminación de gonadotropinas de la circulación está relacionada con los patrones de sulfonación y sialilación de las isoformas componentes: las isoformas sulfonadas se eliminan más rápidamente que las sialiladas. Aunque la sialilación de las moléculas de LH aumenta en SOP, el porcentaje de isoformas de LH sulfonadas es proporcional al IMC en SOP. Por lo tanto, es probable que el aumento de las isoformas de LH sulfonadas en SOP explique su acelerado recambio de LH. Debido a que el recambio de LH parece ser el principal determinante de la biodisponibilidad de LH, se espera que este cambio disminuya la bioactividad in vivo de la LH(16,29).
El mecanismo por el cual la obesidad suprime la amplitud del pulso LH no está claro. Existe la posibilidad de que la producción de estrógeno en exceso de tejido adiposo desempeñe un papel en la supresión de la amplitud de pulso de LH de las mujeres, como se informó en hombres, y la bioactividad de LH, tal vez afectando la sialilación de LH(26,27).
Además, la propia obesidad puede explicar el exceso de formación periférica de testosterona independientemente del SOP. Los adipocitos convierten la androstenediona circulante en testosterona a través de la 17βHSD, que está regulado positivamente por la insulina. La expresión de esta enzima en la grasa subcutánea se correlaciona con el IMC y disminuye con la pérdida de peso en la obesidad.
El grado en que la anovulación hiperandrogénica de las mujeres obesas se deba a la obesidad aun no ha sido determinado. Los síntomas de SOP pueden mejorar con una pérdida de peso del 5% a 10%. Sin embargo, se puede requerir una pérdida de peso del 25% a 50% en los muy obesos, y la corrección de la anovulación puede requerir la corrección tanto del hiperandrogenismo como del síndrome metabólico. El hiperandrogenismo de la mayoría de los pacientes con SOP con obesidad mórbida se puede corregir con la pérdida sustancial de peso lograda por la cirugía bariátrica(29).
En resumen, el papel principal de la obesidad en la patogénesis de SOP parece estar relacionado con un aumento de la resistencia a la insulina, lo que agrava la fertilidad.
Obesidad y embarazo
Durante el embarazo, la obesidad aumenta la probabilidad de desarrollar diabetes gestacional, hipertensión arterial y preeclampsia y de tener un parto por cesárea, entre otras complicaciones. En el largo plazo, la obesidad se asocia a problemas reproductivos y al desarrollo de enfermedades crónicas no transmisibles (ECNT), tales como hipertensión arterial, diabetes tipo 2, dislipidemias y algunos tipos de cáncer(10). Pero las consecuencias de la obesidad se extienden más allá de la mujer, a su descendencia. Los recién nacidos de madres obesas durante el embarazo presentan más complicaciones en el período perinatal al nacer grande para la edad gestacional (GEG), macrosómico, pretérmino(33). Al mismo tiempo, un ambiente obesogénico durante los períodos preconcepcional y gestacional incrementará en el niño el riesgo de desarrollar en el largo plazo obesidad y ECNT del adulto(10). Las pacientes con un IMC â¥25 kg/m2 tendrían mayores probabilidades de tener un aborto, independientemente del método utilizado para la concepción (OR: 1,67, IC95% 1,25 a 2,25). Sin embargo, cuando se diferenciaron las diferentes tratamientos de reproducción asistida (TRA), solo en la inducción de ovulación y donación ovocitaria este riesgo incrementado de aborto permaneció, pero no en fecundación in vitro (FIV)(32,33).
La obesidad está relacionada con 18% de las causas obstétricas de mortalidad materna y con 80% de las muertes relacionadas con la anestesia. Las complicaciones gestacionales son superiores en mujeres obesas que en aquellas con normopeso, especialmente durante el tercer trimestre, e incluyen hipertensión, diabetes gestacional, preeclampsia, tromboembolismo, macrosomía fetal, infecciones urinarias, amenaza de parto pretérmino y parto pretérmino, muerte fetal anteparto sin causa, parto vaginal instrumentado, cesárea, distocia de hombros, complicaciones quirúrgicas y anestésicas, hemorragia posparto, infección y dehiscencia de la herida quirúrgica, y endometritis puerperal(35).
En mujeres obesas se han descrito con mayor frecuencia defectos congénitos del sistema nervioso central fetal (como defectos del tubo neural), grandes vasos, pared abdominal e intestino. Estos podrían estar originados por una absorción o distribución insuficiente de nutrientes esenciales como el ácido fólico, la incipiente hiperglucemia causada por la resistencia a la insulina en el momento de la organogénesis, o la peor visualización de los órganos fetales por ecografía que llevaría a subsiguientes errores en el diagnóstico ecográfico prenatal(10,32,35).
Obesidad y fecundación in vitro (FIv)
Los procesos de FIV en mujeres obesas bajo hiperestimulación ovárica controlada (HOC) requieren altas dosis de gonadotropinas debido a la presencia de una resistencia a la acción de las mismas, que conduce a una peor respuesta ovárica. Las dosis de gonadotropinas necesitan ser incrementadas a medida que aumenta el IMC, tanto en protocolos largos como cortos de estimulación ovárica(36).
Además, las pacientes obesas bajo HOC requieren periodos más largos de estimulación y presentan mayores tasas de cancelación tanto en inducción de la ovulación como en FIV. También se ha descrito en mujeres obesas bajo HOC una mayor incidencia de asincronía folicular y concentraciones menores de estradiol sérico a final del ciclo(38).
De este modo, en pacientes obesas es frecuente la necesidad de altas dosis de gonadotropinas, largos períodos de estimulación ovárica y altas tasas de cancelación del ciclo por respuesta insuficiente. Esta 'resistencia a las gonadotropinas' representaría una respuesta atenuada debida a una absorción reducida del fármaco y/o a una distribución anormal del mismo en el organismo que llevaría a una concentración efectiva de FSH exógena más baja en el ovario. También se piensa que la concentración sérica de leptina induce la resistencia a las gonadotropinas, pues está relacionada con la cantidad de tejido adiposo en el organismo, siendo frecuente en mujeres obesas la hiperleptinemia. El efecto estimulador de la FSH sobre la síntesis esteroidea de las células de la granulosa in vitro es inhibido por la leptina, y se han relacionado altas concentraciones intrafoliculares de leptina con una relativa resistencia a las gonadotropinas durante la estimulación ovárica para FIV en mujeres con SOP. En estas mujeres, la alta incidencia de obesidad androide también se ha asociado con peores resultados(38,39). En una reciente revisión sistemática acerca del efecto del sobrepeso y la obesidad sobre las TRA se concluyó que las tasas de gestación en las mujeres sin sobrepeso (20 a 25 kg/ m2) eran significativamente mayores (OR: 1,40, IC95% 1,22 a 1,60) que en aquellas con sobrepeso (>25 kg/m2). De forma similar, las mujeres sin obesidad (20 a 30 kg/m2) presentaron tasas significativamente mayores de embarazo (OR: 1,47, IC95% 1,20 a 1,80) que las pacientes obesas (>30 kg/m2)(39).
Estrategias para mejorar la Función reproductiva en la mujer obesa
La mejor opción para mejorar la fecundidad y el desarrollo gestacional en la mujer obesa es la reducción de peso pregestacional, independientemente del modo de concepción. La primera línea de tratamiento consiste en la "terapia de estilo de vida' que combina dieta hipocalórica, ejercicio adaptado y apoyo psicológico. Solo cuando esta medida falle (pérdida insuficiente de peso (<10%) en un plazo razonable de tiempo (al menos 6 meses)) y el IMC sea alto, sobre todo en asociación a comorbilidad, medidas de segunda línea como la farmacoterapia (poco efectiva) o de tercera línea como la cirugía bariátrica (con riesgos importantes) podrán ser consideradas. La conciencia y la educación pueden alentar a las mujeres a lograr y mantener un peso saludable, específicamente cuando ellos consideran la posibilidad de tener hijos. En general, la obesidad aumenta los riesgos para la salud y las complicaciones relacionadas a la reproducción y el embarazo para la madre y el bebé, lo que hace que la conciencia previa a la concepción y asesoramiento de suma importancia(40,41).
El control de peso debe realizarse de forma rigurosamente científica de manera de garantizar que las personas consuman alimentos nutricionalmente comidas balanceadas, limitar su ingesta calórica y hacer ejercicio regularmente. Las personas obesas, sin embargo, pueden experimentar desnutrición o enfermedades relacionadas si restringen excesivamente su dieta o aumentar la cantidad de ejercicio sin precisión y determinar el equilibrio necesario entre los dos los riesgos son particularmente altos en las mujeres(41).
Financiamiento: Autofinanciado
Conflicto de Intereses: El autor declara no tener conflicto de intereses
Referencias Bibliográficas
1. Black R, Victora C, Walker S, Bhutta Z, Christian P, de Onis M, et al; The Maternal and Child Nutrition Study Group. Maternal and child undernutrition and overweight in low-income and middle-income countries. Lancet 2013 doi:pii: S0140-6736 (13) 60937-X. 10.1016/S0140-6736(13)60937-X. [ Links ]
2. Flegal K, Carroll M, Ogden C, Johnson C. Prevalence and trends in obesity among US adults, 1999-2000. JAMA. 2002;288:1723-27. [ Links ]
3. Flegal K, Carroll M, Ogden C, Curtin L. Prevalence and trends in obesity among US adults, 1999-2008. JAMA. 2010;303(3):235-41. [ Links ]
4. Álvarez-Dongo D, Sánchez-Abanto J, Gómez-Guizado G, Tarqui-Mamani C. Sobrepeso y obesidad: prevalencia y determinantes sociales del exceso de peso en la población peruana (2009-2010). Rev Peru Med Exp Salud Publica. 2012;29(3):303-13. [ Links ]
5. Araya M, Padilla O. Obesidad en mujeres chilenas en edad fértil. Rev Med Chile. 2014;142:1440-8. [ Links ]
6. MINSA Evolución de la situación nutricional en Perú 2012-2013. http:// http://www.ins.gob.pe. [ Links ]
7. Calle EE, Thun MJ, Petrelli JM, Rodríguez C, Heath CW Jr. >Body mass index and mortality in a prospective cohort of U.S. adults. N Engl J Med. 1999;341:1097-105. [ Links ]
8. Bellver J, Busso C, Pellicer A, Remohí J, Simón C. Obesity and assisted reproductive technology outcomes. Reprod Biomed Online. 2006;12:562-8. [ Links ]
9. Gambineri A, Pelusi C, Viccenati V, Pagotto U, Pasquali R. Obesity and polycystic ovariansyndrome. Int J Obes Relat Metab Disord. 2002;26:883-96. [ Links ]
10. Kalliala I, Markozannes G, Gunter MJ, Paraskevaidis E, Gabra H, Mitra A, ET al. Obesity and gynaecological and obstetric conditions: umbrella review of the literature. BMJ. 2017 Oct 26;359:j4511. doi: 10.1136/bmj.j4511 [ Links ]
11. Esquivel Solís V. Factores asociados a la obesidad en mujeres en edad fértil. Rev costarric salud pública [online]. 2004;13(25):42-7. ISSN 1409-1429. [ Links ]
12. Barrios-De-Tomasi J, Barrios-De-Tomasi E, Vergara-Galicia J. Efecto de la obesidad en la reproducción femenina. Rev Mex Ciencias Farmacéuticas. 2013;44(3):818. [ Links ]
13. Brown LM, Clegg DJ. Central effects of estradiol in the regulation of food intake, body weight and adiposity. J Steroid Biochem Mol Biol. 2010;122(1-3):65-73. [ Links ]
14. Schneider JE, Wise JD, Benton NA, Brozek JM, Keen-Rhinehart E. When do we eat? Ingestive behavior, survival, and reproductive success. Horm Behav. 2013. doi: 10.1016/j.yhbeh.2013.07.005. [ Links ]
15. Cammisotto P, Bendayan M. A review on gastric leptin: the exocrine secretion of a gastric hormone. Anat Cell Biol. 2012;45:1-16. [ Links ]
16. Chen X, Jia X, Qiao J, Guan Y, Kang J. Adipokines in reproductive function: a link between obesity and polycystic ovary syndrome. J Mol Endocrinol. 2013;50:R21-R37. doi: 10.1530/JME-12-0247. [ Links ]
17. Vincent RP, Ashrafian H, leRoux CW. Mechanisms of disease: the role of gastrointestinal hormones in appetite and obesity. Nat Clin Pract Gastroenterol Hepatol. 2008;5(5):268-77. [ Links ]
18. Dye L, Warner P, Bancroft J. Food craving during menstrual cycle and its relationship to stress, happiness of relationship and depression; a preliminary enquiry. J Affect Dis. 1995;34(3):157-64. [ Links ]
19. Talmor A, Dunphy B. Female obesity and infertility. Best Practice & Research Clin Obstet Ginaecol. 2015 May;29(4):498-506. doi: 10.1016/j.bpobgyn.2014.10.014. [ Links ]
20. Jungheim ES, Travieso JL, Carson KR, Moley KH. Obesity and reproductive function. Obstet Gynecol Clin North Am. 2012;39(4):479-93. . doi: 10.1016/j. ogc.2012.09.002. [ Links ]
21. Boots C, Stephenson MD. Does obesity increase the risk of miscarriage in spontaneous conception: a systematic review. Semin Reprod Med. 2011;29(6):507-13. [ Links ]
22. Ali AT, Hochfeld WE, Myburgh R, Peppers MS. Adipocyte and adipogenesis. Eur J Cell Biol. 2013. doi: 10.1016/j. ejcb.2013.06.001. [ Links ]
23. Gregor MF, Hotamisligil GS. Thematic review series: Adipocyte Biology. Adipocyte stress: the endoplasmic reticulum and metabolic disease. J Lipid Res. 2007;48(9):1905-14. [ Links ]
24. Apridonidze T, Essah PA, Iuorno MJ, Nestler JE. Prevalence and characteristics of the metabolic syndrome in women with polycystic ovary syndrome. J Clin Endocrinol Metab 2005;90:1929-35. [ Links ]
25. Meyer C, McGrath B, Cameron J, Kotsopoulos D, Teede HJ. Vascular dysfunction and metabolic parameters in polycystic ovary syndrome. J Clin Endocrinol Metab 2005;90:4630e5. [ Links ]
26. Meyer C, McGrath B, Teede H. Overweight women with polycystic ovary syndrome have evidence of subclinical cardiovascular disease. J Clin Endocrinol Metab. 2005;90:5711e6. [ Links ]
27. Rosenfield RL, Ehrmann DA. The pathogenesis of polycystic ovary syndrome (PCOS): the hypothesis of PCOS as functional ovarian hyperandrogenism revisited. Endocrine Rev. 2016;37(5):467-520. doi:10.1210/er.20151104. [ Links ]
28. Azziz R, Adashi EY. Stein and Leventhal: 80 years on. Am J Obstet Gynecol. 2016;214:247.e1-247.e11. doi: 10.1016/j.ajog.2015.12.013 [ Links ]
29. Adams JM, Taylor AE, Crowley WF Jr, Hall JE. Polycystic ovarian morphology with regular ovulatory cycles: insights into the pathophysiology of polycystic ovarian syndrome. J Clin Endocrinol Metab. 2004;89:4343-50. [ Links ]
30. Bellver J, Ayllón Y, Ferrando M, Melo M, Goyri E, Pellicer A, Remohí J, Meseguer M. Female obesity impairs in vitro fertilization outcome without affecting embryo quality. Fertil Steril. 2010;93:447-54. [ Links ]
31. Metwally M, Ong KJ, Ledger WL, Li TC. Does high body mass index increase the risk of miscarriage after spontaneous and assisted conception? A meta-analysis of the evidence. Fertil Steril. 2008;90:714-26. [ Links ]
32. Hall F, Neubert A. Obesity and pregnancy. Obstet Gynaecol Surv. 2005;4:253-60. [ Links ]
33. Linné Y. Effects of obesity on women's reproduction and complications during pregnancy. Obes Rev. 2004;5:137-43. [ Links ]
34. Callaway LK, Prins JB, Chang AM, McIntyre HD. The prevalence and impact of overweight and obesity in an Australian obstetric population. Med J Aust. 2006;184:56-9. [ Links ]
35. Ramsay JE, Greer I, Sattar N. Obesity and reproduction. BMJ. 2006;333:1159-62. [ Links ]
36. Bellver J, Melo MA, Bosch E, Serra V, Remohí J, Pellicer Obesity and poor reproductive outcome: the potential role of the endometrium. Fertil Steril. 2007;88:44651. [ Links ]
37. Dessolle L, Daraï E, Cornet D, Rouzier R, Coutant C, Mandelbaum J, et al. Determinants of pregnancy rate in the donor oocyte model: a multivariate analysis of 450 frozen-thawed embryo transfers. Hum Reprod. 2009;24:3082-9. [ Links ]
38. De Ugarte DA, De Ugarte CM, Sahakian V. Surrogate obesity negatively impacts pregnancy rates in third-party reproduction. Fertil Steril. 2010;93:100810. [ Links ]
39. Ferrando M, Bellver J. Impacto de la obesidad sobre la reproducción humana natural y asistida. Rev Esp Obes. 2008;6:302-16. [ Links ]
40. Rhoton-Vlasak AS, Roussos-Ross K, Cua GM2, Odera EL3, Irani TA3, Vasilopoulos T4. Obesity and reproduction: a study to determine how effectively medical education enhances awareness of the reproductive risks related to obesity. JBRA Assist Reprod. 2017 Oct 25. doi: 10.5935/1518-0557.20170059. [Epub ahead of print] [ Links ]
41. Phelan S. Pregnancy: a "teachable moment" for weight control and obesity prevention. Am J Obstet Gynecol. 2010;202:135e1-8. doi: 10.1016/j.ajog.2009.06.008. [ Links ]
Correspondencia:
Citar como: Manrique H. Impacto de la obesidad en la salud reproductiva de la mujer adulta. Rev Peru Ginecol Obstet. 2017;63(4):607-614
Recibido: 25 octubre 2017
Aceptado: 30 octubre 2017