Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Ginecología y Obstetricia
versión On-line ISSN 2304-5132
Rev. peru. ginecol. obstet. vol.63 no.4 Lima oct./dic. 2017
CASO CLÍNICO
Defecto amplio del tubo neural. A propósito de un caso
Open neural tube defect: A case report
Mileidy Egleet Mejias Quintero1,a, Haidar Salem Salem1,b
1. Hospital Gutiérrez Ortega de Valdepeñas. Ciudad Real, España.
a. Facultativo Especialista del Área de Ginecología y Obstetricia
b. Jefe de Servicio de Ginecología y Obstetricia
RESUMEN
Los defectos del tubo neural representan la segunda causa de malformación congénita más frecuentes del desarrollo prenatal y constituyen el 10% de las mismas. Su origen suele ser multifactorial, dando lugar a un cierre incompleto o defectuoso del neuroporo anterior y/o posterior, y ocasionando diferentes niveles de defectos en el sistema nervioso central. A pesar de toda la investigación realizada, nuestros conocimientos sobre la etiología genética de esta malformación son todavía muy limitados. Se desconoce cuántos genes pueden conferir riesgo de anomalía en el desarrollo del tubo neural. El diagnóstico se basa principalmente en el estudio ecográfico del sistema nervioso central en el segundo trimestre de la gestación, aunque su valoración en el primer trimestre nos permite una aproximación diagnóstica bastante confiable por la presencia de marcadores ecográficos descritos hace pocos años. Una vez confirmado el diagnóstico el manejo depende (en países como España en donde se permite el aborto) de la voluntad de los padres de continuar o no con la gestación; y en caso de continuar, existen opciones de tratamiento quirúrgico intrauterino o posterior al nacimiento. El pronóstico de esta malformación suele ser variable y depende de localización, tamaño y su asociación o no con hidrocefalia.
Palabras clave. Defecto del tubo neural, Espina bífida, Ventriculomegalia, 'signo del limón', 'signo de la banana'.
ABSTRACT
Neural tube defects are the second most frequent cause of congenital malformation during prenatal development. They constitute 10% of them. The origin is usually multifactorial, and it results in an incomplete or defective closure of the anterior or posterior neuropore, causing different levels of defects in the central nervous system. Despite all the research done, our knowledge of genetics in this topic is very limited so we don't know how many genes can confer risk of anomaly in the development of the neural tube. Diagnosis is mainly based on the ultrasound study of the central nervous system generally during the second trimester. Nevertheless, assessment in the first trimester allows us a fairly reliable diagnostic approach by means of the echographic markers described a few years ago. Once the diagnosis is confirmed, and if abortion is allowed in the country, the management depends on the parents' willingness to continue or not with the gestation. In case of continuing with it, there are options for intrauterine or post-natal surgical treatment. The prognosis of this malformation is usually variable and depends on location, size and its association or not with hydrocephalus.
Keywords: Neural tube defects, spina bifida, ventriculomegaly, "lemon sign" "banana sign".
Introducción
Los defectos del tubo neural (DTN) se refieren a una serie de trastornos del desarrollo del sistema nervioso central de origen multifactorial, en donde se produce un cierre incompleto o defectuoso del neuroporo anterior o posterior en los días 24 y 27 después de la concepción, aproximadamente entre la quinta y la sexta semana de gestación(1).
Los defectos del tubo neural constituyen un 10% de las malformaciones fetales y se les considera la segunda causa de malformaciones fetales después de las cardiopatías congénitas. En España, su incidencia es de 1/1 000 niños nacidos, aunque en algunas regiones llega a 4,5 o 6 por cada 1 000(2), con una estimación de 300 000 o más nacidos a nivel mundial(3).
Se ha realizado estudios epidemiológicos en búsqueda de factores genéticos y no genéticos que contribuyan a la etiología de los DTN además de su relación con el déficit de ácido fólico. Con el fin de disminuir su incidencia, se ha fomentado públicamente por parte de distintos organismos sanitarios el uso de ácido fólico antes de la gestación y durante las primeras 12 semanas de embarazo, evidenciándose una importante reducción de la prevalencia y recurrencia de los casos de DTN, por lo que su práctica se continúa hasta nuestros días(4).
A continuación se describe un caso clínico valorado en nuestro centro.
Caso clínico
Se trató de paciente de 34 años de edad, primigesta con antecedente de hipotiroidismo subclínico tratado adecuadamente durante la gestación. Negó la presencia de hábitos tóxicos o antecedentes quirúrgicos de interés, y presentaba un índice de masa corporal adecuado (IMC: 21,6).
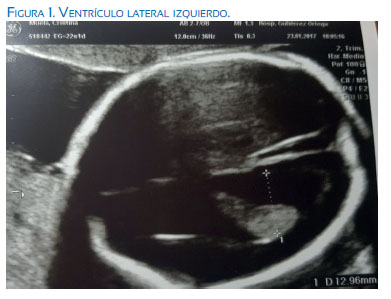
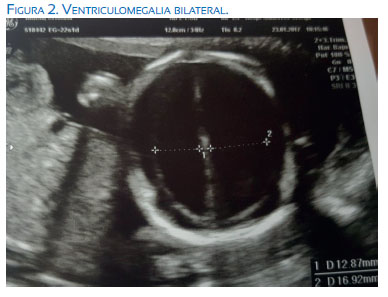
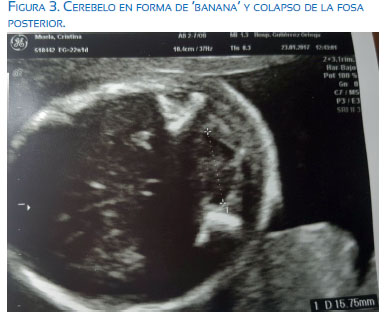
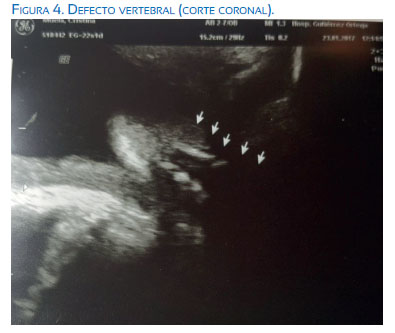
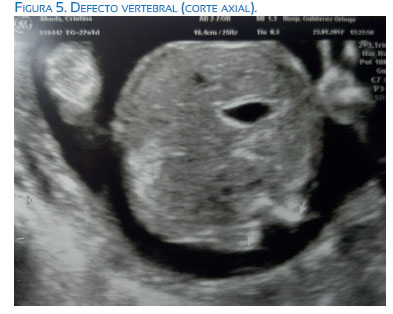
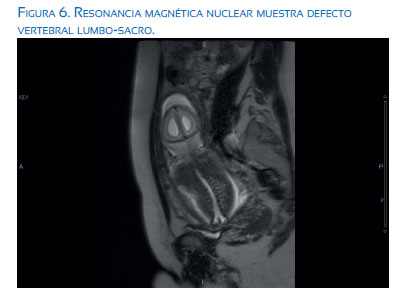
En la valoración del primer trimestre se evidenció translucencia nucal de 1,64 mm con longitud corona nalga (LCR) 58 mm, resultando el cribado del primer trimestre normal, de riesgo bajo y T21 1/2 093 y T18 <1/10 000. Acudió posteriormente a la ecografía morfológica del segundo trimestre, evidenciándose lo que sigue. A nivel del polo cefálico se halló una dilatación severa de ambos ventrículos laterales (I: 12,9 mm / D: 16,9 mm aproximadamente) (figuras 1 y 2) y del tercer ventrículo; fosa posterior colapsada por el desplazamiento caudal de las estructuras como el cerebelo, que se presentaba con apariencia de "banana' (figura 3) y anormalidad de la morfología craneal, con leve agudizamiento frontal, 'signo del limón'. A nivel de la columna vertebral se evidenció defecto amplio abierto del tubo neural, tipo mielocele, de localización lumbar y sacra, que afectaba todos los cuerpos vertebrales desde T12 L1 hasta S5 (figuras 4 , 5 y 6). No parecía observarse saco meníngeo que recubriera las raíces nerviosas. A pesar de los hallazgos, impresionó una adecuada movilidad de miembros inferiores durante la exploración.
La paciente fue derivada a un centro terciario para su valoración, y tras confirmar el diagnóstico le explicaron el pronóstico de esta malformación, indicándoles que suele ser variable ya que depende de la localización, tamaño y la asociación o no con hidrocefalia. Por los hallazgos, era posible la existencia de compromiso neurológico de los miembros inferiores de tipo sensitivo-motor así como vegetativo, afectando el control de los esfínteres. Además, la dilatación ventricular observada orientaban a un posible compromiso de las funciones cognitivas, lo cual depende de la afectación cortical secundaria.
Discusión
A pesar de una extensa investigación, nuestros conocimientos sobre la etiología genética de los DTN en humanos es todavía limitada. Más de 100 genes han sido investigados por su riesgo de asociación con espina bífida, incluidos aquellos relacionados con el metabolismo del ácido fólico, de la glucosa, ácido retinoide y de la apoptosis. Sin embargo, desconocemos cuántos genes pueden conferir riesgo de DTN en humanos(4,5).
La mayoría de los DTN consiste en malformaciones aisladas de origen multifactorial, aunque también pueden formar parte de un síndrome en asociación con desórdenes cromosómicos, como resultado de exposición a factores ambientales o a deficiencias de ácido fólico, uso de anticonvulsivantes como ácido valproico, antagonistas del ácido fólico tales como carbamazapina, fenobarbital, fenitoína, primadona, sulfasalazina, trimetroprim o metrotexato(6).
Los diferentes tipos anatómicos de DTN varían desde aquellos que pueden afectar la columna (vértebra, meninges y cordón espinal) hasta los que afectan el cráneo o ambos, pudiendo ser clasificados como abierto o cerrado. Dentro de los tipos más comunes de DTN están la anencefalia, encefalocele y espina bífida(6). La anencefalia está asociada invariablemente con la pérdida gestacional o muerte neonatal, mientras que el encefalocele y la espina bífida pueden estar asociadas con muerte posnatal o con la presencia de importantes secuelas neurológicas, tales como la parálisis de miembros inferiores, incontinencia de esfínteres, convulsiones e infecciones frecuentes del sistema nervioso central. Incluso con una cirugía que cierre el defecto espinal y la derivación ventrículo-peritoneal, la espina bífida se sigue asociando con mortalidad prematura y diferentes grados de discapacidad. En los casos menos severos, como la espina bífida oculta, las secuelas son menores y la mortalidad es muy rara(7).
En el diagnóstico prenatal se hace énfasis en una exploración ecográfica muy detallada de las estructuras anatómicas intracraneales y óseas, así como de la columna vertebral, sobre todo durante la ecografía morfológica de las 20 semanas.
En el primer trimestre (11 a 13 semanas), se ha propuesto la medida de la translucencia nucal intracraneal como marcador de defectos del tubo neural en el mismo corte sagital habitualmente utilizado para medir la translucencia nucal (TN). Aquí, el cuarto ventrículo se presenta como una translucencia intracraneal paralela a la TN, delimitada por dos zonas hiperecogénicas: la parte dorsal del tronco cerebral en la parte anterior y los plexos coroideos del cuarto ventrículo en la parte posterior. Entre el cuarto ventrículo y el hueso occipital hay otra fina translucencia que es la cisterna magna. Los fetos con espina bífida abierta, el desplazamiento caudal del cerebro es evidente desde el primer trimestre, lo que resulta en la compresión del cuarto ventrículo y la pérdida de la normal translucencia intracraneal que en feto normales presenta valores medios de 1,5 mm a 2,5 mm para LCR de 45 a 85 mm, respectivamente(8).
Solo 6 a 33% de los casos de espina bífida pueden ser diagnosticados en el primer trimestre, entre las 11 y 14 semanas, y esto es debido a la ausencia de marcadores fácilmente reconocibles en el primer trimestre(9).
De forma excepcional, la determinación de alfafetoproteína en suero materno queda restringido a aquellas pacientes cuyo índice de masa corporal sea >35 kg/m2, o aquellas en donde la exploración ecográfica ha sido muy limitada, o en aquellos lugares en donde el acceso al sistema sanitario sea dificultoso para la paciente. Por otro lado, en caso de que surja la indicación de una prueba invasiva, se podrá solicitar alfafetoproteína y acetilcolinesterasa en líquido amniótico, como pruebas complementarias en la valoración del sistema nervioso central (SNC).
En ocasiones, la resonancia magnética (RMN) es considerada como una prueba adicional si se requiere una evaluación detallada del SNC para el asesoramiento tanto en el diagnóstico como en el manejo de este tipo de casos(10), además de permitir la identificación de anomalías adicionales en el SNC.
El manejo prenatal de fetos con DTN incluye el asesoramiento a los padres de las opciones terapéuticas o de la interrupción voluntaria de la gestación en aquellos países en donde la legislación así lo contemple.
Desde hace unos 20 años se realiza la reparación intrauterina del mielomeningocele (MMC), para prevenir la hidrocefalia, la malformación de Chiari II y preservar la funcionalidad de las raíces nerviosas desprotegidas(11). La primera cirugía intrauterina en un MMC se realizó en 1997 en los Estados Unidos de América (EUA) y las primeras publicaciones ya comprobaban una disminución en la tasa de hidrocefalia y malformación de Chiari, pero sin conseguir disminuir completamente las secuelas(12).
Este hecho unido a un grado no despreciable de morbilidad materna (rotura prematura de membranas, dehiscencia de sutura uterina) hizo que la cirugía prenatal fuera cuestionada. Por este motivo, desde 2002 se trabajó en el diseño de un ensayo clínico aleatorizado (Management of Mielomeningocele Study (MOMS)) circunscrito a solo 4 hospitales en EE UU, para comparar la evolución posnatal de fetos afectos de MMC, unos sometidos a corrección quirúrgica prenatal y otros a corrección quirúrgica posnatal. Se aleatorizó 100 gestantes con feto afecto de MMC en cada grupo, con la idea inicial de realizar un seguimiento hasta los 5 años de vida. Sin embargo, un análisis interno realizado a los 30 meses fue tan favorable a la corrección quirúrgica prenatal que obligó a la finalización del estudio antes de lo previsto. Fue publicado en el New England Journal of Medicine en marzo de 2011. Los resultados mostraron que los recién nacidos operados prenatalmente necesitaban menos derivaciones ventrículo-peritoneales, sin reportar una importante morbilidad materna(13).
La reparación fetoscópica de los defectos del tubo neural no parece incrementar sustancialmente las complicaciones materno fetales en comparación con la reparación por histerectomía, permitiendo así incluso la posibilidad de un parto vaginal tras la reparación(14).
Un reciente estudio multicéntrico (CECAM trial) utiliza una técnica quirúrgica fetoscópica única utilizando un parche de biocelulosa colocado sobre la lesión, asociado a un cierre simple de la piel, lo cual difiere de otras cirugías fetales abiertas en donde se disecciona la duramadre y el defecto se cierra en múltiples capas. Dentro de los beneficios de ese enfoque y de la técnica endoscópica incluyen una mínima morbilidad materna y cicatriz miometrial. Sin embargo, las limitaciones actuales de este enfoque incluyen una pérdida potencial de acceso a la cavidad, rotura prematura de membranas y la propia prematuridad en sí. Ello sugiere que los ensayos de fase II son necesarios para prevenir estas complicaciones y para evaluar aun más los riesgos y beneficios de este enfoque(15).
Por otra parte, un ensayo clínico multicéntrico y aleatorizado ha comparado los resultados del tratamiento estándar posnatal con la reparación prenatal del mielomeningocele, en relación al impacto y estrés familiar que este tipo de patología suele causar en el entorno familiar, evidenciando mejores resultados en el grupo con cirugía prenatal(16), además de reducir la necesidad de derivación ventrículo-peritoneal (40% versus 80%) y mostrar mejores resultados en la actividad motora de miembros inferiores a los 30 meses de edad(17).
En cuanto al pronóstico de esta malformación, es variable y depende de su tamaño, localización y la asociación o no con hidrocefalia, ya que esta condiciona un compromiso de las funciones cognitivas derivadas de la compresión cortical secundaria.
La mortalidad a 5 años de vida se suele situar en torno al 34 o 35%, aproximadamente(18).
Los autores arriba citados declaran que no existe ningún conflicto de intereses relacionado con el artículo.
Fuente de financiamiento: Autofinanciado.
Referencias Bibliográficas
1. Suárez-Obando F, Ordónez-Vásquez A, Zarante. Defectos del tubo neural y ácido fólico: patogenia, metabolismo y desarrollo embriológico. Una revisión de la literatura. Rev Colomb Obstet Ginecol. 2010;61(1):49-60. [ Links ]
2. Soler P, Costales C, Montalvo J, Martínez-Ten P, Gómez M, Barron E, Gandasegui A. Utilidad de los signos indirectos en el diagnóstico de los defectos del tubo neural. Toko Gin Pract. 2001;60:65-8. [ Links ]
3. Botto L, Moore C, Khoury M, Erickson J. Neural-tube defects. N Engl J Med. 1999 Nov 11;341(20):1509-19. [ Links ]
4. Au K, Ashley-Koch A, Northrup H. Epidemiologic and genetic aspects of spina bifida and other neural tube defects. Dev Disabil Res Rev. 2010;16(1):6"15. doi:10.1002/ ddrr.93. [ Links ]
5. Wang Y, Liu Y, Ji W, Qin H, Wu H, Xu D, et al. Analysis of MTR and MTRR polymorphisms for neural tube defects risk association. Medicine. 2015;94(35):1-8. DOI: 10.1097/MD.0000000000001367. [ Links ]
6. McLone DG, Bowman RM. Pathophysiology and clinical manifestations of myelomeningocele (spina bifida). UpToDate Literature review current through: Mar 2017. | This topic last updated: Apr 08, 2016. https://www.uptodate.com/contents/pathophysiology-and-clinical-manifestations-of-myelomeningocele-spina-bifida. [ Links ]
7. Blencowe H, Cousens S, Modell B, Lawn J. Folic acid to reduce neonatal mortality from neural tube disorders. Intern J Epidemiol. 2010;39:i110"i121. doi:10.1093/ije/ dyq028. [ Links ]
8. Chaoui R, Nicolaides KH. From nuchal translucency to intracranial translucency: towards the early detection of spina bifida. Ultrasoud Obstet Gynecol. 2010;35:133-8. DOI:10.1002/uog.7552. [ Links ]
9. Lerma D. Ecografía Obstétrica. Ecografía de la semana 20. Madrid, España: Panamericana. 2015:81-120. [ Links ]
10. Wilson R. Prenatal screening, diagnosis, and pregnancy management of fetal neural tube defects. J Obstet Gynaecol Can. 2014 Oct;36(10):927-39. doi: 10.1016/ S1701-2163(15)30444-8. [ Links ]
11. Farmer DL, Von Koch CS, Peacock WJ. In utero repair of myelomeningocele, experimental pathophysiology, initial clinical experience and outcomes. Arch Surg, 2003;138:872-8. http://dx.doi.org/10.1001/archsurg.138.8.872. [ Links ]
12. Adzick NS, Sutton LN, Cromblehome TM, Flake AW. Successful fetal surgery for spina bifida. Lancet. 1998;352:1675-6. http://dx.doi.org/10.1016/S0140-6736(98)00070-1. [ Links ]
13. Carreras E, Maroto A, Arévalo S, Rodó C, García-Fontecha C, Ruiz C, et al. Tratamiento prenatal del mielomeningocele. Diagn Prenat. 2012;23(4):148"53. http:// dx.doi.org/10.1016/j.diapre.2012.06.006. [ Links ]
14. Belfort M, Whitehead W, Shamshirsaz A, Bateni Z, Olutoye O, Mann D, et al. Fetoscopic open neural tube defect repair. Development and refinement of a two-port, carbon dioxide insufflation technique. Obstet Gynecol. 2017;129(4):734-43. doi: 10.1097/ AOG.0000000000001941. [ Links ]
15. Pedreira D, Zanon N, Nishikuni K, Moreira de Sá R, Acacio G, Chmait R, Kontopoulos E, Quintero R. Endoscopic surgery for the antenatal treatment of myelomeningocele: the CECAM trial. Am J Obstet Gynecol. 2016 Jan;214(1):111.e1-111.e11. doi: 10.1016/j. ajog.2015.09.065. [ Links ]
16. Antiel R, Adzick N, Thom E, Burrows P, Farmer D, et al. Impact on family and parental stress of prenatal vs postnatal repair of myelomeningocele. Am J Obstet Gynecol. 2016;215:522.e1-6. doi: 10.1016/j.ajog.2016.05.045. [ Links ]
17. Adzick NS, Thom EA, Spong CY, Brock JW, Burrows PK, Johnson MP, et al. A randomized trial of prenatal versus postnatal repair of myelomeningocele. N Engl J Med. 2011;364:993"1004. doi: 10.1056/NEJMoa1014379. [ Links ]
18. Oakeshott P, Hunt GM, Poulton A, Reid F. Expectation of life and unexpected death in open spina bifida: a 40year complete, non-selective, longitudinal cohort study. Dev Med Child Neurol. 2010;52:749"53. [ Links ]
Correspondencia:
Mileidy Egleet Mejias Quintero
Calle Bodegas Bilbaínas 31. Valdepeñas. Ciudad Real. Código Postal: 13300 España.
0034 617119540
mileidymejias4@hotmail.com
Citar como: Mejias Quintero ME, Salem Salem H. Defecto amplio del tubo neural. A propósito de un caso. Rev Peru Ginecol Obstet. 2017;63(4):635-639
Recibido: 4 julio 2017
Aceptado: 4 setiembre 2017